2. 山西大学化学生物学与分子工程教育部重点实验室, 山西 太原 030006;
3. 山西大学地产中药功效物质研究与利用山西省重点实验室, 山西 太原 030006;
4. 山西省食品药品检验所, 山西 太原 030001
2. Key Laboratory of Chemical Biology and Molecular Engineering of Ministry of Education, Shanxi University, Taiyuan 030006, China;
3. Key Laboratory of Effective Substances Research and Utilization in Traditional Chinese Medicine of Shanxi Province, Shanxi University, Taiyuan 030006, China;
4. Shanxi Institute for Food and Drug Control, Taiyuan 030001, China
抑郁症是一种涉及社会、心理和生物等多种因素及其相互作用的精神疾病, 临床表现有心境低落、思路迟缓, 并伴有食欲减退、睡眠障碍等躯体症状[1-3]。应激是指机体稳定的内环境受到外来非特异性的刺激而出现的不协调状态[4]。适当的应激能够提高机体对环境的适应能力, 但过度应激会诱导机体产生心理、生理等障碍[5]。其中, 压力反应中的应激源是抑郁症发生的重要因素[3]。
慢性不可预知温和刺激(chronic unpredictable mild stress, CUMS) 是一种经典的动物造模手段, 通过模拟人类生活中经历的不良应激事件[6], 从而诱发动物抑郁样行为, 进而观察抑郁症的发生、发展情况及抗抑郁药物的效应[7, 8]。然而, 越来越多的实验观察发现, 抑郁模型实验数据组内也存在很大的离散度[9, 10]。研究结果提示, 在相同条件下, 相同种属的动物接受一系列相同的刺激会产生不同的应激状态。这种现象与人类抑郁发生的异质性十分相似: 在现实生活中, 大多数个体对于应激刺激是敏感的, 并且容易产生抑郁行为, 这种状态称为应激敏感。但仍有部分个体受到应激刺激后能够适应刺激、克服应激源, 避免抑郁状态的发生[11]。这种应对刺激时呈抵抗的状态称为应激抵抗。
应激敏感与应激抵抗是机体受到应激后的两种相反的结果。两者共性的生物学特点有助于揭示机体应对刺激产生的生物学变化; 而对于其差异的探索则有利于进一步了解由压力和逆境引起的抵抗适应性的分子机制, 进而深入探讨抑郁症的发病机制, 并为临床特异个体提供独特的治疗方法, 实现精准治疗。
代谢组学是一门新兴的系统生物学研究方法, 通过研究机体内源性小分子代谢物及相应的代谢通路准确地反映生物体的病理状态[12, 13]。抑郁症是一种系统性的综合病症, 其发病伴有氨基酸代谢、糖代谢、能量代谢、血脂代谢等多系统异常。代谢组学技术为揭示应激敏感与应激抵抗发病机制的异同提供新策略和新视角[12, 14, 15]。
本文采用CUMS复制大鼠抑郁模型, 应用粪便代谢组学结合多元统计分析, 区分应激敏感大鼠和应激抵抗大鼠; 并通过糖水偏爱率结果对分组结果进行验证; 最后, 通过比较应激敏感大鼠和应激抵抗大鼠的粪便差异代谢物、代谢通路的异同, 表征二者在代谢组学层面的特征, 阐释应激敏感和应激抵抗的机制。研究结果将为抑郁症的研究提供新视角, 为临床特异个体提供独特的治疗方法, 亦可为抗抑郁药物的研发提供思路。
材料与方法实验动物 雄性SPF级SD大鼠, 体重180~220 g, 购自北京维通利华实验动物技术有限公司[许可证号SCXK (京) 2016-0006]。将大鼠置于室温20~24 ℃、湿度45%~55%和光/暗周期为12 h/12 h的动物房里适应性饲养1周, 自由进食实验室标准饲料和自来水。所有动物实验和福利均按照《国家卫生研究院实验动物护理与使用指南》进行, 并经山西大学动物伦理委员会批准(批准号: SXULL 20180055)。
药物与试剂 蔗糖, 上海生工生物工程股份有限公司; 磷酸盐缓冲液(PBS), 山西百奥生物技术有限公司; 重水(D2O) 和3-(三甲基硅基) 氘代丙酸钠-2, 2, 3, 3-D4 (TMSP), Cambridge Isotope Laboratories Inc., 美国。
仪器 Bruker 600-MHz AVANCE Ⅲ核磁共振检测仪(Bruker, 德国); 代谢笼(苏州实验动物笼具厂); Neofuge 13R高速冷冻离心机(上海力申科学仪器有限公司)。
动物分组 大鼠适应性饲养7天, 期间进行旷场实验和糖水训练。适应期结束后, 将大鼠随机分为对照组(n = 6) 和模型组(n = 10)。空白组继续正常饲养, 模型组大鼠进行单笼饲养并实施CUMS造模程序, 持续28天。
CUMS模型的复制 CUMS模型是目前公认的最有效的动物抑郁症模型, 已被广泛应用于抑郁症发病机制和抗抑郁药物的作用机制研究。造模程序如前所述[12], 除对照组外, 模型组大鼠每天随机遭受一种不可预测的轻度应激, 包括: ①禁食(24 h); ②禁水(24 h); ③ 50 ℃热刺激(10 min); ④ 4 ℃冰水浴(5 min); ⑤夹尾(2 min); ⑥足部电击(电压36 V, 1次电击2 s, 每隔10 s刺激1次, 共10次); ⑦束缚(3 h); ⑧昼夜紊乱; ⑨超声刺激(频率40 MHz, 3 h)。同种刺激不连续出现, 且出现总次数不超过4次。
糖水偏爱实验测定 糖水偏爱实验训练及测试方法如下所述, 适应期第5天晚上8:00进行糖水偏爱训练: 大鼠进行孤养, 每只大鼠给予一瓶自来水、一瓶现配的1%蔗糖水进行糖水偏爱训练。训练12 h后撤掉所有水瓶, 并开始禁水24 h。于适应期第7天早晨8:00进行糖水偏爱基线的测定: 给予大鼠一瓶自来水和一瓶现配的1%蔗糖水, 测试时间为1 h。正式实验的第28天进行糖水偏爱测试, 并按下式计算各大鼠糖水偏爱率: 糖水偏爱率=蔗糖水消耗量/ 总饮水量× 100%。
粪便样品收集 第28天, 所有大鼠置于代谢笼中, 自由饮水, 收集12 h内的粪便样本。粪便样本保存于-80 ℃, 待测。
1H NMR代谢组学分析 称取粪便100 mg于1.5 mL离心管中, 加入1 000 μL PBS (0.1 mol·L-1, pH 7.4), 涡旋充分混匀; 然后, 用液氮反复冻融3次。冻融物混匀后, 冰浴超声20 s, 静置40 s, 重复20次, 离心15 min (13 000 ×g, 4 ℃)。取500 μL上清液, 加入100 μL含有0.002 5% TMSP的D2O, 混匀, 转移至5 mm NMR测试管中, 待测。
样品在Bruker 600 MHz AVANCE Ⅲ NMR仪上检测: 1D CPMG (Carr-Purcell-Meiboom-Gill) 脉冲序列, 检测谱宽12 019.2 kHz, 扫描次数为64次, FID分辨率0.183 Hz, 采样时间2.726 3 s, 延迟时间1.0 s, 采样间隔41.6 s, 采样点为65 536。
采用MestReNova核磁图谱数据处理软件(Mestrelab Research, Santiagode Compostella, 西班牙) 对粪便1H NMR图谱进行傅里叶转换, 然后进行相位、基线的调整。以TSP的化学位移(δ 0.0) 为标准对所有图谱进行化学位移校正。切除δ 4.7~5.1区间的残余水峰, 并以0.01为单位对核磁图谱(δ 0.60~9.00) 做等宽度分割进行分段积分, 并对积分数据进行面积归一化。将上述数据保存在Excel表格中, 用于多元统计分析。
采用SIMCA-P 13.0软件对积分数据进行多元统计分析。主成分分析(principal component analysis, PCA) 反映样品整体的分布趋势, 得分图显示分析结果。归一化数据经单位方差换算标度化处理后, 进一步进行偏最小二乘法判别分析(partial least squares-discriminant analysis, PLS-DA) 和正交偏最小二乘法判别分析(orthogonal projection to latent structure discriminate analysis, OPLS-DA)。其中, PLS-DA用于分析NMR数据与分组变量之间的关系; OPLS-DA可最大化凸显组别之间的差异。参数R2和Q2分别表示模型拟合情况和预测能力。根据OPLS-DA模型相应的散点图得到变量投影重要性(variable importance in the projection, VIP) > 1的代谢物信息。
使用HMDB (http://www.hmdb.ca/)、BMRB (http://www.bmrb.wisc.edu/) 等生物学数据库进行生物标志物的鉴定; 使用MetPA平台(http://metpa.metabolomics.ca) 进行代谢通路分析。
统计学方法 采用SPSS 22.0软件进行统计分析。所有实验数据均以
通过分析每个化合物的化学位移、偶合常数及峰形等信息, 结合HMDB (http://www.hmdb.ca/)、BMRB (http://www.bmrb.wisc.edu/)等公共数据库对图谱中的主要化合物进行指认。在大鼠粪便样本中共指认出40个内源性代谢产物, 其代表性图谱、化学位移以及谱峰归属见图 1和表 1。
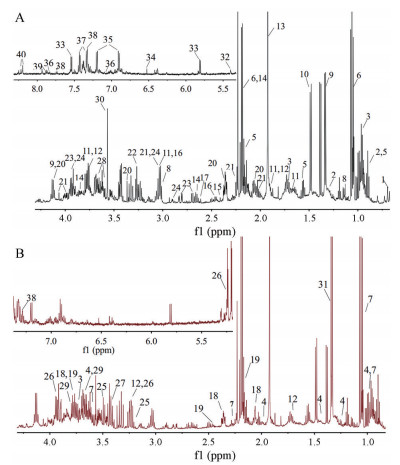
|
Figure 1 Typical 1H NMR spectrum of fecal samples. A: Negative control group; B: Chronic unpredictable mild stress (CUMS) model group. The metabolites marked with numbers are shown in Table 1 |
| Table 1 Peak assignments in the 1H NMR spectra of feces of rats |
首先, 采用无监督的PCA对样本所包含的生物信息进行总体轮廓分析。在PCA得分散点图(图 2A) 中, 空白组分布相对集中, 而CUMS抑郁大鼠组内显示出离散趋势。空白组与部分CUMS组(红色虚线内) 之间能明显分开; 但与部分CUMS抑郁大鼠(黑色虚线内) 发生重叠。研究结果提示, 相同的CUMS造模, 抑郁组大鼠代谢轮廓存在差异, 即机体对相同程度的刺激呈现不同的应答状态。
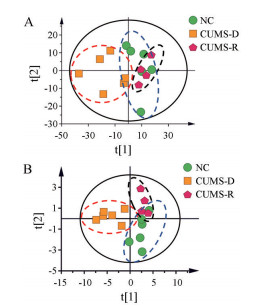
|
Figure 2 The metabolic profiles of fecal samples. A: Principal component analysis (PCA) score plot between the negative control (NC), the CUMS-depression (CUMS-D) groups and the CUMS-resilience (CUMS-R) groups; B: Partial least squares-discriminant analysis (PLS-DA) score plot between the NC, CUMS-D and CUMS-R groups |
为了解释样本间差异的生物学基础, 进一步进行有监督的PLS-DA分析。PLS-DA散点图(图 2B) 显示, 空白组与红色虚线内的CUMS组沿纵轴明显分离, 而黑色虚线内的CUMS组介于空白组和红色虚线内的CUMS样本之间。即便在有监督的PLS-DA模型中, 黑色虚线内的CUMS组大鼠样本也没有表现出明显分离。研究结果表明, 实验动物受到相同应激后, 并不是所有个体都呈现抑郁状态, 有部分个体能适应应激, 呈现应激抵抗状态。
同时, 比较这三个组在造模第28天的糖水偏爱率(图 3)。结果发现, 和空白组比较, 红色虚线内的CUMS组大鼠的糖水偏爱率显著降低(P < 0.05), 而黑色虚线内的CUMS组大鼠的糖水偏爱率和空白对照组无显著性差异(P > 0.05)。糖水偏爱率结果与PCA结果一致: CUMS造模28天后, 黑色虚线内的CUMS组大鼠未表现出抑郁状态。
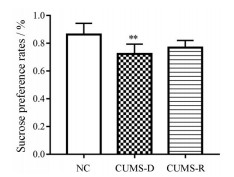
|
Figure 3 Sucrose preference rates of rats from the NC, CUMS-D and CUMS-R groups after 28-day CUMS modeling. n = 6, 4. |
基于上述研究结果, 把红色虚线内的CUMS组称为应激敏感组(CUMS-D), 把黑色虚线内的CUMS组称为应激抵抗组(CUMS-R)。
3 应激敏感大鼠和应激抵抗大鼠粪便代谢组学研究 3.1 与CUMS应激敏感相关的粪便生物标志物为了寻找与应激敏感相关的粪便生物标志物, 建立基于空白组大鼠和应激敏感组大鼠的粪便样本的OPLS-DA模型, 并进一步绘制OPLS-DA得分图(图 4A, 模型参数: R2X = 0.648, R2Y = 0.992, Q2 = 0.853) 和相应的载荷图(图 4B)。载荷图中每一个点代表一个代谢物, 若该点偏离中心越远表明该变量对模型的贡献越大。载荷图得到的VIP值(> 1) 结合独立样本t检验(P < 0.05) 寻找差异代谢物, 共得到23个峰面积具有显著性差异的代谢物(表 2)。与空白组相比, 应激敏感大鼠粪便样本中丙酸、乳酸、精氨酸等代谢物含量显著升高, 异亮氨酸、缬氨酸、α-酮异戊酸等显著降低。
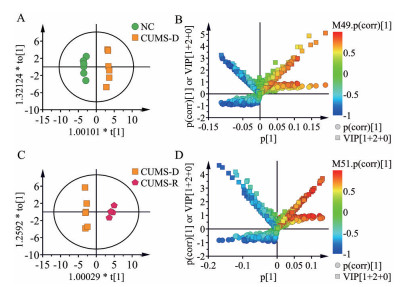
|
Figure 4 Orthogonal projection to latent structure discriminate analysis (OPLS-DA) score plot and the corresponding loading plot of fecal samples. A, C: OPLS-DA score plot between the NC and the CUMS-D groups, as well as between the CUMS-D and the CUMS-R groups; B, D: The corresponding loading plot between the NC and the CUMS-D groups, as well as between the CUMS-D and the CUMS-R groups |
| Table 2 The changes of differential metabolites of fecal samples of the NC (n = 6), CUMS-D (n = 6) and CUMS-R (n = 4) groups. *P < 0.05, **P < 0.01, ***P < 0.001; #P < 0.05, ##P < 0.01, ###P < 0.001 |
为了寻找在相同CUMS造模下, 应激敏感大鼠和应激抵抗大鼠的差异生物标志物, 建立相应的OPLS-DA模型, 寻找差异变量, 并对其进行分析。绘制OPLS-DA得分图(图 4C, 模型参数: R2X = 0.701, R2Y = 0.989, Q2 = 0.891) 和相应的载荷图(图 4D)。VIP值(> 1) 和独立样本t检验(P < 0.05) 结合寻找差异代谢物, 共得到17个峰面积具有显著性差异的代谢物(表 2)。与应激抵抗组大鼠相比, 应激敏感大鼠粪便样本中丙酸、天冬酰胺、肌酐等代谢物含量显著升高, 异亮氨酸、缬氨酸、丙氨酸等含量显著降低。
3.3 应激敏感大鼠与应激抵抗大鼠粪便生物标志物和代谢通路的异同应激敏感大鼠和应激抵抗大鼠粪便生物标志物共计26个(表 2), 其中前14个是两组间相同的生物标志物。与空白组比较, 14个代谢物水平在应激敏感大鼠中发生显著变化, 其中丙酸、肌酐、天冬酰胺、D-葡萄糖含量显著升高, 其他代谢物含量显著降低。然而, 14个代谢物水平在应激抵抗大鼠中并无显著差异。与应激敏感组比较, 应激抵抗大鼠的14个代谢物水平发生显著变化, 其中丙酸、肌酐、天冬酰胺、D-葡萄糖含量显著降低, 其他代谢物含量显著升高。
与空白组比较, 应激敏感大鼠有9个代谢物水平发生显著变化, 包括脂类、乳酸、丁酸、精氨酸、脯氨酸、牛磺酸、胆碱、甘露醇和天冬氨酸。与应激敏感大鼠比较, 应激抵抗大鼠色氨酸、尿嘧啶和丙三醇发生了特异性变化。
计算不同代谢物的权重并分析应激敏感与应激抵抗大鼠粪便代谢轮廓的差异(表 3)。根据权重结果可知, 在空白组中, 权重占比前三的代谢物分别是丙氨酸、丙酸、亮氨酸。在应激敏感大鼠中, 权重占比前三的代谢物为丙酸、丙氨酸、天冬酰胺。在应激抵抗大鼠中, 权重占比前三的代谢物分别是丙氨酸、亮氨酸、丙酸。在空白组和应激抵抗大鼠中, 丙氨酸都是最重要的, 应激敏感大鼠权重占比最大的是丙酸。
| Table 3 Weight of 14 common metabolites in the NC, CUMS-D and CUMS-R groups |
虽然3组中均有丙酸和丙氨酸, 比较权重数值结果显示, 丙酸在应激敏感大鼠中的重要性(25.86%) 远大于其余两组, 而丙氨酸在应激敏感大鼠中的重要性(15.51%) 小于其余两组。
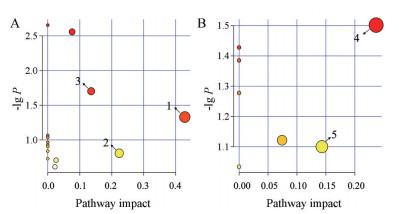
将两组间的差异代谢物导入MetPA (http://www.metaboanalyst.ca/) 进行通路分析。以代谢通路影响值(pathway impact) 大于0.1为条件, 筛选得到潜在靶标通路。结果显示, 3条代谢途径与应激敏感显著相关, 包括牛磺酸和亚牛磺酸代谢、丙氨酸、天门冬氨酸和谷氨酸代谢以及精氨酸和脯氨酸代谢(图 5A)。甘油酯代谢以及色氨酸代谢是应激抵抗的特异性代谢通路(图 5B)。
|
Figure 5 MetPA analysis of metabolic pathways in feces of rats. A: The CUMS-D group; B: The CUMS-R group. 1: Taurine and hypotaurine metabolism; 2: Alanine, aspartate and glutamate metabolism; 3: Arginine and proline metabolism; 4: Glycerolipid metabolism; 5: Tryptophan metabolism. The size and the color of each circle reflected the pathway impact value and the P-value, respectively |
本研究对SD大鼠进行CUMS造模。基于粪便核磁代谢数据, 应用多元统计分析, 发现相同应激条件下的两种不同状态的大鼠: 应激敏感大鼠和应激抵抗大鼠。同时, 发现了应激敏感大鼠与应激抵抗大鼠的糖水偏爱率亦有显著差异。通过进一步鉴定并筛选得到应激敏感和应激抵抗相关的差异标志物。研究结果为抑郁动物模型的研究、抑郁症的发生以及抗抑郁药物的研发奠定了基础。
越来越多的实验观察发现, 抑郁模型组内实验数据具有很大的离散度[9, 10]。研究结果提示, 在相同条件下, 相同种属的动物接受一系列相同的刺激会产生不同的应激状态, 即CUMS应激敏感和应激抵抗。本研究从代谢组学角度, 探讨了应激敏感和应激抵抗大鼠生物学特性的异同。其中, 糖水偏爱率是评价抑郁症模型大鼠快感缺乏的有效客观的“金”指标——抑郁症核心症状之一[16, 17]。大量研究表明, 快感缺失症状不仅具有诊断价值, 还有早期识别、预测疾病治疗的潜力[18]。本研究用糖水偏爱率评估应激敏感大鼠和应激抵抗大鼠的快感缺失程度。结果表明, 与正常大鼠相比, 应激敏感大鼠的糖水偏爱率降低, 表明该组大鼠快感缺失, 出现抑郁样行为。而应激抵抗大鼠的糖水偏爱率与空白组相比没有明显变化, 较应激敏感大鼠有上升趋势, 表明该组大鼠未出现抑郁症状。
代谢组学可通过生物体液中的代谢物含量的动态变化, 直接反映疾病的病理变化趋势[19], 反映机体的病理生理状态及相关多种生化途径的变化[20]。本研究表明, 应激敏感大鼠与空白组大鼠, 与应激抵抗大鼠的代谢特征显著不同: 在14个共有的差异代谢物中, 应激敏感大鼠中的丙酸、肌酐、天冬酰胺、D-葡萄糖含量显著升高。其中, 丙酸是短链脂肪酸, 丙酸代谢与肠道菌群的代谢高度相关, 其在体液中的含量能反映体内肠道菌群的代谢状况, 并且能维持大肠的正常功能[12]。肌酸是天然存在的有机酸, 可为大脑和骨骼肌提供能量[21], 同时也是肌肉组织中的储能物质。食物中的蛋白质通过胃肠道消化吸收成为氨基酸, 然后在肾脏、肝脏及胰腺等部位合成肌酸, 最终代谢成为肌酐[22]。天冬酰胺等一些氨基酸可能对肠道细菌的最优生长是“必须的”, 对于人和动物在营养上和功能上是重要的[23]。与正常大鼠和应激抵抗大鼠比较, 应激敏感大鼠的丙酸、肌酐及天冬酰胺水平升高, 但目前对天冬酰胺变化的意义缺乏文献报道, 需进一步研究。
其次, 与应激敏感大鼠的粪便生物标志物相比, 应激抵抗大鼠中的色氨酸, 尿嘧啶以及丙三醇的含量发生显著变化。色氨酸是蛋白质生物合成的必需氨基酸, 能够影响哺乳动物的生理机能, 包括神经系统、免疫及胃肠功能等。色氨酸主要通过犬尿氨酸代谢生成5-HT[24], 且是合成5-HT的唯一底物[25]。色氨酸代谢产生的5-HT超过95%分布在胃肠道。色氨酸与代谢产物5-HT主要参与肠道免疫和蠕动功能的调节[26]。研究结果表明, 色氨酸代谢在抑郁症的发生发展过程中占有重要地位。与应激敏感大鼠相比, 应激抵抗大鼠色氨酸的含量明显下降, 表明应激抵抗大鼠中色氨酸代谢未受到应激扰乱。
脂肪在小肠上段经各种酶及胆汁酸盐的作用, 水解为丙三醇、脂肪酸等。中链、短链脂肪酸构成的甘油三酯进行乳化后可吸收, 经门静脉入血; 长链脂肪酸构成的甘油三酯与载脂蛋白、胆固醇等结合成乳糜微粒, 最后经淋巴入血[27]。在本实验中, 与应激敏感大鼠相比, 应激抵抗大鼠的丙三醇含量上升, 表明应激抵抗大鼠的甘油酯代谢正常, 机体趋于正常状态。
此外, 与正常大鼠的粪便生物标志物相比, 应激敏感大鼠多种氨基酸的含量发生显著变化, 如精氨酸、脯氨酸、牛磺酸和天冬氨酸。精氨酸是动物细胞内生物功能最多的氨基酸。动物消化吸收精氨酸的主要部位在小肠, 它在胃肠道的生长、发育、成熟和修复等方面有着重要调节作用[28]。有研究表明, 精氨酸及其代谢产物均具有产生γ-氨基丁酸(GABA) 的能力, 而抑郁行为会受GABA的调控, 表明精氨酸代谢途径会影响抑郁行为的发生[29]。经典抗抑郁复方逍遥散能显著调节抑郁大鼠的脯氨酸代谢[30]。牛磺酸能合成胆汁酸盐, 促进脂肪及脂溶性物质的消化吸收。牛磺酸对肠道菌群存在调节作用, 增加保护性菌群, 降低有害菌群的生长, 降低肠道炎症发生率及减轻其危害[31]。牛磺酸对机体稳态、神经和内分泌系统的生理功能至关重要[32, 33]。并且, 有研究表明, 牛磺酸可有效干预利血平诱导的急性抑郁症[32]。结果表明, 氨基酸代谢与抑郁症之间存在着密切联系。
根据权重结果可知, 与空白组和应激抵抗大鼠比较, 应激敏感大鼠丙酸含量显著升高, 并且较为重要。有研究表明, 抑郁大鼠丙酸含量的升高可能由抑郁症引起的肠道菌群结构和功能紊乱[12]。短链脂肪酸等肠道菌群的代谢产物被认为是肠道微生物-肠-脑通讯的关键介质。丙酸的含量升高, 肠道微生物群中产生丙酸盐的菌群增加, 丙酸盐可引起小胶质细胞活化、神经毒性细胞因子产生、神经行为异常, 从而影响抑郁症的发生[34]。
本研究应用代谢组学方法对CUMS诱发的应激敏感和应激抵抗大鼠的粪便的代谢模式进行了系统的分析, 并进一步研究应激敏感大鼠和应激抵抗大鼠的糖水偏爱率的差别。本研究发现应激敏感大鼠和应激抵抗大鼠的糖水偏爱率有显著差异, 且具有显著不同的代谢谱和代谢通路。代谢组学研究表明, 包括牛磺酸和亚牛磺酸代谢, 丙氨酸、天门冬氨酸和谷氨酸代谢以及精氨酸和脯氨酸代谢等3条代谢通路是应激敏感的重要通路。甘油酯代谢和色氨酸代谢是应激抵抗的特异性代谢通路。本研究从代谢组学角度探讨了相同刺激下, 机体出现敏感和抵抗两种不同状态的机制, 为抑郁症的研究提供了新视角, 亦为临床个体化和精准治疗以及抗抑郁药物的研发提供了新思路。
作者贡献: 王森岩和卫拂晓负责实验实施、数据收集、结果分析和文章撰写等工作; 刘欢乐负责动物实验实施和对文章内容的修改完善; 秦雪梅和赵思俊对整个实验内容给予监督; 刘晓节负责文中实验方案设计和提供文章思路, 在文章写作方面进行指导和修改。
利益冲突: 本文研究内容无任何利益冲突。
| [1] |
Xue YL, Xu JT, Qiu JH. Effect of icariin on depression-like behavior and neuronal damage in depression rats[J]. J Clin Exp Med (临床和实验医学杂志), 2021, 20: 2152-2156. |
| [2] |
Wang BM, Qiao P, Wang W, et al. Effect of Albiziae Flos and Polygalae Radix alone and their combination on depression-like behavior and CREB and NOX2 expression in hippocampus of chronic unpredictable stress-induced rats[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2021, 27: 32-39. |
| [3] |
Wu YR, Luo H. Research progress on the effect of stress on adolescent depression [J/OL]. Chin J Child Health Care (中国儿童保健杂志), 2021 [2021-12-25]. http://kns.cnki.net/kcms/detail/61.1346.R.20210623.1521.028.html.
|
| [4] |
He X, Liu W, Zhu B, et al. Study on the effect and mechanism of stress factors on rat intestinal flora[J]. Clin J Med Off (临床军医杂志), 2021, 49: 361-364. |
| [5] |
Ren SY, Wang ZZ, Chen NH. Research progress on anti-depression effects of ginsenosides[J]. Acta Pharm Sin (药学学报), 2019, 54: 2204-2208. |
| [6] |
Katz RJ, Roth KA, Carroll BJ. Acute and chronic stress effects on open field activity in the rat: implications for a model of depression[J]. Neurosci Biobehav Rev, 1981, 5: 247-251. DOI:10.1016/0149-7634(81)90005-1 |
| [7] |
Xu P, Pang ZZ, Huang SY, et al. Experimental research of punicalagin on depression-like behaviors and optimizing the composition of intestinal flora in mice [J/OL]. Chin J Immunol (中国免疫学杂志), 2021 [2021-12-25]. https://kns.cnki.net/kcms/detail/22.1126.R.20211111.1508.006.html.
|
| [8] |
Li X, Fang X, Xu XH, et al. Effect of ephrin-B2 on hippocampal neurons in a rat depression model[J]. Chin J Geriatr Cardiovasc Cerebrovasc Dis (中华老年心脑血管病杂志), 2021, 23: 1090-1094. |
| [9] |
Hjemdal O, Vogel PA, Solem S, et al. The relationship between resilience and levels of anxiety, depression, and obsessive-compulsive symptoms in adolescents[J]. Clin Psychol Psychother, 2011, 18: 314-321. DOI:10.1002/cpp.719 |
| [10] |
Gourley SL, Swanson AM, Koleske AJ. Corticosteroid-induced neural remodeling predicts behavioral vulnerability and resilience[J]. J Neurosci, 2013, 33: 3107-3112. DOI:10.1523/JNEUROSCI.2138-12.2013 |
| [11] |
Li Y. Differential Expression of Hippocampal EphA4 and EphrinA3 in Anhedonic-like Behavior, Stress Resilience, and Antidepressant Drug Treatment After Chronic Unpredicted Mild Stress (慢性不可预见性应激敏感与抵抗及氟西汀用药有效与抵抗大鼠海马中Eph家族蛋白的改变) [D]. Wuhan: Wuhan University, 2014.
|
| [12] |
Lv M, Wang YZ, Zhao D, et al. Anti-depression mechanisms of Xiaoyao Powder based on fecal metabolomics[J]. Chin Tradit Herb Drug (中草药), 2020, 51: 3482-3492. |
| [13] |
Liu Z, Zhou N, Liu T, et al. Progress in depression based on metabolomics[J]. Chin J Pathophysiol (中国病理生理杂志), 2020, 36: 2264-2275. |
| [14] |
Liu ZR, Yang B, Liu F, et al. A metabolomic study of Baihe Zhimu decoction in a rat model of depression[J]. Chin J Third Mil Med Univ (第三军医大学学报), 2019, 41: 1917-1925. |
| [15] |
Li T, Li X, Tian JS, et al. Metabolic pathways related to liver-soothing and depression-relieving effect of Bupleuri Radix-Paeoniae Radix Alba combination: based on 1H-NMR metabolomics[J]. Mod Chin Med (中国现代中药), 2021, 23: 1380-1390. |
| [16] |
Jiang N, Zhang YW, Yao CH, et al. Overview of animal behavioral tests of depression[J]. Acta Lab Anim Sci Sin (中国实验动物学报), 2021, 29: 830-838. |
| [17] |
Gao RJ, Huang H, Jiang N, et al. Improvement effects of soybean isoflavones on lipopolysaccharide-induced depression-like behavior in mice[J]. Soybean Sci (大豆科学), 2021, 40: 539-545. |
| [18] |
Wu ZN, Zhang C. Research advances in inflammatory mechanism of anhedonia[J]. J Shanghai Jiaotong Univ Med Sci (上海交通大学学报(医学版)), 2021, 41: 241-245. |
| [19] |
Wang XX, Tao ZP, Li Y, et al. Progress in the application of metabolomics on anti-depression with traditional Chinese medicine[J]. Mod Tradit Chin Med Mater Med-World Sci Technol (世界科学技术-中医药现代化), 2020, 22: 1913-1921. |
| [20] |
Sheng N, Wang CH, Jia ZX, et al. The mechanism of Er-xian Decoction in regulating lipid metabolism disorders on bilateral ovariectomized rats based on metabolomics study[J]. Acta Pharm Sin (药学学报), 2021, 56: 2403-2409. |
| [21] |
Feng Y, Meng MD, Feng JY, et al. Antidepressant-like effects of the petroleum ether fraction of Xiaoyaosan in the CUMS rat model of depression[J]. Acta Pharm Sin (药学学报), 2020, 55: 305-314. |
| [22] |
He R, Xie J, Su H, et al. Effect of temperature on muscle nutritional components and blood biochemical parameters of Pelodiscus sinensis alive without water[J]. Food Sci (食品科学), 2014, 35: 194-199. |
| [23] |
Wu G. Amino acids: metabolism, functions, and nutrition[J]. Amino Acids, 2009, 37: 1-17. |
| [24] |
Modoux M, Rolhion N, Mani S, et al. Tryptophan metabolism as a pharmacological target[J]. Trends Pharmacol Sci, 2021, 42: 60-73. DOI:10.1016/j.tips.2020.11.006 |
| [25] |
Roth W, Zadeh K, Vekariya R, et al. Tryptophan metabolism and gut-brain homeostasis[J]. Int J Mol Sci, 2021, 22: 2973. DOI:10.3390/ijms22062973 |
| [26] |
Li XL, Jang M, Ruan Z, et al. Review of effects of L-tryptophan and its metabolite 5-hydroxytryptamine on intestinal function[J]. Food Safe Qual Detec Technol (食品安全质量检测学报), 2014, 5: 1997-2002. |
| [27] |
Sun LX, Gao WH. Lipid metabolism test[J]. World Health Digest (中外健康文摘), 2011, 8: 139-140. |
| [28] |
Ren YF, Wu CT. The mechanism of L-arginine in the repair of intestinal mucosal injury[J]. Chin Crit Care Med (中国危重病急救医学), 2006, 18: 764-765. |
| [29] |
Zhao YX. A Study on the Antidepressant Mechanism of Arginine Metabolism Mediated by Chaigui Granules Regulating Intestinal Flora (柴归颗粒调节肠道菌群介导精氨酸代谢抗抑郁作用机制研究) [D]. Taiyuan: Shanxi University, 2021.
|
| [30] |
Liu CC. Plasma Metabolomics Studies on the Clinical Antidepressant Effect of Xiaoyaosan (逍遥散临床治疗抑郁症的血浆代谢组学研究) [D]. Taiyuan: Shanxi University, 2016.
|
| [31] |
Yu H, Guo ZZ, Shen SR, et al. Effects of taurine on gut microbiota and metabolism in mice[J]. Amino Acids, 2016, 48: 1601-1617. DOI:10.1007/s00726-016-2219-y |
| [32] |
Zhang XF, Yan CJ, Zhou Q, et al. Intervention of taurine on CUMS-induced depression in mice[J]. J Chin Inst Food Sci Technol (中国食品学报), 2021, 21: 123-130. |
| [33] |
Li CS, Zhang Q, Wang YT, et al. Physiological function of taurine in endocrine system[J]. Prog Vet Med (动物医学进展), 2016, 37: 109-112. |
| [34] |
Li HH. Study on the Relationship Between Intestinal Microflora, Short Chain Fatty Acids and Schizophrenia (肠道菌群及短链脂肪酸与精神分裂症的相关性研究) [D]. Zhengzhou: Zhengzhou University, 2020.
|
 2022, Vol. 57
2022, Vol. 57


