2. 江苏省中医药研究院中药组分与微生态研究中心, 江苏 南京 210028
2. Multi-component of Traditional Chinese Medicine and Microecology Research Center, Jiangsu Provincial Academy of Chinese Medicine, Nanjing 210028, China
金属-有机框架(metal-organic frameworks, MOFs) 是一种由无机金属离子或金属团簇与有机配体通过配位键自组装形成的新型晶体多孔材料[1], 其独特的结构使其在气体储存、催化、传感、锂离子电池等领域广受青睐。尤其是, MOFs凭借其高孔隙率和大比表面积所带来的载药空间[2, 3], 近年来逐渐成为药物递送领域的热点, 被认为是一种极具潜力的药物递送载体[4]。
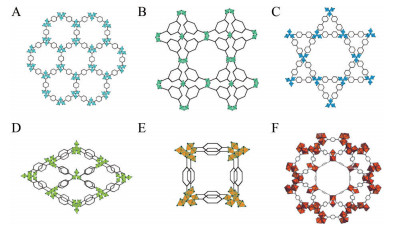
MOFs金属节点种类较多, 常见的有Cr、Cu、Zr、Al、Zn、Fe等(图 1[5-8]), 其中, 由金属Fe作为节点构成的MOFs (Fe基MOFs), 具有相对其他金属构成的MOFs更好的生物相容性和安全性[9], 同时, 还能通过辅助诱导铁死亡等方式直接发挥抗肿瘤功能。此外, 由于Fe固有的磁响应能力, 使得Fe基MOFs具有天然的磁靶向和核磁共振成像潜力, 通过对其结构等进行调整, 可发挥主动靶向和诊疗一体化的功能[10]。因此, Fe基MOFs作为一种具有高安全性和高附加值的新型药物载体, 在抗肿瘤药物递送方面具有独特优势[11]。
|
Figure 1 The structures of metal-organic frameworks (MOFs). A: MIL88-Cr; B: MOF199-Cu; C: NU1000-Zr; D: MIL53-Al; E: MOF5-Zn; F: MIL101-Fe |
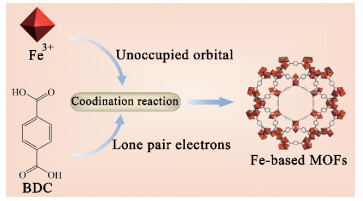
Fe基MOFs依靠Fe离子或团簇提供的空轨道接受有机配体的孤对电子, 进而形成配位键并组装成聚合物晶体(图 2)。目前的制备方法主要有溶剂热合成法、超声合成法、微波合成法、干凝胶转化法等。
|
Figure 2 Fe-based MOFs are formed by coordination reaction between Fe and organic ligand (take MIL101 Fe-based MOF as an example). BDC: 1, 4-Dicarboxybenzene |
溶剂热法是最为常见、简便和有效的合成方法, 通常是将Fe盐(如FeCl3·H2O等) 和有机配体[如对苯二甲酸(1, 4-dicarboxybenzene, BDC)、均苯三甲酸等] 溶于合适的溶剂中, 在高温高压条件下进行合成。常用溶剂主要有N, N-二甲基甲酰胺(N, N-dimethylformamide, DMF)、水、甲醇、乙醇、二甲基亚砜等, 其中以DMF和水最为常用。
DMF有极强的溶解能力, 且在反应过程中因加热分解而产生的二甲胺可辅助配体脱质子, 从而与Fe进行配位。Chen等[12]将0.675 g的FeCl3·6H2O和0.225 g的BDC溶于15 mL的DMF中, 在110 ℃条件下反应24 h得到MIL101型Fe基MOF。然而, DMF存在一定的毒性问题, 因此在载药前应当对MOFs孔隙中的残留DMF进行彻底的清除。常规的清除方法是使用合适的溶剂进行溶出和清洗, Chen等[12]为清除MIL101型Fe基MOF中残留的DMF, 使用大量乙醇和去离子水进行清洗, 之后使用95%的乙醇浸泡24 h, 并在200 ℃条件下真空干燥过夜, 才进行后续载药。
水是另一种常用溶剂, 使用水作为合成溶剂的方法也被称为水热合成法。以Fe3+和均苯三甲酸为原料, 通过水热合成法即可制备MIL100等构型的Fe基MOFs, 这一过程中常添加氢氟酸作为矿化剂以调节其晶体状态[7]。使用水作为溶剂的好处是安全性更高, 然而水的溶解能力有限, 对有机配体的水溶性要求较高, 并在一定程度上限制了制备的效率。
1.2 超声合成法超声合成法是一种高效快速的合成方法, 与溶剂热法的区别在于, 由超声波提供配位反应所需能量, 而不由加热提供。Gordon等[13]将1.35 g的FeCl3·6H2O和0.83 g的BDC溶于25 mL的DMF中, 在不控制温度的条件下使用探头超声, 仅10 min便合成出均匀的MIL53型Fe基MOF, 而溶剂热法通常需几小时到几十小时不等。
1.3 微波合成法微波合成法是利用微波提供能量, 合成Fe基MOFs的方法, 同样具有快速和高效的特点。Dong等[14]用微波将反应物溶液加热至150 ℃, 10 min就合成出MIL53型Fe基MOF。Ma等[15]对微波合成法制备MIL88B型Fe基MOF的反应时间进行了研究, 发现即使是微波介入仅1 min, 也可得到结晶度良好的MIL88B微晶。
1.4 干凝胶转化法干凝胶转化法的特点是所使用的Fe无需是离子状态, 单质Fe也可直接用于合成, 且反应可持续性好, 产生的废物少。Imteaz等[16]通过干凝胶转化法, 将0.341 g的Fe单质和0.884 g的均苯三甲酸置于反应容器上层, 3 mL的水置于反应容器下部, 165 ℃条件下直接合成了MIL100型Fe基MOF。
2 Fe基MOFs作为抗肿瘤药物载体的特点 2.1 较强的载药能力Fe基MOFs具有较强的载药能力, 主要表现在其载药量高、荷载药物极性跨度大、对药物尺寸的适应能力强等特点(表 1[4, 9, 10, 12, 13, 17-35])。
| Table 1 Statistics of drug loading of Fe-based MOFs. DOX: Doxorubicin; siRNA: Small interfering ribonucleic acid; 5-Fu: Fluorouracil |
当前的有机纳米药物普遍存在载药量过低的问题, 如脂质体的载药量通常难以超过1 wt%, 而聚合物纳米粒只有约6 wt%的载药量[9]。这就意味着患者会摄入大量辅料, 导致身体负担加重。
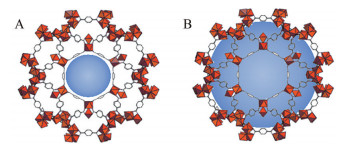
MOFs具有高孔隙率和大比表面积的特点, 被公认具有更高的载药潜力[36]。而MOFs的孔隙通常处于微孔级别(孔径小于2 nm), 是对其载药能力的限制。使用在空间结构上具有更长分子尺寸的有机配体可带来更大的孔径, 然而经由这种策略制备的MOFs通常稳定性较差, 孔隙易崩塌[37]。而MIL100、MIL101等构型Fe基MOFs具有笼形结构, 除了常规的微孔, 其笼内空间则呈现介孔级别(2~50 nm) 的孔径(图 3), 从而在保证结构稳定性的前提下极大地提高了载药能力[19, 37]。以抗白血病药物白消安(busulfan, Bu) 为例, 脂质体对其负载量仅有0.4 wt%, 而MIL100型的Fe基MOF对Bu的载药量可达25 wt%, 是脂质体的62.5倍[19]; Gao等[33]使用MOF-5型Fe基MOF实现了对抗肿瘤药物5-氟尿嘧啶(fluorouracil, 5-Fu) 35 wt%的载药量, 相比之下, 采用壳聚糖-金纳米粒复合系统对5-Fu的载药量最高为11.85 wt%, 不足Fe基MOF的1/3[38], 即使是以高载药量著称的胶束也只能达到19 wt%的载药量, 仍不及Fe基MOFs[39]的载药量。
|
Figure 3 Micropores (A) on the surface and mesoporous (B) inside the cage structure of Fe-based MOFs |
肿瘤联合用药的兴起对纳米载体提出了新要求, 即拥有对两种或以上不同药物的负载能力。不同药物往往具有不同极性, 目前很多纳米载体主要针对某单一极性的药物进行递送, 如递送疏水性药物的胶束[40]。此类纳米载体难以独自承担联合给药的任务, 必须引入其他的纳米系统。
Fe基MOFs自身结构中既包含高极性的Fe离子或Fe团簇, 又包含低极性的有机配体, 提供了高适应性的内部微环境。因此无论是亲水性药物、疏水性药物还是两亲性药物, 均能进行有效负载, 这为不同性质药物发挥协同抗肿瘤作用提供了有利条件。在这方面的研究中, Horcajada等[19]使用MIL100型的Fe基MOF对不同性质的药物进行了负载实验。结果发现, 对于疏水性的布洛芬, 其载药量可达33 wt%, 两亲性咖啡因的载药量可达33 wt%, 而亲水性舒利苯酮的载药量更是达到了惊人的69.2 wt%。而且对于不同极性的药物, Fe基MOFs可将之同时进行荷载, 如Bernhard等[22]使用MIL-88A构型Fe基MOF, 成功地按照1∶3、1∶1和3∶1等不同比例同时荷载了亲水性的伊立替康和疏水性的5-Fu, 其中伊立替康和5-Fu的载药量分别为10.3 wt%和3.61 wt%时, 即两药比例为3∶1时, 对宫颈癌细胞的耐药性有良好的对抗作用, 具有最佳抗肿瘤效果。
2.1.3 Fe基MOFs具有对不同尺寸药物的高适应能力孔隙是MOFs载药的主要基础, 理想情况下, 药物尺寸应与MOFs孔隙相适应, 否则易存在药物释放的可控性不高、制剂的稳定性和生物利用度低的情况, 并伴随着潜在的毒性风险[41]。
MIL53、MIL88、MIL89等柔性结构的Fe基MOFs具有独特的“呼吸现象”, 其孔隙的开放程度能随药物尺寸做出调整[36]。Horcajada等[18]发现, 使用柔性的MIL53型Fe基MOF上负载模型药物布洛芬时, 其孔隙会针对布洛芬的几何尺寸和能量特性进行适应性改变, 从而减小布洛芬在孔隙中的可移动性。出于这种对药物的适应性行为, MIL53型Fe基MOF能以近似零级动力学的行为, 实现对布洛芬长达3周的释放, 拥有出色的缓释能力, 有效延长了药物的血浆半衰期, 提高了其生物利用度[18]。
2.2 良好的肿瘤靶向性纳米药物的靶向能力可将药物富集于肿瘤部位, 减少正常组织的分布, 起到减毒增效的作用[42]。在这方面, Fe基MOFs藉由良好的尺寸和形貌控制而拥有优良的被动靶向能力, 同时也能通过Fe对磁场的响应能力和表面修饰等获得主动靶向能力。
2.2.1 Fe基MOFs具有良好的被动靶向能力被动靶向是通过纳米药物自身固有的非特异性质, 被动性地在肿瘤组织富集[43, 44]。其中, 依靠自身尺寸并借助高通透性和滞留(enhanced permeability and retention effect, EPR) 效应在肿瘤部位进行富集, 是纳米药物对肿瘤被动靶向最主要的策略[45, 46]。在EPR效应中, 通常认为大尺寸纳米粒保留性较好而渗透性较差, 而小尺寸纳米粒渗透性好而保留性差[47, 48]。因此, 能平衡渗透性与保留性的尺寸是至关重要的, 而这个理想尺寸通常因肿瘤类型而改变[47, 48]。Fe基MOFs有着良好的尺寸可调控性, 一般来说, 通过简单控制合成时间、物料浓度等条件可有效控制尺寸[49], 从而可针对不同肿瘤调整粒径, 以得到优良的被动靶向性。
机体的生理性屏障是保护特定组织和器官的重要防线, 其中最具代表性的就是血脑屏障(blood-brain barrier, BBB)。BBB通过控制血液和大脑之间的物质交换而保护大脑稳态, 然而对于常规的纳米药物而言, 却是一道难以跨越的天堑, 直接阻碍了其对脑内肿瘤的靶向[50]。常规纳米药物难以跨越BBB的一大原因在于其球形外貌穿透性较弱, 而Qiao等[23]发现MIL-88B型Fe基MOF的子弹形外貌, 与善于入侵大脑的狂犬病毒的外貌相近, 因而具有良好的BBB穿透能力。在此基础上, 通过调整溶剂量对MOF的直径及长宽比等进行了优化, 辅以狂犬病毒蛋白修饰, 获得了仿生狂犬病毒Fe基MOF, 被证明有良好的脑肿瘤靶向能力[23, 31]。
2.2.2 Fe基MOFs具有良好的主动靶向能力主动靶向包括物理靶向和生物靶向, 物理靶向依靠自身特有的物理化学性质(如磁性等), 配合外部物理干预使纳米药物主动靶向至肿瘤或在肿瘤微环境中特异性释放[51]; 生物靶向主要依靠修饰在纳米药物表面的靶向配体, 与肿瘤部位表达的分子靶标相结合使纳米药物靶向于肿瘤[52, 53]。
2.2.2.1 Fe基MOFs具有良好的磁靶向能力通过磁场将磁响应性纳米药物引导至肿瘤部位的磁靶向是最典型的物理靶向手段, 具有低成本、高效率和易操作的特点[54]。超顺磁Fe3O4纳米粒曾是最佳的磁靶向纳米材料, 然而, 菲力磁Fe3O4纳米粒因超敏反应导致退市[55, 56], 使人们产生了对其安全性的怀疑。而磁性Fe基MOFs作为一种有机无机相结合的材料, 相对纯粹无机纳米载体有更高的安全性[36]。Yang等[57]制备了透明质酸修饰的磁性Fe基MOF, 磁滞曲线分析表明其饱和磁化强度为34 emu·g-1, 具有理想的磁靶向能力, 且体外实验表明该MOF在不负载药物的情况下对HeLa细胞无明显抑制作用, 有良好的安全性。
2.2.2.2 Fe基MOFs具有良好的生物靶向能力生物靶向需将靶向配体修饰于纳米药物的表面, 以暴露出靶向配体的活性中心, 因此理想载体应具有良好的表面可修饰性[58]。使用功能化的有机配体能有效提高Fe基MOFs的表面可修饰性, 其中最经典的方式是使用氨基化配体制备氨基化Fe基MOFs。如使用2-氨基对苯二甲酸(2-aminoterephthalic acid, BDC-NH2) 替代BDC, 能赋予MOFs氨基位点, 这些氨基位点可用作进一步表面修饰的桥头堡, 与多种靶向配体通过共价键等方式结合, 将靶向配体固定于MOFs表面, 产生主动靶向效果。Gao等[33]利用该策略制备了Fe-MOF-5-NH2负载5-Fu, 并通过其表面的氨基修饰叶酸, 从而提高了MOF对肝癌细胞的靶向能力。
2.3 较高的安全性MOFs由金属节点和有机配体通过配位键构成, 因此决定其安全性的因素主要有以下3点: MOFs在体内降解的难易度、解离后产生的金属离子的安全性和有机配体的安全性。
2.3.1 Fe基MOFs具有良好的可生物降解性良好的生物可降解性能够保障载体在较短时间内分解成小分子物质, 进而排出体外, 减轻机体代谢负担[59]。配位键相对较弱的结合力保证了Fe基MOFs良好的可降解性[60], 尤其是在酸性和还原性的肿瘤微环境中, 更易造成Fe基MOFs配位键的解离。Baati等[61]制备了MIL88A、MIL88B及MIL100等多种Fe基MOFs, 通过静脉注射到大鼠体内, 发现Fe基MOFs在体内会被肝脏和脾脏迅速分解成Fe离子和有机配体, 并通过尿液和粪便排除, 基本不存在代谢毒性。
2.3.2 Fe基MOFs中的Fe元素具有较高的安全性常见的组成MOFs的金属元素有Cr、Cu、Zr、Al、Zn、Fe等, 其中, Cr通常被认为是毒性最大的, 而Zn和Fe通常被认为是毒性最小的两种[62]。Cr基MOFs是最早被开发用于药物传递的MOFs, 正是由于毒性过高的问题, 研究者才转而开发Fe基MOFs代替其进行药物递送[11]。Zn通常被认为是安全的, 但Tamames-Tabar等[63]的一项研究显示, 由于Zn2+竞争性结合离子通道, 干扰细胞的新陈代谢, 导致Zn基MOFs依然有高于Fe基MOFs的毒性[11]。Fe元素作为人体必须微量元素和血红蛋白的关键组成成分, 具有更高安全性[21, 64]。Ploetz等[65]研究了MIL100型Fe基MOF的细胞毒性, 结果显示, 在浓度为100 μg·mL-1时对HeLa细胞活性几乎无任何影响, 而其IC50值高达3 g·mL-1。而在实际应用中, MIL88A构型的Fe基MOF已被美国食品药品监督管理局(Food and Drug Administration, FDA) 批准作为补铁剂应用, 也证明了其较高的安全性[7]。
2.3.3 Fe基MOFs中的有机配体影响其安全性值得注意的是, 药物的毒性总是和剂量相关的, 过多Fe的摄入也会造成肝脏和脾脏的氧化应激等机体代谢负担[62], 因此必须考虑如何控制Fe的剂量。Fe基MOFs中有机配体的存在减轻了Fe的比重, 如MIL100型Fe基MOF中Fe与配体均苯三甲酸的比例为3∶2[25], 结合两者分子质量可得出Fe占MOF全部质量的28.5%左右, 极大降低了Fe的摄入量。
此外, 配体本身的毒性也影响MOF的安全性。Fe基MOFs中以BDC、均苯三甲酸等羧酸类配体居多, 此二者对于大鼠口服半数致死量为6.4和8.4 g·kg-1[19], 且易从体内排出, 属于较为安全的配体[66]。然而二者依然存在一定问题, 主要为对口腔、呼吸道、眼组织和皮肤等具有一定刺激性[62], 因此对有机配体的优化仍值得研究。
2.4 辅助诱导肿瘤铁死亡铁死亡是一种通过多不饱和脂肪酸过氧化造成的铁依赖性非凋亡性细胞死亡形式[67, 68]。肿瘤细胞对凋亡途径的抗性及其对Fe元素的旺盛需求使得铁死亡迅速成为抗肿瘤研究的热点[68-70]。
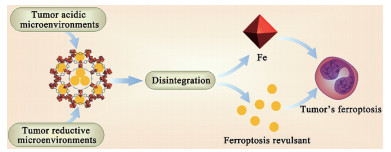
在众多纳米载体中, Fe基MOFs自带Fe元素, 且良好的可降解性保证其能在肿瘤微环境中迅速释放Fe离子参与铁死亡过程, 可以说是辅助诱导铁死亡的理想纳米载体(图 4)。Xu等[71]使用转铁蛋白修饰的Fe基MOF负载荜茇酰胺用于乳腺癌的治疗, 荜茇酰胺是一种有效的铁死亡诱导剂, 可通过降低肿瘤细胞内谷胱甘肽(glutathione, GSH) 水平诱导铁死亡发生, 这一过程需大量Fe参与, 而转铁蛋白通过增加肿瘤细胞对Fe基MOF的摄入效率来提升细胞内Fe含量, 进而通过芬顿反应产生大量活性氧(reactive oxygen species, ROS), 破坏肿瘤细胞膜, 展现了良好的抗肿瘤效果。
|
Figure 4 Fe-based MOFs disintegrate in acidic and reductive tumor microenvironment, release Fe and ferroptosis revulsant, and jointly induce tumor iron death, which has the effect of medicine and auxiliary combination |
肿瘤细胞内H2O2不足是制约通过铁死亡机制发挥抗肿瘤效果的关键因素, 而通过与肿瘤饥饿疗法的联合可有效解决这一问题[4]。如Yang等[24]使用Fe基MOF负载葡萄糖氧化酶(glucose oxidase, GOx) 和多柔比星(doxorubicin, DOX), 藉由肿瘤微环境中高水平的GSH对Fe3+的还原作用, 造成MOF解离, 释放GOx和Fe2+, GOx用于肿瘤饥饿治疗的同时产生大量H2O2, 解决了肿瘤细胞内H2O2不足的问题, 依靠H2O2与Fe2+发生芬顿反应, 加速肿瘤细胞铁死亡进程, 并与化疗药物DOX协同诱导肿瘤免疫原性死亡, 启动肿瘤免疫过程, 而肿瘤饥饿疗法通过抑制肿瘤细胞糖酵解降低了乳酸堆积, 从而改善肿瘤免疫微环境, 协同提高了肿瘤免疫治疗效率, 形成一种多效协同的抗肿瘤机制。
3 Fe基MOFs的功能与类型随着近年来研究的不断加深, Fe基MOFs逐渐被开发出多种类型, 在递送抗肿瘤药物的同时还具有辅助成像、磁热疗、光疗及智能响应释放等诸多功能, 表现出诊疗一体化、多疗法协同抗肿瘤等应用潜力(图 5)。
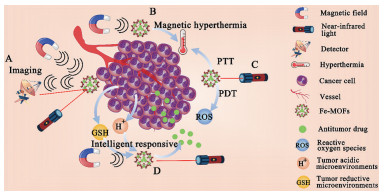
|
Figure 5 Functions and types of Fe-based MOFs. A: Fe-based MOFs can play the role of imaging under excitation of magnetic field and light; B: Fe-based MOFs can play the role of magnetic hyperthermia under magnetic field; C: Fe-based MOFs can play the role of photodynamic therapy (PDT) and photothermal therapy (PTT) under the excitation of light; D: Fe-based MOFs can play an intelligent release effect under the influence of external stimuli and tumor microenvironment. GSH: Glutathione |
通过使用具有成像功能的材料构成药物递送系统, 可实现在递送药物的同时, 辅助肿瘤病情诊断, 具有诊疗一体化的功能。
3.1.1 核磁成像型Fe基MOFs以顺磁性金属阳离子(如Gd3+、Mn2+、Fe3+等) 作为金属节点的MOFs可作为造影剂提高核磁成像的成像能力, 而其中低毒性的Fe3+是最佳选择[6]。Fe基MOFs结构中的Fe离子可视为路易斯酸, 与一部分水分子能通过强配位作用结合, 而游离水分子能通过MOFs的孔隙扩散, 并与结合水分子进行交换, 进而影响水质子弛豫, 使Fe基MOFs拥有核磁成像功能[19]。Wang等[31]利用聚乳酸和聚乙二醇修饰的MIL101型Fe基MOF荷载二氢青蒿素(dihydroartemisinin, DHA), 用于宫颈癌治疗, 发现该MOF在提高DHA药效的同时还具有良好的T2核磁成像能力, 由于肿瘤处EPR效应对其的保留, 成像时间可一直持续到注射后24 h。
3.1.2 荧光成像型Fe基MOFs电子在受到激发后会从基态跃迁至激发态, 而激发态的电子不稳定, 会通过释放能量回到基态, 以荧光形式释放的能量可用于荧光成像, 能实时反映药物或机体状态[72, 73]。Fe基MOFs可通过多种策略获得荧光成像能力, 首先, 某些构型的Fe基MOFs (如MIL53型) 本身就具有荧光成像能力[74]; 其次, 良好的可修饰性使很多原本无荧光或荧光较弱的Fe基MOFs使用荧光试剂(如5-羧基荧光素) 进行表面修饰进而拥有荧光成像能力[33]; 最后, 强大的载药能力使其可直接负载荧光剂[如吲哚菁绿(indocyanine green, ICG)] 进行荧光成像[26]。值得注意的是, Fe3+和Fe2+之间的转换会引起Fe基MOFs荧光强度的变化。Xie等[75]发现抗坏血酸能通过干预Fe离子与BDC-NH2之间的电荷转移影响其荧光能力, 当抗坏血酸将Fe3+还原为Fe2+的时候, Fe与配体间的电荷转移被抑制, 从而对BDC-NH2的荧光具有增强作用, 这启示或可利用这种荧光变化来反映肿瘤微环境的氧化还原情况, 帮助及时调整肿瘤治疗策略。
3.1.3 多模态成像型Fe基MOFs在实际诊疗中, 单一成像体系往往难以提供足够全面的信息, 而在Fe基MOFs的核磁共振或荧光成像基础上, 通过功能化修饰或制备核壳结构MOFs等方式, 可使其具有多模态成像的功能[26, 76]。Fan等[77]使用氨基化MIL101型Fe基MOF荷载免疫佐剂CpG-ODN (cytosine phosphate-guanosine oligonucleotide), 并利用其氨基结合ICG制备得到ICG-CpG@MOF, 该MOF在体内可通过释放CpG-ODN激活免疫反应, 产生对乳腺癌细胞的杀伤作用, 且由于Fe3+和ICG的存在而同时具有核磁、荧光、光声、光热四重成像功能, 极大提高了对肿瘤内部情况的诊断能力。
3.2 Fe基MOFs的磁热疗功能热疗通过对肿瘤组织选择性地加热至39~45 ℃, 产生对肿瘤的抑制和杀伤作用[78], 具有高安全性的特点[79]。近年来研究还发现, 热疗能与化疗[80]、基因疗法[81]、免疫疗法[82]等产生良好的协同作用。然而, 传统加热方法效率和精度不足导致热疗发展缓慢, 疗效有限[83]。而磁热疗法通过磁性纳米制剂对肿瘤的靶向性, 配合交变磁场对人体的高穿透力, 在肿瘤部位直接产生感应热[84], 具有对深层肿瘤的有效杀伤能力, 被认为是一种极具前景的肿瘤治疗方式[83]。
磁性Fe3O4-MOF兼具Fe3O4对交变磁场的良好响应能力和MOFs的安全性, 是一种新型磁热制剂, 适用于磁热疗法与化疗等其他疗法的协同治疗。Xiang等[85]利用聚乙烯吡咯烷酮修饰的Fe3O4-MOF负载DOX用于裸鼠舌鳞癌的治疗, 发现在外加磁场作用下, Fe3O4-MOF能使肿瘤部位迅速升温至42.4 ± 0.3 ℃, 与DOX显示了良好的磁热疗-化疗协同抗肿瘤作用。
3.3 Fe基MOFs的光疗功能肿瘤光疗主要指光热疗法(photothermal therapy, PTT) 与光动力疗法(photodynamic therapy, PDT), 利用光热剂或光敏剂在特定光线激发下产生热量或ROS来产生对肿瘤的杀伤作用, 因其疗效高、不良反应小等特点而成为抗肿瘤疗法的热点[86]。光疗纳米制剂的关键在于光热剂和光敏剂的选择, 卟啉是一种具有光热和光敏特性的大分子杂环化合物, 同时其结构上具有天然配位点, 可与Fe元素配位组成Fe基MOFs。Wang等[87]利用这一特点制备了Fe-卟啉MOF, 在1 W·cm-2的近红外光下, 50 μg·mL-1的Fe-卟啉MOF可产生48.6 ℃的高温, 具有肿瘤光热治疗效应; 同时, 其中的Fe原子通过自旋状态的改变可促进ROS产生, 发挥光动力治疗效应。两相联合能使裸鼠的宫颈癌显著消退, 且无明显器官损伤和炎症反应。
3.4 Fe基MOFs的智能响应释放功能智能响应型纳米药物能对肿瘤微环境(如酸性、还原性微环境等) 或外部物理刺激(如磁场、光照、超声波等) 进行响应, 从而控制药物释放, 在增强疗效同时还能降低药物不良反应。
3.4.1 肿瘤微环境响应型Fe基MOFs肿瘤微环境响应型纳米药物主要利用肿瘤酸性和还原性等微环境特点, 使纳米载体发生状态变化或结构崩解, 达成药物在肿瘤组织中定点释放的目的。对于Fe3+构筑的Fe基MOFs, 肿瘤微环境中GSH会改变其中Fe离子的价态, 从而导致MOFs结构的崩解, 带来对肿瘤微环境的响应性释放[24]。肿瘤的酸性微环境也能加速Fe基MOFs的崩解, 而在其表面修饰以pH响应性涂层则是一种很好的策略。Yang等[57]使用羟基磷灰石修饰得到具有pH响应能力的Fe基MOF, 在肿瘤酸性微环境下释放所负载的DOX, 用于抑制HeLa细胞, 能避免因药物在正常组织释放造成的不良反应。
3.4.2 物理刺激响应型Fe基MOFs除了对肿瘤微环境进行响应, 通过超声、磁场、激发光等外部刺激也可控制纳米载体的变化, 控制药物的释放部位及释放时间。
超声波可导致Fe基MOFs发生空化和塌陷, 进而释放其中所包含的药物。Ibrahim等[35]制备了Fe-NDC型Fe基MOFs, 分别负载钙黄绿素和DOX, 发现在无超声刺激时, 药物释放缓慢(10 min释放17.8%), 而在低频超声干预下, 其释放速率显著提高(10 min释放95.2%)。通过磁场触发药物释放是另一种物理刺激响应释放形式。Xiang等[85]所制备的负载DOX的Fe3O4-MOF具有磁场响应能力, 经测试发现, 该MOF在无磁场介入情况下6 h内药物释放量仅为4%, 而磁场介入后, 15 min内即可释放7.3%的药物, 经3次磁场介入累计可释放24%。
3.4.3 多重刺激响应型Fe基MOFs能同时对多种因素进行响应的多重响应型载体可带来多重效果。He等[88]在构建的二硫化Fe基MOF中掺杂了Cu元素, 并用其负载液态全氟戊烷, 二硫键的存在使其能对肿瘤还原型微环境进行响应, 消耗GSH的同时释放Fe离子, 诱发裸鼠肝肿瘤的铁死亡; 同时Cu元素的掺杂使其能响应近红外刺激, 将液态全氟戊烷转化为气态, 所产生的气泡可提供超声成像的效果。
4 总结与展望目前的药物纳米载体中, 有机载体与无机载体都已逐步走向成熟, 但也有各自固有的问题: 有机载体安全性相对较高, 但载药量低; 无机载体载药量高, 但通常毒性较大。而由无机和有机相结合构成的MOFs载体则集合了两者的优势, 其中, Fe基MOFs具有载药能力强、靶向性好、安全性高以及能辅助诱发肿瘤铁死亡的特点, 同时基于Fe元素及配体的特性, 又发展出成像、磁热疗、光疗、响应性释放等不同功能的Fe基MOFs, 在抗肿瘤疗法多元化和联合治疗的大趋势下, 必将在抗肿瘤药物递送领域得到进一步开发利用。
尽管有以上诸多优势, Fe基MOFs用于抗肿瘤药物递送的研究时日尚浅, 仍存在一定问题, 需进一步改进和完善。首当其冲的是Fe基MOFs目前的制备工艺尚不适宜于工业化生产: 溶剂热法需高温高压条件, 能源耗费较高且效率低, 且常用到氢氟酸等有毒试剂, 环境友好性较差; 微波等方法尽管高效快速, 但对仪器精度和操作要求较高, 目前仍大多局限于实验室制备, 导致商业化的Fe基MOFs产量依然有限, 价格较高, 限制了其应用。因此, 开发高效且环境友好的Fe基MOFs合成方法是其走向市场的关键之一。其二, 孔隙是Fe基MOFs用于载药的关键, Fe基MOFs制备过程中大多需依靠有机溶剂作为介质, 造成了有机溶剂在孔隙中易残留, 带来毒性问题; 而使用水作为合成介质则由于其溶解性较差限制了有机配体的选择性和合成效率, 同时, 水的表面张力较大, 在进行载药前的活化过程中, 随着水的清除过程而产生对孔隙的应力, 造成孔隙崩塌而降低载药量。这方面的改进可从优化溶剂和活化方式进行, 良好的合成介质应当具有无毒、易挥发和表面张力小的特点, 而使用冻干法和二氧化碳超临界流体法进行活化, 则可借助升华过程和二氧化碳超临界流体对孔隙的应力更小的特点保护孔隙结构, 从而提高其载药效率。第三, 很多Fe基MOFs在开发之初是为了应用于吸附、催化等方面, 在选用有机配体时多以其化工性质为主进行考虑, 对人体而言难免具有一定的刺激性, 从药用角度出发, 对其有机配体的优化应当受到研究者的重视, 尤其是使用带有特定功能或抗癌药理效果的化合物充当有机配体, 可进一步提高其抗肿瘤效果, 并具有药辅合一的优势。最后, Fe基MOFs的构型和种类繁多, 不同的Fe基MOFs因其结构等的不同可能导致其稳定性和安全性的差异, 然而目前, 评价不同种类Fe基MOFs的体内外代谢过程与安全性、生物相容性方面的研究相对较少, 有必要就此方面进行系统性研究, 以提供足以支持Fe基MOFs走上临床应用的安全性证据。
作者贡献: 郭弘主要负责收集资料和撰写; 李霞和瞿鼎给出重要意见与建议; 陈彦对文章的主体和修改进行指导。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Xia Q, Wang H, Huang B, et al. State-of-the-art advances and challenges of iron-based metal organic frameworks from attractive features, synthesis to multifunctional applications[J]. Small, 2019, 15: e1803088. |
| [2] |
Ma L, Jiang F, Fan X, et al. Metal-organic-framework-engineered enzyme-mimetic catalysts[J]. Adv Mater, 2020, 32: e2003065. DOI:10.1002/adma.202003065 |
| [3] |
Zhou Y, Niu B, Wu B, et al. A homogenous nanoporous pulmonary drug delivery system based on metal-organic frameworks with fine aerosolization performance and good compatibility[J]. Acta Pharm Sin B, 2020, 10: 2404-2416. DOI:10.1016/j.apsb.2020.07.018 |
| [4] |
Wan X, Song L, Pan W, et al. Tumor-targeted cascade nanoreactor based on metal-organic frameworks for synergistic ferroptosis-starvation anticancer therapy[J]. ACS Nano, 2020, 14: 11017-11028. DOI:10.1021/acsnano.9b07789 |
| [5] |
Lu Z, Liu J, Zhang X, et al. Node-accessible zirconium MOFs[J]. J Am Chem Soc, 2020, 142: 21110-21121. DOI:10.1021/jacs.0c09782 |
| [6] |
Gu ZY, Yang CX, Chang N, et al. Metal-organic frameworks for analytical chemistry: from sample collection to chromatographic separation[J]. Acc Chem Res, 2012, 45: 734-745. DOI:10.1021/ar2002599 |
| [7] |
Wang Y, Wu W, Liu J, et al. Cancer-cell-activated photodynamic therapy assisted by Cu(Ⅱ)-based metal-organic framework[J]. ACS Nano, 2019, 13: 6879-6890. DOI:10.1021/acsnano.9b01665 |
| [8] |
Wang Y, Jia X, Yang H, et al. A strategy for constructing pore-space-partitioned MOFs with high uptake capacity for C2 hydrocarbons and CO2[J]. Angew Chem Int Ed Engl, 2020, 59: 19027-19030. DOI:10.1002/anie.202008696 |
| [9] |
Pham H, Ramos K, Sua A, et al. Tuning crystal structures of iron-based metal-organic frameworks for drug delivery applications[J]. ACS Omega, 2020, 5: 3418-3427. DOI:10.1021/acsomega.9b03696 |
| [10] |
Wyszogrodzka G, Dorożyński P, Gil B, et al. Iron-based metal-organic frameworks as a theranostic carrier for local tuberculosis therapy[J]. Pharm Res, 2018, 35: 144. DOI:10.1007/s11095-018-2425-2 |
| [11] |
Liu X, Liang T, Zhang R, et al. Iron-based metal-organic frameworks in drug delivery and biomedicine[J]. ACS Appl Mater Interfaces, 2021, 13: 9643-9655. DOI:10.1021/acsami.0c21486 |
| [12] |
Chen Q, Xu M, Zheng W, et al. Se/Ru-decorated porous metal-organic framework nanoparticles for the delivery of pooled siRNAs to reversing multidrug resistance in taxol-resistant breast cancer cells[J]. ACS Appl Mater Interfaces, 2017, 9: 6712-6724. DOI:10.1021/acsami.6b12792 |
| [13] |
Gordon J, Kazemian H, Rohani S. MIL-53(Fe), MIL-101, and SBA-15 porous materials: potential platforms for drug delivery[J]. Mater Sci Eng C Mater Biol Appl, 2015, 47: 172-179. DOI:10.1016/j.msec.2014.11.046 |
| [14] |
Dong WF, Liu X, Shi WB, et al. Metal-organic framework MIL-53(Fe): facile microwave-assisted synthesis and use as a highly active peroxidase mimetic for glucose biosensing[J]. RSC Adv, 2015, 5: 17451-17457. DOI:10.1039/C4RA15840G |
| [15] |
Ma MY, Bétard A, Weber I, et al. Iron-based metal-organic frameworks MIL-88B and NH2-MIL-88B: high quality microwave synthesis and solvent-induced lattice "breathing"[J]. Cryst Growth Des, 2013, 13: 2286-2291. DOI:10.1021/cg301738p |
| [16] |
Imteaz AJJ, Nazmul AK, Sung HJ. Synthesis of a metal-organic framework, iron-benezenetricarboxylate, from dry gels in the absence of acid and salt[J]. Cryst Growth Des, 2012, 12: 5878-5881. DOI:10.1021/cg3014317 |
| [17] |
Al Haydar M, Abid HR, Sunderland B, et al. Metal organic frameworks as a drug delivery system for flurbiprofen[J]. Drug Des Devel Ther, 2017, 11: 2685-2695. DOI:10.2147/DDDT.S145716 |
| [18] |
Horcajada P, Serre C, Maurin G, et al. Flexible porous metal-organic frameworks for a controlled drug delivery[J]. J Am Chem Soc, 2008, 130: 6774-6780. DOI:10.1021/ja710973k |
| [19] |
Horcajada P, Chalati T, Serre C, et al. Porous metal-organic-framework nanoscale carriers as a potential platform for drug delivery and imaging[J]. Nat Mater, 2010, 9: 172-178. DOI:10.1038/nmat2608 |
| [20] |
Leng X, Dong X, Wang W, et al. Biocompatible Fe-based micropore metal-organic frameworks as sustained-release anticancer drug carriers[J]. Molecules, 2018, 23: 2490. DOI:10.3390/molecules23102490 |
| [21] |
Gao X, Zhai M, Guan W, et al. Controllable synthesis of a smart multifunctional nanoscale metal-organic framework for magnetic resonance/optical imaging and targeted drug delivery[J]. ACS Appl Mater Interfaces, 2017, 9: 3455-3462. DOI:10.1021/acsami.6b14795 |
| [22] |
Bernhard I, Stefan W, Hanna E. Liposome-coated iron fumarate metal-organic framework nanoparticles for combination therapy[J]. Nanomaterials (Basel), 2017, 7: 351. DOI:10.3390/nano7110351 |
| [23] |
Qiao C, Zhang R, Wang Y, et al. Rabies virus-inspired metal-organic frameworks (MOFs) for targeted imaging and chemotherapy of glioma[J]. Angew Chem Int Ed Engl, 2020, 59: 16982-16988. DOI:10.1002/anie.202007474 |
| [24] |
Yang J, Ma S, Xu R, et al. Smart biomimetic metal organic frameworks based on ROS-ferroptosis-glycolysis regulation for enhanced tumor chemo-immunotherapy[J]. J Control Release, 2021, 334: 21-33. DOI:10.1016/j.jconrel.2021.04.013 |
| [25] |
Rezaei M, Abbasi A, Varshochian R, et al. NanoMIL-100(Fe) containing docetaxel for breast cancer therapy[J]. Artif Cells Nanomed Biotechnol, 2018, 46: 1390-1401. DOI:10.1080/21691401.2017.1369425 |
| [26] |
Cai W, Gao H, Chu C, et al. Engineering phototheranostic nanoscale metal-organic frameworks for multimodal imaging-guided cancer therapy[J]. ACS Appl Mater Interfaces, 2017, 9: 2040-2051. DOI:10.1021/acsami.6b11579 |
| [27] |
Zhou Y, Liu L, Cao Y, et al. A nanocomposite vehicle based on metal-organic framework nanoparticle incorporated biodegradable microspheres for enhanced oral insulin delivery[J]. ACS Appl Mater Interfaces, 2020, 12: 22581-22592. DOI:10.1021/acsami.0c04303 |
| [28] |
Simon MA, Anggraeni E, Soetaredjo FE, et al. Hydrothermal synthesize of HF-free MIL-100(Fe) for isoniazid-drug delivery[J]. Sci Rep, 2019, 9: 16907. DOI:10.1038/s41598-019-53436-3 |
| [29] |
Gandara-Loe J, Ortuño-Lizarán I, Fernández-Sanchez L, et al. Metal-organic frameworks as drug delivery platforms for ocular therapeutics[J]. ACS Appl Mater Interfaces, 2019, 11: 1924-1931. DOI:10.1021/acsami.8b20222 |
| [30] |
Taherzade SD, Rojas S, Soleimannejad J, et al. Combined cutaneous therapy using biocompatible metal-organic frameworks[J]. Nanomaterials (Basel), 2020, 10: 2296. DOI:10.3390/nano10122296 |
| [31] |
Wang C, Jia X, Zhen W, et al. Small-sized MOF-constructed multifunctional diagnosis and therapy platform for tumor[J]. ACS Biomater Sci Eng, 2019, 5: 4435-4441. DOI:10.1021/acsbiomaterials.9b00813 |
| [32] |
Yao YR, Jin YJ, Jia X, et al. Construction of hyaluronic acid-covered hierarchically porous MIL-nanoMOF for loading and controlled release of doxorubicin[J]. Chemistry, 2021, 27: 2987-2992. DOI:10.1002/chem.202004335 |
| [33] |
Gao X, Cui R, Song L, et al. Hollow structural metal-organic frameworks exhibit high drug loading capacity, targeted delivery and magnetic resonance/optical multimodal imaging[J]. Dalton Trans, 2019, 48: 17291-17297. DOI:10.1039/C9DT03287H |
| [34] |
Hu Q, Yu J, Liu M, et al. A low cytotoxic cationic metal-organic framework carrier for controllable drug release[J]. J Med Chem, 2014, 57: 5679-5685. DOI:10.1021/jm5004107 |
| [35] |
Ibrahim M, Sabouni R, Husseini GA, et al. Facile ultrasound-triggered release of calcein and doxorubicin from iron-based metal-organic frameworks[J]. J Biomed Nanotechnol, 2020, 16: 1359-1369. DOI:10.1166/jbn.2020.2972 |
| [36] |
Wu MX, Yang YW. Metal-organic framework (MOF)-based drug/cargo delivery and cancer therapy[J]. Adv Mater, 2017, 29: 1606134. DOI:10.1002/adma.201606134 |
| [37] |
Pham MH, Vuong GT, Vu AT, et al. Novel route to size-controlled Fe-MIL-88B-NH2 metal-organic framework nanocrystals[J]. Langmuir, 2011, 27: 15261-15267. DOI:10.1021/la203570h |
| [38] |
Sathiyaseelan A, Saravanakumar K, Mariadoss AVA, et al. pH-controlled nucleolin targeted release of dual drug from chitosan-gold based aptamer functionalized nano drug delivery system for improved glioblastoma treatment[J]. Carbohydr Polym, 2021, 262: 117907. DOI:10.1016/j.carbpol.2021.117907 |
| [39] |
Li G, Song S, Zhang T, et al. pH-sensitive polyelectrolyte complex micelles assembled from CS-g-PNIPAM and ALG-g-P(NIPAM-co-NVP) for drug delivery[J]. Int J Biol Macromol, 2013, 62: 203-210. DOI:10.1016/j.ijbiomac.2013.08.041 |
| [40] |
Isoglu IA, Ozsoy Y, Isoglu SD. Advances in micelle-based drug delivery: cross-linked systems[J]. Curr Top Med Chem, 2017, 17: 1469-1489. DOI:10.2174/1568026616666161222110600 |
| [41] |
Schneemann A, Bon V, Schwedler I, et al. Flexible metal-organic frameworks[J]. Chem Soc Rev, 2014, 43: 6062-6096. DOI:10.1039/C4CS00101J |
| [42] |
Pérez-Herrero E, Fernández-Medarde A. Advanced targeted therapies in cancer: drug nanocarriers, the future of chemotherapy[J]. Eur J Pharm Biopharm, 2015, 93: 52-79. DOI:10.1016/j.ejpb.2015.03.018 |
| [43] |
Tsujimoto A, Uehara H, Yoshida H, et al. Different hydration states and passive tumor targeting ability of polyethylene glycol-modified dendrimers with high and low PEG density[J]. Mater Sci Eng C Mater Biol Appl, 2021, 126: 112159. DOI:10.1016/j.msec.2021.112159 |
| [44] |
Das RP, Singh BG, Kunwar A. Preparation of a size selective nanocomposite through temperature assisted co-assembly of gelatin and pluronic F127 for passive targeting of doxorubicin[J]. Biomater Sci, 2020, 8: 4251-4265. DOI:10.1039/D0BM00725K |
| [45] |
Sebak AA, El-Shenawy BM, El-Safy S, et al. From passive targeting to personalized nanomedicine: multidimensional insights on nanoparticles' interaction with the tumor microenvironment[J]. Curr Pharm Biotechnol, 2021, 22: 1444-1465. DOI:10.2174/1389201021666201211103856 |
| [46] |
Golombek SK, May JN, Theek B, et al. Tumor targeting via EPR: strategies to enhance patient responses[J]. Adv Drug Deliv Rev, 2018, 130: 17-38. DOI:10.1016/j.addr.2018.07.007 |
| [47] |
Liu R, Xiao W, Hu C, et al. Theranostic size-reducible and no donor conjugated gold nanocluster fabricated hyaluronic acid nanoparticle with optimal size for combinational treatment of breast cancer and lung metastasis[J]. J Control Release, 2018, 278: 127-139. DOI:10.1016/j.jconrel.2018.04.005 |
| [48] |
Ma JB, Shen JM, Yue T, et al. Size-shrinkable and protein kinase Cα-recognizable nanoparticles for deep tumor penetration and cellular internalization[J]. Eur J Pharm Sci, 2021, 159: 105693. DOI:10.1016/j.ejps.2020.105693 |
| [49] |
Cui R, Zhao P, Yan Y, et al. Outstanding drug-loading/release capacity of hollow Fe-metal-organic framework-based microcapsules: a potential multifunctional drug-delivery platform[J]. Inorg Chem, 2021, 60: 1664-1671. DOI:10.1021/acs.inorgchem.0c03156 |
| [50] |
Daneman R, Prat A. The blood-brain barrier[J]. Cold Spring Harb Perspect Biol, 2015, 7: a020412. DOI:10.1101/cshperspect.a020412 |
| [51] |
Vangijzegem T, Stanicki D, Laurent S. Magnetic iron oxide nanoparticles for drug delivery: applications and characteristics[J]. Expert Opin Drug Deliv, 2019, 16: 69-78. DOI:10.1080/17425247.2019.1554647 |
| [52] |
Kumari P, Ghosh B, Biswas S. Nanocarriers for cancer-targeted drug delivery[J]. J Drug Target, 2016, 24: 179-191. DOI:10.3109/1061186X.2015.1051049 |
| [53] |
Zhang Y, Cao J, Yuan Z. Strategies and challenges to improve the performance of tumor-associated active targeting[J]. J Mater Chem B, 2020, 8: 3959-3971. DOI:10.1039/D0TB00289E |
| [54] |
Zhou Z, Shen Z, Chen X. Tale of two magnets: an advanced magnetic targeting system[J]. ACS Nano, 2020, 14: 7-11. DOI:10.1021/acsnano.9b06842 |
| [55] |
FDA. Approved drug products with therapeutic equivalence evaluations 41st edition (orange book) [EB/OL]. Silver Spring: FDA, 2021 [2021-8-30]. https://www.fda.gov/media/71474/download.
|
| [56] |
FDA. Approved drug products with therapeutic equivalence evaluations March 20, 2020 edition [EB/OL]. Silver Spring: FDA, 2020 [2021-8-30]. https://www.fda.gov/media/136324/download.
|
| [57] |
Yang Y, Xia F, Yang Y, et al. Litchi-like Fe3O4@Fe-MOF capped with HAp gatekeepers for pH-triggered drug release and anticancer effect[J]. J Mater Chem B, 2017, 5: 8600-8606. DOI:10.1039/C7TB01680H |
| [58] |
Mukherjee A, Waters AK, Kalyan P, et al. Lipid-polymer hybrid nanoparticles as a next-generation drug delivery platform: state of the art, emerging technologies, and perspectives[J]. Int J Nanomedicine, 2019, 14: 1937-1952. DOI:10.2147/IJN.S198353 |
| [59] |
Mei X. Principles and Methods of Nanotoxicology (纳米毒理学原理与方法)[M]. Beijing: Science Press, 2019.
|
| [60] |
Wang HS, Ding Y. Recent advances of metal-organic frameworks applied in biomedicine[J]. Acta Pharm Sin (药学学报), 2020, 55: 1511-1519. |
| [61] |
Baati T, Njim L, Neffati F, et al. In depth analysis of the in vivo toxicity of nanoparticles of porous iron(ⅲ) metal-organic frameworks[J]. Chem Sci, 2013, 4: 1597-1607. DOI:10.1039/c3sc22116d |
| [62] |
Kumar P, Anand B, Tsang YF, et al. Regeneration, degradation, and toxicity effect of MOFs: opportunities and challenges[J]. Environ Res, 2019, 176: 108488. DOI:10.1016/j.envres.2019.05.019 |
| [63] |
Tamames-Tabar C, Cunha D, Imbuluzqueta E, et al. Cytotoxicity of nanoscaled metal-organic frameworks[J]. J Mater Chem B, 2014, 2: 262-271. DOI:10.1039/C3TB20832J |
| [64] |
Zimmermann MB, Hurrell RF. Nutritional iron deficiency[J]. Lancet, 2007, 370: 511-520. DOI:10.1016/S0140-6736(07)61235-5 |
| [65] |
Ploetz E, Zimpel A, Cauda V, et al. Metal-organic framework nanoparticles induce pyroptosis in cells controlled by the extracellular pH[J]. Adv Mater, 2020, 32: e1907267. DOI:10.1002/adma.201907267 |
| [66] |
Horcajada P, Gref R, Baati T, et al. Metal-organic frameworks in biomedicine[J]. Chem Rev, 2012, 112: 1232-1268. DOI:10.1021/cr200256v |
| [67] |
Dixon SJ, Lemberg KM, Lamprecht MR, et al. Ferroptosis: an iron-dependent form of nonapoptotic cell death[J]. Cell, 2012, 149: 1060-1072. DOI:10.1016/j.cell.2012.03.042 |
| [68] |
Hassannia B, Vandenabeele P, Vanden Berghe T. Targeting ferroptosis to iron out cancer[J]. Cancer Cell, 2019, 35: 830-849. DOI:10.1016/j.ccell.2019.04.002 |
| [69] |
Su Z, Yang Z, Xie L, et al. Cancer therapy in the necroptosis era[J]. Cell Death Differ, 2016, 23: 748-756. DOI:10.1038/cdd.2016.8 |
| [70] |
Li CQ, Tang HX, Zhang Y, et al. Advance in construction of ferroptosis-inducing nanomedicine for cancer therapy[J]. Acta Pharm Sin (药学学报), 2020, 55: 2099-2109. |
| [71] |
Xu R, Yang J, Qian Y, et al. Ferroptosis/pyroptosis dual-inductive combinational anti-cancer therapy achieved by transferrin decorated nanoMOF[J]. Nanoscale Horiz, 2021, 6: 348-356. DOI:10.1039/D0NH00674B |
| [72] |
Matea CT, Mocan T, Tabaran F, et al. Quantum dots in imaging, drug delivery and sensor applications[J]. Int J Nanomedicine, 2017, 12: 5421-5431. DOI:10.2147/IJN.S138624 |
| [73] |
Abelha TF, Dreiss CA, Green MA, et al. Conjugated polymers as nanoparticle probes for fluorescence and photoacoustic imaging[J]. J Mater Chem B, 2020, 8: 592-606. |
| [74] |
Jia J, Xu F, Long Z, et al. Metal-organic framework MIL-53(Fe) for highly selective and ultrasensitive direct sensing of MeHg+[J]. Chem Commun (Camb), 2013, 49: 4670-4672. DOI:10.1039/c3cc40821c |
| [75] |
Xie W, Tian M, Luo X, et al. A dual-mode fluorescent and colorimetric immunoassay based on in situ ascorbic acid-induced signal generation from metal-organic frameworks[J]. Sensors Actuators B Chem, 2020, 302: 127180. DOI:10.1016/j.snb.2019.127180 |
| [76] |
Shang W, Zeng C, Du Y, et al. Core-shell gold nanorod@metal-organic framework nanoprobes for multimodality diagnosis of glioma[J]. Adv Mater, 2017, 29: 1604381. DOI:10.1002/adma.201604381 |
| [77] |
Fan Z, Liu H, Xue Y, et al. Reversing cold tumors to hot: an immunoadjuvant-functionalized metal-organic framework for multimodal imaging-guided synergistic photo-immunotherapy[J]. Bioact Mater, 2021, 6: 312-325. DOI:10.1016/j.bioactmat.2020.08.005 |
| [78] |
Payne M, Bossmann SH, Basel MT. Direct treatment versus indirect: Thermo-ablative and mild hyperthermia effects[J]. Wiley Interdiscip Rev Nanomed Nanobiotechnol, 2020, 12: e1638. |
| [79] |
Datta NR, Ordóñez SG, Gaipl US, et al. Local hyperthermia combined with radiotherapy and-/or chemotherapy: recent advances and promises for the future[J]. Cancer Treat Rev, 2015, 41: 742-753. DOI:10.1016/j.ctrv.2015.05.009 |
| [80] |
Lim ZW, Varma VB, Ramanujan RV, et al. Magnetically responsive peptide coacervates for dual hyperthermia and chemotherapy treatments of liver cancer[J]. Acta Biomater, 2020, 110: 221-230. DOI:10.1016/j.actbio.2020.04.024 |
| [81] |
Kim J, Kim J, Jeong C, et al. Synergistic nanomedicine by combined gene and photothermal therapy[J]. Adv Drug Deliv Rev, 2016, 98: 99-112. DOI:10.1016/j.addr.2015.12.018 |
| [82] |
Moy AJ, Tunnell JW. Combinatorial immunotherapy and nanoparticle mediated hyperthermia[J]. Adv Drug Deliv Rev, 2017, 114: 175-183. DOI:10.1016/j.addr.2017.06.008 |
| [83] |
Kumar CS, Mohammad F. Magnetic nanomaterials for hyperthermia-based therapy and controlled drug delivery[J]. Adv Drug Deliv Rev, 2011, 63: 789-808. DOI:10.1016/j.addr.2011.03.008 |
| [84] |
Zhang YF, Li GL, Gao X, et al. Method for ferrite nanomaterials-mediated cellular magnetic hyperthermia[J]. ACS Biomater Sci Eng, 2020, 6: 6652-6660. DOI:10.1021/acsbiomaterials.0c01443 |
| [85] |
Xiang Z, Qi Y, Lu Y, et al. MOF-derived novel porous Fe3O4@C nanocomposites as smart nanomedical platforms for combined cancer therapy: magnetic-triggered synergistic hyperthermia and chemotherapy[J]. J Mater Chem B, 2020, 8: 8671-8683. DOI:10.1039/D0TB01021A |
| [86] |
Zhen X, Cheng P, Pu K. Recent advances in cell membrane-camouflaged nanoparticles for cancer phototherapy[J]. Small, 2019, 15: e1804105. DOI:10.1002/smll.201804105 |
| [87] |
Wang L, Qu X, Zhao Y, et al. Exploiting single atom iron centers in a porphyrin-like MOF for efficient cancer phototherapy[J]. ACS Appl Mater Interfaces, 2019, 11: 35228-35237. DOI:10.1021/acsami.9b11238 |
| [88] |
He H, Du L, Guo H, et al. Redox responsive metal organic framework nanoparticles induces ferroptosis for cancer therapy[J]. Small, 2020, 16: e2001251. DOI:10.1002/smll.202001251 |
 2022, Vol. 57
2022, Vol. 57


