2. 重庆市中药研究院, 重庆 400065
2. Chongqing Academy of Chinese Materia Medica, Chongqing 400065, China
脑卒中又称“中风”, 临床表现为偏瘫、麻木、失语及感觉障碍等, 其发病率高、起病急, 且致死率高, 是严重危害现代社会人们生命健康的重大疾病[1]。缺血性脑卒中是最常见的脑卒中类型, 其发病机制极其复杂[1, 2]。现代研究认为, 该病主要是由脑部血液循环障碍而导致脑组织缺血, 进而引起的一系列包括兴奋性损伤、炎症反应、氧化应激以及钙超载等病理过程的综合结果[3]。其中, 脑缺血再灌注后的神经元凋亡这一病理过程已经成为当前研发抗缺血性脑卒中药物的热点方向。
肉苁蓉(Cistanche deserticola Y. C. Ma) 是列当科肉苁蓉属的寄生植物, 作为一种传统中药, 它具有润肠通便、补肾益精和抗衰益智的功效[4]。毛蕊花糖苷是肉苁蓉中含量较高的苯乙醇苷类成分, 具有重要的药用价值[5]。现代药理研究表明, 毛蕊花糖苷可能通过对抗自由基损伤、增强端粒酶活性等发挥抗衰老作用[6], 通过提高中枢胆碱能系统功能改善学习记忆障碍[7], 但目前关于其抗脑缺血再灌注损伤的药理活性及作用机制尚不清楚, 特别是毛蕊花糖苷发挥神经保护作用的构效关系不清楚, 亟待揭示。本论文围绕毛蕊花糖苷及其系列结构片段(咖啡酸3, 4-二羟基苯乙酯、咖啡酸、3, 4-二羟基苯乙醇) 抗神经细胞缺氧缺糖/再灌注(oxygen-glucose deprivation/reperfusion, OGD/R) 损伤的保护作用及对线粒体凋亡通路的调节, 阐明了毛蕊花糖苷治疗缺血性脑卒中的潜在药理作用、分子机制及核心药效团, 最终对于抗缺血性脑卒中的创新药物研究具有一定的借鉴意义。
材料与方法试剂与仪器 化合物购自宝鸡市辰光生物科技有限公司; Hoechst33258染色液购自北京索莱宝科技有限公司; 线粒体膜电位染色试剂盒(JC-1) 购自南京碧云天生物技术公司; 结晶紫染色液购自北京雷根(Leagene) 生物技术有限公司; DMEM培养基和青链霉素购自北京中科迈晨(Macgene) 科技有限公司; 胎牛血清购自北京百诺威生物科技有限公司; 溴化噻唑蓝四氮唑(MTT) 购自美国Sigma公司; 蛋白抗体购自美国Cell Signaling Technology公司; ECL化学发光超敏显色试剂盒购自上海翌圣(Yeasen) 生物科技有限公司; Tanon-5200Multi凝胶成像分析系统购自上海天能公司; Sunrise-Basic酶标仪购自美国Tecan公司; IX73倒置荧光显微镜购自日本Olympus公司; HT7800透射电镜购自日本Hitachi公司。
细胞培养与处理 PC12细胞系购自中国医学科学院细胞中心。使用DMEM培养基(含10%胎牛血清、100 u·mL-1青霉素、100 μg·mL-1链霉素) 培养, 24 h传代1次。
OGD/R模型 细胞密度约为80%时开始诱导模型, 吸去培养基并清洗细胞3次。加入含药物(2.5、5、10和20 μmol·L-1) 的Earle's平衡盐溶液(1× EBSS, 无钙镁糖酚红), 将细胞置于日本三菱化学株式会社2.5 L厌氧罐, 于37 ℃培养6 h。复氧时清洗细胞并加入含相同浓度药物的DMEM完全培养基后于37 ℃继续培养24 h, 建立OGD/R损伤模型。
MTT法检测细胞存活率 细胞给药处理到指定时间后, 每孔加入100 μL含0.5 mg·mL-1 MTT的DMEM培养基, 37 ℃避光孵育4 h。取出孔板并吸去培养基, 每孔加100 μL DMSO, 摇匀后用Tecan公司Sunrise-Basic酶标仪测量570 nm处吸光值。
结晶紫染色 细胞给药处理到指定时间后, 每孔加入500 μL 4%多聚甲醛, 室温孵育20 min后用PBS清洗3次, 每孔加入500 μL 0.5%结晶紫染液, 室温孵育30 min后加入PBS清洗3次, 用Olympus公司IX73倒置荧光显微镜观察细胞形态。
Hoechst33258染色 细胞给药处理到指定时间后, 吸去培养基并加入500 μL 4%多聚甲醛室温固定30 min。加入PBS清洗后, 加入1 mL Hoechst33258染液, 室温避光孵育30 min后PBS清洗。用Olympus公司IX73倒置荧光显微镜(激发波长352 nm, 发射波长461 nm) 观察细胞核形态。使用Image J软件分析细胞凋亡情况。
线粒体JC-1染色 细胞给药处理到指定时间后, 吸去培养基并加入1 mL JC-1染色工作液(试剂盒提供), 37 ℃避光孵育30 min, 加入PBS清洗。用Olympus公司IX73倒置荧光显微镜观察JC-1单体的绿色荧光(激发波长514 nm, 发射波长529 nm), 以及JC-1聚合物的红色荧光(激发波长585 nm, 发射波长590 nm)。使用Image J软件分析检测线粒体膜电位变化情况。
透射电镜分析 细胞给药处理到指定时间后, 吸去培养基并加入3%戊二醛室温孵育2 h, 然后加入1%四氧化锇溶液室温孵育1 h。对细胞沉淀进行丙酮脱水、环氧丙烷渗透和树脂包埋处理, 包埋块切片, 采用枸橼酸铅和醋酸铀进行双染色, 用Hitachi公司HT7800透射电镜观察细胞线粒体结构。
蛋白免疫印迹 (Western blot) 分析 细胞给药处理到指定时间后, 收细胞并加入RIPA裂解液(含蛋白酶抑制剂) 提取细胞总蛋白。用8%~15% SDS-PAGE分离总蛋白, 湿法转移至PVDF膜上。将PVDF膜放入5%脱脂奶粉, 室温封闭30 min。洗涤后加入一抗, 室温孵育2 h。充分洗涤后加入二抗, 室温孵育1 h。充分洗涤, 用ECL显影液显影, 在凝胶成像系统(Tanon-5200Multi) 上拍照。使用Image J软件分析蛋白的相对表达量。
分子对接 选取靶蛋白CK2α'文件(PDB ID: 5OOI), 蛋白质与小分子都赋予OPLS_2005力场, 采用Schrödinger 2018的Covalent Docking模块, 以Lys171为反应氨基酸, 将Lys171定义为盒子中心, 在≤ 20 Å内, 以Michael Addition反应类型进行共价对接。
统计学分析 所有数据用平均值±标准差(
毛蕊花糖苷的核心结构是咖啡酸3, 4-二羟基苯乙酯, 即毛蕊花糖苷除去两个糖环后的结构。咖啡酸3, 4-二羟基苯乙酯可进一步水解为咖啡酸和3, 4-二羟基苯乙醇(图 1A)。因此, 本研究主要针对毛蕊花糖苷及其3种结构片段——咖啡酸3, 4-二羟基苯乙酯、咖啡酸和3, 4-二羟基苯乙醇进行了OGD/R神经损伤的活性评价。鉴于OGD/R模型可体外模拟缺血性脑卒中的病理过程[8], 本研究首先利用MTT法和结晶紫染色分析了毛蕊花糖苷及其系列结构片段对OGD/R模型的保护作用。MTT检测结果显示(图 1B), OGD/R显著降低PC12细胞存活率, 毛蕊花糖苷及其结构片段咖啡酸3, 4-二羟基苯乙酯和咖啡酸可有效提升PC12细胞存活率, 但3, 4-二羟基苯乙醇未见明显保护作用。此外, 结晶紫染色结果发现(图 1C), OGD/R可导致神经细胞形态明显改变, 主要为突触长度变短、数量减少及细胞变圆、体积减小等, 而毛蕊花糖苷及其结构片段咖啡酸3, 4-二羟基苯乙酯和咖啡酸可以显著维持神经细胞正常形态, 而3, 4-二羟基苯乙醇未见明显保护作用。上述结果提示, 毛蕊花糖苷及其结构片段咖啡酸3, 4-二羟基苯乙酯和咖啡酸可以有效保护OGD/R所致的神经细胞损伤。

|
Figure 1 Verbascoside and its structural fragments protected against oxygen-glucose deprivation/reperfusion (OGD/R)-induced PC12 cells injury. A: Chemical structure of verbascoside and its structural fragments; B: Verbascoside and its structural fragments improved cell viability of PC12 cells exposed to OGD/R in a dose-dependent manner in MTT assay; C: Verbascoside and its structural fragments maintained normal morphology, increased the length and volume of neurons exposed to OGD/R in crystal violet staining assay (20×). n = 3, |
脑组织在缺血损伤情况下, 产生大量的氧自由基和细胞毒性蛋白, 并导致细胞内Ca2+超载以及凋亡信号通路的激活, 最终诱导神经元凋亡[9]。因此, 本实验采用Hoechst33258染色法评价毛蕊花糖苷及系列结构片段对OGD/R诱导的PC12细胞凋亡的保护作用。Hoechst33258是一种DNA结合染料, 在凋亡细胞中, 染色体与Hoechst33258的结合增加, 呈现强蓝色荧光, 故常用于检测细胞凋亡[10]。结果表明(图 2), 模型组细胞核染色较深, 细胞核固缩、破碎, 表明ODG/R可导致PC12细胞凋亡; 毛蕊花糖苷及其结构片段咖啡酸3, 4-二羟基苯乙酯和咖啡酸处理组可观察到Hoechst33258染色明显减弱, 细胞核形态恢复正常, 即显著抑制了细胞凋亡现象的发生, 而3, 4-二羟基苯乙醇未见上述保护作用, 结果具有统计学意义。由此可见, 毛蕊花糖苷及其结构片段咖啡酸3, 4-二羟基苯乙酯和咖啡酸具有抑制OGD/R诱导神经细胞凋亡的作用。
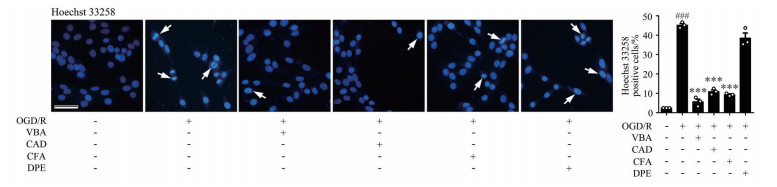
|
Figure 2 Verbascoside and its structural fragments prevented OGD/R-induced PC12 cells apoptosis (20×). Verbascoside and its structural fragments effectively reversed OGD/R-induced PC12 cells apoptosis in Hoechst33258 staining assay. n = 3, |
当缺血性脑卒中发作时, 神经细胞发生氧化应激反应, 产生的氧自由基损伤细胞线粒体, 导致线粒体膜通透性增加[11, 12]。为进一步探索毛蕊花糖苷及系列结构片段对神经细胞线粒体损伤的保护作用, 本研究利用JC-1荧光染色和透射电镜对线粒体形态和功能进行了评价。JC-1染色结果显示(图 3A), OGD/R可导致PC12细胞线粒体膜发生去极化(表现为绿色荧光增加), 而毛蕊花糖苷及其结构片段咖啡酸3, 4-二羟基苯乙酯和咖啡酸可升高线粒体膜电位(红色荧光增加, 绿色荧光减少), 3, 4-二羟基苯乙醇未见明显保护作用, 结果具有统计学意义。此外, 透射电镜结果显示(图 3B), OGD/R显著损伤细胞线粒体形态, 表现为数量减少、结构变圆膨胀、嵴结构消失以及亮度增加等, 而毛蕊花糖苷及其结构片段咖啡酸3, 4-二羟基苯乙酯和咖啡酸可维持线粒体原有结构, 同时3, 4-二羟基苯乙醇未表现出明显保护作用。上述实验结果表明, 毛蕊花糖苷及其结构片段咖啡酸3, 4-二羟基苯乙酯和咖啡酸可有效抑制OGD/R诱导的PC12细胞线粒体损伤。
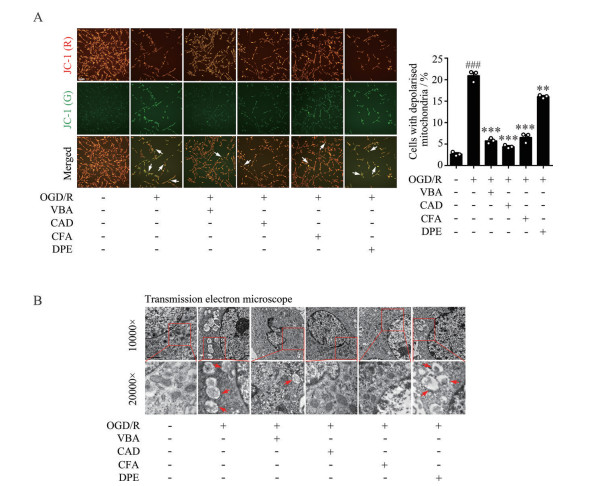
|
Figure 3 Verbascoside and its structural fragments inhibited OGD/R-induced mitochondria injury in PC12 cells. A: Verbascoside and its structural fragments inhibited mitochondria depolarization in PC12 cells exposed to OGD/R by JC-1 staining assay (20×); B: Verbascoside and its structural fragments maintained the normal structure of mitochondria in PC12 cells exposed to OGD/R by transmission electron microscope assay (10 000×, 20 000×). n = 3, |
基于前期研究结果, 本课题组推测咖啡酸可能是毛蕊花糖苷发挥神经保护活性的核心活性片段。因此, 本研究进一步研究了这两个分子发挥抑制神经细胞凋亡作用的分子机制。通过Western blot检测半胱天冬氨酸蛋白酶3 (cysteinyl aspartate specific proteinase 3, caspase 3)/DNA修复酶(poly ADP-ribose polymerase, PARP) 凋亡通路中关键蛋白的表达, 结果显示(图 4A、B), OGD/R可导致PC12细胞内B淋巴细胞瘤2 (B cell lymphoma 2, Bcl 2) 和caspase 3的表达减少, Bcl 2相关X蛋白(Bcl 2 associated X protein, Bax)、剪切态caspase 3和剪切态PARP (cleaved caspase 3, cleaved PARP) 的表达增加, 表明细胞线粒体凋亡通路被激活。与模型组相比, 毛蕊花糖苷及咖啡酸可明显逆转上述指标的变化, 即升高Bcl 2的表达并抑制Bax、剪切态caspase 3和剪切态PARP的增加, 且呈现剂量依赖性, 结果具有统计学意义。综上所述, 毛蕊花糖苷及咖啡酸表现出了显著抑制线粒体凋亡信号通路的作用。
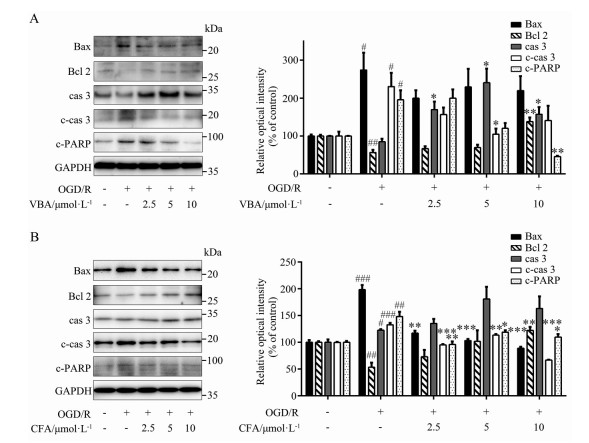
|
Figure 4 Verbascoside and its major active fragment caffeic acid inhibited mitochondrial cysteinyl aspartate specific proteinase 3 (caspase 3)/poly ADP-ribose polymerase (PARP) apoptosis pathway. Verbascoside (A) and caffeic acid (B) inhibited the cleavage of caspase 3 and PARP, down-regulated Bcl 2 associated X protein (Bax), and increased B cell lymphoma 2 (Bcl 2) expression. n = 3, |
毛蕊花糖苷是肉苁蓉中另一成分松果菊苷的脱糖产物。文献报道, 松果菊苷的作用靶点为酪蛋白激酶2的α'亚基(casein kinase 2 α' subunit, CK2α')。松果菊苷与CK2α'的171位赖氨酸共价结合, 通过靶向CK2蛋白促进线粒体融合, 从而发挥神经保护作用[13]。因此推测, 毛蕊花糖苷及咖啡酸发挥神经保护作用的靶点可能也是CK2α'。为了验证这一假设, 本研究以CK2α'为靶蛋白选取其PDB结构, 利用Schrödinger分别与毛蕊花糖苷及咖啡酸进行共价对接模拟。对接结果显示, 毛蕊花糖苷(图 5A) 及咖啡酸(图 5B) 均可以其α, β-不饱和羰基与Lys171上的氨基共价结合。除此之外, 小分子中羰基及羟基还可与CK2α'上不同氨基酸形成多个氢键相互作用, 进一步稳固小分子与靶蛋白的结合。由此可以证明, 毛蕊花糖苷及咖啡酸均有靶向CK2α'的结构基础, 且具有共同的结合位点即Lys171上的氨基, 因此其可能具有一致的发挥神经保护作用的潜在靶点CK2α', 这也为咖啡酸可能是毛蕊花糖苷发挥神经保护活性的核心活性片段的推测提供了依据。
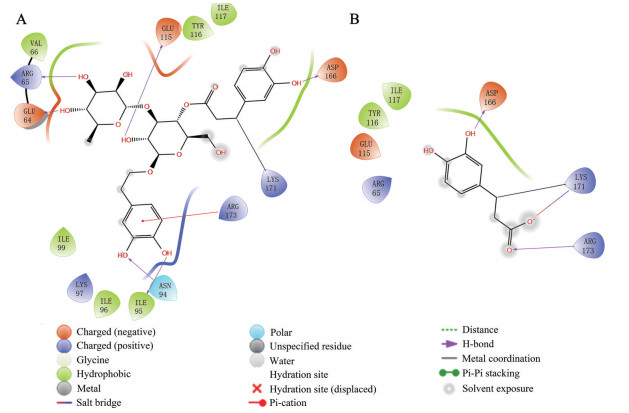
|
Figure 5 Verbascoside and caffeic acid covalently modify the Lys171 site of casein kinase 2 α' subunit (CK2α'). A: Docking analysis of verbascoside covalent binding mode to CK2α'; B: Docking analysis of caffeic acid covalent binding mode to CK2α' |
缺血性脑卒中由于其起病急、致死致残率高等特点, 严重威胁着中老年群体的生命健康。因此, 寻找有效的治疗缺血性脑卒中的特效药物一直是当前临床医学的热点问题。缺血性脑卒中发作时, 因局部脑组织缺血缺氧, 引发神经细胞线粒体功能异常、数量减少, 受损的线粒体进而激活了下游caspase凋亡信号通路, 最终导致神经细胞损伤。因此, 治疗缺血性脑卒中的一个重要方向就是从保护神经线粒体功能入手, 发现潜在的先导药物分子[14]。
本研究发现, 肉苁蓉关键药效成分毛蕊花糖苷及其结构片段咖啡酸3, 4-二羟基苯乙酯和咖啡酸可以对神经细胞线粒体结构、数量和功能起到良好的保护作用, 进而可以抑制神经细胞凋亡、维持神经细胞形态, 而结构片段3, 4-二羟基苯乙醇未见明显保护作用。这些结果提示, 咖啡酸3, 4-二羟基苯乙酯和咖啡酸可能是毛蕊花糖苷发挥神经细胞保护作用的关键活性片段。特别是咖啡酸是活性最好且结构最简单的化合物, 同时其具有与毛蕊花糖苷相似的神经保护机制, 即通过抑制Bcl 2/Bax介导的线粒体caspase 3/PARP凋亡通路发挥抗神经细胞OGD/R损伤的作用, 以及共同的潜在作用靶点CK2α'。由此可见, 咖啡酸可能是毛蕊花糖苷的核心药效团结构, 对于今后深入探索毛蕊花糖苷的神经保护药理机制及基于结构的抗脑缺血神经保护药物研发具有较好的指导意义。
细胞凋亡在脑缺血损伤中十分重要, 抗凋亡蛋白Bcl 2是细胞凋亡机制的主要靶点分子, 研究表明Bcl 2的过表达可以减轻缺血性损伤, 而促凋亡蛋白Bax可以抑制其表达。Caspase 3则是细胞凋亡的最终执行者[15]。给药后剪切态caspase 3和PARP的回调表明caspase 3/PARP凋亡通路的启动减少, 细胞凋亡受到抑制。CK2是一种广泛调节多种信号蛋白的丝氨酸/苏氨酸激酶, 参与许多细胞生命活动, 包括细胞增殖和细胞凋亡等[16], 其α'亚基CK2α'可能通过促进线粒体融合发挥抗脑缺血神经保护作用[13], 是毛蕊花糖苷及咖啡酸的潜在作用靶点。
综上所述, 本研究揭示了肉苁蓉关键药效成分毛蕊花糖苷发挥抗脑缺血再灌注损伤的保护作用及潜在机制, 特别是提出了咖啡酸可能是毛蕊花糖苷发挥神经保护作用的关键药效团, 这对治疗缺血性脑卒中创新药物的研发具有参考价值。
作者贡献: 张一驰负责细胞培养、活力分析、蛋白表达检测及论文撰写; 张晓雯负责细胞形态学分析、结果整理及论文撰写; 王丽超负责细胞形态学分析; 屠鹏飞负责论文的设计及审阅; 曾克武、王天文负责实验设计、指导、结果整理及论文撰写和修改。
利益冲突: 本文的研究内容无任何利益冲突。
| [1] |
Chen C, Liu L, Shu YQ, et al. Blockade of HCN2 channels provides neuroprotection against ischemic injury via accelerating autophagic degradation in hippocampal neurons[J]. Neurosci Bull, 2020, 36: 875-894. DOI:10.1007/s12264-020-00513-7 |
| [2] |
Su ZF, Sun ZW, Zhang Y, et al. Regulatory effects of miR-146a/b on the function of endothelial progenitor cells in acute ischemic stroke in mice[J]. Kaohsiung J Med Sci, 2017, 33: 369-378. DOI:10.1016/j.kjms.2017.05.010 |
| [3] |
Chen XN, Yang AL, Zhao YN, et al. Research progress on pathogenesis of ischemic stroke and traditional Chinese medicine commonly used for treatment of ischemic stroke[J]. Chin J Chin Mater Med (中国中药杂志), 2019, 44: 422-432. |
| [4] |
Zhi YJ, Zhen YQ, Tian W, et al. Research progress on chemical constituents and pharmacological effects of Cistanche deserticola and predictive analysis of quality markers (Q-Marker)[J]. Chin Tradit Herbal Drugs (中草药), 2021, 52: 2758-2767. |
| [5] |
Liu B, Ouyang J, Yuan X, et al. Adsorption properties and preparative separation of phenylethanoid glycosides from Cistanche deserticola by use of macroporous resins[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2013, 937: 84-90. DOI:10.1016/j.jchromb.2013.08.018 |
| [6] |
Shen C, Jiang J, Li Y, et al. Anti-ageing active ingredients from herbs and nutraceuticals used in traditional Chinese medicine: pharmacological mechanisms and implications for drug discovery[J]. Br J Pharmacol, 2017, 174: 1395-1425. DOI:10.1111/bph.13631 |
| [7] |
Lin J, Gao L, Huo SX, et al. Effect of acteoside on learning and memory impairment induced by scopolamine in mice[J]. Chin J Chin Mater Med (中国中药杂志), 2012, 37: 2956-2959. |
| [8] |
Zhang L, Xu J, Han YF, et al. Detection of autophagic flux in primary cerebral cortical neurons after oxygen glucose deprivation/reperfusion (OGD/R) using various methods[J]. J Chem Neuroanat, 2021, 117: 101999. DOI:10.1016/j.jchemneu.2021.101999 |
| [9] |
Budd SL. Mechanisms of neuronal damage in brain hypoxia/ischemia: focus on the role of mitochondrial calcium accumula-tion[J]. Pharmacol Ther, 1998, 80: 203-229. DOI:10.1016/S0163-7258(98)00029-1 |
| [10] |
Cao X, Fu M, Bi R, et al. Cadmium induced BEAS-2B cells apoptosis and mitochondria damage via MAPK signaling pathway[J]. Chemosphere, 2021, 263: 128346. DOI:10.1016/j.chemosphere.2020.128346 |
| [11] |
Yang JL, Mukda S, Chen SD. Diverse roles of mitochondria in ischemic stroke[J]. Redox Biol, 2018, 16: 263-275. DOI:10.1016/j.redox.2018.03.002 |
| [12] |
Nieminen AL. Apoptosis and necrosis in health and disease: role of mitochondria[J]. Int Rev Cytol, 2003, 224: 29-55. |
| [13] |
Zeng KW, Wang JK, Wang LC, et al. Small molecule induces mitochondrial fusion for neuroprotection via targeting CK2 without affecting its conventional kinase activity[J]. Signal Transduct Target Ther, 2021, 6: 71. DOI:10.1038/s41392-020-00447-6 |
| [14] |
He Z, Ning N, Zhou Q, et al. Mitochondria as a therapeutic target for ischemic stroke[J]. Free Radic Biol Med, 2020, 146: 45-58. DOI:10.1016/j.freeradbiomed.2019.11.005 |
| [15] |
Meng J, Ma H, Zhu Y, et al. Dehydrocostuslactone attenuated oxygen and glucose deprivation/reperfusion-induced PC12 cell injury through inhibition of apoptosis and autophagy by activating the PI3K/AKT/mTOR pathway[J]. Eur J Pharmacol, 2021, 911: 174554. DOI:10.1016/j.ejphar.2021.174554 |
| [16] |
El-Awaad E, Birus R, Marminon C, et al. Broad-spectrum anticancer activity and pharmacokinetic properties of a prenyloxy-substituted indeno[1, 2-b]indole derivative, discovered as CK2 inhibitor[J]. Pharmaceuticals (Basel), 2021, 14: 542. DOI:10.3390/ph14060542 |
 2022, Vol. 57
2022, Vol. 57
