2. 中国医学科学院, 北京协和医学院肿瘤医院, 分子肿瘤学国家重点实验室, 北京 100021;
3. 中央民族大学, 生物成像与系统生物学研究中心, 北京 100081
2. State Key Laboratory of Molecular Oncology, Cancer Hospital, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100021, China;
3. Center for Imaging and Systems Biology, Minzu University of China, Beijing 100081, China
体外培养多细胞肿瘤球(multicellular tumor spheroids, MCTS) 是一种三维细胞模型, 球体直径一般不超过1 mm, 由于具有三维结构, 在基因转录、酶表达、代谢活性等方面更接近体内肿瘤, 可以模拟体内肿瘤对抗癌药物的反应, 有助于提高抗肿瘤药物体外筛选的效率和成功率[1-3]。因此, MCTS的模型构建与分析表征引起了人们关注[4-7]。一些抗癌药物与其代谢物的荧光吸收和发射光谱相互干扰, 难以通过荧光成像确定药物是否被代谢, 而利用质谱成像技术可以特异检测药物及代谢产物并获得其在MCTS中的空间分布信息[8]。目前应用于质谱成像的电离技术主要包括基质辅助激光解吸电离(MALDI)、二次离子质谱电离(SIMS) 和解吸电喷雾电离(DESI) 等。MALDI针对不同极性内源性代谢物需要选择适宜的基质类型, 进行多次喷涂操作, 影响了质谱成像结果的稳定性和重复性[9]。SIMS-MSI技术具有很高的空间分辨率(低至50 nm), 可在亚细胞水平进行成像, 满足MCTS质谱成像所需。但是SIMS-MSI技术对于分子质量超过500 Da的化合物分析灵敏度有限, 且高能的一次离子会产生广泛的表面碎裂使该技术在生物样本分析受到局限[10]。DESI-MSI可以在常压敞开环境中运行, 一方面由于解吸依赖于局部微萃取, 可以针对生物样本和研究目的灵活调整喷雾溶剂体系, 提高对目标物的检测灵敏度; 另一方面DESI无需喷涂基质, 避免了分子离域, 并且消除了基质对于中高极性小分子代谢物的成像干扰。然而, DESI-MSI对小尺寸样本的精细结构微区进行可视化分析仍具有挑战。本研究以紫杉醇(paclitaxel, PTX) 为例, 采用本课题组自主研发的敞开式空气动力辅助解吸电喷雾离子化(AFADESI) 技术, 结合MCTS模型建立药物成像代谢组学方法, 在更接近实体肿瘤的体外模型上获得与肿瘤球微区结构相关的药物以及药物引起的内源性代谢物变化信息。
材料与方法仪器 ACQUITY UPLC I-Class超高效液相色谱系统(美国Waters公司); Q-Exactive四极杆-静电场轨道阱高分辨质谱(美国Thermo Fisher Scientific公司); XPE205分析天平(美国METTLER TOLEDO公司); Leica CM1860切片机(德国Leica公司); HERA cell 150i CO2细胞培养箱(美国Thermo Fisher公司); DSZ2000X倒置生物显微镜(北京京瑞天下科技公司); Countess Ⅱ FL全自动细胞计数仪(美国Thermo Fisher公司); SpeedVac SPD121P离心浓缩仪(美国Thermo Fisher公司); Sigma 3-30K高速台式冷冻离心机(德国Sigma公司)。
药品与试剂 紫杉醇注射液(INJ, 批号: 18060211, 江苏扬子江药业集团有限公司); 注射用紫杉醇(白蛋白结合型, ALB, 批号: B42008407, 石家庄欧意药业有限公司); 注射用紫杉醇脂质体(力朴素, LPS, 批号: 120050709, 南京绿叶制药有限公司); 葡萄糖(批号: 20081310, 福州海王福药制药有限公司); 生理盐水(批号: 2101043203, 石家庄四药有限公司)。胎牛血清、RPMI1640基础培养基、青霉素和链霉素(美国Gbico公司)、超低吸附U型底96孔板(美国Thermo Fisher公司); 细胞培养皿(美国Corning公司); Surgipath Cryo-Gel (德国Leica公司); 阳离子防脱玻片(美国Thermo Scientific公司); CellTiter-Blue细胞活力检测试剂盒(美国Promega公司); HPLC级乙腈(德国Merck公司); 纯净水(杭州娃哈哈公司)。
MCTS形成与培养 食管癌KYSE-150细胞系, 日本京都大学医学部Shimada教授惠赠。将生长贴附培养皿中的80%~90%区域的KYSE-150食管癌细胞消化、清洗后对细胞计数, 重新离心后弃去上清, 用完全培养基稀释至每毫升25万个细胞。将200 μL细胞悬浮液加入到超低吸附U型底96孔板中(每孔大约5万个细胞)。孵育约1天后, 细胞聚集成固体球体。放回培养箱继续培养12 h左右形成直径约为1 mm的MCTS。然后继续培养48 h用于后续实验。
MCTS的药物处理与切片制备 将3种紫杉醇注射液分别按照说明书配制成含60 μmol·L-1紫杉醇的培养基备用, 分别记作INJ、ALB和LPS组。将接种48 h的细胞培养板取出, 用含60 μmol·L-1药物的培养基替换一半原有培养基使得3种剂型的终浓度为30 μmol·L-1, 设置不给药对照组。给药后继续培养0.3、1、2、4、8、12、24、36、48、60和72 h共11个时间点。各组MCTS药物处理达到各指定时间点后, 取出6个平行重复的MCTS, 使用移液器吸取培养液丢弃, 用生理盐水洗涤MCTS三次后, 转移至Surgipath Cryo-Gel中包埋, 在-20 ℃预冷的Leica CM1860切片机中冷冻固定5 min以上。在-20 ℃冷冻条件下, 使用CM1860切片机将MCTS切成厚度为15 μm的冰冻切片。
MCTS的质谱成像分析 基于AFADESI-MSI平台进行质谱成像代谢组学研究, 使用20 μm内径喷针和HESI离子源, 喷雾溶液为乙腈-水(8∶2, v/v), 分别在正离子和负离子检测模式(喷雾电压±7 kV) 下进行, 全扫描模式(full scan) 下采集m/z 70~1 000内的质谱信息, 参数设置如下: 毛细管温度350 ℃, 最大注入时间200 ms, AGC target 3e6, 分辨率70 000, 扫描速度1.6 scans·s-1, 喷雾气压力0.7 MPa, 抽气速度45 L·min-1。移动平台参数设置如下: 喷雾溶剂流速3 μL·min-1, X轴移动速度0.04 mm·s-1, Y轴控制每行间距0.04 mm。
PTX的质谱成像分析 紫杉醇的质谱成像研究在正离子模式(喷雾电压7 kV) 下进行, 采用target SIM模式采集m/z 875~879内的质谱信息, 分辨率设置为35 000, 其他条件与“MCTS的质谱成像分析”参数相同。
数据处理 质谱成像原始数据通过软件Xcalibur 2.3将.raw转成.cdf格式, 采用本课题组与科迈恩(北京) 科技有限公司联合开发的MassImager Pro质谱成像系统工作站。对数据进行批量读取、图像重构、背景扣除。采用MCTS光学图像与质谱成像数据精准匹配叠加后, 选取MCTS所在区域进行圈选, 获得该区域的平均质谱图, 并以m/z-Intensity的形式导出二维数据矩阵, 用于后续统计分析和信息挖掘。将数据导入到MarkerView 1.2.1 (美国AB SCIEX公司) 中进行峰对齐, 将其导出保存为.txt格式数据文件。再将归一化后的数据导入SIMCA-P 14.0软件进行主成分分析(PCA)、偏最小二乘判别分析(PLS-DA) 和100次置换验证。结合PLS-DA模型中VIP > 1以及独立样本t检验(P < 0.01) 和倍率变化(FC < 0.5或FC > 2) 筛选差异代谢物[11]。通过HMDB数据库(http://hmdb.ca) 和LipidMaps数据库(http://www.lipidmaps.org/) 并结合二级碎片离子对筛选出的差异代谢物进行匹配和识别, 按照本课题组已发表的相关研究的方法进行确认以最终完成代谢物鉴定[12]。将中高极性差异代谢物上传至MetaboAnalyst (https://www.metaboanalyst.ca) 网站进行通路分析和富集分析。
结果 1 基于AFADESI的MCTS质谱成像分析课题组前期采用超低吸附微孔板法建立了食管癌MCTS模型, 该培养方法重现性好、形态规则, 可以获得尺寸可控的具有高度一致性的食管癌MCTS。进一步对MCTS冰冻切片制备步骤及喷雾溶剂、喷针内径等进行考察和优化, 首次建立了适合于MCTS这种微小体积样本的AFADESI-MSI分析方法。该方法在保持高空间分辨率的条件下, 可以高灵敏的检测到单个MCTS切片中多种类型的内源性代谢物, 包括胆碱、氨基酸、多胺、肉碱、核苷、有机酸和磷脂等, 代表性内源性代谢物的质谱成像图如图 1所示。
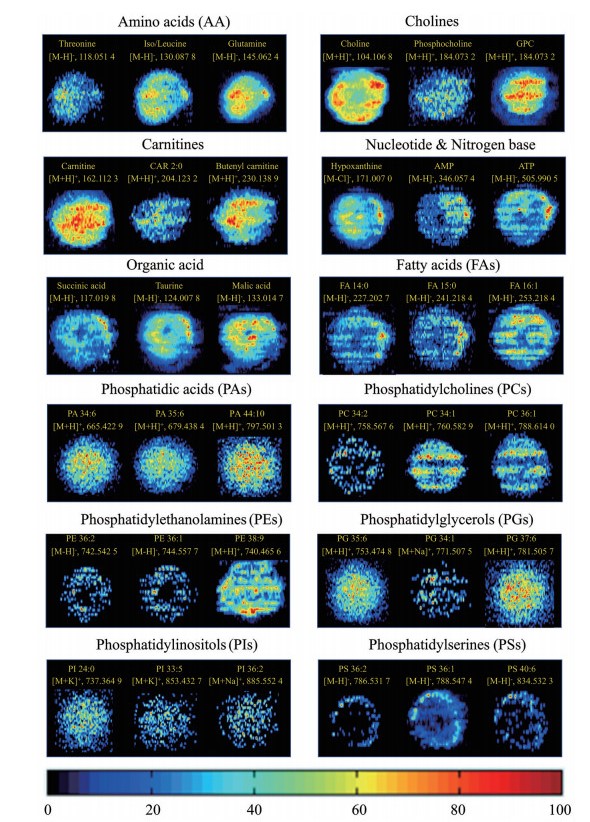
|
Figure 1 Representative metabolites MS image of multicellular tumor spheroids (MCTS) in air flow assisted desorption electrospray ionization mass spectrometry imaging (AFADESI MS) system |
紫杉醇分子的离子化效率低, 不能直接从成像代谢组学数据中提取紫杉醇加合离子的信息用于表征药物的分布, 通过target-SIM扫描方式在m/z 875~879检测紫杉醇[M+Na]+信号(理论值: m/z 876.320 3), 紫杉醇的质谱成像结果如图 2所示, 展示了相应MCTS切片中紫杉醇[M+Na]+的质谱成像图, 结果表明三种制剂中紫杉醇在MCTS中的渗透速度和富集程度具有明显差异: 渗透速度方面, 紫杉醇注射液组(INJ) > 紫杉醇白蛋白制剂(ALB) > 紫杉醇脂质体组(LPS); 富集程度方面: 紫杉醇白蛋白制剂(ALB) > 常规紫杉醇制剂(INJ) 组 > 紫杉醇脂质体组(LPS)。这种差异与紫杉醇的制剂设计有关, 通过质谱成像技术可以直观反映药物分布差异。
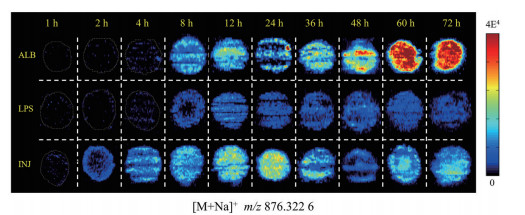
|
Figure 2 The MS images of [M+Na]+ of paclitaxel penetrating and enriching in MCTS. ALB: Paclitaxel for injection (albumin bound); LPS: Paclitaxel liposome for injection; INJ: Common paclitaxel injection |
将紫杉醇注射剂处理前以及处理后不同时间点及对照组MCTS切片的质谱数据进行处理。图 3为给药前初始时刻与给药48 h后MCTS切片分别在正负离子检测模式下采集数据的多元变量统计分析结果, PCA得分图显示两组数据聚类分组趋势明显, PLS-DA分析及置换验证结果表明药物干预引起MCTS代谢轮廓发生显著改变, 代谢物的种类或水平发生了明显变化。
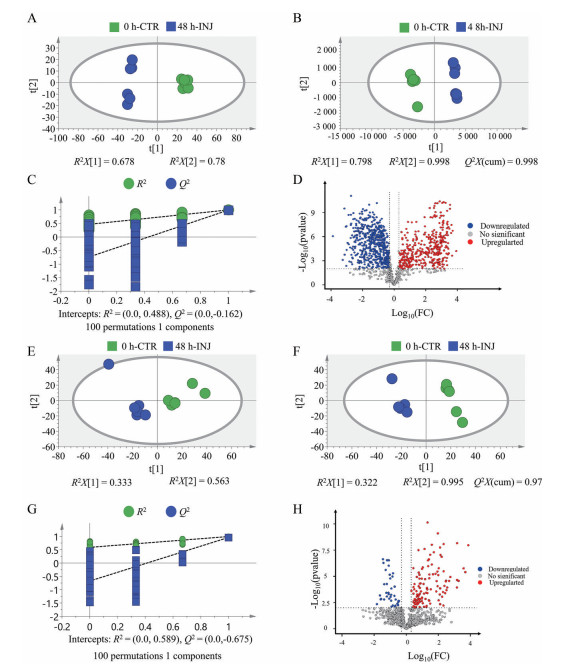
|
Figure 3 Statistical analysis based on positive/negative ion mode AFADESI-MSI data from MCTS before or after treated by paclitaxel injection (INJ) for 48 h. A, E: PCA score plot; B, F: PLS-DA score plot; C, G: Permutation test of the PLS-DA model; D, H: Volcano plot. CTR: Control group |
基于多元变量统计分析建立的有效模型筛选VIP > 1的变量, 匹配采用独立样本t检验和倍率变化的结果, 对其中具有显著性差异且倍率变化超过2倍的变量进行代谢物鉴定。最终, 正负离子检测模式数据中分别有89个和120个差异变量匹配到代谢物, 其中67个中高极性代谢物、142个脂类代谢物。
3.1 时间特征为寻找差异代谢物之间的联系, 对代谢物在各时间点的平均强度进行Z-score归一化并进行热图分析, 如图 4A所示, 绝大多数中高极性代谢物的下调发生在INJ组处理后的4 h以内; 图 4B表明给药后脂类代谢物的变化可以大致分成3个阶段: 0~4 h表现为相关脂质水平降低; 在8~48 h和60~72 h两个阶段, 脂质主要表现为上调趋势。
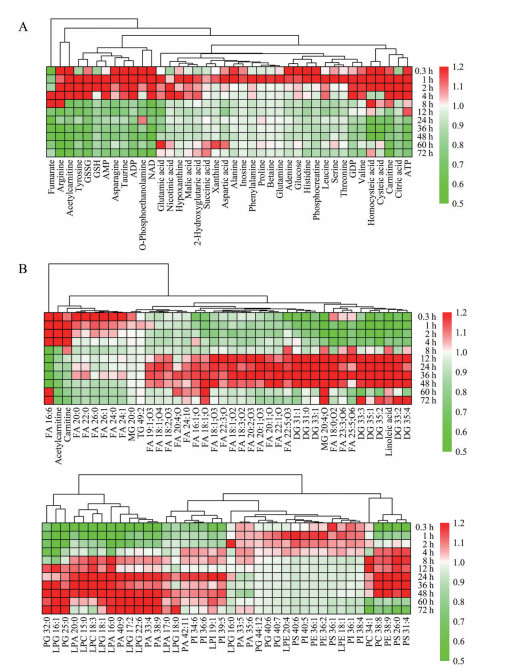
|
Figure 4 Heatmap of top 40 polar metabolites (A) and top 80 lipid metabolites (B) in MCTS during treating with INJ. ADP: Adenosine diphosphate; AMP: Adenosine monophosphate; ATP: Adenosine triphosphate; GDP: Guanosine diphosphate; GSH: Glutathione; GSSG: Glutathione disulfide; NAD: Nicotinamide adenine dinucleotide; FA: Fatty acids; MG: Monocylglycerol; DG: Diacylglycerol; TG: Triacylglycerol; PA: Phosphatidic acids; PC: Phosphatidylcholines; PE: Phosphatidylethanolamines; PG: Phosphatidylglycerols; PI: Phosphatidylinositols; PS: Phosphatidylserines; LPA: Lysobisphosphatidic acids; LPC: Lysophosphatidylcholine; LPE: Lysophosphatidylethanolamine; LPG: Lysophosphatidylglycerols; LPI: Lysophosphatidylinositols |
通过MetaboAnalyst对差异代谢物进行富集分析和通路分析, 如图 5所示, 给药后代谢组变化涉及谷氨酰胺、天冬氨酸、精氨酸等氨基酸代谢物, 葡萄糖、苹果酸、ATP等能量代谢物, 谷胱甘肽等氧化还原代谢物等, 相关的能量代谢和氧化还原相关代谢、谷氨酰胺代谢、精氨酸代谢通路发生了显著改变。
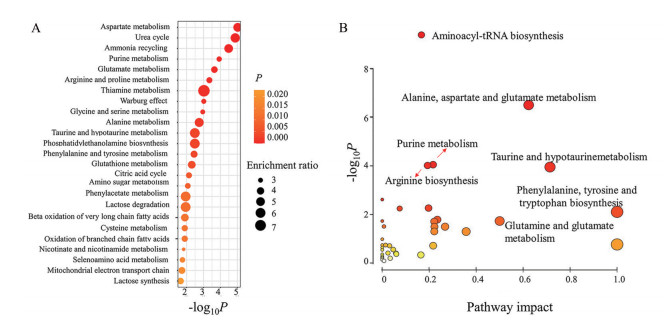
|
Figure 5 Enrichment analysis (A) and pathway analysis (B) of polar metabolites in MCTS after treated by INJ for 48 h |
质谱成像结果显示, 代谢物在MCTS不同微区的空间分布有差异, 存在均匀分布(代谢物在MCTS中无明显的区域差异性分布)、外周分布(代谢物在MCTS外周增殖区质谱响应强度高于中心区域) 和中心分布(代谢物在MCTS中心区域响应强度高于外周增殖区) 三种模式。INJ给药后0~4 h, MCTS中代谢物变化主要发生在中心区域, 在此期间118个差异代谢物中的88个呈现中心分布; 给药后8~72 h, 代谢物变化主要发生在外周区域, 在此期间91个差异代谢物的85个呈现外周分布。如图 6所示, INJ组处理MCTS后谷氨酰胺、亮氨酸、谷胱甘肽等代谢物表现出明显的区域分布差异。
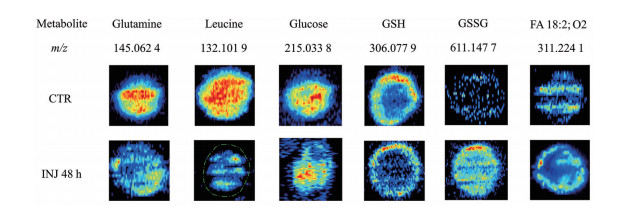
|
Figure 6 Representative distribution change of metabolites in MCTS after treated by INJ |
本研究关注3种紫杉醇制剂引起MCTS细胞活力变化及代谢组学变化的相关性。采用CellTiter-Blue试剂检测细胞活力变化。以常规紫杉醇注射液组筛选的差异代谢物为参考, 提取相应ALB组和LPS组的数据进行分析, 差异代谢物变化与细胞活力曲线的相关性系数如表 1所示, 11个代谢物的变化趋势与MCTS细胞活力变化具有相关关系, 其中9个代谢物的变化与MCTS细胞活力变化呈现正相关关系, 2个代谢物的变化与MCTS细胞活力变化呈负相关关系。
| Table 1 Correlation coefficient between the changing of MCTS cell viability versus the key metabolites after treated by PTX |
基于本课题组自主开发的AFADESI-MSI平台建立了MCTS质谱成像代谢组学方法。结果表明, 该方法可以覆盖低极性的脂类物质到中高极性的代谢物, 能够满足质谱成像代谢组学研究的需要。质谱成像结果体现了内源性代谢物在食管癌肿瘤细胞球中的分布具有明显的空间异质性。代谢产物的异质性分布与MCTS的不同增殖区密切相关, 且MCTS外部区域的代谢活性高于中心区。这可能是因为球体外围的细胞可以直接获得营养和氧气, 因此与球体中心出现的静止和坏死的细胞相比, 它们在细胞的生长和增殖中保持活跃。以往的研究表明, MCTS中心区的静止细胞为了适应缺氧微环境, 明显降低了线粒体功能所引起的能量代谢和氧耗, 这也是导致静止区肿瘤细胞代谢活性降低的原因之一[13, 14]。与小分子代谢物相比, 脂质的异质性空间分布特征更加明显。这可能是由于脂质分子的异常代谢重编程引起的, 这种重编程是由缺氧诱导因子引起的, 例如随着癌症的发展或进展, 在缺氧条件下经常产生的脂肪酸合成增加和脂质积聚[15, 16]。
紫杉醇的质谱成像结果展示了紫杉醇在MCTS中的渗透速度和富集程度与剂型有关, INJ组紫杉醇以游离态存在, 可以直接渗透于MCTS并发挥药效, 因此在给药后INJ处理的MCTS切片中可以最早观察到药物的渗透并且快速富集, 在给药后24 h左右达到饱和, 随后略有下降。LPS组处理8 h后, MCTS切片中药物强度和药物分布与INJ处理2 h时相当, 一定程度体现了脂质体制剂对紫杉醇分子的缓释特性[17], 并且在给药后12 h开始MCTS中药物的强度小范围波动。LPS组处理MCTS的切片中药物的含量远低于常规注射剂组, 在体内药物代谢动力学研究中观察到的紫杉醇制剂提高药物的组织亲和力的现象消失, 说明紫杉醇脂质体制剂对肿瘤靶向性的产生依赖于动物体内药物处置过程[8, 17]。此外, 由于体外肿瘤球模型难以主动清除脂质体辅料, 沉积的脂质体辅料干扰MCTS中细胞摄取紫杉醇, 造成LPS组MCTS中紫杉醇暴露量低于预期。相比于INJ组和LPS组处理的MCTS中紫杉醇分别在12 h和24 h左右达到饱和, ALB组MCTS中观察到了紫杉醇药物的持续富集, 给药60 h左右达到饱和。ALB制剂利用了独特的Gp60-窖蛋白-SPARC蛋白介导转运模式, 有利于药物主动靶向肿瘤细胞并在肿瘤组织中富集[18-20]。
有研究显示紫杉醇给药后可以引起细胞脂质组的变化, 一些研究认为紫杉醇引起脂质上调, 但也有研究认为给药后脂质呈现下调趋势[21, 22]。这种差异与各研究中涉及的细胞样本及不同处理有关, 但同样是基于HeLa细胞的紫杉醇给药研究, 其药物处理时长也有6~72 h的差异[21, 23], 提示对肿瘤细胞脂质代谢的考察应考虑时间因素。
本研究基于AFADESI-MSI的质谱成像代谢组学研究发现在紫杉醇给药后MCTS中不同类型的代谢物发生的变化具有时间和空间特征。在INJ组处理后的4 h以内, 绝大多数中高极性代谢物显著下调, 紫杉醇的质谱成像结果中可以看到这段时间INJ组中PTX逐步渗透整个MCTS并开始富集, 说明PTX的细胞毒性作用逐渐明显, 引起这些代谢物水平快速降低。这是因为紫杉醇可以迅速引起MCTS中能量代谢和氧化还原代谢的改变, 通过糖酵解、三羧酸循环、谷氨酰胺代谢和脂肪酸氧化等方式产生的ATP被大量消耗用于对抗紫杉醇的细胞毒性, 并消耗GSH应对氧化应激。在紫杉醇注射液处理1~2 h的结果中可以看到GSH水平快速降低, 氧化型谷胱甘肽(GSSH) 水平快速提高, 也为这一观点提供了证据。
本研究中发现食管癌MCTS外周区域脂肪酸类、磷脂类代谢物显著增加并参与生物合成, 并且主要发生在紫杉醇注射剂给药后8~72 h, 此时紫杉醇已经完全渗透MCTS并有所累积。脂肪酸是甘油脂、甘油磷脂和其他脂质的组成部分, 有证据表明, 在几乎所有正常细胞组织中脂肪酸合酶(FASN) 的表达和活性均极低, 而在许多实体癌和侵袭性癌症中都明显上调[24]。另外, 胆碱激酶是磷脂酰胆碱生物合成中的关键酶, 其表达在多种癌细胞和肿瘤中上调, 可以被不同的生长因子和癌基因编码蛋白如ras激活[25]。众多脂类物质的上调在相同的时间段, 表明脂类物质摄取增加, 有相关研究表明这一现象可能与脂蛋白转运酶(LPL) 等脂类摄取、转运过程的活跃程度增加有关, 说明在肿瘤生存和耐药过程中脂代谢起着关键的作用[26-29]。许多相关研究均表明了抗肿瘤治疗中脂类物质的显著上调与耐药细胞增殖相关, 本研究中也观察到类似的脂质组学变化。MCTS中活跃的脂代谢对于耐药细胞的生存和增殖具有重要作用, 相关代谢活动在MCTS外周的细胞增殖区更活跃, 为针对耐药细胞探索PTX联合脂代谢抑制剂的治疗方案提供参考。
相关性分析中可以看出, 内源性代谢物的变化与细胞活力具有相关性, 并且有可能用于指示MCTS细胞活力的变化。但这种相关性在不同剂型紫杉醇之间并不相同, 需要进一步探讨这些代谢物(组) 作为生物标志物的潜力, 用于评价紫杉醇药效。
综上所述, 本研究建立了适合于MCTS的AFADESI-MSI分析方法, 紫杉醇的质谱成像结果显示紫杉醇不同剂型在MCTS中的渗透速度和富集程度不同, 反映了剂型设计的差异; 质谱成像代谢组学研究发现了紫杉醇引起MCTS中代谢物的变化具有明显的时间和空间特征, MCTS中代谢物分布的空间差异性与其微区结构特征和生化特征相关。本研究充分体现了质谱成像与MCTS模型相结合的技术优势, 为药物代谢组学研究提供了新的方法策略, 对于加深对肿瘤代谢的认识、提高抗肿瘤药物研发效率具有重要意义和潜在应用价值。
作者贡献: 储小平负责具体实验实施、数据分析及论文初稿撰写; 臧清策负责实验设计及成像技术支持; 刘家兴协助数据分析; 李丽美、马立颖协助实验实施; 贺玖明负责成像技术指导和支持; 张瑞萍负责实验设计、论文修改; 再帕尔·阿不力孜负责总体指导和支持。
利益冲突: 本文无利益冲突。
| [1] |
Nath S, Devi G R. Three-dimensional culture systems in cancer research: focus on tumor spheroid model[J]. Pharmacol Ther, 2016, 163: 94-108. DOI:10.1016/j.pharmthera.2016.03.013 |
| [2] |
Mahmood T A, de Jong R, Riesle J, et al. Adhesion-mediated signal transduction in human articular chondrocytes: the influence of biomaterial chemistry and tenascin-C[J]. Exp Cell Res, 2004, 301: 179-188. DOI:10.1016/j.yexcr.2004.07.027 |
| [3] |
Cui X, Hartanto Y, Zhang H. Advances in multicellular spheroids formation[J]. J R Soc Interface, 2017, 14: 20160877. DOI:10.1098/rsif.2016.0877 |
| [4] |
Costa EC, Gaspar VM, Coutinho P, et al. Optimization of liquid overlay technique to formulate heterogenic 3D co-cultures models[J]. Biotechnol Bioeng, 2014, 111: 1672-1685. DOI:10.1002/bit.25210 |
| [5] |
Zhou Q, Shao S, Wang J, et al. Enzyme-activatable polymer-drug conjugate augments tumour penetration and treatment efficacy[J]. Nat Nanotechnol, 2019, 14: 799-809. DOI:10.1038/s41565-019-0485-z |
| [6] |
Weng Q, Zhou L, Xia L, et al. In vitro evaluation of FL118 and 9-Q20 cytotoxicity and cellular uptake in 2D and 3D different cell models[J]. Cancer Chemother Pharmacol, 2019, 84: 527-537. DOI:10.1007/s00280-019-03846-x |
| [7] |
Vasyutin I, Zerihun L, Ivan C, et al. Bladder organoids and spheroids: potential tools for normal and diseased tissue modelling[J]. Anticancer Res, 2019, 39: 1105-1118. DOI:10.21873/anticanres.13219 |
| [8] |
Lukowski JK, Weaver E M, Hummon A B. Analyzing liposomal drug delivery systems in three-dimensional cell culture models using MALDI imaging mass spectrometry[J]. Anal Chem, 2017, 89: 8453-8458. DOI:10.1021/acs.analchem.7b02006 |
| [9] |
Sun J, He Q, Xue J, et al. Review of matrix-assisted laser desorption/ionization mass spectrometry in analysis and imaging of small molecules[J]. Sci Sin Chim (中国科学: 化学), 2016, 46: 1119-1125. DOI:10.1360/N032016-00088 |
| [10] |
Mcdonnell LA, Heeren RMA. Imaging mass spectrometry[J]. Mass Spectrom Rev, 2007, 26: 606-643. DOI:10.1002/mas.20124 |
| [11] |
Wang H, Cai Y, Liu M, et al. Comparative study on the protective effect of Salvia miltiorrhiza and Anemarrhena asphodeloides on AD cell model using UHPLC-QTOF/MS based cell metabolomics[J]. Acta Pharm Sin (药学学报), 2021, 56: 2394-2402. |
| [12] |
Zang Q, Sun C, Chu X, et al. Spatially resolved metabolomics combined with multicellular tumor spheroids to discover cancer tissue relevant metabolic signatures[J]. Anal Chim Acta, 2021, 1155: 338342. DOI:10.1016/j.aca.2021.338342 |
| [13] |
Freyer JP. Decreased mitochondrial function in quiescent cells isolated from multicellular tumor spheroids[J]. J Cell Physiol, 1998, 176: 138-149. DOI:10.1002/(SICI)1097-4652(199807)176:1<138::AID-JCP16>3.0.CO;2-3 |
| [14] |
Kunz-Schughart LA, Doetsch J, Mueller-Klieser W, et al. Proliferative activity and tumorigenic conversion: impact on cellular metabolism in 3-D culture[J]. Am J Physiol Cell Physiol, 2000, 278: C765-C780. DOI:10.1152/ajpcell.2000.278.4.C765 |
| [15] |
Ackerman D, Simon MC. Hypoxia, lipids, and cancer: surviving the harsh tumor microenvironment[J]. Trends Cell Biol, 2014, 24: 472-478. DOI:10.1016/j.tcb.2014.06.001 |
| [16] |
Bensaad K, Favaro E, Lewis CA, et al. Fatty acid uptake and lipid storage induced by HIF-1α contribute to cell growth and survival after hypoxia-reoxygenation[J]. Cell Rep, 2014, 9: 349-365. DOI:10.1016/j.celrep.2014.08.056 |
| [17] |
Qian J, Wang YX, Yu YQ, et al. A comparison of pharmacokinetics between paclitaxel liposome for injection and commercial paclitaxel injection in patients with cancer[J]. Tumor (肿瘤), 2011, 31: 1103-1107. |
| [18] |
Wang Y. Quantitative Determination of Total and Unbound Paclitaxel in Human Plasma by Liquid Chromatography-Tandem Mass Spectrometry (LC-MS/MS法测定人血浆中总紫杉醇和游离紫杉醇)[D]. Hangzhou: Zhejiang University of Technology, 2016.
|
| [19] |
Jiang HF, Li HP, Wang CY, et al. Albumin bound paclitaxel in the treatment of advanced breast cancer[J]. Tumor (肿瘤), 2013, 37: 1158-1159. |
| [20] |
Desai N. Increased antitumor activity, intratumor paclitaxel concentrations, and endothelial cell transport of cremophor-free, albumin-bound paclitaxel, ABI-007, compared with cremophor-based paclitaxel[J]. Clin Cancer Res, 2006, 12: 1317-1324. DOI:10.1158/1078-0432.CCR-05-1634 |
| [21] |
Li X, Yuan YJ. Lipidomic analysis of apoptotic HeLa cells induced by paclitaxel[J]. OMICS, 2011, 15: 655-664. DOI:10.1089/omi.2011.0027 |
| [22] |
Chen X, Chen S, Yu D. Metabolic reprogramming of chemoresistant cancer cells and the potential significance of metabolic regulation in the reversal of cancer chemoresistance[J]. Metabolites, 2020, 10: 289. DOI:10.3390/metabo10070289 |
| [23] |
Zhang XR. Study on the in vitro Activity and Lipidomics Analysis of Paclitaxel-Hyaluronan (紫杉醇-透明质酸复合制剂的体外活性及脂质组学研究)[D]. Tianjin: Tianjin University, 2008.
|
| [24] |
Lupu R, Menendez JA. Pharmacological inhibitors of fatty acid synthase (FASN) --catalyzed endogenous fatty acid biogenesis: a new family of anti-cancer agents?[J]. Curr Pharm Biotechnol, 2006, 7: 483-493. DOI:10.2174/138920106779116928 |
| [25] |
Janardhan S, Srivani P, Sastry GN. Choline kinase: an important target for cancer[J]. Curr Med Chem, 2006, 13: 1169-1186. DOI:10.2174/092986706776360923 |
| [26] |
Kristensen L, Kristensen T, Abildgaard N, et al. LPL gene expression is associated with poor prognosis in CLL and closely related to NOTCH1 mutations[J]. Eur J Haematol, 2016, 97: 175-182. DOI:10.1111/ejh.12700 |
| [27] |
Mátrai Z, Andrikovics H, Szilvási A, et al. Lipoprotein lipase as a prognostic marker in chronic lymphocytic leukemia[J]. Pathol Oncol Res, 2017, 23: 165-171. DOI:10.1007/s12253-016-0132-z |
| [28] |
Cao D, Song X, Che L, et al. Both de novo synthetized and exogenous fatty acids support the growth of hepatocellular carcinoma cells[J]. Liver Int, 2017, 37: 80-89. DOI:10.1111/liv.13183 |
| [29] |
Kuemmerle NB, Rysman E, Lombardo PS, et al. Lipoprotein lipase links dietary fat to solid tumor cell proliferation[J]. Mol Cancer Ther, 2011, 10: 427-436. DOI:10.1158/1535-7163.MCT-10-0802 |
 2022, Vol. 57
2022, Vol. 57


