2. 云南省农业科学院药用植物研究所, 云南 昆明 650200;
3. 玉溪师范学院化学生物与环境学院, 云南 玉溪 653100
2. Institute of Medicinal Plants, Yunnan Academy of Agricultural Sciences, Kunming 650200, China;
3. College of Chemistry, Biology and Environment, Yuxi Normal University, Yuxi 653100, China
滇龙胆(Gentiana rigescens Franch.) 又名“坚龙胆”、“龙胆草”等, 为龙胆科龙胆属植物, 传统的药用部位是其干燥根及根茎[1, 2]。最早记载于《神农本草经》, 称其“味苦涩, 主骨间寒热, 惊痫邪气, 续绝伤, 定五脏, 杀蛊毒”[3]。2020年版《中国药典》收载滇龙胆为龙胆的基原植物之一, 性寒味苦, 归肝、胆经, 具有清热燥湿、泻肝胆实火, 除下焦湿热之效用[4]。现代药理研究表明, 滇龙胆具有保肝[5, 6]、抗炎镇痛[7, 8]、神经保护[9]、调节免疫[10]、抗肿瘤、治疗心脑血管疾病等作用[10]。
中药材、中成药存在多成分、多靶点、多通路的复杂成分信息, 在作用机制研究方面具有一定的局限性。不同的栽培、贮藏、加工和配伍等方式均会导致其品质和功效的差异[11]。因此, Liu等[12]提出了质量标志物(quality marker, Q-marker) 的五大原则: ①可测性; ②特有性; ③有效性; ④中医药理论的关联性; ⑤溯源性, 以期对化学成分进行定性和定量分析, 筛选作为中药安全性和有效性的标志性物质, 为中草药的质量控制提供参考价值。网络药理学在药物作用机制的研究及药物作用靶点的确认方面具有很好的预测能力[13]。中药指纹图谱可以根据其“完整性”和“模糊性”的特点, 评价中药及中药制剂半成品质量的真实性、卓越性、稳定性和一致性[14, 15]。本研究以质量标志物理论为基础, 运用网络药理学(有效性研究) 结合高效液相色谱(可测性研究) 对2个产地10批滇龙胆药材进行分析, 从生物信息和化学角度预测其潜在质量标志物, 为后续的研究及质量控制提供参考。
材料与方法实验仪器 Agilent 1260 Infinity高效液相色谱仪(安捷伦科技有限公司); G1315D DAD VL检测器, G1311C Quat Pump VL四元梯度泵(带脱气机), G1316 ATCC柱温箱, G1329B ALS自动进样器, Agilent Technologies色谱工作站; AR1140电子天平(美国奥豪斯公司); DFY-500型中药粉碎机(温岭市林大机械有限公司); UPTL-II-40 L超纯水处理系统(成都优普电子产品有限公司); SY3200-T型超声波清洗器(声源超声波仪器设备有限公司)。
药材与试剂 如表 1所示, 10批野生滇龙胆分别采集自云南和贵州2个地区, 经云南省农业科学院药用植物研究所张金渝研究员鉴定均为滇龙胆。对照品龙胆苦苷(批号110770-201515, 纯度99.1%)、马钱苷酸(批号111865-201403, 纯度94.7%) 购自中国食品药品检定研究院; 獐芽菜苦苷(批号B11001, 纯度98.0%)、獐芽菜苷(批号B11118, 纯度98.0%) 购自上海士锋生物科技有限公司; 异荭草素、6'-O-β-D-葡萄糖基龙胆苦苷、异牡荆素(批号B2246) 购自上海安谱实验科技股份有限公司; 甲醇、乙腈(色谱纯, 美国Tedia公司); 超纯水; 其余试剂为分析纯。
| Table 1 Information of 10 batches of G. rigescens. G. rigescens: Gentiana rigescens Franch. |
色谱条件 Agilent Intersil-C18柱(4.6 mm × 150 mm, 5 μm, 日本GL Sciences公司); 流动相: 0.1%甲酸水溶液(A) 和乙腈(B), 流速1 mL·min-1, 梯度洗脱(0~2.5 min, 7%~10% B; 2.5~20 min, 10%~26% B; 20~29.02 min, 26%~58.3% B; 29.02~30 min, 58.3%~90% B; 30~34 min, 90% B); 柱温30 ℃; 进样量5 μL; 检测波长241 nm。
对照品溶液的制备 精密称取对照品龙胆苦苷36.0 mg、獐芽菜苦苷7.0 mg、獐芽菜苷7.0 mg、6'-O-β-D-葡萄糖基龙胆苦苷7.0 mg、马钱苷酸8.0 mg、异荭草素7.0 mg、异牡荆素7.0 mg, 置于10 mL锥形瓶中, 以甲醇溶解, 并稀释定容至刻度, 摇匀, 即得龙胆苦苷、獐芽菜苦苷、獐芽菜苷、6'-O-β-D-葡萄糖基龙胆苦苷、马钱苷酸、异荭草素和异牡荆素的对照品储备溶液, 放置于4 ℃下避光保存。
质量标志物对照品溶液的制备 精密称取对照品獐芽菜苷7.0 mg、龙胆苦苷36.0 mg、獐芽菜苦苷7.0 mg分别置于10 mL锥形瓶中, 以色谱纯甲醇溶解, 并稀释定容至刻度, 摇匀, 即得獐牙菜苷、龙胆苦苷、獐牙菜苦苷的对照品储备溶液, 放置于4 ℃下避光保存。
供试品溶液的制备 精密称取样品粉末0.25 g, 置试管中, 精密加入80%甲醇溶液15 mL, 摇匀, 超声提取40 min (功率150 W, 工作频率55 kHz), 放冷后滤过, 滤液用0.22 μm针式过滤器过滤, 即得。
定性和定量分析方法学考察 参照2020版中国药典指导原则[16]对建立的方法进行方法学考察, 对方法的精密度、重复性、稳定性、线性关系、检测限(LOD)、定量限(LOQ) 考察、加标回收率进行检测。
精密度 取滇龙胆样品(S1), 制备供试品溶液, 连续进样6次。以龙胆苦苷为参照峰, 计算相对峰面积和相对保留时间的相对标准偏差(RSD)。
重复性 取滇龙胆样品(S1) 各6份, 制备供试品溶液进行测定。以龙胆苦苷为参照峰, 计算相对峰面积和相对保留时间RSD。
稳定性 取滇龙胆样品(S1), 制备供试品溶液, 分别于0、2、4、8、12和24 h测定。以龙胆苦苷为参照峰, 计算相对峰面积和相对保留时间RSD。
线性关系、LOD及LOQ 精密量取混合对照品溶液1 mL, 按70%比例加入色谱纯甲醇稀释, 制备6个不同浓度混合对照品溶液。按所设定的色谱条件进行测定, 以峰面积值Y为纵坐标, 对照品质量浓度X为横坐标, 考察线性关系。以3倍基线噪音和10倍基线噪音时的溶液浓度作为LOD和LOQ。
加标回收率 精密称取已知獐芽菜苷、龙胆苦苷、獐芽菜苦苷含量的同一批次(S5) 滇龙胆样品10份, 每份25.0 mg, 对3种成分按50%、100%、150%水平的质量分数加入到对照品溶液, 进行3次水平检测, 计算加标回收率和RSD。
指纹图谱的建立及相似度分析 分别取10批滇龙胆药材, 制备供试品溶液依次进样测定, 记录HPLC图。将10批供试品色谱图导入“中药色谱指纹图谱相似度评价系统(2004版) ”中, 采用中位数法, 时间窗设置为0.1, 生成对照图谱并进行相似度计算。
候选化合物靶点检索 通过中药系统药理数据库PubChem Compound (PubChem (nih.gov))、Swiss Target Prediction (http://www.swisstargetprediction.ch/) 对化合物进行检索, 候选化合物作用的靶点, 并通过Uniprot数据库(http://www.uniprot.org) 将预测出的靶点蛋白名转换为对应的基因名。
靶点蛋白与蛋白互作 (PPI) 网络绘制及核心靶点筛选 将获得的靶点蛋白以“gene symbol”形式导入到STRING 11.0数据库(https://string-db.org/cgi/input.pl), 物种选择为homo sapiens, 其他参数设置不变, 去掉网络中的单一节点, 获得PPI网络图。对PPI进行拓扑特征分析, 选取在“中介中心性” (betweenness)、“接近中心性” (closeness)、“度中心性” (degree) 3个参数均大于中位数且degree ≥ 8的值作为筛选条件, 所筛选出的点作为核心靶点。
功能 (GO) 富集与通路 (KEGG) 富集分析 利用David 6.8数据库(https://david.ncifcrf.gov/) 对潜在的核心靶点蛋白进行GO功能和KEGG通路富集分析。GO功能分析主要用于描述基因靶点的功能, 包括细胞功能、分子功能和生物功能。KEGG富集分析可以得到潜在靶点所富集的信号通路。GO和KEGG分析均以P < 0.05代表具有统计学意义。
“成分-靶点-通路”网络的构建 将滇龙胆的活性成分、作用靶点、信号通路载入Cytoscape 3.7.1软件构建“成分-靶点-通路”网络。
结果 1 滇龙胆定性研究方法学考察 1.1 精密度结果显示, 各对照品峰相对峰面积RSD < 2.44%, 相对保留时间RSD < 0.25%, 表明仪器精密度良好, 符合指纹图谱要求。
1.2 重复性结果显示, 各对照品峰相对峰面积RSD < 2.58%, 相对保留时间RSD < 0.34%, 表明该方法的重复性良好, 符合指纹图谱要求。
1.3 稳定性结果显示, 各对照品峰相对峰面积RSD < 2.8%, 相对保留时间RSD < 0.19, 表明供试品溶液在24 h内稳定性良好, 符合指纹图谱要求。
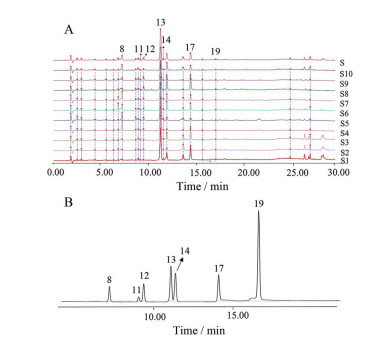
2 指纹图谱及相似度分析采用平均数法进行多点校正和色谱峰匹配, 结果共标定21个共有峰, 得到滇龙胆药材指纹图谱叠加图。经过与对照品的比对, 指认了其中7个色谱峰, 分别为马钱苷酸(8号峰)、6'-O-β-D-葡萄糖基龙胆苦苷(11号峰)、獐芽菜苦苷(12号峰)、龙胆苦苷(13号峰)、獐芽菜苷(14号峰)、异荭草素(17号峰)、异牡荆素(19号峰), 结果见图 1。运用“中药色谱指纹图谱相似度评价系统(2004版)”软件对10批滇龙胆药材指纹图谱的相似度进行计算, 结果表明10批滇龙胆药材具有良好的一致性。
|
Figure 1 Fingerprint overlay (A) and chromatogram of reference substance (B) of 10 batches of G. rigescens. 8: Loganic acid; 11: 6'-O-β-D-Glucosylgentiopicroside; 12: Swertiamarin; 13: Gentiopicroside; 14: Sweroside; 17: Isoorientin; 19: Isovitexin |
现代药理研究表明, 滇龙胆中环烯醚萜类、黄酮类、三萜类、生物碱类等成分是其发挥抗氧化、抗炎、抗癌、利胆、保肝、镇痛等药理活性的有效物质基础, 其中环烯醚萜类居于主要地位。滇龙胆主要以环烯醚萜类成分龙胆苦苷、獐芽菜苦苷、獐芽菜苷、马钱苷酸、6'-O-β-D-葡萄糖基龙胆苦苷等作为标志性成分[8, 17, 18]。Liu等[19]在对不同地理溯源滇龙胆进行质量评价时, 以环烯醚萜类成分作为标志物; Qi等[20]在对不同部位和不同栽培年份的滇龙胆进行定性和定量表征时, 以环烯醚萜苷类作为标志物; Shen等[21]在探索野生和栽培生态类型之间的差异研究中, 选择龙胆苦苷作为化学标记成分; Shen等[22]在评价不同加工方法的滇龙胆质量控制时, 以测定环烯醚萜类含量为指标。以上研究表明滇龙胆产地、部位、年份、种质差异、栽培方式、加工方法等的化学标志物均与环烯醚萜类化合物密切相关。结合HPLC色谱分析结果, 最终确定龙胆苦苷、獐芽菜苦苷、獐芽菜苷、马钱苷酸、6'-O-β-D-葡萄糖基龙胆苦苷5种成分为滇龙胆质量标志物的潜在来源范围进行分析。
3.2 候选化合物靶点预测通过数据库对龙胆苦苷、獐芽菜苦苷、马钱苷酸、獐芽菜苷、6'-O-β-D-葡萄糖基龙胆苦苷5种环烯醚萜类化合物进行筛选, 将筛选出的靶点蛋白合并, 除去重复靶点, 得到与5个化合物相关的70个靶点蛋白。
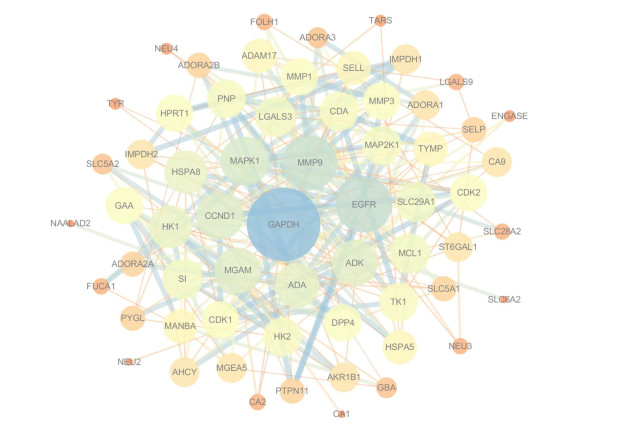
3.3 PPI网络分析70个靶点蛋白的PPI网络见图 2。经筛选后共得到19个重要核心靶点, 主要包括3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)、基质金属蛋白酶-9 (matrix metalloproteinase 9, MMP9)、丝裂原活化蛋白激酶1 (mitogen-activated protein kinase 1, MAPK1)、表皮生长因子受体(epidermal growth factor receptor, EGFR)、麦芽糖酶葡糖淀粉酶(maltase-glucoamylase, MGAM)、腺苷激酶(adenosine kinase, ADK)、腺苷脱氨酶(adenosine deaminase, ADA) 等, 且发现这19个靶点主要与龙胆苦苷、獐芽菜苦苷、獐芽菜苷、6'-O-β-D-葡萄糖基龙胆苦苷等成分有关。
|
Figure 2 Protein-protein interaction network (PPI) network of G. rigescens. GAPDH: Glyceraldehyde-3-phosphate dehydrogenase; MAPK1: Mitogen-activated protein kinase 1; EGFR: Epidermal growth factor receptor; MGAM: Maltase-glucoamylase; ADK: Adenylate kinase; ADA: Adenosine deaminase; CCND1: Cyclin-D1; LGALS3/9: Galectin 3/9; MAP2K1: Mitogen-activated protein kinase kinase 1; SLC29A1: Solute carrier family 29 member 1; MCL1: MCL1 apoptosis regulator, BCL2 family member; HK1: Hexokinase 1; HPRT1: Hypoxanthine phosphoribosyl transferase 1; ADK: Adenosine kinase (by homology); PNP: Purine nucleoside phosphorylase; CDA: Cytidine deaminase; SI: Sucrase-isomaltase; GAA: α-glucosidase; DPP4: Dipeptidyl peptidase 4; HK2: Hexokinase 2; CDK1/2: Cyclin-dependent kinase 1/2; MMP1/3/9: Matrix metallopeptidase 1/3/9; ADAM17: ADAM metallopeptidase domain 17; SELL: Selectin L; TYMP: Thymidine phosphorylase; TK1: Thymidine kinase 1; HSPA5/8: Heat shock protein family A member 5/8; MANBA: Mannosidase-β; IMPDH1/2: Inosine monophosphate dehydrogenase 1/2; ADORA1/3: Adenosine A1/3 receptor; ST6GAL1: ST6 β-galactoside-α-2, 6-sialyltransferase 1; OGA: O-GlcNAcase; AHCY: Adenosylhomocysteinase; AKR1B1: Aldo-keto reductase family 1 member B; ADORA2A/2B: Adenosine A2a/2b receptor; PYGL: Glycogen phosphorylase L; SELP: Selectin P; SLC5A1/2: Solute carrier family 5 member 1/2; FOLH1: Folate hydrolase 1; SLC28A2: Solute carrier family 28 member 2; FUCA1: α-L-Fucosidase 1; PTPN11: Protein tyrosine phosphatase non-receptor type 11; GBA: Glucosylceramidase β; NEU3: Neuraminidase 3; GRK1: G protein-coupled receptor kinase 1; ADH1A: Alcohol dehydrogenase 1A; DAO: D-Amino acid oxidase; ENGASE: Endo-β-N-acetylglucosaminidase; TARS: TAR DNA binding protein; NEU4: Neuraminidase 4; TYR: Tyrosinase; NAALAD2: N-acetylated α-linked acidic dipeptidase 2; NEU2: Neuraminidase 2; SLC6A2: Solute carrier family 6 member 2; CA1/2/7/9/12/13/14: Carbonic anhydrase 1/2/7/9/12/13/14 |
19个潜在核心靶点在GO富集分析中获取77个GO条目, 其中生物过程(biological process, BP) 占45个, 分子功能(molecular function, MF) 占16个, 细胞组成(cellular component, CC) 占16个, 选择P < 0.05, FDR < 0.05的条目进行展示, 见表 2。GO分析结果提示BP显著富集在腺苷脱氨酶、糖磷酸化、典型糖酵解; MF主要富集在肌联蛋白结合、三磷酸腺苷结合、内肽酶活性; CC主要涉及胞质溶胶、黏附斑激酶、细胞膜、顶端质膜、细胞外基质、细胞外泌体。
| Table 2 Go enrichment analysis of core target of G. rigescens. GO: Gene ontology; BP: Biological process; CC: Cellular component; MF: Molecular function; FDR: False discovery rate |
KEGG富集分析得到48条通路, 选择P < 0.05, FDR < 0.05的前15条通路进行展示, 见表 3。富集到的前15条通路主要涉及膀胱癌、缺氧诱导因子1信号通路、胰腺癌、甲状腺癌、乙型肝炎、丝裂原活化蛋白激酶信号通路等, 表明这19个核心靶点可能主要通过调控这些通路达到干预疾病的目的。
| Table 3 Top 15 KEGG pathway enrichment analysis of core target of G. rigescens. KEGG: Kyoto encyclopedia of genes and genomes |
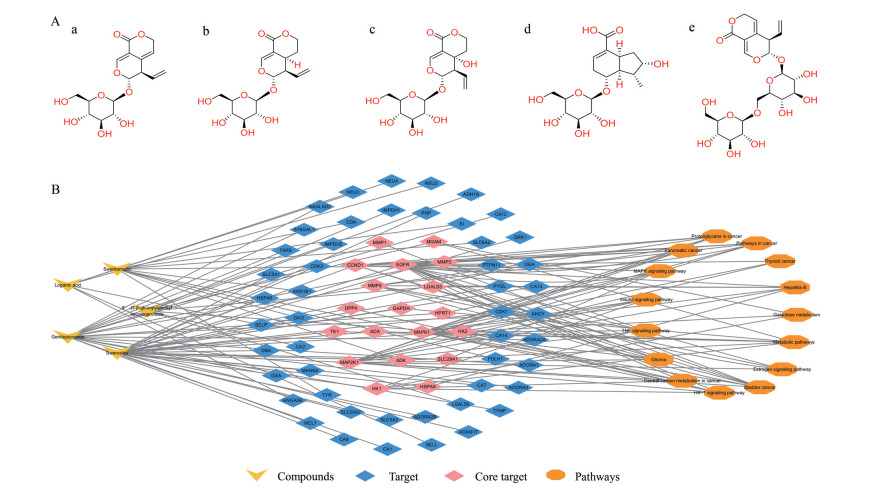
滇龙胆的5种主要成分的分子结构如图 3A所示。其5种活性成分、70个作用靶点、15条信号通路结果显示, 活性成分通过多靶点在不同的信号通路中发挥作用, 成分、靶点、通路间存在错综复杂的关系, 符合中药“多成分、多靶点”的特点(图 3B)。以度中心性为参考, 发现獐芽菜苷(degree = 28)、龙胆苦苷(degree = 18)、獐芽菜苦苷(degree = 10) 等化合物在网络中具有较高的连接度, 可能是滇龙胆发挥药效的主要活性物质。环烯醚萜类成分的网络药理学研究从成分有效性角度提示龙胆苦苷、獐芽菜苷、獐芽菜苦苷等成分可作为滇龙胆潜在质量标志物进行深层次研究。
|
Figure 3 Molecular structure of 5 main components (A) and ''compounds-targets-pathways'' network (B) of G. rigescens. a: Gentiopicroside; b: Sweroside; c: Swertiamarin; d: Loganic acid; e: 6'-O-β-D-Glucosylgentiopicroside |
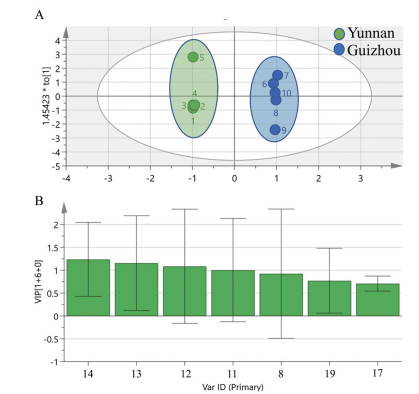
为更好地观察组间差异, 采用各组间的正交偏最小二乘(orthogonal partial least squares-discriminant analysis, OPLS-DA) 方法进行监督模式识别。结合评价OPLS-DA模型的3个指标: 模型拟合参数R2X = 0.928、R2Y = 0.903、模型预测参数Q2=0.508, 均大于0.5, 表明建立的数学模型稳定且预测能力较强。OPLS-DA得分矩阵图见图 4A, 可看出2个产地滇龙胆样品明显聚为2类: S1、S2、S3、S4、S5产地聚为一类; S6、S7、S8、S9、S10产地聚为一类。
|
Figure 4 Orthogonal partial least squares-discriminant analysis (OPLS-DA) score (A) and variable importance in the projection (B) of 10 batches of G. rigescens |
为确定引起各产地滇龙胆差异的物质, 通过各变量投影重要性指标(variable importance in the projection, VIP) 值正态分布图(图 4B), 筛选出贡献较大变量作为其质量差异的标志化合物。以VIP > 1作为筛选条件, 最终确定14号峰(獐芽菜苷)、13号峰(龙胆苦苷)、12号峰(獐芽菜苦苷) 可作为区分不同产地滇龙胆主要标志性成分。鉴于此, 本研究对獐芽菜苷、龙胆苦苷、獐芽菜苦苷3个主要标志性成分展开定量分析。
5 滇龙胆质量标志物含量测定 5.1 方法学考察 5.1.1 线性关系、LOD及LOQ经过测定, 线性关系、LOD和LOQ结果见表 4。
| Table 4 Results of linear relationship, LOD and LOQ investigation of 3 main components of 10 batches of G. rigescens. R: Correlation coefficient; LOD: Limit of detection; LOQ: Limit of quantitation |
测得主要成分獐芽菜苷、龙胆苦苷、獐芽菜苦苷的峰面积RSD分别为4.79%、0.08%、0.46%, 结果表明仪器精密度良好。
5.1.3 重复性测得主要成分獐芽菜苷、龙胆苦苷、獐芽菜苦苷的峰面积RSD分别为2.99、2.31%、1.48%, 结果表明实验所用方法重复性良好。
5.1.4 稳定性测得主要成分獐芽菜苷、龙胆苦苷、獐芽菜苦苷的峰面积RSD分别为1.89%、1.23%、2.48%, 结果表明实验所用方法稳定性良好。
5.1.5 加标回收率结果在97.40%~103.35%之间, RSD为1.73%~3.10%, 表明方法准确性高。
5.2 样品测定取10批滇龙胆样品, 制备供试品溶液进行峰面积的测定, 计算獐芽菜苷、龙胆苦苷、獐芽菜苦苷的含量, 结果见表 5。
| Table 5 Results of three main components of ten batches of G. rigescens detection |
由表 5可见, 10批滇龙胆样品的3种化学成分种类差异不大, 但含量具有一定的差异, 各批次样品龙胆苦苷含量均大于3%, 且龙胆苦苷含量大于獐芽菜苦苷和獐芽菜苷, 均符合药典的含量要求[4]。
讨论中药质量是影响工业发展和民生的重大问题, 关系到中药的临床疗效和产业发展前景, 有必要不断完善中药质量评价体系, 使其具有合理性、先进性和实用性。质量标志物思想是以中医理论为基础、多学科知识网络为支撑, 针对中药的生物属性、配伍关系、生产制备工艺等, 构建药效-物质基础-质量控制的关系链。展现了中药质量关键属的本质内涵和中药质量共性问题的思维模式, 重点阐述中药从生产到生产的全过程中特定质量核心物质的可追溯性和传递性, 并对整个过程的动态质量进行分析和控制, 以确保中药的有效性[12, 23]。网络药理学在成分、疾病、基因、靶点、中药相互作用网络的基础上, 阐释中药的作用机制[15]。
本研究依据刘昌孝院士提出的质量标志物理念, 从有效性及可测性角度预测滇龙胆的潜在质量标志物。通过文献查阅和HPLC色谱分析初步锁定滇龙胆质量标志物的来源范围为环烯醚萜类化合物。基于网络药理学从有效性的角度出发, 确定环烯醚萜类成分中5种活性成分可通过GAPDH、MMP9、HRAS等19个核心靶点作用于缺氧诱导因子-1信号通路、乙型肝炎、催乳素信号通路、胰腺癌等15个信号通路发挥药理作用。滇龙胆中的环烯醚萜类成分在保肝、抗炎镇痛中能发挥一定的作用[19, 24]; Mao等[25]发现龙胆苦苷的抗炎作用多与核转录因子-κB (NF-κB) 通路和丝裂原活化蛋白激酶(MAPK) 通路相关, 对肿瘤坏死因子-α (TNF-α)、白细胞介素-6 (IL-6)、白细胞介素-1β (IL-1β) 这几个炎症因子均有明显的抑制效果。Ye等[26]研究发现龙胆苦苷能通过抑制MAPKs途径中P38、ERK、JNK的磷酸化, 降低COX-2的表达, 减少PGE2的产生, 使MMP-1、MMP-3、MMP-13的表达降低, 达到抑制Ⅱ型胶原降解的目的, 对软骨细胞有一定的保护作用。Xu等[27]研究表明獐芽菜苦苷可通过抑制肝脏内的p38 MAPK和NF-KB通路的激活, 缓解HFD介导的肝硬化和炎症。
为进一步明确滇龙胆的质量标志物, 采用HPLC色谱从可测性角度对不同产地滇龙胆进行定性和定量研究, 通过OPLS-DA筛选出獐芽菜苷、龙胆苦苷、獐芽菜苦苷为主要标志性成分, 不同产地滇龙胆中3种标志性成分含量高低各异且具有显著差异; 结合网络药理学分析结果确定这3种化学成分既是造成产地间差异的主要标记性成分, 又是滇龙胆发挥临床功效的活性成分, 最终确定獐芽菜苷、龙胆苦苷、獐芽菜苦苷为滇龙胆潜在的质量标志物。
滇龙胆是我国云南的特色药用植物, 具有抗炎、保肝等作用。随着化学成分研究的不断深入, 药理学研究已从提取物的研究转向单体化合物的筛选。目前, 网络药理学结合指纹图谱对滇龙胆特征成分的质量标准研究较少, 有必要建立科学有效的质量控制方法。本研究通过网络药理学和指纹图谱对滇龙胆潜在的质量标志物进行分析预测, 为全面建立滇龙胆质量评价方法和质量追溯体系提供了理论依据。
作者贡献: 刘春路主要进行了本文方法建立、数据处理、文章撰写及对编辑部修改意见进行修改等。沈涛、张霁主要对实验思路、方法建立、数据处理及文章修改进行专业的指导。徐福荣、王元忠主要进行本文的选题与设计、实验思路、方法建立的指导及文章校对。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Pan Y, Shen T, Pan J, et al. Simultaneous determination of four neuritogenic compounds in Gentiana rigescens from different regions by ultra-performance liquid chromatography tandem mass spectrometry[J]. Asian J Chem, 2015, 27: 1248-1250. |
| [2] |
Zhu ZY. Important Natural Medicines in Yunnan (云南重要天然药物)[M]. Kunming: Yunnan Science Press, 2006: 343-344.
|
| [3] |
Editorial Board of "Chinese Materia Medica" of the State Administration of Traditional Chinese Medicine. Chinese Materia Medica (中华本草)[M]. Vol 6. Shanghai: Shanghai Science Press, 1999: 1240-1999.
|
| [4] |
Chinese Pharmacopoeia Committee. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. 2020 Ed. Vol 1. Beijing: China Medical Science Press, 2020: 99-100.
|
| [5] |
Yang YG, Zhao YL, Zuo ZT, et al. Investigation of a mdical plant for hepatic diseases with secoiridoids using HPLC and FT-IR spectroscopy for a case of Gentiana rigescens[J]. Molecules, 2020, 25: 1219. DOI:10.3390/molecules25051219 |
| [6] |
Zhang XD, Allan AC, Li CX, et al. De novo assembly and characterization of the transcriptome of the Chinese medicinal herb, Gentiana rigescens[J]. Int J Mol Sci, 2015, 16: 11550-11573. DOI:10.3390/ijms160511550 |
| [7] |
Pan Y, Zhao YL, Zhang J, et al. Phytochemistry and pharmacological activities of the genus Gentiana (Gentianaceae)[J]. Chem Biodivers, 2016, 13: 107-150. DOI:10.1002/cbdv.201500333 |
| [8] |
Li W, Zhou W, Kim S, et al. Three new secoiridoid glycosides from the rhizomes and roots of Gentiana scabra and their anti-inflammatory activities[J]. Nat Prod Res, 2015, 29: 1-8. DOI:10.1080/14786419.2014.955488 |
| [9] |
Mustafa AM, Caprioli G, Dikmen M, et al. Evaluation of neuritogenic activity of cultivated, wild and commercial roots of Gentiana lutea L.[J]. J Funct Foods, 2015, 19: 164-173. DOI:10.1016/j.jff.2015.09.018 |
| [10] |
Ning Y, Cheng YP, Ma AP, et al. Latest progress on the pharmacological activity of Gentiana scabra Bunge[J]. Chem Eng (化学工程师), 2017, 31: 47-49. |
| [11] |
Sun Y, Xu G, Ma SC, et al. Development of an overall evaluation system for traditional Chinese medicine[J]. Acta Pharm Sin (药学学报), 2021, 56: 1749-1756. |
| [12] |
Liu CX, Chen SL, Xiao XH, et al. A new concept on quality marker of Chinese materia medica: quality control for Chinese medicinal products[J]. Chin Tradit Herb Drugs (中草药), 2016, 47: 1443-1457. |
| [13] |
Zhong RX, Ding ZH, Yang YN, et al. Study on the pharmacodynamic material basis and mechanisms of Ju-Hong Tan-Ke liquid for the treatment of "phlegm, cough, and asthma" based on network pharmacology[J]. Acta Pharm Sin (药学学报), 2020, 55: 2134-2144. |
| [14] |
Xie PS. The concept, attributes, technology and application of chromatographic fingerprint identification of traditional Chinese medicine[J]. China J Chin Mater Med (中国中药杂志), 2001, 26: 5-7. |
| [15] |
Zhang H, Chen Y, Wang JN, et al. Application of fingerprint technology in quality evaluation and process control of traditional Chinese medicine formula granules[J]. China J Chin Mater Med (中国中药杂志), 2018, 43: 3822-3827. |
| [16] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. 2020 Ed. Vol 4. Beijing: China Medical Science Press, 2020: 466-468.
|
| [17] |
Chu BW. Multi-level Evaluation of Chinese Medicine Fingerprint Combined with Chemometrics on Gentiana yunnanensis (中药指纹图谱结合化学计量学对滇龙胆的多层次评价)[D]. Kunming: Yunnan University of Chinese Medicine, 2016.
|
| [18] |
Chu BW, Zhang J, Li ZM, et al. Research advances in chemical constituents and pharmacological activity from Gentiana rigescens[J]. Chin J Exp Tradit Med Form (中国实验方剂学), 2016, 22: 213-222. |
| [19] |
Liu L, Zuo ZT, Xu FR, et al. Study on quality response to environmental factors and geographical traceability of wild Gentiana rigescens Franch[J]. Front Plant Sci, 2020, 11: 1128. DOI:10.3389/fpls.2020.01128 |
| [20] |
Qi LM, Zhang J, Zhao YL, et al. Quantitative and qualitative characterization of Gentiana rigescens Franch (Gentianaceae) on different parts and cultivations years by HPLC and FTIR spectroscopy[J]. J Anal Methods Chem, 2017, 2017: 3194146. |
| [21] |
Shen YX, Zhao YL, Zhang J, et al. Study on different parts of wild and cultivated Gentiana rigescens with fourier transform infrared spectroscopy[J]. Spectrosc Spect Anal (光谱学与光谱分析), 2016, 36: 667-671. |
| [22] |
Shen YX, Zhao YL, Zhang J, et al. Study on the discrimination of Gentiana rigescens with different processing methods by using FTIR spectroscopy[J]. Spectrosc Spect Anal (光谱学与光谱分析), 2016, 36: 1369-1373. |
| [23] |
Liu CX. Quality marker (Q-marker) of Chinese materia medica: improving quality standard and quality control theory of CMM and promoting scientific development of CMM industry[J]. Chin Tradit Herb Drugs (中草药), 2019, 50: 4517-4518. |
| [24] |
Yang Y, Li J, Wei C, et al. Amelioration of nonalcoholic fatty liver disease by swertiamarin in fructose-fed mice[J]. Phytomedicine, 2019, 59: 152782. DOI:10.1016/j.phymed.2018.12.005 |
| [25] |
Mao GH, Zhang LQ, Qian F, et al. Research progress on anti-inflammatory activity of three kinds of iridoid glycosides in Chinese materia medica[J]. Chin Tradit Herb Drugs (中草药), 2019, 50: 225-228. |
| [26] |
Ye J. Exploring the Protective Effect and Mechanism of Total Secoiridoid Glucoside and Gentiopicroside Extracted from Gentiana officinalis H. Smith on Chondrocytes Induced by IL-1β (黄管秦艽中总环烯醚萜苷、龙胆苦苷对IL-1β诱导大鼠软骨细胞损伤的保护作用及机制研究)[D]. Lanzhou: Gansu University Chinese Medicine, 2014.
|
| [27] |
Xu L, Li DD, Zhu YQ, et al. Swertiamarin supplementation prevents obesity-related chronic inflammation and insulin resistance in mice fed a high-fat diet[J]. Adipocyte, 2021, 10: 160-173. DOI:10.1080/21623945.2021.1906510 |
 2022, Vol. 57
2022, Vol. 57


