近年来大量研究显示, 蛋白质内稳态失控在恶性肿瘤等疾病进展中发挥重要作用。其中泛素-蛋白酶体通路异常是导致蛋白质内稳态失控的重要因素。而在该过程中, 负责移除蛋白底物泛素链的去泛素化酶至关重要, 其活性或表达异常可造成关键致癌/抑癌蛋白的功能变化, 直接导致肿瘤发生发展和恶性演进。基于此, 靶向去泛素化酶的小分子抑制剂已经成为抗肿瘤候选药物的热点领域。本综述将重点介绍泛素-蛋白酶体通路、尤其是去泛素化酶对肿瘤的调控作用和机制, 并针对小分子抑制剂的研究现状和最新进展展开讨论, 为基于去泛素化酶的抗肿瘤新策略研究提供思路。
1 泛素-蛋白酶体通路作为抗肿瘤药物作用靶点的研究现状 1.1 泛素化修饰是调控蛋白质稳定性和功能的重要方式泛素(ubiquitin, Ub) 是一种存在于所有真核生物(大部分真核细胞) 中的小分子蛋白质, 含有76个氨基酸残基, 分子量大约为8.451 kDa。泛素化是指泛素分子结合到蛋白质底物上, 从而调节底物蛋白的稳定性及功能的过程, 是一种重要的蛋白质翻译后修饰方式(post translational modifications, PTMs)[1]。该过程主要在蛋白质上添加进化保守的小蛋白, 包括泛素或泛素样蛋白(ubiquitin-like proteins, UBLs), 并靶向蛋白质用于蛋白酶体降解或非降解信号传导[2]。修饰蛋白上的泛素蛋白分子通过与泛素活化酶E1、泛素结合酶E2和泛素连接酶E3之间的结合, 进而发生一系列酶促反应与赖氨酸侧链残基共价结合[3]。E1活化酶首先以ATP依赖的方式激活泛素蛋白的末端甘氨酸, 与E1的一个半胱氨酸形成硫酯键; 然后通过反式硫酯化转移到E2结合酶的活性位点半胱氨酸上。随后, 600多个E3连接酶中的一个作为适配器(E3连接酶的Hect家族除外, 它涉及第三个硫代酯中间体的形成), 同时结合E2-Ub中间体和靶蛋白, 以催化羧基末端甘氨酸之间的异肽键形成, 最后将这些底物(依赖降解通路) 转移至蛋白酶体降解(图 1)。
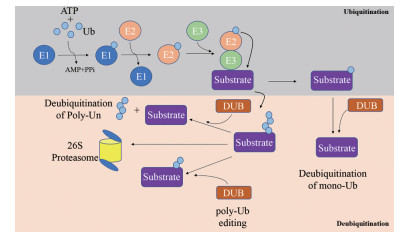
|
Figure 1 Ubiquitination and deubiquitination process. Ub: Ubiquitin; DUB: Deubiquitylating enzyme; E1: Ubiquitin activating enzyme; E2: Ubiquitin conjugating enzyme; E3: Ubiquitin protein ligase |
底物蛋白质往往通过发生多个泛素化反应, 产生单泛素链或多泛素链。因为泛素本身具有7个赖氨酸(K) 残基, 包括Lys6、Lys11、Lys27、Lys29、Lys33、Lys48和Lys63, 所以可通过将其他的泛素蛋白转移到这7个赖氨酸残基或氨基末端中的一个来延伸这种泛素修饰[4]。根据形成的链拓扑结构不同, 泛素化修饰对分子过程及生命活动造成的影响也会有所不同。如用K48、K11连接的多泛素链标记的结合蛋白质用于降解[5], 而K63和线性泛素链修饰是胞内信号传导的重要方式, 因此在多种生命活动如DNA复制、DNA修复、信号转导通路和炎症过程中发挥重要作用[6]。K6和K27多泛素化蛋白分别与DNA损伤反应和线粒体维持相关[7, 8]。此外, K29和K33聚泛素化蛋白分别与溶酶体降解和T细胞受体信号传导有关[9]。泛素化调节蛋白质相互作用、定位和酶活性, 从而影响细胞过程, 包括转录、DNA损伤信号和DNA修复、细胞周期进展、内吞、凋亡和其他各种过程[10]。这些过程一旦发生异常, 将导致恶性肿瘤、神经退行性疾病以及免疫/炎症相关疾病的发生。
1.2 去泛素化酶等泛素-蛋白酶体通路关键蛋白是肿瘤治疗的潜在新靶点近年来, 泛素-蛋白酶体通路失调与恶性肿瘤之间的相关性研究已经成为热点, 诸多研究表明靶向干预该通路有望成为理想的抗肿瘤治疗策略。其中, 针对蛋白酶体抑制剂的研究进展最快, 目前被FDA批准的蛋白酶体抑制剂有bortezomib、carfilzomb和ixazomb[11, 12], 已上市并被用于多发性骨髓瘤和套细胞淋巴瘤的治疗。蛋白酶体抑制剂阻断蛋白酶体对底物蛋白的降解和调控, 可使肿瘤细胞中错误折叠的蛋白聚集或稳定抑癌蛋白使肿瘤细胞凋亡。但泛素-蛋白酶体系统参与生命活动的调控机制复杂且涉及多个层次, 而蛋白酶体抑制剂针对泛素-蛋白酶体途径的下游, 其特异性较差、造成的不良反应众多(如患者背根神经节处会出现泛素化蛋白的积聚, 引起周围神经病变等)、复发频繁最终可能会产生耐药性[13, 14]。
与靶向蛋白酶体相比, 特异性靶向具有较强底物蛋白质选择性的E3泛素连接酶以及去泛素化酶(deubi-quitylating enzymes, DUBs), 有望获得更佳的调控特异性, 有可能为抗肿瘤治疗提供更好的策略。如来那度胺通过靶向抑制E3泛素连接酶CRBN (cereblon) 发挥显著的活性, 通过形成CRBN-CRL4 (cullin-RING ligase 4) 复合物结合的新底物, 导致泛素化和蛋白酶体依赖性降解, 从而产生抗骨髓瘤活性[15], 已成功获批用于多发性骨髓瘤、骨髓增生异常综合征(myelodysplastic syndromes, MDS) 恶性肿瘤和自身免疫性疾病的治疗[16]。近年来有越来越多的研究关注去泛素化酶在抗肿瘤治疗中的潜在价值, 下文将介绍去泛素化酶调控恶性肿瘤发生发展的相关机制, 并对目前用于临床肿瘤治疗研究的去泛素化酶小分子抑制剂进行简单介绍, 展示去泛素化酶作为抗肿瘤治疗新靶点所具有的潜力。
2 去泛素化酶调控恶性肿瘤的具体作用和机制去泛素化酶的主要功能是从已经结合有泛素链的底物蛋白质上去除泛素蛋白, 进而调节多种生命过程, 如防止蛋白酶体或溶酶体依赖的蛋白质降解, 或通过改变蛋白质的功能, 调节细胞凋亡、细胞周期、染色体分离、基因表达、DNA修复、激酶激活等[1], 因此在恶性肿瘤发生及发展中扮演重要角色。
去泛素化酶可分为7大家族共计98个成员: 泛素特异性蛋白酶(ubiquitin-specific proteases, USPs)、泛素羧基末端水解酶(ubiquitin carboxy-terminal hydrolases, UCHs)、卵巢肿瘤蛋白酶(ovarian tumour proteases, OTUs)、Machado-Joseph病蛋白结构域蛋白酶(Machado-Joseph disease protein domain proteases, MJDs)、JAMM/MPN区域相关金属肽酶(JAMM/MPN domain-associated metallopeptidases, JAMMs)、含锌指的泛素肽酶1 (zinc finger-containing ubiquitin peptidase 1, ZUP1) 以及motif与泛素相互作用的新DUB家族(motif interacting with ubiquitin-containing novel DUB family proteases, MINDYs)[17, 18]。除JAMMS为金属肽酶外, 其余6个家族成员均为半胱氨酸蛋白酶。
USP是去泛素化酶中家族成员数目最多的, 在人类中目前已发现有56个成员。USP家族成员的蛋白晶体结构被解析得最为透彻, 在PDB数据库中占据全体去泛素化酶的59%[19]。由于现有已报道的针对USP家族成员的研究数量最多、研究方向最为广泛、作用机制探究最为深入, 本文更多地以USP家族成员为代表, 介绍去泛素化酶调控恶性肿瘤的作用与机制。
2.1 影响转录因子或基因转录调控过程的去泛素化酶以目前相关研究最为成熟的人泛素特异性蛋白酶7 (ubiquitin-specific protease 7, USP7) 为例。USP7又称疱疹病毒相关蛋白酶(Hausp), 是一种半胱氨酸肽酶, 属于USP家族。USP7已被发现在慢性淋巴细胞白血病、前列腺癌、胶质瘤、非小细胞肺癌、上皮性卵巢癌等肿瘤患者中过度表达, 诱导细胞浸润, 并与肿瘤患者的不良预后紧密相关[20-22]。
转录因子p53是一种重要的抑癌因子, 在超过50%的人类肿瘤中丢失或突变, 多种致癌机制导致其被蛋白酶体降解[23], 其负调节因子MDM2 (murine double minute 2) 是一种重要的E3泛素连接酶, 介导p53蛋白的泛素化, 导致其经由蛋白酶体通路降解。p53和MDM2会特异性地识别并结合USP7的N末端TRAF (tumor necrosis factor-receptor associated factor) 样结构域(USP7-NTD), 且USP7优先与MDM2相互作用[24], 防止其降解, 因此对MDM2蛋白表现出更强的去泛素化酶活性和稳定能力[25], 以维持足够的MDM2蛋白作为p53蛋白的E3泛素连接酶, 确保p53蛋白在静止条件下保持在低水平, 进而为肿瘤的发生发展创造条件(图 2)。总的来说, USP7在人类肿瘤中的过度表达将会抑制MDM2和MDMX (murine double minute X) 的降解从而抑制p53信号, 减少其引起细胞周期阻滞和凋亡, 继而有助于肿瘤的发生和发展, 这一调控机制的发现使得USP7成为肿瘤治疗的潜在靶点之一[26]。
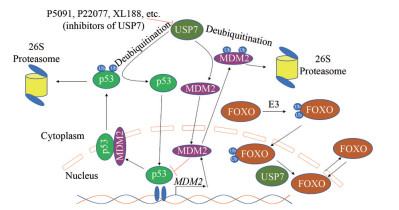
|
Figure 2 USP7 regulates p53-MDM2-USP7 pathway and transcriptional activity of FOXO. USP7: Ubiquitin-specific protease 7; FOXO: Forkhead box O; MDM2: Murine double minute 2 |
除p53-MDM2-USP7通路外, USP7还参与了多种重要的肿瘤相关蛋白的调控, 如PTEN (phosphatase and tensin homologue deleted on chromosome 10)、FOXO4 (forkhead box O4)、C-Myc (MYC proto-oncogene, bHLH transcription factor) 和N-Myc (MYCN proto-oncogene, bHLH transcription factor) 的调控。USP7去泛素化PTEN, 减少其单链化, 导致核排斥和PTEN失活, 进而促进癌症发生与转移[27]; USP7去泛素化FOXO4并诱导其核输出(图 2), 抑制其转录活性, 从而抑制CDK抑制剂p21、kip1和CDKN1B等抑癌靶基因的表达[28]; USP7去泛素化转录因子FOXP3 (forkhead box-p3), 增加FOXP3蛋白的含量, 从而提高Treg细胞抑制肿瘤特异性T细胞免疫的功能, 并在体内促进肿瘤的生长[29]。USP7去泛素化C-Myc调控因子TRRAP (transformation/transcription domain-associated protein), 从而促进C-Myc表达, C-Myc是细胞生长、增殖和凋亡的主要调控因子; USP7在体内和体外诱导N-Myc去泛素化, 进而稳定N-Myc。这些发现为USP7可能在肿瘤细胞信号传导中发挥致癌作用提供了新的认知[30]。
除USP7外, USP家族中多名成员也同样被发现与抑癌或致癌基因转录调控相关, 如USP2 (ubiquitin-specific proteases 2) 可以去泛素化稳定多个下游底物, 如MDM2、MDMX、cyclin D1、Fas (fatty acid synthase)、TGF-βR1 (transforming growth factor-β type 1 receptor) 和cyclin A1等[31]; USP8 (ubiquitin-specific peptidase 8, 又称UBPY) 在早期内小体上去泛素化EGFR (epidermal growth factor receptor), 使EGFR免于降解[32]; USP15调节转化生长因子-β通路, 与Smad7-Smad特异性E3泛素蛋白连接酶2 (Smad7-Smad specific E3 ubiquitin protein ligase 2, SMURF2) 复合物结合, 使其去泛素化从而稳定Ⅰ型转化生长因子β受体, 增强β信号[33]。
去泛素化酶其他家族成员也在抑癌或者促癌因子转录方面发挥作用。MJD家族成员ATXN3 (ataxin-3) 及OTU家族的OTUD5 (ovarian tumour proteases deubiquitinase 5) 可以去泛素化稳定p53, 使得p53应答基因的选择性激活, 导致细胞周期阻滞及细胞凋亡[34, 35]; UCH家族成员UCHL3 (ubiquitin carboxy-terminal hydrolases L3) 通过去泛素稳定TRAF2进而激活NF-κB信号, 导致肿瘤发生[36]; 同样属于UCH家族的BAP1 [breast cancer 1 (BRCA1)-associated protein 1] 可以去泛素稳定KLF5 (kruppel-like factor 5), 促进乳腺癌细胞的增殖、存活、迁移和肿瘤生长[37]。
2.2 调控DNA损伤及修复的去泛素化酶DNA损伤反应(DNA damage response, DDR) 是由DNA损伤触发的细胞内的一系列相关反应, 主要包括DNA修复等[38]。DDR的缺陷与多种人类疾病尤其是肿瘤密切相关[39]。目前, 已有报道发现, 泛素或泛素样蛋白的加入和去除是调控DDR的关键机制[40], 越来越多的研究证明去泛素化酶在DNA修复过程中发挥重要的作用, 与人类肿瘤密切相关, 这提示靶向去泛素化酶调控DNA修复可能是治疗恶性肿瘤的新方向[41]。
这方面的研究大多集中于USP家族成员[42]。USP1去泛素化FANCD2-FANCI (Fanconi anemia complementation group D2-Fanconi anemia complementation group I), 影响范可尼贫血(Fanconi anemia, FA) 核心复合物的形成和在DNA损伤位点的招募积累, 从而启动FA-BRCA通路介导DNA链间交联修复[43]。
USP11 (ubiquitin-specific proteases 11) 去泛素化PALB2 (partner and localizer of breast cancer 2), 促使其与BRCA1相互作用, 形成BRCA1-PALB2-BRCA2复合物, 从而启动G1期细胞同源重组(homologous recombination, HR) DNA修复途径[44]。
USP9X (ubiquitin-specific protease 9X) 通过调节S期蛋白Claspin [claspin homolog (Xenopus laevis)] 来维持DNA复制叉的稳定性和DNA损伤检查点的反应。USP9X耗竭会影响Claspin在复制叉动力学和DNA损伤反应中的作用, 从而导致DNA损伤的积累[45]。
2.3 通过其他机制调控恶性肿瘤的去泛素化酶与蛋白酶体相关的去泛素化酶如PSMD14 (proteasome 26S subunit, non-ATPase 14, 也称为POH1)、USP14 (ubiquitin-specific proteases 14) 和UCHL5 (ubiquitin carboxy-terminal hydrolases L5) 会与蛋白酶体形成二聚体, 附着在蛋白酶体上。这些特殊的去泛素化酶修饰底物上的泛素结构后, 使得底物可以进入蛋白酶体催化降解核心位点或从破坏中解放[10]。靶向蛋白酶体相关的去泛素化酶可能会对肿瘤细胞起到更好的细胞毒性效果, 且毒性比靶向核心蛋白酶体催化功能的药物要小[46]。JAMM金属蛋白酶PSMD14在肝癌细胞中表达增高[47], 且其缺失会抑制多发性骨髓瘤细胞的增殖[48], 还具有调节癌基因受体酪氨酸激酶HER2 (human epidermal growth factor receptor-2) 泛素化和稳定性的作用[49]; USP14主要与蛋白酶体19S RPN1亚基(也称为PSMD2) 可逆地结合在一起, 从而增强了它的活性[50], 通过修饰底物上的泛素链来阻止蛋白质降解。USP14在非小细胞肺癌、卵巢癌等组织中表达上调[51]。与USP14类似, UCHL5同样与蛋白酶体可逆地相互作用, 与RPN13受体(也称为ADRM1) 结合[52], 或增强蛋白酶体降解作用, 或从泛素化蛋白中去除远端泛素结构, 从而使得蛋白质逃避被降解的命运[53]。UCHL5在上皮性卵巢癌、肝细胞癌中过度表达, 并能促进细胞迁移和侵袭, 与晚期肿瘤进展及临床预后不良有关[54, 55]。
氧化应激是阻碍肿瘤发生和发展的一个重要障碍[56]。有研究发现[57], 抑制去泛素化酶活性使肿瘤细胞对抗氧化剂谷胱甘肽的耗竭敏感, 谷胱甘肽的缺失使肿瘤细胞依赖去泛素化酶活性来维持蛋白质的稳态和细胞活力。在肿瘤细胞株上抑制GCLC来限制谷胱甘肽的合成, 同时添加去泛素化酶抑制剂(主要抑制USP7), 此时会导致多泛素化蛋白的积累, 诱导蛋白质毒性应激, 导致细胞死亡, 而单独抑制谷胱甘肽的合成并不足以导致大多数肿瘤细胞株的死亡[58]。虽然该研究并未探求其详细作用机制, 但提示联合抑制谷胱甘肽与去泛素化酶具有潜在的肿瘤治疗效果。
3 靶向抑制去泛素化酶的小分子化合物发现和研究进展 3.1 去泛素化酶小分子抑制剂的研究概况目前, 已被报道的去泛素化酶小分子抑制剂约61个, 分为泛素类似物、催化抑制剂、变构抑制剂3种类型, 对应了29种不同的去泛素化酶[19]。目前发现的去泛素化酶抑制剂往往可以同时抑制多种去泛素化酶活性, 由此可以看出, 已开发的去泛素化酶小分子抑制剂多为多靶点抑制剂, 其特异性和选择性有待提高。
通过统计目前已报道的去泛素化酶抑制剂以及其对应的去泛素化酶的蛋白晶体结构上传至PDB (Protein Data Bank) 数据库的情况[19], 可以发现, 针对不同去泛素化酶家族成员的抑制剂的数量并不均衡(表 1)。由于对USP家族的蛋白结构、底物蛋白与作用机制研究最为深入, 其对应小分子抑制剂的开发也最为丰富。由此可见, 对去泛素化酶成员蛋白结构及调控机制研究越深入透彻, 其抑制剂的研发速度越快, 相应抑制剂的数量越多, 作用机制亦更为明确[19]。
| Table 1 Proportion of inhibitors of deubiquitinase families to Protein Data Bank database. *The rest 2% were pan inhibitors. USPs: Ubiquitin-specific proteases; JAMMs: JAMM/MPN domain-associated metallopeptidases; OTUs: Ovarian tumor proteases; MJDs: Machado-Joseph disease protein domain proteases; MINDYs: Motif interacting with ubiquitin-containing novel DUB family proteases; ZUP1: Zinc finger-containing ubiquitin peptidase 1 |
以目前研究最为成熟的去泛素化酶之一——USP7为例, 目前人们已经解析其蛋白结构及作用的底物蛋白[20], 并明确其在调控肿瘤细胞MDM2/MDMX-p53通路中的关键作用, 据此开发出多种不同作用方式的USP7抑制剂, 且这些抑制剂多具有较高的选择性(表 2)[59-67]。第一类为不直接结合抑制USP7活性的抑制剂如P5091, 属于第一代USP7抑制剂。P5091通过促进MDM2和MDMX泛素化加速其被蛋白酶体降解, 从而激活p53及下游p21, 对抗USP7的去泛素化酶活性, 从而诱导多发性骨髓瘤细胞凋亡[59]。第二类为共价结合抑制剂如P22077, 它会共价修饰USP7催化中心的半胱氨酸223 (Cys223), 引起活性部位构象的改变, 从而抑制其酶活性[60]。第三类为变构抑制剂, 代表有XL188、FT671等, 它们基于对USP7、USP7-配体配合物的晶体结构和功能域特别是催化核的了解而设计, 或直接与USP7的泛素结合位点结合, 或选择性地结合到USP7的S4-S5口袋抑制其去泛素化酶活性[66]。天然产物小檗碱被认为是一种新型USP7抑制剂, 可破坏MDM2-DAXX-USP7复合物从而使得MDM2泛素化及降解[68], 其与复合物的结合机制有待进一步研究。
| Table 2 Some reported selective inhibitors of USP7 |
此外, 目前开发去泛素化酶选择性抑制剂仍存在诸多问题: ①大多数报道的去泛素化酶抑制剂表现出的抑制活性较弱, 或包含不良的化学特征, 或对目前已知的去泛素化酶家族的选择性较差[69]。②泛素化和去泛素化是细胞内的过程, 目前的抑制剂筛选发现模型主要是基于体外过程的生化方法, 如要发现效果更为确切的抑制剂, 尚需构建和优化更多高效准确的评价体系与方法[10]。③去泛素化酶通过硫醇基团进行泛素分子的转移, 大多数高通量筛选去泛素化抑制剂的环境中需添加高浓度还原剂, 因此可能产生假阳性或非选择性结果[70]。
3.2 去泛素化酶抑制剂在肿瘤治疗中的作用基于去泛素化酶的小分子抑制剂已被广泛用于抗肿瘤实验治疗, 其中绝大多数的去泛素化酶抑制剂仍处于临床前研究阶段[19] (表 3)[71-91]。2015年, USP14/UCHL5双抑制剂VLX1570成为第一个进行临床研究的去泛素化酶抑制剂, 但在临床试验阶段因剂量限制毒性被终止[71]。目前, 仍未有其他去泛素化酶抑制剂被批准进入临床研究。与此同时也发现, 限于目前的研究水平, 已发现的与肿瘤治疗相关的去泛素化酶抑制剂主要集中在USP家族中, 非USP家族成员抑制剂与恶性肿瘤治疗之间的关系有待进一步研究。
| Table 3 Representative deubiquitinase inhibitors in tumor therapy |
P22077可以选择性抑制USP7、USP10及USP47, 能有效地诱导具有完整USP7-MDM2-p53轴的神经母细胞瘤细胞凋亡, 在体内原位神经母细胞瘤细胞小鼠模型中, P22077对异种移植物生长有明显的抑制作用[74]; P22077还可以导致T细胞急性淋巴细胞白血病细胞的生长抑制和凋亡[75], 抑制黑色素瘤细胞的转移[76]。
B-AP15选择性地抑制USP 4和UCHL5的去泛素化活性, 而不抑制蛋白酶体的活性, 可抑制鳞状细胞癌、肺癌、乳腺癌和结直肠癌体内实体瘤模型中肿瘤的生长, 并抑制急性髓系白血病模型中肿瘤细胞的器官浸润[77]; B-AP15还被发现可以降低多发性骨髓瘤细胞株和多发性骨髓瘤患者细胞的存活率, 抑制细胞的增殖, 并克服了硼替佐米的耐药性。在不同的人多发性骨髓瘤异种移植模型的体内研究表明, B-AP15具有良好的耐受性, 可以抑制肿瘤生长并延长小鼠存活时间[78]; B-AP15对雄激素受体依赖性和非依赖性前列腺癌细胞均具有增殖抑制活性与细胞毒性的作用, 对雄激素依赖性前列腺癌细胞雄激素受体的表达有抑制作用[79]; B-AP15通过激活内质网应激, 抑制Wnt/Notch1信号通路, 导致肝癌细胞存活率下降[80]。
P5091作为USP7和USP47的选择性双重抑制剂, 可以诱导抵抗常规治疗和硼替佐米治疗的多发性骨髓瘤细胞凋亡, 在多发性骨髓瘤细胞株、患者肿瘤细胞、多发性骨髓瘤异种移植动物模型以及生化和遗传模型中均显示出良好的抗肿瘤活性[59]; P5091在体外可以抑制大肠癌细胞的增殖并诱导其凋亡, 在HCT116异种移植小鼠模型中也抑制了肿瘤的生长[89]; P5091对野生型和突变型p53的卵巢癌细胞具有增殖抑制作用并诱导细胞坏死和凋亡, 且对野生型p53的作用效果更强[90]。
去泛素化酶抑制剂在多种恶性肿瘤模型中所表现出的抗肿瘤活性, 提示其作为抗肿瘤药物具有巨大潜力, 在未来可能需要进一步的临床前研究和临床试验。
3.3 去泛素化酶抑制剂的研究方法与策略目前, 研究者们已开发多种分析方法来筛选和验证有效且具有选择性的去泛素化酶小分子抑制剂。泛素-7-氨基-4-甲基香豆素(ubiquitin C-terminal 7-amino-4-methylcoumarin, Ub-AMC) 被广泛用于去泛素化酶抑制剂的高通量筛选, 其缺点在于易受到化合物自身荧光的干扰[92], 且AMC和其他标记物(如罗丹明和四甲基罗丹明) 与天然的去泛素化酶底物不同, 它们的处理需在非生理条件下进行, 这与细胞内的天然去泛素化酶底物不同, 因此减少了抑制剂在细胞或治疗环境中的评价适用性。为此, 研究人员开发出了新型的去泛素化酶活性分析底物: 基于活性的探针(activity based probes, ABPs), 如泛素-乙烯基甲基砜(Ub-VS)、泛素-乙烯基甲酯(Ub-VME) 和泛素-丙炔酸(Ub-PA), 通过不可逆共价标记去泛素化酶的亲核半胱氨酸, 可以在SDS-PAGE上显示出分子量变化。小分子抑制剂可以直接添加到裂解液中, 或在裂解前处理细胞, 然后使用Western blot等进行检测, 从而能够在一种生理相关性更强的背景下评估小分子抑制剂的活性[19]。
等温滴定量热法(isothermal titration calorimetry, ITC)、表面等离子体共振法(surface plasmon resonance, SPR)、差异扫描荧光法(differential scanning fluorimetry, DSF) 和氢氘交换质谱法(hydrogen-deuterium exchange mass spectrometry, HDX-MS) 可用于确认抑制剂与去泛素化酶的靶标结合[66]。基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption/ionization time-of-flight, MALDI-TOF) 可以评估去泛素化酶在未经修饰的双泛素(diubiquitin, di-Ub) 裂解分析中的活性, 允许在多种分析格式中进行一致的选择性分析[93]。
以往大量工作的重心放在从功能上发现抑制去泛素化酶的小分子, 获得了许多与去泛素化酶活性位点半胱氨酸形成共价键的化合物, 但这些化合物的选择性往往很差[18]。最近报道的去泛素化酶选择性抑制剂都是通过变构调节发挥作用的, 可分为两类: ①以XL188和GNE-6640为代表的变构抑制剂; ②以FT671和IU1为代表的空间阻滞抑制剂[94]。有研究表明, 去泛素化酶的半胱氨酸肽酶催化三联结构通常不处于“功能性”结构状态, 需要进行变构调节才能使其完全发挥功能和行使去泛素化过程。变构调节可以由底物介导、分子内重组触发或由关键的辅助因素(如USP1) 诱发[10]。这提示研究者需要更加清晰地了解去泛素化酶的蛋白结构, 发现新的变构位点, 开发特异性更强的小分子抑制剂。
Varca等[69]开发了快速识别和验证相关酶的选择性抑制剂的途径。第一步为初级分析, 所有小分子化合物在给定浓度下在Ub-Rho体系中对所有去泛素化酶进行测试。随后对选定的小分子化合物进行剂量响应及选择性测试, 选出最合适的化合物。这些被选中的化合物进行再合成和生化测定确定活性。最后通过基于竞争活性的蛋白质分析(activity-based protein profiling, ABPP) 和定量质谱(quantitative mass spectrometry, QMS) 评估目标在细胞环境中与天然酶的结合和选择性。
4 结语与展望大量的研究报道, 去泛素化酶通过调节蛋白质相互作用、定位和酶活性, 从而影响细胞过程, 包括转录、DNA损伤信号和DNA修复、细胞周期进展、氧化应激、凋亡等, 发挥极其重要的生理功能。其与肿瘤发生发展关系之密切, 已成为肿瘤治疗领域的新热点, 其相关抑制剂也被发现在多种人类肿瘤中发挥出显著的抗肿瘤作用, 在肿瘤治疗临床前研究中表现出不俗的治疗效果。
去泛素化酶作为抗肿瘤药物新靶点, 具有诸多独特的优势。①去泛素化酶广泛地参与了各种生理和病理过程。去泛素化酶通过下游底物的泛素化作用, 拮抗E3泛素连接酶的生物学效应, 发挥抑癌或抑瘤作用。同时, 作为蛋白酶, 去泛素化酶的表达水平和酶活性也可以通过转录、转录后和翻译后修饰等多种调控机制来参与肿瘤的发展。因此, 去泛素化酶在肿瘤信号网络中起着重要的作用, 对疾病的发展起着重要的作用[10]。②去泛素化酶可以调节传统靶向治疗不敏感或不受直接抑制的蛋白质水平, 其中可能包括“不可成药”的靶点。这些潜在靶点的例子包括转录因子、耐药酶和蛋白质相互作用中相对“无特征”而难以用小分子干预的蛋白质[19]。③去泛素化酶大部分家族成员的催化结构域明确, 易于用化合物干预, 每个去泛素化酶都包含一个泛素切割结构域, 该结构域在不同的去泛素化酶亚家族中甚至在去泛素化酶亚家族内部都不同, 并赋予某些去泛素化酶中泛素连接的特异性[95]。因此, 开发强效、选择性的小分子去泛素化酶抑制剂很有可能为肿瘤治疗提供具有前景的新策略, 具有重大的科学意义和应用价值。
但同时, 对于去泛素化酶在肿瘤发生发展的调控机制研究还有待进一步深入, 绝大多数相关研究集中在USP家族成员尤其是USP7, 并且对于同一去泛素化酶家族成员, 它们调控肿瘤进展的机制有很多共同的地方[96], 能否更细致地区分这些去泛素化酶作用底物及机制的不同将成为研发特异性小分子抑制剂的关键。目前, 人们对于去泛素化酶蛋白结构及功能底物的了解不充分、不均衡, 对于去泛素化酶与肿瘤发生相关的内在机制仍缺少探索认知。这也导致了目前大多数去泛素化酶的小分子抑制剂存在特异性差等缺陷。此外, 原有的抑制剂筛选方法与技术也存在与实际生理环境相容性差、易出现假阳性[10]等缺陷, 这些都亟须进一步的研究工作来解决。
最近, 基于去泛素化酶的肿瘤干预策略研究受到越来越多的关注, 在去泛素化酶生化分析和候选先导物筛选技术方面也有了重大的改进, 越来越多的小分子去泛素化酶抑制剂被发现, 且在选择性方面有所提升。将小分子抑制剂改造为特异性探针, 去探究去泛素化酶下游调控机制, 为类药分子的临床评估提供了基础, 也为进一步研究相关调控过程、生化机制以及在疾病模型中的药效评估提供了多种工具[10]。有理由相信, 去泛素化酶及其抑制剂在肿瘤治疗等领域具有光明的前景, 未来一定会出现更多令人激动的成果, 推动其最终成为临床上可靠的肿瘤治疗靶点。
作者贡献: 刘湘宁、杜佳泯负责执笔、作图; 钱美佳、董晓武负责调研文献、整理抑制剂相关资料; 朱虹、何俏军指导和修改; 杨波负责审校。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Suresh B, Lee J, Kim KS, et al. The importance of ubiquitination and deubiquitination in cellular reprogramming[J]. Stem Cells Int, 2016, 2016: 6705927. |
| [2] |
Pfoh R, Lacdao IK, Saridakis V. Deubiquitinases and the new therapeutic opportunities offered to cancer[J]. Endocr Relat Cancer, 2015, 22: T35-T54. DOI:10.1530/ERC-14-0516 |
| [3] |
Skaar JR, Pagan JK, Pagano M. SCF ubiquitin ligase-targeted therapies[J]. Nat Rev Drug Discov, 2014, 13: 889-903. DOI:10.1038/nrd4432 |
| [4] |
Ikeda F, Dikic I. Atypical ubiquitin chains: new molecular signals. 'Protein modifications: beyond the usual suspects' review series[J]. EMBO Rep, 2008, 9: 536-542. DOI:10.1038/embor.2008.93 |
| [5] |
Grice GL, Nathan JA. The recognition of ubiquitinated proteins by the proteasome[J]. Cell Mol Life Sci, 2016, 73: 3497-3506. DOI:10.1007/s00018-016-2255-5 |
| [6] |
Olzmann JA, Li L, Chudaev MV, et al. Parkin-mediated K63-linked polyubiquitination targets misfolded DJ-1 to aggresomes via binding to HDAC6[J]. J Cell Biol, 2007, 178: 1025-1038. DOI:10.1083/jcb.200611128 |
| [7] |
Heidelberger JB, Voigt A, Borisova ME, et al. Proteomic profiling of VCP substrates links VCP to K6-linked ubiquitylation and c-Myc function[J]. EMBO Rep, 2018, 19: e44754. |
| [8] |
Sun Z, Lu H, Xiao W, et al. Progress in K27 ubiquitin modification[J]. Chin J Biotechnol (生物工程学报), 2020, 36: 1484-1492. |
| [9] |
McKeon JE, Sha D, Li L, et al. Parkin-mediated K63-polyubiquiti-nation targets ubiquitin C-terminal hydrolase L1 for degradation by the autophagy-lysosome system[J]. Cell Mol Life Sci, 2015, 72: 1811-1824. DOI:10.1007/s00018-014-1781-2 |
| [10] |
Harrigan JA, Jacq X, Martin NM, et al. Deubiquitylating enzymes and drug discovery: emerging opportunities[J]. Nat Rev Drug Discov, 2018, 17: 57-78. DOI:10.1038/nrd.2017.152 |
| [11] |
Buckley DL, Crews CM. Small-molecule control of intracellular protein levels through modulation of the ubiquitin proteasome system[J]. Angew Chem Int Ed Engl, 2014, 53: 2312-2330. DOI:10.1002/anie.201307761 |
| [12] |
Okazuka K, Ishida T. Proteasome inhibitors for multiple myeloma[J]. Jpn J Clin Oncol, 2018, 48: 785-793. DOI:10.1093/jjco/hyy108 |
| [13] |
Cho H, Yoon DH, Lee JB, et al. Comprehensive evaluation of the revised international staging system in multiple myeloma patients treated with novel agents as a primary therapy[J]. Am J Hematol, 2017, 92: 1280-1286. DOI:10.1002/ajh.24891 |
| [14] |
Fricker LD. Proteasome inhibitor drugs[J]. Annu Rev Pharmacol Toxicol, 2020, 60: 457-476. DOI:10.1146/annurev-pharmtox-010919-023603 |
| [15] |
Fan WJ, Fan ZQ, Yang MJ, et al. Molecular mechanism of CRBN in the activity of lenalidomid eagainst myeloma—review[J]. J Exp Hematol (中国实验血液学杂志), 2018, 26: 1240-1243. |
| [16] |
Sievers QL, Gasser JA, Cowley GS, et al. Genome-wide screen identifies cullin-RING ligase machinery required for lenalidomide-dependent CRL4CRBN activity[J]. Blood, 2018, 132: 1293-1303. |
| [17] |
Wei RB, Liu XD, Yu WX, et al. Deubiquitinases in cancer[J]. Oncotarget, 2015, 6: 12872-12889. DOI:10.18632/oncotarget.3671 |
| [18] |
D'arcy P, Wang X, Linder S. Deubiquitinase inhibition as a cancer therapeutic strategy[J]. Pharmacol Ther, 2015, 147: 32-54. DOI:10.1016/j.pharmthera.2014.11.002 |
| [19] |
Schauer NJ, Magin RS, Liu X, et al. Advances in discovering deubiquitinating enzyme (DUB) inhibitors[J]. J Med Chem, 2020, 63: 2731-2750. DOI:10.1021/acs.jmedchem.9b01138 |
| [20] |
Pozhidaeva A, Bezsonova I. USP7: structure, substrate specificity, and inhibition[J]. DNA Repair (Amst), 2019, 76: 30-39. DOI:10.1016/j.dnarep.2019.02.005 |
| [21] |
Ma M, Yu N. Ubiquitin-specific protease 7 expression is a prognostic factor in epithelial ovarian cancer and correlates with lymph node metastasis[J]. Onco Targets Ther, 2016, 9: 1559-1569. |
| [22] |
Zhao GY, Lin ZW, Lu CL, et al. USP7 overexpression predicts a poor prognosis in lung squamous cell carcinoma and large cell carcinoma[J]. Tumour Biol, 2015, 36: 1721-1729. DOI:10.1007/s13277-014-2773-4 |
| [23] |
Kruiswijk F, Labuschagne CF, Vousden KH. p53 in survival, death and metabolic health: a lifeguard with a licence to kill[J]. Nat Rev Mol Cell Biol, 2015, 16: 393-405. DOI:10.1038/nrm4007 |
| [24] |
Hu M, Gu L, Li M, et al. Structural basis of competitive recognition of p53 and MDM2 by HAUSP/USP7: implications for the regulation of the p53-MDM2 pathway[J]. PLoS Biol, 2006, 4: e27. DOI:10.1371/journal.pbio.0040027 |
| [25] |
Brooks CL, Li M, Hu M, et al. The p53-Mdm2-HAUSP complex is involved in p53 stabilization by HAUSP[J]. Oncogene, 2007, 26: 7262-7266. DOI:10.1038/sj.onc.1210531 |
| [26] |
Qi SM, Cheng G, Cheng XD, et al. Targeting USP7-mediated deubiquitination of MDM2/MDMX-p53 pathway for cancer therapy: are we there yet?[J]. Front Cell Dev Biol, 2020, 8: 233. DOI:10.3389/fcell.2020.00233 |
| [27] |
Song MS, Salmena L, Carracedo A, et al. The deubiquitinylation and localization of PTEN are regulated by a HAUSP-PML network[J]. Nature, 2008, 455: 813-817. DOI:10.1038/nature07290 |
| [28] |
van der Horst A, de Vries-Smits AM, Brenkman AB, et al. FOXO4 transcriptional activity is regulated by monoubiquitination and USP7/HAUSP[J]. Nat Cell Biol, 2006, 8: 1064-1073. DOI:10.1038/ncb1469 |
| [29] |
van Loosdregt J, Fleskens V, Fu J, et al. Stabilization of the transcription factor Foxp3 by the deubiquitinase USP7 increases Treg-cell-suppressive capacity[J]. Immunity, 2013, 39: 259-271. DOI:10.1016/j.immuni.2013.05.018 |
| [30] |
Zhou J, Wang J, Chen C, et al. USP7: target validation and drug discovery for cancer therapy[J]. Med Chem, 2018, 14: 3-18. |
| [31] |
Cheng J, Guo J, North BJ, et al. Functional analysis of deubiquitylating enzymes in tumorigenesis and development[J]. Biochim Biophys Acta Rev Cancer, 2019, 1872: 188312. |
| [32] |
Mizuno E, Iura T, Mukai A, et al. Regulation of epidermal growth factor receptor down-regulation by UBPY-mediated deubiquitination at endosomes[J]. Mol Biol Cell, 2005, 16: 5163-5174. DOI:10.1091/mbc.e05-06-0560 |
| [33] |
Eichhorn PJ, Rodón L, Gonzàlez-Juncà A, et al. USP15 stabilizes TGF-β receptor I and promotes oncogenesis through the activation of TGF-β signaling in glioblastoma[J]. Nat Med, 2012, 18: 429-435. DOI:10.1038/nm.2619 |
| [34] |
Liu H, Li X, Ning G, et al. The Machado-Joseph disease deubi-quitinase ataxin-3 regulates the stability and apoptotic function of p53[J]. PLoS Biol, 2016, 14: e2000733. DOI:10.1371/journal.pbio.2000733 |
| [35] |
Luo J, Lu Z, Lu X, et al. OTUD5 regulates p53 stability by deubiquitinating p53[J]. PLoS One, 2013, 8: e77682. DOI:10.1371/journal.pone.0077682 |
| [36] |
Zhang MH, Zhang HH, Du XH, et al. UCHL3 promotes ovarian cancer progression by stabilizing TRAF2 to activate the NF-κB pathway[J]. Oncogene, 2020, 39: 322-333. DOI:10.1038/s41388-019-0987-z |
| [37] |
Qin J, Zhou Z, Chen W, et al. BAP1 promotes breast cancer cell proliferation and metastasis by deubiquitinating KLF5[J]. Nat Commun, 2015, 6: 8471. DOI:10.1038/ncomms9471 |
| [38] |
Ciccia A, Elledge SJ. The DNA damage response: making it safe to play with knives[J]. Mol Cell, 2010, 40: 179-204. DOI:10.1016/j.molcel.2010.09.019 |
| [39] |
Jackson SP, Bartek J. The DNA-damage response in human biology and disease[J]. Nature, 2009, 461: 1071-1078. DOI:10.1038/nature08467 |
| [40] |
Jackson SP, Durocher D. Regulation of DNA damage responses by ubiquitin and SUMO[J]. Mol Cell, 2013, 49: 795-807. DOI:10.1016/j.molcel.2013.01.017 |
| [41] |
Jacq X, Kemp M, Martin NM, et al. Deubiquitylating enzymes and DNA damage response pathways[J]. Cell Biochem Biophys, 2013, 67: 25-43. DOI:10.1007/s12013-013-9635-3 |
| [42] |
Li Y, Yuan J. Role of deubiquitinating enzymes in DNA double-strand break repair[J]. J Zhejiang Univ Sci B (浙江大学学报), 2021, 22: 63-72. DOI:10.1631/jzus.B2000309 |
| [43] |
Castella M, Jacquemont C, Thompson EL, et al. FANCI regulates recruitment of the FA core complex at sites of DNA damage independently of FANCD2[J]. PLoS Genet, 2015, 11: e1005563. DOI:10.1371/journal.pgen.1005563 |
| [44] |
Orthwein A, Noordermeer SM, Wilson MD, et al. A mechanism for the suppression of homologous recombination in G1 cells[J]. Nature, 2015, 528: 422-426. DOI:10.1038/nature16142 |
| [45] |
McGarry E, Gaboriau D, Rainey MD, et al. The deubiquitinase USP9X maintains DNA replication fork stability and DNA damage checkpoint responses by regulating CLASPIN during S-phase[J]. Cancer Res, 2016, 76: 2384-2393. DOI:10.1158/0008-5472.CAN-15-2890 |
| [46] |
Richardson PG. A review of the proteasome inhibitor bortezomib in multiple myeloma[J]. Expert Opin Pharmacother, 2004, 5: 1321-1331. DOI:10.1517/14656566.5.6.1321 |
| [47] |
Wang B, Ma A, Zhang L, et al. POH1 deubiquitylates and stabilizes E2F1 to promote tumour formation[J]. Nat Commun, 2015, 6: 8704. DOI:10.1038/ncomms9704 |
| [48] |
Song Y, Li S, Ray A, et al. Deubiquitylating enzyme Rpn11/POH1/PSMD14 as therapeutic target in multiple myeloma[J]. Blood, 2016, 128: 4469. DOI:10.1182/blood.V128.22.4469.4469 |
| [49] |
Liu H, Buus R, Clague MJ, et al. Regulation of ErbB2 receptor status by the proteasomal DUB POH1[J]. PLoS One, 2009, 4: e5544. DOI:10.1371/journal.pone.0005544 |
| [50] |
Eletr ZM, Wilkinson KD. Regulation of proteolysis by human deubiquitinating enzymes[J]. Biochim Biophys Acta, 2014, 1843: 114-128. DOI:10.1016/j.bbamcr.2013.06.027 |
| [51] |
Wu N, Liu C, Bai C, et al. Over-expression of deubiquitinating enzyme USP14 in lung adenocarcinoma promotes proliferation through the accumulation of β-catenin[J]. Int J Mol Sci, 2013, 14: 10749-10760. DOI:10.3390/ijms140610749 |
| [52] |
Yao T, Song L, Xu W, et al. Proteasome recruitment and activation of the Uch37 deubiquitinating enzyme by Adrm1[J]. Nat Cell Biol, 2006, 8: 994-1002. DOI:10.1038/ncb1460 |
| [53] |
Lam YA, Xu W, DeMartino GN, et al. Editing of ubiquitin conjugates by an isopeptidase in the 26S proteasome[J]. Nature, 1997, 385: 737-740. DOI:10.1038/385737a0 |
| [54] |
Wang L, Chen YJ, Xu K, et al. High expression of UCH37 is significantly associated with poor prognosis in human epithelial ovarian cancer[J]. Tumour Biol, 2014, 35: 11427-11433. DOI:10.1007/s13277-014-2446-3 |
| [55] |
Fang Y, Fu D, Tang W, et al. Ubiquitin C-terminal hydrolase 37, a novel predictor for hepatocellular carcinoma recurrence, promotes cell migration and invasion via interacting and deubiquitinating PRP19[J]. Biochim Biophys Acta, 2013, 1833: 559-572. DOI:10.1016/j.bbamcr.2012.11.020 |
| [56] |
Chio IIC, Tuveson DA. ROS in cancer: the burning question[J]. Trends Mol Med, 2017, 23: 411-429. DOI:10.1016/j.molmed.2017.03.004 |
| [57] |
Harris IS, Endress JE, Coloff JL, et al. Deubiquitinases maintain protein homeostasis and survival of cancer cells upon glutathione depletion[J]. Cell Metab, 2019, 29: 1166-1181. DOI:10.1016/j.cmet.2019.01.020 |
| [58] |
Gill JG, Piskounova E, Morrison SJ. Cancer, oxidative stress, and metastasis[J]. Cold Spring Harb Symp Quant Biol, 2016, 81: 163-175. DOI:10.1101/sqb.2016.81.030791 |
| [59] |
Chauhan D, Tian Z, Nicholson B, et al. A small molecule inhibitor of ubiquitin-specific protease-7 induces apoptosis in multiple myeloma cells and overcomes bortezomib resistance[J]. Cancer Cell, 2012, 22: 345-358. DOI:10.1016/j.ccr.2012.08.007 |
| [60] |
Pozhidaeva A, Valles G, Wang F, et al. USP7-specific inhibitors target and modify the enzyme's active site via distinct chemical mechanisms[J]. Cell Chem Biol, 2017, 24: 1501-1512. DOI:10.1016/j.chembiol.2017.09.004 |
| [61] |
Reverdy C, Conrath S, Lopez R, et al. Discovery of specific inhibitors of human USP7/HAUSP deubiquitinating enzyme[J]. Chem Biol, 2012, 19: 467-477. DOI:10.1016/j.chembiol.2012.02.007 |
| [62] |
Colland F, Formstecher E, Jacq X, et al. Small-molecule inhibitor of USP7/HAUSP ubiquitin protease stabilizes and activates p53 in cells[J]. Mol Cancer Ther, 2009, 8: 2286-2295. DOI:10.1158/1535-7163.MCT-09-0097 |
| [63] |
Turnbull AP, Ioannidis S, Krajewski WW, et al. Molecular basis of USP7 inhibition by selective small-molecule inhibitors[J]. Nature, 2017, 550: 481-486. DOI:10.1038/nature24451 |
| [64] |
Wang F, Wang L, Wu J, et al. Active site-targeted covalent irreversible inhibitors of USP7 impair the functions of Foxp3+ T-regulatory cells by promoting ubiquitination of Tip60[J]. PLoS One, 2017, 12: e0189744. DOI:10.1371/journal.pone.0189744 |
| [65] |
Chen C, Song J, Wang J, et al. Synthesis and biological evaluation of thiazole derivatives as novel USP7 inhibitors[J]. Bioorg Med Chem Lett, 2017, 27: 845-849. DOI:10.1016/j.bmcl.2017.01.018 |
| [66] |
Lamberto I, Liu X, Seo HS, et al. Structure-guided development of a potent and selective non-covalent active-site inhibitor of USP7[J]. Cell Chem Biol, 2017, 24: 1490-1500. DOI:10.1016/j.chembiol.2017.09.003 |
| [67] |
Kategaya L, Di Lello P, Rougé L, et al. USP7 small-molecule inhibitors interfere with ubiquitin binding[J]. Nature, 2017, 550: 534-538. DOI:10.1038/nature24006 |
| [68] |
Zhang X, Gu L, Li J, et al. Degradation of MDM2 by the interaction between berberine and DAXX leads to potent apoptosis in MDM2-overexpressing cancer cells[J]. Cancer Res, 2010, 70: 9895-9904. DOI:10.1158/0008-5472.CAN-10-1546 |
| [69] |
Varca AC, Casalena D, Chan WC, et al. Identification and validation of selective deubiquitinase inhibitors[J]. Cell Chem Biol, 2021, 28: 1758-1771.e13. DOI:10.1016/j.chembiol.2021.05.012 |
| [70] |
Wrigley JD, Eckersley K, Hardern IM, et al. Enzymatic characterisation of USP7 deubiquitinating activity and inhibition[J]. Cell Biochem Biophys, 2011, 60: 99-111. DOI:10.1007/s12013-011-9186-4 |
| [71] |
Wang X, Mazurkiewicz M, Hillert EK, et al. The proteasome deubiquitinase inhibitor VLX1570 shows selectivity for ubiquitin-specific protease-14 and induces apoptosis of multiple myeloma cells[J]. Sci Rep, 2016, 6: 30667. DOI:10.1038/srep30667 |
| [72] |
Paulus A, Akhtar S, Caulfield TR, et al. Coinhibition of the deubiquitinating enzymes, USP14 and UCHL5, with VLX1570 is lethal to ibrutinib- or bortezomib-resistant Waldenstrom macro-globulinemia tumor cells[J]. Blood Cancer J, 2016, 6: e492. DOI:10.1038/bcj.2016.93 |
| [73] |
Shukla N, Somwar R, Smith RS, et al. Proteasome addiction defined in Ewing sarcoma is effectively targeted by a novel class of 19S proteasome inhibitors[J]. Cancer Res, 2016, 76: 4525-4534. DOI:10.1158/0008-5472.CAN-16-1040 |
| [74] |
Fan YH, Cheng J, Vasudevan SA, et al. USP7 inhibitor P22077 inhibits neuroblastoma growth via inducing p53-mediated apoptosis[J]. Cell Death Dis, 2013, 4: e867. DOI:10.1038/cddis.2013.400 |
| [75] |
Shan H, Li X, Xiao X, et al. USP7 deubiquitinates and stabilizes OTCH1 in T-cell acute lymphoblastic leukemia[J]. Signal Transduct Target Ther, 2018, 3: 29. DOI:10.1038/s41392-018-0028-3 |
| [76] |
Vishnoi M, Boral D, Liu H, et al. Targeting USP7 identifies a meta-stasis-competent state within bone marrow-resident melanoma CTCs[J]. Cancer Res, 2018, 78: 5349-5362. DOI:10.1158/0008-5472.CAN-18-0644 |
| [77] |
D'Arcy P, Brnjic S, Olofsson MH, et al. Inhibition of proteasome deubiquitinating activity as a new cancer therapy[J]. Nat Med, 2011, 17: 1636-1640. DOI:10.1038/nm.2536 |
| [78] |
Tian Z, D'Arcy P, Wang X, et al. A novel small molecule inhibitor of deubiquitylating enzyme USP14 and UCHL5 induces apoptosis in multiple myeloma and overcomes bortezomib resistance[J]. Blood, 2014, 123: 706-716. DOI:10.1182/blood-2013-05-500033 |
| [79] |
Cai J, Xia X, Liao Y, et al. A novel deubiquitinase inhibitor b-AP15 triggers apoptosis in both androgen receptor-dependent and -independent prostate cancers[J]. Oncotarget, 2017, 8: 63232-63246. DOI:10.18632/oncotarget.18774 |
| [80] |
Ding Y, Chen X, Wang B, et al. Deubiquitinase inhibitor b-AP15 activates endoplasmic reticulum (ER) stress and inhibits Wnt/Notch1 signaling pathway leading to the reduction of cell survival in hepatocellular carcinoma cells[J]. Eur J Pharmacol, 2018, 825: 10-18. DOI:10.1016/j.ejphar.2018.02.020 |
| [81] |
Kapuria V, Peterson LF, Fang D, et al. Deubiquitinase inhibition by small-molecule WP1130 triggers aggresome formation and tumor cell apoptosis[J]. Cancer Res, 2010, 70: 9265-9276. DOI:10.1158/0008-5472.CAN-10-1530 |
| [82] |
Peterson LF, Sun H, Liu Y, et al. Targeting deubiquitinase activity with a novel small-molecule inhibitor as therapy for B-cell malignancies[J]. Blood, 2015, 125: 3588-3597. DOI:10.1182/blood-2014-10-605584 |
| [83] |
Fu P, Du F, Liu Y, et al. WP1130 increases cisplatin sensitivity through inhibition of USP9X in estrogen receptor-negative breast cancer cells[J]. Am J Transl Res, 2017, 9: 1783-1791. |
| [84] |
Liu H, Chen W, Liang C, et al. WP1130 increases doxorubicin sensitivity in hepatocellular carcinoma cells through USP9X-dependent p53 degradation[J]. Cancer Lett, 2015, 361: 218-225. DOI:10.1016/j.canlet.2015.03.001 |
| [85] |
Sun H, Kapuria V, Peterson LF, et al. Bcr-Abl ubiquitination and USP9X inhibition block kinase signaling and promote CML cell apoptosis[J]. Blood, 2011, 117: 3151-3162. DOI:10.1182/blood-2010-03-276477 |
| [86] |
Kushwaha D, O'Leary C, Cron KR, et al. USP9X inhibition promotes radiation-induced apoptosis in non-small cell lung cancer cells expressing mid-to-high MCL1[J]. Cancer Biol Ther, 2015, 16: 392-401. DOI:10.1080/15384047.2014.1002358 |
| [87] |
Wang S, Kollipara RK, Srivastava N, et al. Ablation of the oncogenic transcription factor ERG by deubiquitinase inhibition in prostate cancer[J]. Proc Natl Acad Sci U S A, 2014, 111: 4251-4256. DOI:10.1073/pnas.1322198111 |
| [88] |
Chen J, Dexheimer TS, Ai Y, et al. Selective and cell-active inhibitors of the USP1/UAF1 deubiquitinase complex reverse cisplatin resistance in non-small cell lung cancer cells[J]. Chem Biol, 2011, 18: 1390-1400. DOI:10.1016/j.chembiol.2011.08.014 |
| [89] |
An T, Gong Y, Li X, et al. USP7 inhibitor P5091 inhibits Wnt signaling and colorectal tumor growth[J]. Biochem Pharmacol, 2017, 131: 29-39. DOI:10.1016/j.bcp.2017.02.011 |
| [90] |
Wang M, Zhang Y, Wang T, et al. The USP7 inhibitor P5091 induces cell death in ovarian cancers with different p53 status[J]. Cell Physiol Biochem, 2017, 43: 1755-1766. DOI:10.1159/000484062 |
| [91] |
Morra F, Merolla F, Napolitano V, et al. The combined effect of USP7 inhibitors and PARP inhibitors in hormone-sensitive and castration-resistant prostate cancer cells[J]. Oncotarget, 2017, 8: 31815-31829. DOI:10.18632/oncotarget.16463 |
| [92] |
Dang LC, Melandri FD, Stein RL. Kinetic and mechanistic studies on the hydrolysis of ubiquitin C-terminal 7-amido-4-methylcoumarin by deubiquitinating enzymes[J]. Biochemistry, 1998, 37: 1868-1879. DOI:10.1021/bi9723360 |
| [93] |
Ritorto MS, Ewan R, Perez-Oliva AB, et al. Screening of DUB activity and specificity by MALDI-TOF mass spectrometry[J]. Nat Commun, 2014, 5: 4763. DOI:10.1038/ncomms5763 |
| [94] |
Wang Y, Jiang Y, Ding S, et al. Small molecule inhibitors reveal allosteric regulation of USP14 via steric blockade[J]. Cell Res, 2018, 28: 1186-1194. DOI:10.1038/s41422-018-0091-x |
| [95] |
Magin RS, Liu X, Felix A, et al. Small molecules as tools for functional assessment of deubiquitinating enzyme function[J]. Cell Chem Biol, 2021, 28: 1090-1100. DOI:10.1016/j.chembiol.2021.04.021 |
| [96] |
Poondla N, Chandrasekaran AP, Kim KS, et al. Deubiquitinating enzymes as cancer biomarkers: new therapeutic opportunities?[J]. BMB Rep, 2019, 52: 181-189. DOI:10.5483/BMBRep.2019.52.3.048 |
 2022, Vol. 57
2022, Vol. 57


