2. 复旦大学附属华山医院普外科, 上海 200040
2. Department of General Surgery, Huashan Hospital, Fudan University, Shanghai 200040, China
胃癌是我国主要恶性肿瘤种类之一[1], 手术是首选治疗方案。因目前胃癌早期诊断率偏低, 多数患者就诊时已处于局部进展期, 肿瘤组织浸润出黏膜外[2], 不得不采取全胃切除。但是, 全胃切除后患者生活质量低, 餐后腹部不适, 胆汁反流性食管炎和高血糖高发[3, 4]。因此, 胃癌手术发展趋势之一是术前先行化疗, 缩小肿瘤体积和浸润范围, 从而在确保病灶彻底切除的前提下留一定的胃功能, 避免全胃切除, 切实提高患者术后的生活质量及长期预后[5]。
值得注意的是, 以全身化疗行术前化疗时, 能抵达肿瘤的药量有限, 缩瘤效果并不理想, 还会干扰免疫系统及胃肠道屏障功能, 不利于术后恢复[6]。若能行局部化疗, 则有望提高病灶内药物浓度, 降低全身毒性[7, 8]。胃癌病灶的位置特点使通过内镜注射行局部化疗成为可能[9-11]。因此, 本文以紫杉醇(paclitaxel, PTX) 为模型药物, 以纳米晶作为制剂形式, 设计了一种具有高药物含量、良好稳定性和显著肿瘤细胞靶向性能的新型纳米制剂——叶酸修饰磷脂包被紫杉醇纳米晶(PTX NC@FA)。胃癌病灶内及周边可注射的体积有限, 纳米晶的高药物含量特征符合胃癌瘤旁注射对制剂药物含量的要求[12-14]。胃癌细胞多高表达叶酸受体[15], 叶酸修饰有利于提高肿瘤细胞对纳米晶的摄取。
本文以“从小到大”法制备紫杉醇纳米晶, 以超声法将类脂及叶酸修饰磷脂(FA-DSPE-PEG2000) 包被于紫杉醇纳米晶表面, 得到PTX NC@FA。研究内容包括颗粒形态、粒径分布、ζ-电位、药物含量、FA-DSPE-PEG2000含量、晶型特征、稳定性和体外释放行为, 并在细胞水平考察PTX NC@FA对人胃癌细胞SGC-7901的细胞毒性, 进一步考察PTX NC@FA在两种不同肿瘤大小(瘤体积100 mm3或300 mm3) 情况下裸鼠SGC-7901皮下肿瘤模型上单次瘤旁给药(剂量20 mg·kg-1) 的缩瘤效果。
材料与方法仪器 透射电子显微镜H-600 (日本日立公司); 透析袋(MW 3 500, 美国Viskase公司); JY92-IIDN超声波细胞粉碎机(宁波新芝公司); ZS-10-82激光粒度仪(英国马尔文公司); Agilent 1100高效液相色谱仪(HPLC, 美国安捷伦科技公司); Diamonsil®C18色谱柱(250 mm × 4.6 mm, 5 μm, 迪马科技有限公司); Power Wave XS酶标仪(美国BioTek仪器公司); 204/1/G差式量热扫描仪(differential scanning calorimetry, DSC, 德国耐驰公司); D2 Phaser X射线衍射仪(X-ray diffractometer, XRPD, 美国Bruker公司)。
药物与试剂 PTX、维生素E聚乙二醇琥珀酸酯(D-α-tocopherol polyethylene glycol 1000 succinate, TPGS)、噻唑蓝(thiazolyl blue tetrazolium bromide, MTT) (大连美仑生物技术有限公司); 紫杉醇注射液(Taxol, 美国百时美-施贵宝公司); 蛋黄卵磷脂(egg yolk phosphatidylcholine, EPC)、胆固醇(cholesterol, Chol)、N-(羰基-甲氧基聚乙二醇2000)-1, 2-二硬酯酰-sn-甘油-3-磷酰乙醇胺(MeO-PEG-DSPE2000) (上海艾伟拓医药科技有限公司); 磷脂-聚乙二醇-叶酸(FA-DSPE-PEG2000, 上海芃硕生物科技有限公司); DMEM细胞培养基、胰蛋白酶和细胞用磷酸盐缓冲液(PBS) (美国赛默飞世尔科技有限公司)。
细胞株与动物 人胃癌细胞株SGC-7901购自中国科学院上海细胞库。SPF级裸鼠(雄性, 体重20 ± 2 g) 购自上海斯莱克实验动物有限公司(生产许可证号SCXK沪2017-0005), 动物实验符合动物实验伦理学标准, 经复旦大学药学院实验动物伦理委员会批准。
纳米晶制备
“从小到大”法制备纳米晶 精密称取PTX 3.00 mg和TPGS 4.00 mg, 以适量乙醇溶解后于37 ℃水浴上减压旋蒸, 形成均匀薄膜后, 加入35 mmol·L-1 NaHCO3溶液5 mL, 于25 ℃空气摇床中振荡水化, 即得PTX纳米晶(paclitaxel nanocrystals, PTX NC)。
超声法对PTX NC进行磷脂包被 精密称取EPC 2.30 mg、Chol 1.15 mg、TPGS 1.15 mg、MeO-PEG-DSPE2000 1.12 mg和FA-DSPE-PEG2000 0.49 mg, 以适量乙醇溶解后, 减压旋蒸后挥去乙醇, 形成均匀薄膜。用上述所得PTX纳米晶混悬液水化薄膜后, 120 W探头超声15 min, 即得PTX NC@FA。无叶酸修饰的磷脂包被紫杉醇纳米晶(PTX NC@0% FA) 的制备方法类似, 但以等摩尔MeO-PEG-DSPE2000代替FA-DSPE-PEG2000。所得PTX NC@FA及PTX NC@0% FA混悬液以25 155 ×g离心30 min, 待上清完全澄清后, 取沉淀冻干, 供后续药物含量、FA-DSPE-PEG2000含量、DSC和XRPD测试之用。
颗粒形态、粒径分布及ζ-电位检测 以透射电子显微镜观察PTX NC及PTX NC@FA的形态。以激光粒度仪测定PTX NC@FA及PTX NC@0% FA的粒径分布和ζ-电位, 每个样品测3次, 求均值。
药物含量和包封率检测 分别精密称取5.00 mg PTX NC、PTX NC@FA及PTX NC@0% FA冻干品, 以乙腈溶解, 0.45 μm滤膜过滤后, 采用HPLC测定PTX含量, 色谱条件: Diamonsil®C18色谱柱(250 mm × 4.6 mm, 5 μm), 乙腈-水(70∶30, v/v), 进样量20 μL, 洗脱时间12 min, 流速0.7 mL·min-1, 柱温25 ℃, 检测波长227 nm。
按公式(1) 和(2) 计算药物含量(drug loading, DL) 和包封率(encapsulation efficiency, EE):
| $ {\rm{DL}} = \frac{{W}_{1}}{{W}_{2}} × 100\% $ | (1) |
| $ {\rm{EE}} = \frac{{W}_{1}}{{W}_{0}} × 100\% $ | (2) |
其中, W0为纳米晶中药物的投量, W1为纳米晶中紫杉醇质量, W2为纳米晶总质量。
FA-DSPE-PEG2000含量检测 分别精密称取约5.00 mg PTX NC@FA及PTX NC@0% FA冻干品, 以DMSO-异丙醇混合溶剂(1∶9, v/v) 溶解并定容至1.0 mL, 0.45 μm滤膜过滤, 采用HPLC测定FA-DSPE-PEG2000含量, 色谱条件: Diamonsil®C18色谱柱(250 mm × 4.6 mm, 5 μm), 梯度洗脱(80%~100% B, 10 min), 其中A相为甲醇-10 mmol·L-1醋酸铵(60∶40, v/v), 以醋酸调pH至6.4, B相为异丙醇-10 mmol·L-1醋酸铵(90∶10, v/v), 以醋酸调pH至6.4, 进样量20 μL, 洗脱时间10 min, 流速0.7 mL·min-1, 柱温25 ℃, 检测波长350 nm。按公式(3) 计算FA-DSPE-PEG2000含量。
| $ {\rm{FA-DSPE-PEG}}_{2000}含量 = \frac{{m}_{1}}{{m}_{2}} × 100\% $ | (3) |
其中, m1为纳米晶中FA-DSPE-PEG2000质量, m2为纳米晶总质量。
X射线粉末衍射分析(XRPD) 考察PTX原料药(PTX bulk)、PTX NC、PTX NC@FA及PTX NC@FA包被材料(1% FA bulk) 的XRPD特征, 具体参数如下: 测量范围3°~50°, 温度25 ℃, 湿度55.2% RH, 扫描速度0.02°·s-1, 管电压40 kV, 管电流100 mA。
差示扫描量热分析(DSC) 考察紫杉醇原料药(PTX bulk)、PTX NC、PTX NC@FA及PTX NC@FA包被材料(1% FA bulk) 的DSC特征。具体参数如下: 测量范围30~300 ℃, 参比物为空气, 升温速率10 ℃·min-1。
稳定性检测 按300 μg·mL-1 PTX浓度, 将PTX NC、PTX NC@0% FA和PTX NC@FA分散在10 mmol·L-1 PBS (pH 7.4) 中, 于37 ℃静置, 在0、1、2、4、8、16和96 h以DLS测量其粒径分布。
按300 μg·mL-1 PTX浓度, 将PTX NC、PTX NC@0% FA和PTX NC@FA分散在10 mmol·L-1 PBS (pH 7.4)-胎牛血清(FBS) 的混合液中(1∶1, v/v), 于37 ℃静置, 在0、1、2、4、8、16和96 h以酶标仪测定混合液在560 nm处吸光度(A) 值[16]。
体外释放实验 分别取1 mL的PTX NC@FA、PTX NC@0% FA和PTX游离药(PTX浓度均为0.6 mg·mL-1) 置于透析袋内, 浸入60 mL释放介质[含1% Tween 80 (w/v) 的PBS] 中, 在37 ℃水浴震荡, 100 r·min-1, 于0、0.5、1、2、4、6、8、12、24、48、72和96 h取出透析袋, 测定袋内残余药物的量, 从而求出释放百分率。游离药PTX组配制方法为将3.00 mg PTX用78.00 mg Tween 80溶解后, 用13%乙醇稀释至PTX浓度为0.6 mg·mL-1。
体外细胞毒性实验 以DMEM培养基培养SGC-7901细胞, 按照细胞数3 000个/孔种植在96孔细胞培养皿上, 37 ℃培养过夜后, 观察细胞形态, 确认细胞状态良好后, 将原有培养介质替换为含有PTX NC@FA、PTX NC@0% FA或Taxol的新鲜介质, 设定药物系列浓度为0.04、1.76、7.03、14.05、35.13和70.26 μmol·L-1, 孵育24 h, 吸弃培养液, 向每孔加入20 μL MTT (5 mg·mL-1), 孵育4 h, 吸弃孔内培养液, 向每孔加入DMSO 200 μL, 在空气摇床上振荡至蓝紫色结晶全部溶解, 以酶标仪测定各孔在波长490 nm处A值, 按公式(4) 计算细胞存活率(CSR)。
| $ {\rm{CSR}} = \frac{{A}_{{实}{验}{孔}}-{A}_{{空}{白}{孔}}}{{A}_{{对}{照}{孔}}-{A}_{{空}{白}{孔}}} ×100\% $ | (4) |
体内缩瘤药效评价 在裸鼠右侧腋窝皮下接种SGC-7901细胞悬液200 μL (含1.0×106个细胞)。待肿瘤生长至瘤体积约为100 mm3 (小体积) 和300 mm3 (大体积) 两种情况, 各随机设4组: 生理盐水(阴性对照) 组、Taxol组、PTX NC@0%FA组和PTX NC@FA组, 每组7只, 单次瘤旁注射给药(PTX 20 mg·kg-1), 给药体积200 μL。每隔一天用电子秤称量裸鼠体重并用电子游标卡尺测量肿瘤长(L) 和宽(W), 按公式(5) 计算瘤体积(V); 按公式(6) 计算相对瘤体积(RV); 按公式(7) 计算肿瘤体积抑瘤率(IR)。
| $ V = L×W^{2}/2 (5) $ | (5) |
| $ {\rm{RV}} = \frac{{V}_{\mathrm{当}\mathrm{天}}}{{V}_{0\mathrm{天}}} ×100\% $ | (6) |
| $ {\rm{IR}} = \frac{{V}_{\mathrm{对}\mathrm{照}\mathrm{组}}-{V}_{\mathrm{实}\mathrm{验}\mathrm{组}}}{{V}_{\mathrm{对}\mathrm{照}\mathrm{组}}} ×100\% $ | (7) |
给药后第12天时, 处死裸鼠, 完整剥离腋窝皮下肿瘤, 拍照, 用生理盐水进行心脏灌流, 取出心、肝、脾、肺、肾及瘤旁组织, 制成H&E染色切片后进行组织学观察。
统计学方法 使用GraphPad Prism软件版本8计算IC50值并进行实验组间的统计分析, P < 0.05被认为具有统计学意义。
结果 1 粒径分布、ζ-电位与微观形态PTX NC和PTX NC@FA均呈短棒状。PTX NC平均粒径为99.8 ± 3.1 nm, 多分散指数(PDI) 为0.12 ± 0.01, ζ-电位为-10.8 ± 0.9 mV; PTX NC@FA粒径略大, 平均粒径为175.3 ± 2.5 nm, PDI为0.17 ± 0.02, ζ-电位为-2.5 ± 0.2 mV。结果见图 1。
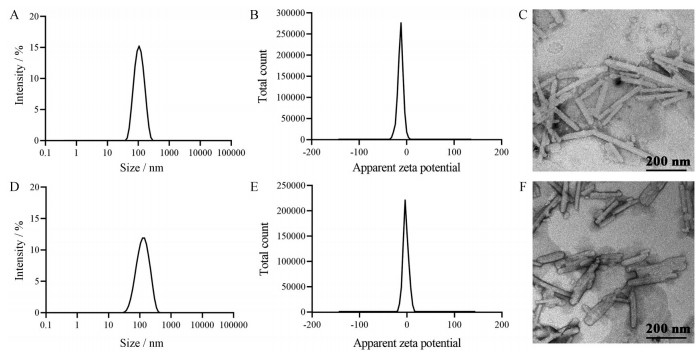
|
Figure 1 Particle size distribution, ζ-potential and microscopic morphology of paclitaxel nanocrystal (PTX NC) (A-C) and folic acid-modified phospholipid-encapsulated paclitaxel nanocrystals (PTX NC@FA) (D-F) |
在PTX定量色谱条件下, PTX NC@FA液相图谱如图 2A所示。该色谱条件下, PTX保留时间约为8 min, 而辅料EPC、TPGS和FA-DSPE-PEG2000保留时间 < 4 min (图 2B~D)。PTX NC、PTX NC@0% FA和PTX NC@FA的DL和EE见表 1所示, 体现了纳米晶药物含量高的特征。
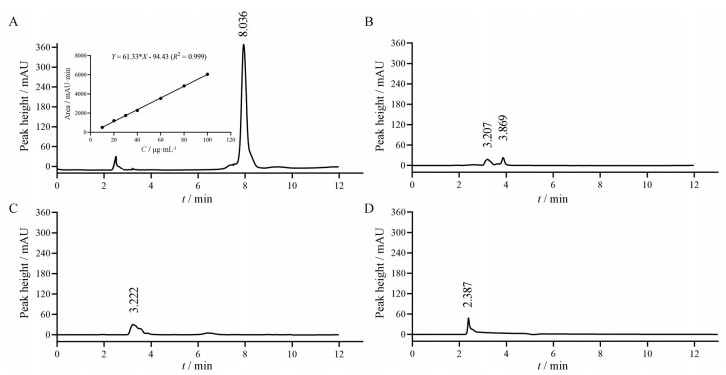
|
Figure 2 HPLC chromatograms of PTX NC@FA (insert: standard curve for PTX) (A), egg yolk phosphatidylcholine (EPC) (B), D-α-tocopherol polyethylene glycol 1000 succinate (TPGS) (C) and distearoyl phosphatidyl acetamide-polyethylene glycol 2000-folic acid (FA-DSPE-PEG2000) (D) in PTX NC@FA under the conditions for PTX |
|
Table 1 Drug loading (DL) and encapsulation efficiency (EE) of PTX NC, PTX NC@0% FA and PTX NC@FA. n = 3, |
因FA-DSPE-PEG2000、EPC和TPGS三者在206 nm处都有较强的吸收(图 3A), 为避免EPC和TPGS可能对FA-DSPE-PEG2000定量造成的干扰, 选择350 nm作为FA-DSPE-PEG2000的检测波长, 液相图谱如图 3B所示, 线性关系良好。
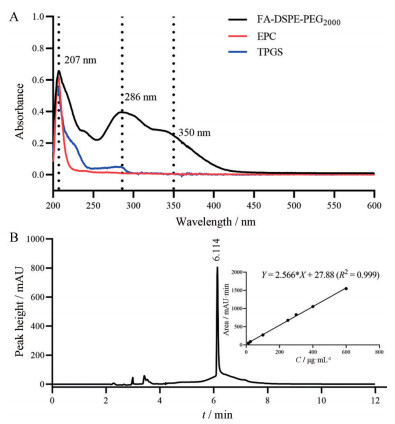
|
Figure 3 A: Ultraviolet scanning spectrum of FA-DSPE-PEG2000, EPC and TPGS. B: HPLC chromatogram of PTX NC@FA under the conditions for FA-DSPE-PEG2000 (insert: standard curve for FA-DSPE-PEG2000) |
经测定, 5.00 mg冻干品中, FA-DSPE-PEG2000质量为0.22 ± 0.03 mg, 质量占比(4.40 ± 0.60) %; PTX质量为1.37 ± 0.03 mg, FA-DSPE-PEG2000与PTX的质量比约为1∶6.2, 与投量比基本一致。
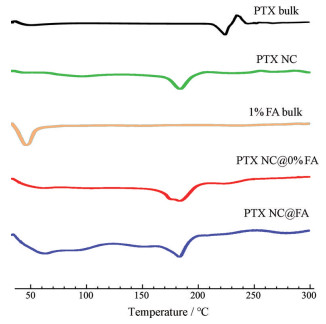
3 晶型特征由XRPD图谱(图 4) 可知, PTX NC和PTX NC@ FA的特征衍射峰(30.4°和34.4°) 显著不同于PTX原料药(5.6°、9.0°和12.5°)。在PTX NC@FA组的衍射图谱中, 除了30.4°和34.4°的衍射峰, 还存在一些与包被材料(1% FA bulk) 类似的特征衍射峰。DSC图谱(图 5) 也有类似趋势, PTX原料药在224 ℃处有放热峰, 233 ℃处有吸热峰, 而PTX NC和PTX NC@FA的图谱中没有上述特征峰, 却在185 ℃处出现了放热峰。上述结果提示, PTX NC和PTX NC@FA中PTX的晶型不同于PTX原料药, 而磷脂包被过程对PTX晶型的影响不显著。
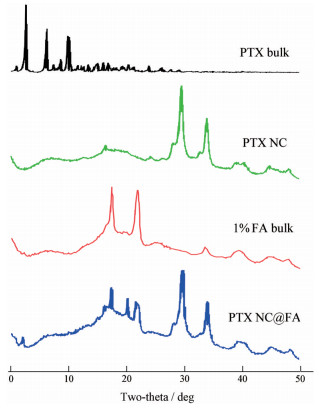
|
Figure 4 X-ray powder diffraction (XRPD) diagrams of PTX bulk, physical mixture of coating lipids of PTX NC@FA (1% FA bulk), PTX NC and PTX NC@FA |
|
Figure 5 Differential scanning calorimeter (DSC) diagrams of PTX bulk, 1% FA bulk, PTX NC, PTX NC@0% FA and PTX NC@FA |
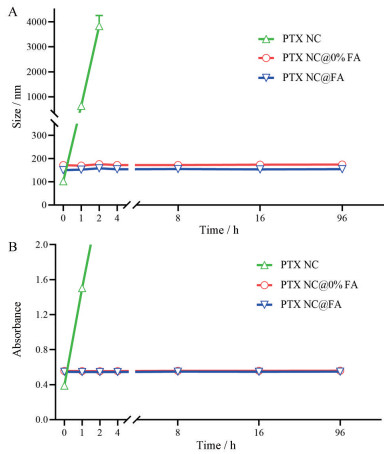
PTX NC@0% FA和PTX NC@FA在PBS中96 h内粒径基本保持不变, 在含FBS的PBS中A值亦不随时间增长; 相比之下, PTX NC不稳定, 在PBS中放置1 h后粒径已增长至近1 000 nm, 2 h后目测可见明显絮状沉淀, 在PBS/FBS中放置2 h后A值增长到1.5 (图 6)。结果表明, 磷脂包被能显著提高纳米晶的稳定性。
|
Figure 6 Stability of nanocrystal. A: Size distribution in PBS measured by DLS; B: Absorbance at 560 nm (indicating aggregation) in PBS/FBS mixture size. n = 3, |
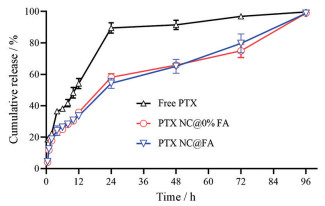
经预实验测定, PTX在含有1% Tween 80的PBS中饱和溶解度约为16 μg·mL-1, 故设定为体外释放实验条件, 使其满足漏槽条件。PTX NC@FA可在96 h内完全释放药物, 有无叶酸修饰对释放行为影响不大(图 7)。
|
Figure 7 In vitro drug release profiles of nanocrystals. n = 3, |
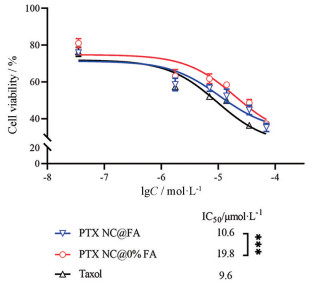
如图 8所示, PTX NC@FA的IC50值为10.6 μmol·L-1, 显著低于PTX NC@0% FA (19.8 μmol·L-1), 可见叶酸修饰能提高纳米晶对肿瘤细胞的细胞毒性。
|
Figure 8 In vitro cytotoxicity of PTX NC@FA after 24 h co-incubation. Tested cell line: Human gastric cancer cells SGC-7901. n = 3, |
小肿瘤(100 mm3) 情况下单次瘤旁给药后肿瘤体积随时间变化曲线、肿瘤体积抑制率随时间变化曲线、动物体重随时间变化曲线及第12天处死动物后取出的肿瘤照片见图 9A~D。至给药后的第12天, 生理盐水组瘤体积约为第0天时瘤体积的17倍; Taxol组瘤体积约为第0天时瘤体积的1.7倍; PTX NC@0% FA组的7只动物中有2只肿瘤完全消失, 剩余5只瘤体积约为第0天时瘤体积的1.9倍; PTX NC@FA组7只动物的肿瘤均完全消失, 抑瘤率为100%。各组裸鼠平均体重无差异, 与起始体重相比略有上升。
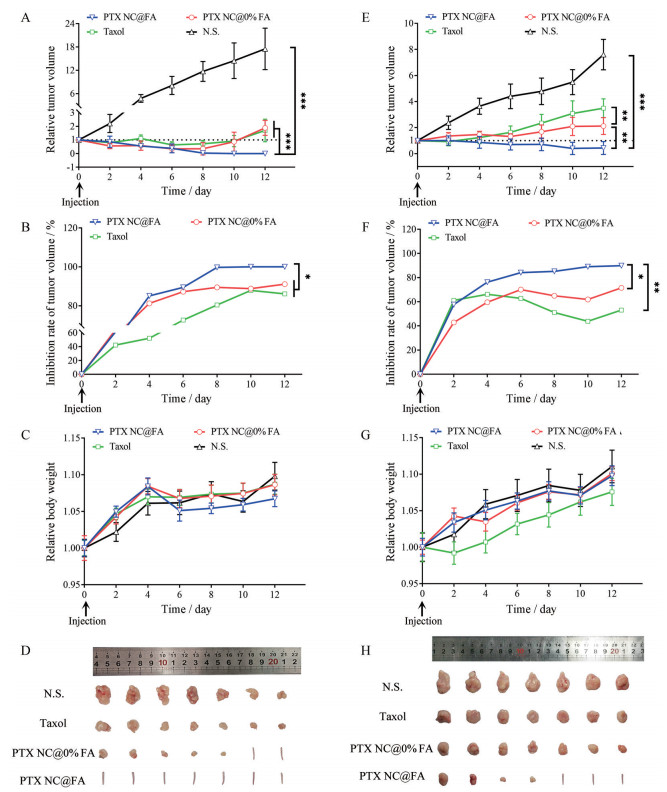
|
Figure 9 In vivo anti-tumor effects of peritumorally-injected normal saline (N.S.), Taxol, PTX NC@0% FA and PTX NC@FA in nude mice bearing subcutaneous SGC-7901 model tumors (single administration: dosage 20 mg·kg-1 on day 0). A-D: Smaller tumor condition where the tumor volume (100 mm3) on day 0; E-H: Larger tumor condition where the tumor volume (300 mm3) on day 0; A, E: Tumor size vs time curves; B, F: Inhibition rate of tumor volume vs time curves. C, G: Body weights vs time curves; D, H: Photographs of tumors on day 12 (the tail represents a nude mouse whose tumor had disappeared). n = 7, |
大肿瘤(300 mm3) 情况下单次瘤旁给药后肿瘤体积随时间变化曲线、肿瘤体积抑制率随时间变化曲线、动物体重随时间变化曲线及第12天处死动物后取出的肿瘤照片见图 9E~H。至给药后的第12天, Taxol组瘤体积约为第0天时瘤体积的3.5倍, 抑瘤率约53%; PTX NC@0% FA抑瘤率约为71%; PTX NC@FA组7只动物中, 3只肿瘤完全消失, 剩余4只瘤体积亦小于第0天时瘤体积, 抑瘤率约90%。可见, PTX NC@FA缩瘤效果显著优于Taxol组和PTX NC@0% FA。各组裸鼠平均体重无差异, 与起始体重相比略有上升。
H&E切片结果(图 10) 显示, 与生理盐水对照组相比, 各组主要脏器在组织学上无明显差异。PTX NC@ FA对注射部位组织亦无明显不良影响。
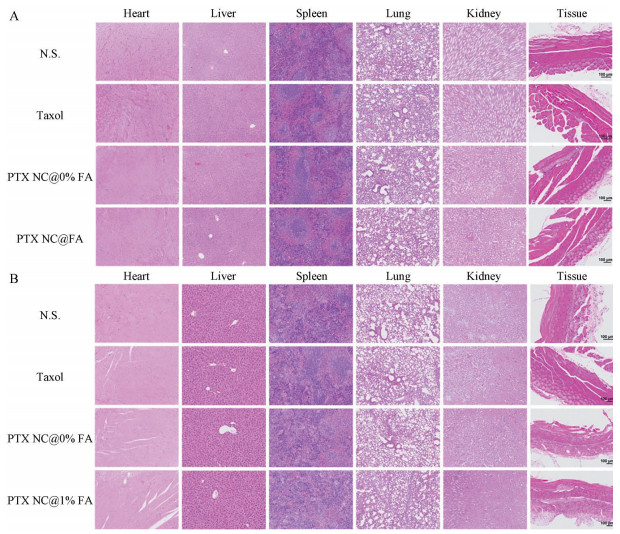
|
Figure 10 Hematoxylin-eosin (H&E) staining of main organs and tissue around the tumor of nude mice treated with N.S., Taxol, PTX NC@0% FA and PTX NC@FA in nude mice bearing subcutaneous SGC-7901 model tumors (single administration: dosage 20 mg·kg-1 on day 0) on day 12. A: Smaller tumor condition where the tumor volume was 100 mm3 on day 0; B: Larger tumor condition where the tumor volume was 300 mm3 on day 0. Scale bar = 100 μm |
纳米晶热力学不稳定, 需对其表面修饰。本课题组已建立了3种纳米晶表面修饰路线, 分别为: ①红细胞膜包被, 系将红细胞膜包覆在药物纳米晶外形成“仿生保护层”[17]; ②聚多巴胺包被, 系利用多巴胺自聚反应, 在纳米晶的表面形成聚多巴胺包被层[18]; ③磷脂包被, 系利用疏水的纳米晶表面与类脂分子的疏水头基之间的疏水作用, 将类脂分子吸附在药物结晶表面, 形成磷脂包被[19]。从原料易得性、工艺可控性和成本经济性等角度出发, 本文采用磷脂包被策略实现纳米晶的稳定化。本文在磷脂包被过程中采用探头超声工艺, 利用了超声输入能量进行强力混合, 增加了磷脂分子疏水头与药物纳米晶疏水表面之间发生相互作用的机会。这一包被过程亦可采用高压均质技术来实现, 具体工艺优化将是后续研究的内容之一。未进行磷脂包被的PTX NC稳定性不佳, 易发生聚沉, 故体外释放实验和体外细胞毒性实验中未设PTX NC组。
在体外细胞毒性实验中, Taxol组亦表现出较强的细胞毒性, 这可能与其增溶剂成分(如聚氧乙烯蓖麻油) 的增溶效果有利于PTX进入肿瘤细胞及其本身对细胞的毒性有关[20]。然而, 在整体动物水平的药效实验中, Taxol的缩瘤效果远不及PTX NC@FA, 这可能与PTX NC@FA纳米晶能更持久地滞留在注射局部有关, 相比之下, Taxol注射液更容易经局部血液循环吸收入血。给药局部、主要脏器和相关淋巴结中的药物分布及血中药代动力学将在后续工作中深入考察。
PTX NC@FA良好的缩瘤效果很可能得益于经FA受体介导内吞进入肿瘤细胞的主动靶向机制。基于内镜注射理念的瘤旁局部给药有利于FA主动靶向效果的发挥, 避免了静脉给药时FA修饰纳米药物面临的吸附天然IgM、激活补体系统和增强免疫原性等的不利因素[21]。FA作为一种小分子维生素, 安全经济、稳定性好, 加之FA-DSPE-PEG2000的加入对纳米晶的药效提升显著, 因此, FA-DSPE-PEG2000作为新型主动靶向功能性辅料有广阔的应用前景。所用其他辅料(如EPC、Chol、TPGS和MeO-PEG-DSPE2000) 均为安全性广为接受的药用辅料[22-24], 有利于后续应用转化。
综上, 作为一种具有良好应用潜力的胃癌术前局部化疗新制剂, PTX NC@FA有望用于术前缩小肿瘤, 增加保胃机会, 提高术后生存质量, 为胃癌患者造福。
作者贡献: 王俊撰写文章和实施研究; 刘瑜负责实验设计、数据分析和文章修改; 黄广建和陆伟跃对研究的思路和设计有关键贡献。
利益冲突: 本研究所有作者均不存在利益冲突。
| [1] |
Zheng RS, Sun KX, Zhang HM, et al. Report of cancer epidemiology in China, 2015[J]. Chin J Oncol (中华肿瘤杂志), 2019, 41: 19-28. |
| [2] |
Chang M, Zhang JC, Zhou Q, et al. Research progress of clinical epidemiology of gastric cancer[J]. Chin J Gastroenterol Hepatol (胃肠病学和肝病学杂志), 2017, 26: 966-969. |
| [3] |
Shuai XM, Gao JM, Liu XH, et al. Clinical efficacy of neoadjuvant chemotherapy combined with laparoscopy-assisted radical gastrectomy for advanced gastric cancer[J]. Chin J Dig Surg (中华消化外科杂志), 2016, 15: 241-246. |
| [4] |
Bueno J, Park YS, Ahn SH, et al. Function-preserving surgery in gastric cancer[J]. J Minim Invas Surg, 2018, 21: 141-147. DOI:10.7602/jmis.2018.21.4.141 |
| [5] |
Ychou M, Boige V, Pignon JP, et al. Perioperative chemotherapy compared with surgery alone for resectable gastroesophageal adenocarcinoma: an FNCLCC and FFCD multicenter phase Ⅲ trial[J]. J Clin Oncol, 2011, 29: 1715-1721. DOI:10.1200/JCO.2010.33.0597 |
| [6] |
Li YS, Li JS. Prevention and treatment of chemotherapy-induced intestinal barrier dysfunction[J]. Chin J Med Postgrad (医学研究生学报), 2005, 18: 845-848. |
| [7] |
Furlanut M, Manzoni GD, Pasini F, et al. Daunorubicin and daunorubicinol tissue concentrations in gastric cancer patients after local administration of a liposomal preparation[J]. Pharmacol Res, 2007, 56: 344-349. DOI:10.1016/j.phrs.2007.08.005 |
| [8] |
Akamo Y, Mizuno I, Ichino T, et al. Endoscopic injection of liposomal adriamycin targeting lymph node metastasis of gastric cancer[J]. Cancer Chemother (Tokyo), 1991, 18: 1822. |
| [9] |
Zhang YQ, Zhou PH. Value of endoscopy application in the management of complications after radical gastrectomy for gastric cancer[J]. Chin J Gastrointest Surg (中华胃肠外科杂志), 2017, 20: 160-165. |
| [10] |
Song XM, Li MZ. Advances in endoscopic treatment of early gastric cancer[J]. Chin J Dig Oncol (消化肿瘤杂志), 2012, 4: 74-76. |
| [11] |
Du XH, Ning N. Endoscopic therapy and surgical treatment for early gastric cancer[J]. Chin J Third Mil Med Univ (第三军医大学学报), 2013, 35: 1903-1906. |
| [12] |
Lu Y, Li Y, Wu W. Injected nanocrystals for targeted drug delivery[J]. Acta Pharm Sin B, 2016, 6: 106-113. DOI:10.1016/j.apsb.2015.11.005 |
| [13] |
Sinha B, Müller RH, Möschwitzer JP. Bottom-up approaches for preparing drug nanocrystals: formulations and factors affecting particle size[J]. Int J Pharm, 2013, 453: 126-141. DOI:10.1016/j.ijpharm.2013.01.019 |
| [14] |
Yue PF, Liu Y, Xie J. Review and prospect on preparation technology of drug nanocrystals in the past thirty years[J]. Acta Pharm Sin (药学学报), 2018, 53: 529-537. |
| [15] |
Assaraf YG, Leamon CP, Reddy JA. The folate receptor as a rational therapeutic target for personalized cancer treatment[J]. Drug Resist Updat, 2014, 17: 89-95. DOI:10.1016/j.drup.2014.10.002 |
| [16] |
Ashton JC. Drug combination studies and their synergy quantification using the chou-talalay method-letter[J]. Cancer Res, 2015, 75: 2400. DOI:10.1158/0008-5472.CAN-14-3763 |
| [17] |
Chai ZL, Ran DN, Lu LW, et al. Ligand-modified cell membrane enables targeted delivery of drug nanocrystals to glioma[J]. ACS Nano, 2019, 13: 5591-5601. DOI:10.1021/acsnano.9b00661 |
| [18] |
Huang ZG, Lv FM, Wang J, et al. RGD-modified PEGylated paclitaxel nanocrystals with enhanced stability and tumor-targeting capability[J]. Int J Pharm, 2019, 556: 217-225. DOI:10.1016/j.ijpharm.2018.12.023 |
| [19] |
Zhao JH, Du JL, Wang J, et al. Folic acid and poly(ethylene glycol) decorated paclitaxel nanocrystals exhibit enhanced stability and breast cancer-targeting capability[J]. ACS Appl Mater Interfaces, 2021, 13: 14577-14586. DOI:10.1021/acsami.1c00184 |
| [20] |
Huizing MT, Rosing H, Koopmans FP, et al. Influence of Cremophor EL on the quantification of paclitaxel in plasma using high-performance liquid chromatography with solid-phase extraction as sample pretreatment[J]. J Chromatogr B Biomed Sci Appl, 1998, 709: 161-165. DOI:10.1016/S0378-4347(98)00043-7 |
| [21] |
Wang H, Ding TH, Guan J, et al. Interrogation of folic acid-functionalized nanomedicines: the regulatory roles of plasma proteins reexamined[J]. ACS Nano, 2020, 14: 14779-14789. DOI:10.1021/acsnano.0c02821 |
| [22] |
Collier MA, Eric M, et al. Electrosprayed myocet-like liposomes: an alternative to traditional liposome production[J]. Pharm Res, 2017, 34: 419-426. DOI:10.1007/s11095-016-2072-4 |
| [23] |
Swenson CE, Bolcsak LE, Batist G, et al. Pharmacokinetics of doxorubicin administered i.v. as Myocet (TLC D-99; liposome-encapsulated doxorubicin citrate) compared with conventional doxorubicin when given in combination with cyclophosphamide in patients with metastatic breast cancer[J]. Anticancer Drugs, 2003, 14: 239. DOI:10.1097/00001813-200303000-00008 |
| [24] |
Yang CL, Wu TT, Qi Y, et al. Recent advances in the application of vitamin E TPGS for drug delivery[J]. Theranostics, 2018, 8: 464-485. DOI:10.7150/thno.22711 |
 2022, Vol. 57
2022, Vol. 57


