纳米药物递送系统革新了肿瘤治疗模式。然而, 肿瘤组织间质高压和致密的细胞外基质限制了传统纳米药物递送系统在肿瘤组织中的深部渗透[1, 2], 进而显著降低了药物的递送效率。目前, 许多研究者尝试通过破坏细胞外基质(extracellular matrix, ECM) 屏障或精确调控纳米材料粒径等手段来促进化疗药物的肿瘤渗透[3-6]。例如, 具有靶向肿瘤成纤维细胞(cancer-associated fibroblasts, CAFs) 功能的多肽/多柔比星(doxorubicin, DOX) 组装体通过消耗CAFs打破ECM屏障, 实现了DOX的高效渗透[7]。此外, Kim等[8]利用DNA杂交技术, 将小粒径的金纳米颗粒(gold nanoparticles, AuNPs) 负载在大孔介孔二氧化硅纳米颗粒上, 通过增强渗透滞留效应(enhanced permeability and retention effect, EPR) 到达肿瘤组织后可响应肿瘤酸性微环境释放出AuNPs, 扩散渗透到整个肿瘤组织。上述策略取得了一定的疗效, 但被破坏的肿瘤ECM屏障会带来加速肿瘤细胞转移的风险, 而粒径的变化效率则受限于对肿瘤微环境响应的敏感性。因此, 迫切需要开发新型、特定肿瘤微环境非依赖性的主动渗透型纳米药物递送系统。
相关研究表明, 生物体内的细胞如免疫细胞和间充质干细胞等具有较强的自主形变能力, 可跨过比其尺寸小的狭窄空间, 到达病灶部位发挥作用[9, 10], 因此, 天然细胞有望成为新型药物递送载体。然而, 载体细胞溶酶体等细胞器会破坏药物的活性, 导致药效降低。研究发现, 细胞来源的囊泡可克服上述缺陷, 纳米尺寸的细胞囊泡使其更容易靶向肿瘤部位, 跨越肿瘤生物屏障。更重要的是, 细胞囊泡保留了源细胞的自主运动能力, 可增强对肿瘤的渗透浸润[11, 12]。目前, 多种细胞来源的囊泡已作为新型药物递送载体用于疾病的治疗, 如癌症、阿尔茨海默症和脑梗死等[13-18]。哺乳动物细胞囊泡的分离困难、成本高和生物安全性较低[19-22]。因此, 寻找适于大规模培养且生物安全性高的生物囊泡具有重要意义。多项研究表明, 酿酒酵母作为一种益生酵母, 生长周期短, 容易进行大规模培养[23], 且本身具有激活免疫系统和增强机体免疫力的性质[24]。更重要的是, 酵母囊泡具有较强的组织渗透能力[25], Kutralam-Muniasamy等[26]详细阐述了酵母细胞来源囊泡在生物递送系统中的潜在应用价值。
基于此, 本研究制备了一种具有肿瘤组织主动深部渗透能力的酵母囊泡仿生纳米药物(YCV/DOX)。简言之, 以具有基因缺陷型的W303a酵母细胞囊泡(yeast cell vesicles, YCV) 作为药物载体, 高效负载化疗药DOX。YCV/DOX可通过EPR效应富集到肿瘤部位, 进而凭借其良好形变的能力, 实现DOX的肿瘤深部高效递送。肿瘤细胞摄取后, 可在溶酶体酸性环境释放DOX, 进而发挥抗肿瘤作用。该仿生载体为化疗药物的增效递送与治疗提供了一种新思路。
材料与方法药品与试剂 盐酸多柔比星、近红外荧光染料DiR iodide (大连美仑生物技术有限公司); 酵母提取物(英国OXOID公司); 蛋白胨、琼脂粉(北京奥博星生物技术公司); 二棕榈酰磷脂酰胆碱(DPPC, 上海芃硕生物技术公司); DiIC18(3) (DiI) (上海碧云天生物技术公司); 罗丹明B (rhodamine B, RB, 上海源叶生物科技有限公司)。
仪器 Optima XPN-100型超速离心机(美国贝克曼库尔特商贸有限公司); NS-300型纳米颗粒跟踪分析(nanoparticle tracking analysis, NTA)、动态光散射(dynamic light scattering, DLS) (英国马尔文帕纳科仪器有限公司); UV-2550型紫外-可见分光光度计(日本岛津公司); Nano-ZS90型纳米粒度分析仪(英国马尔文公司); H1 Synergy全波长荧光酶标仪(美国伯腾仪器有限公司); Tecnai G2 F20型透射电子显微镜(transmission electron microscope, TEM, 美国FEI公司); TCS SP8 STED型激光共聚焦显微镜(confocal laser scanning microscope, CLSM, 德国卡尔蔡司公司); Accuri C6型流式细胞仪(美国BD公司); FX-PRO型小动物活体成像仪(美国Bruker公司)。
W303a酵母菌的培养 从-80 ℃冰箱取出W303a的甘油菌株, 于超净工作台中用接种环将其接种于YPD (yeast extract peptone dextrose medium) 固体培养板上, 放入30 ℃恒温培养箱中培养2~3天, 待菌落直径约为2 mm时, 停止培养。挑取单个菌落接种于YPD液体培养基中, 于30 ℃恒温摇床上180 r·min-1振摇3天, 即可获得高浓度和高纯度的W303a酵母菌。
细胞培养 将小鼠乳腺癌细胞(4T1) 和人正常乳腺细胞(Hs578Bst) 于含10%胎牛血清和1%双抗(100 u·mL-1青霉素和100 μg·mL-1链霉素) 的RPMI1640培养基中培养, 培养箱温度为37 ℃, CO2含量为5%。4T1细胞隔天传代, 每次1传4。Hs578Bst细胞每3~4天传1次, 每次1传3。
实验动物 雌性BALB/c小鼠(15~18 g) 购自河南省实验动物中心, 许可证号: SCXK (京) 2019-0008, 编号: 110322211102478867。所有动物实验均按照郑州大学动物实验伦理委员会和郑州大学动物保护使用委员会的指导方针进行。
YCV的提取及表征 取已培养3天的酵母菌液200 mL, 于5 000 ×g离心5 min, 弃去上清液, 将酵母细胞沉淀用去离子水洗涤1次, 加入10 mL酵母细胞裂解液(含10 mmol·L-1 β-巯基乙醇的0.1 mol·L-1 Tris-HCl, pH 9.4), 混匀后置于37 ℃恒温摇床上孵育2 h, 再于5 000 ×g离心5 min, 去除酵母细胞。上清液于13 000 ×g离心10 min, 去除细胞碎片。过0.22 μm的滤膜, 再于100 000 ×g离心2 h, 沉淀用磷酸盐缓冲液(phosphate buffered saline, PBS) 洗涤1次, 再用1 mL PBS复溶, 过0.22 μm的滤膜后即得到酵母YCV。分别使用TEM、NTA和DLS对YCV的形貌、粒径和电位进行表征。
YCV/DOX的制备与表征 称取2 mg的DOX溶于0.875 mL PBS中, 超声充分溶解后, 与每毫升8×1011个YCV溶液0.125 mL混合, 室温下1 500 r·min-1振摇孵育24 h, 12 000 ×g离心5 min。除去游离的DOX, 即可成功制备YCV/DOX NPs。紫外可见分光光度计对YCV、DOX和YCV/DOX进行全波长扫描, 验证YCV/DOX的成功制备。
药物包封率的测定 精密称取2、1和0.5 mg的DOX溶于875 μL PBS中, 超声溶解后, 与每毫升8×1011个YCV溶液125 μL混合, 室温1 500 r·min-1振摇孵育24 h, 12 000 ×g离心5 min。PBS洗涤除去游离的DOX, 使用荧光酶标仪检测上清液490 nm处的吸光度(A)值, 按照公式(1) 计算DOX的包封率(encapsulation efficiency, EE)。
| $ {\rm{EE}} = {\rm{(DOX_{total} - DOX_{supernatant}) / DOX_{total} }}× 100\% $ | (1) |
其中DOXtotal为DOX的总投料质量, DOXsupernatant为上清液中游离DOX的质量。
药物释放行为研究 分别将含有100 μg DOX的YCV/DOX溶于1 mL PBS溶液(pH 7.4、6.5和5.5) 中, 于37 ℃恒温摇床上孵育。在不同时间点(0.5、1、2、4、8、12、24、36、48和72 h) 取出样品, 于12 000×g离心5 min, 采用激发波长490 nm、发射波长595 nm测定上清液荧光强度。
YCV细胞摄取行为及机制研究 取1 mL含8×1011个YCV的溶液于1.5 mL离心管中, 加入1 mg·mL-1 DiI溶液10 μL, 于37 ℃共孵育15 min。然后转入透析袋(Mw 8 000~12 000) 中以PBS为释放介质透析24 h, 以除去游离的DiI, 制得DiI标记的YCV。
收集对数期的4T1细胞, 接种于6孔板中, 细胞数为3×105个/孔。过夜贴壁后, 用1640培养基将10 μL DiI标记的YCV稀释至1 mL后, 加入到6孔板中, 分别共孵育0.5、1、2和4 h。孵育结束后, 用PBS洗2次, 胰酶消化收集细胞, 使用流式细胞仪检测孵育不同时间后4T1细胞内的荧光强度。
将4T1接种于6孔板中, 方法同上。待细胞贴壁后, 分别加入1 mL含15 μg·mL-1氯丙嗪、20 μg·mL-1阿米洛利和7.5 mmol·L-1甲基β环糊精(methyl-β-cyclodextrin, MβCD) 的新鲜培养基, 作用1 h后弃去上述含药培养基, 加入含YCV/DiI的新鲜培养基, 4 h后收集细胞, 流式细胞仪检测不同抑制剂作用下4T1细胞内的荧光强度。
细胞内药物释放行为研究 向6孔板中各放入一块盖玻片, 收集处于对数期的4T1细胞, 接种于6孔板盖玻片上, 细胞数为3×105个/孔。过夜培养, 加入含YCV/DOX的新鲜1640培养基, 孵育(2、4、6、12和24 h), 其中DOX质量浓度设为10 μg·mL-1。弃去含药培养基, 用PBS洗涤2次, 加入4%多聚甲醛1 mL, 室温固定10 min, 再用PBS洗涤2次, 加入10 μg·mL-1 DAPI染液1 mL, 于37 ℃染色10 min, PBS洗涤2次, 将盖玻片爬于载玻片上, 封片后置于CLSM上观察细胞内的红色荧光分布。
YCV体外抗肿瘤活性考察 以4T1细胞为肿瘤细胞模型, 以Hs578Bst细胞为正常细胞模型, 通过细胞计数试剂盒(cell counting kit-8, CCK8) 检测YCV对两种细胞的增殖抑制作用。分别收集处于对数期的两种细胞, 接种于96孔板中, 细胞数为5×103个/孔。细胞培养过夜后, 分别加入100 μL含1×104、1×105、1×106、1×107、1×108、1×109和1×1010个YCV的新鲜培养基, 每组设置5个复孔。培养24 h, 向每孔中加入10 μL的CCK8, 继续孵育3 h, 采用酶标仪检测在450 nm波长处A450。按照公式(2) 计算细胞存活率(survival rate, SR)。
| $ {\rm{SR}} = (A_{{\rm{s}}} - A_{{\rm{b}}}) / (A_{{\rm{c}}} - A_{{\rm{b}}}) × 100\% $ | (2) |
其中, As代表实验孔吸光度值, Ac代表对照孔吸光度值, Ab代表空白孔吸光度值。
YCV/DOX细胞毒性检测 收集处于对数期的4T1细胞, 接种于96孔板中, 细胞数为5×103个/孔。细胞培养过夜后, 分别加入100 μL不同浓度的DOX和YCV/DOX的新鲜培养基, DOX质量浓度设为0.5、1、2、4、6、8、10和20 μg·mL-1, 每组设置5个复孔。培养24和48 h, 向每孔中加入10 μL的CCK8。继续孵育3 h, 采用酶标仪检测A值。
3D肿瘤球渗透能力考察
DiI标记的脂质体(liposomes/DiI, Lipo/DiI) 的制备 称取14 mg DPPC和2 mg胆固醇溶于5 mL氯仿中, 加入1 mg·mL-1 DiI氯仿溶液200 μL, 混匀后于旋转蒸发仪上将氯仿蒸干。加入4 mL PBS水化, 然后置于超声波细胞破碎仪中超声, 获得澄清透明的溶液, 即为Lipo/DiI。
构建3D肿瘤球 称取0.30 g低熔点琼脂糖于玻璃瓶中, 加入PBS 30 mL, 混匀后, 拧松瓶盖, 置于高压蒸汽锅中于121 ℃灭菌30 min。随后趁热将其铺于96孔板中, 每孔加入100 μL。待其凝固后, 每孔加入含5×103个细胞的4T1细胞悬液100 μL。然后将96孔板固定于脱色摇床上, 20 min内将转速缓慢增加至1 000 r·min-1, 继续振摇30 min, 于20 min内将转速缓慢降至0, 静置10 min。将96孔板转移至细胞培养箱中培养7天, 在第4天时向每孔中补加新鲜培养基100 μL, 以提供足够的营养。培养结束后即可获得密度较高的3D肿瘤球。
在含肿瘤球的96孔板中分别加入Lipo/DiI和YCV/DiI, 使DiI终质量浓度为10 μg·mL-1。培养12 h, 用1 mL枪头将3D细胞球从96孔板中转移至共聚焦培养皿中, 用PBS洗涤2次, 置于CLSM下观察每纵深10 μm焦平面肿瘤球中的红色荧光。
荷瘤小鼠模型的建立 将4T1细胞沉淀重悬于培养基中, 使细胞数为2×107个/mL。吸取200 μL皮下注射于雌性BALB/c小鼠的右前肢腋下。通过游标卡尺测量肿瘤的体积, 按照公式(3) 计算为瘤体积(V, mm3)。接种7~10天后, 待肿瘤体积达100 mm3即可用于药效学研究。
| $ V = L × W^{2} / 2 $ | (3) |
其中, L为肿瘤长径, W为肿瘤短径。
体内组织分布研究 取1×1011个/mL YCV PBS溶液200 μL, 加入1 mg·mL-1 DiR溶液10 μL, 于37 ℃共孵育1 h, 置于透析袋(Mw 12 000~14 000) 中, 以PBS为释放介质透析24 h即可制得DiR标记的YCV溶液(YCV/DiR)。
称取DPPC 7 mg、胆固醇1 mg和DiR 1 mg于棕色茄形瓶中, 加入5 mL氯仿, 超声使其完全溶解。置于旋转蒸发仪上于40 ℃缓慢将氯仿蒸干, 形成一层薄膜。加入PBS溶液2 mL进行水化1 h, 然后将溶液置于超声波细胞粉碎机中超声, 得到澄清的脂质体溶液。将其置于透析袋(Mw 12 000~14 000) 中, 以去离子水为释放介质透析24 h, 即可制得DiR标记的脂质体(Lipo/DiR)。
分别对荷瘤小鼠尾静脉注射Lipo/DiR和YCV/DiR各200 μL。每组3只, 用小动物活体成像系统分别于0.5、1、2、4、6、8、12、24、36和48 h观察小鼠体内的荧光分布。48 h后解剖各组小鼠的主要器官(心、肝、脾、肺、肾和肿瘤组织), 观察其荧光分布。
体内肿瘤深部渗透能力考察 选择RB染料对YCV和Lipo进行示踪。分别单次注射200 μL的Lipo/RB和YCV/RB, 其中RB质量浓度为20 μg·mL-1。给药24 h后剥离肿瘤组织使用冰冻切片机切片。FITC标记的CD31抗体标记肿瘤血管, DAPI标记肿瘤细胞核。使用切片扫描仪对两组染好的切片进行全扫描。
体内抗肿瘤活性研究 待小鼠肿瘤体积达100 mm3左右时, 随机分成6组, 每组5只, 分别通过尾静脉注射不同的制剂: ①生理盐水; ② Lipo; ③ YCV; ④ DOX; ⑤ Lipo/DOX; ⑥ YCV/DOX, 其中DOX剂量为2 mg·kg-1。治疗周期为2周, 隔天给药。每次给药前用游标卡尺测量肿瘤体积。治疗结束后, 剥离各组小鼠的肿瘤组织进行苏木精-伊红染色(hematoxylin-eosin staining, H&E染色) 和脱氧核糖核苷酸末端转移酶介导的缺口末端标记法染色(terminal deoxynucleotidyl transferase-mediated dUTP-biotin nick end labeling, TUNEL染色)。
体内生物安全性考察 在治疗结束后, 剥离各组小鼠的5个重要组织器官(心、肝、脾、肺、肾), 经多聚甲醛固定后制成石蜡切片, 进行H&E染色, 以考察给药后各组织细胞结构的变化。
数据分析 采用GraphPad Prism 8.0.2软件进行处理和分析, 所有数据以平均数±标准差(
采用TEM观察YCV的形貌(图 1A), YCV为粒径约100 nm的球形纳米粒; NTA结果显示, YCV粒径集中分布在100 nm (图 1B), 与TEM结果一致。此外, 使用DLS检测YCV的水合粒径及电位, 其水合粒径为144.5 ± 2.3 nm, 比TEM的粒径偏大。YCV的电位为-8.59 ± 1.33 mV, 有利于带正电荷的DOX的高效负载。
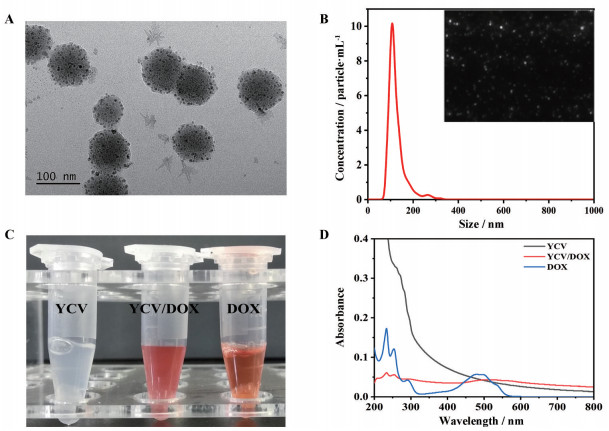
|
Figure 1 Characterization of yeast cell vesicles (YCV) and yeast cell vesicles/doxorubicin (YCV/DOX). A: Transmission electron microscopy (TEM) image; B: Nanoparticle tracking analysis (NTA) result of YCV; C: Photographs of YCV, YCV/DOX and DOX; D: UV-vis spectrum of YCV, YCV/DOX and DOX |
由于带正电的DOX可通过静电作用荷载在负电荷的YCV中, 将二者孵育24 h后, 观察所制备的YCV与YCV/DOX的溶液颜色变化(图 1C), 可以看到YCV自身为乳白色, 而负载DOX后的YCV/DOX为均一的红色溶液。通过紫外可见分光光度计对YCV、DOX和YCV/DOX进行全波长扫描, 结果如图 1D所示。YCV自身无特征吸收峰, 仅在200~300 nm之间有末端吸收。DOX在490 nm处有特征吸收峰。YCV/DOX中含有DOX的特征吸收峰, 说明DOX成功负载在YCV中。
2 YCV/DOX的药物包封与释放YCV对DOX的包封能力见图 2。由图 2A可知, 当固定YCV的含量, YCV对DOX的包封率随DOX投量的增加而降低。当DOX投料量为0.5 mg时, 1×1011个YCV对DOX的包封率为82.5%。随着DOX的投料量的提高, 虽然其药物装载量具有一定的提高, 但其包封率显著下降。综合考虑选用DOX的投料量为0.5 mg。YCV对DOX的高效包封为其抗肿瘤作用提供了有力保障。

|
Figure 2 A: Encapsulation efficiencyof YCV/DOX with different devoted DOX amount. B: Release profile of DOX from YCV/DOX at different pH values. n = 3, |
药物在肿瘤部位的有效释放也是发挥抗肿瘤作用的关键步骤。分别选取pH 5.5、6.5和7.4的PBS溶液来模拟肿瘤细胞内溶酶体、肿瘤组织和体液的pH环境, 考察YCV/DOX在不同pH的PBS溶液中DOX的释放, 结果如图 2B所示。在pH 7.4环境下, 72 h后DOX累积释放率不到5%; 在pH 6.5环境下, 24 h后DOX的累积释放率趋于稳定, 约为21.6%, 说明在肿瘤微环境条件下会部分释放DOX, 作用于肿瘤细胞; 在pH 5.5环境下, DOX的累积释放率显著增加, 24 h可达52.9%, 48 h趋于稳定, 累积释放率约为63.5%, 说明酸性溶酶体环境有利于YCV/DOX中DOX的累积释放。
3 细胞实验 3.1 YCV细胞摄取行为及机制研究通过流式细胞仪检测不同孵育时间下4T1细胞对DiI标记的YCV的摄取情况及在不同抑制剂作用下4T1细胞对DiI标记的YCV的摄取, 结果如图 3A、B所示。4T1细胞中的荧光强度随孵育时间的增加而增强, 具有时间依赖性。为考察4T1细胞对YCV的摄取机制, 使用不同类型的内吞抑制剂对4T1细胞预处理, 由图 3B可知, 只有在MβCD作用下4T1对DiI标记的YCV的摄取量有所减少, 其他抑制剂均无明显细胞摄取抑制作用。结果表明, 4T1对YCV的摄取是时间依赖型的, 而且是通过小窝蛋白介导的内吞。

|
Figure 3 A: Cellular uptake of YCV/DiI by 4T1 cells at different times. B: Cellular uptake behavior of YCV/DiI by 4T1 cells before treated with different inhibitors. MβCD: Methyl-β-cyclodextrin |
通过CLSM检测YCV/DOX在4T1细胞内的荧光分布, 结果如图 4所示。孵育时间从2 h增加至6 h, 可以看到细胞质和细胞核中的红色荧光均逐渐增强, 但细胞数量无明显改变。但当孵育时间增加至12 h时, 细胞质中的红色荧光明显减弱, 红色荧光主要集中分布在细胞核中, 4T1细胞数量明显减少。孵育24 h, DOX几乎完全进入细胞核, 细胞数量急剧下降, 说明YCV/DOX中的DOX在4T1细胞中可释放进入细胞核, 诱发细胞凋亡。

|
Figure 4 Confocal laser scanning microscopy (CLSM) images of 4T1 cells treated with YCV/DOX for different times |
YCV作为新型纳米载体, 其生物安全性至关重要。以Hs578Bst细胞作为正常细胞模型、4T1细胞为肿瘤细胞模型, 考察不同浓度YCV对4T1细胞和Hs578Bst细胞存活率的影响。YCV与细胞作用24 h后, 在YCV的实验浓度范围内, 4T1细胞和Hs578Bst细胞的存活率较高(图 5A), 说明YCV对肿瘤细胞和正常细胞均无明显的细胞毒性, 生物安全性良好。
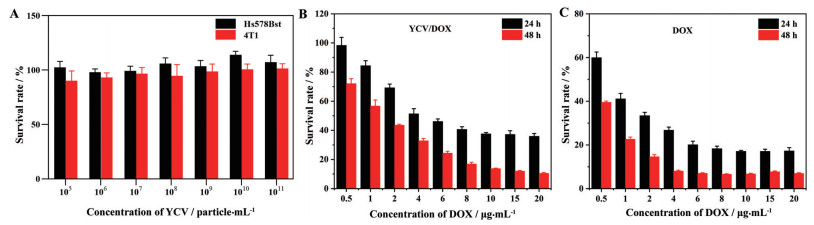
|
Figure 5 A: Cytotoxicity of YCV to Hs578Bst and 4T1 cells for 24 h. In vitro antitumor effect of (B) YCV/DOX and (C) DOX for treatment at 24 and 48 h. n = 6, |
含不同浓度DOX的YCV/DOX和游离DOX对4T1细胞的增殖抑制作用结果如图 5B、C所示。随着DOX浓度的增加和孵育时间的延长, 游离DOX组和YCV/DOX组的4T1细胞存活率逐渐降低。作用24 h后, YCV/DOX组的抑制率约为64.2%; 作用48 h后, 抑制率达89.5%。但是在DOX浓度相同条件下, 相同作用时间内YCV/DOX对4T1细胞的增殖抑制作用较游离DOX组弱, 可能是由于YCV/DOX被4T1细胞摄取后存在药物释放的过程, YCV/DOX中DOX释放相对比较缓慢, 相同时间内进入细胞核的DOX量较少, 导致对细胞内DNA损伤较弱。
3.5 3D肿瘤球渗透能力考察多项研究表明, 生物囊泡具有通过发生自身形变向肿瘤深部渗透的能力。作者制备了类似大小的脂质体, 通过Transwell迁移实验考察了YCV和脂质体的渗透能力。如图 6A所示, 相比于脂质体, 尤其是在12 h, YCV的穿透能力明显增加, 间接证明了YCV可能通过形变增加了渗透。随后, 利用低熔点琼脂糖构建了3D肿瘤细胞球, 以Lipo作为对照, 采用CLSM观察DiI标记的YCV/DiI和Lipo/DiI在3D肿瘤细胞球中的渗透深度, 结果如图 6B所示。Lipo/DiI组在30 μm焦平面上已呈边缘分布的状态, 相比而言, YCV/DiI组从30 μm到50 μm焦平面上荧光分布范围更广, 荧光强度更强。YCV/DiI组渗透深度达50 μm, 而Lipo/DiI组渗透深度约30 μm。总之, 与Lipo相比, YCV具有更强的肿瘤渗透能力, 可能是因为YCV在肿瘤复杂微环境下具有较强的自主变形能力, 使其能渗透至肿瘤组织深部。
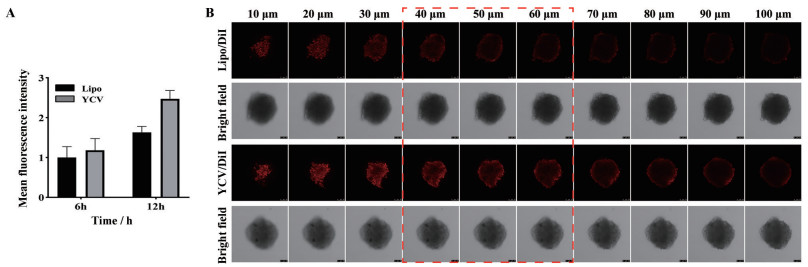
|
Figure 6 A: YCV and liposomes penetrate into the lower chamber of Transwell at different time points. B: CLSM images of 3D tumor cell sphere treated with YCV and liposomes (Lipo) for 24 h. Scale bar: 75 μm. n = 3, |
使用DiR近红外荧光染料示踪YCV与Lipo, 考察其在荷瘤小鼠体内的分布, 结果如图 7A所示。从图中可见, YCV与Lipo均具有一定的肿瘤靶向能力, 但YCV的肿瘤靶向滞留能力相对更强, 可能的原因是天然来源YCV在体内循环时间更长。与Lipo相比, YCV在肝脏中聚集相对较少, 可能是因为Lipo作为合成的纳米材料, 属于外来异物, 容易被肝巨噬细胞识别和摄取, 因此在肝脏中聚集更多, 荧光信号更强。而YCV是生物来源的纳米囊泡, 具有一定的生物相容性, 被肝巨噬细胞摄取的相对较少, 荧光信号更弱。此外, YCV在脾脏中的分布更多(图 7B), 可能的原因是YCV承袭了其母细胞酿酒酵母中的相关蛋白, 可激活免疫系统, 提高机体免疫能力所致。
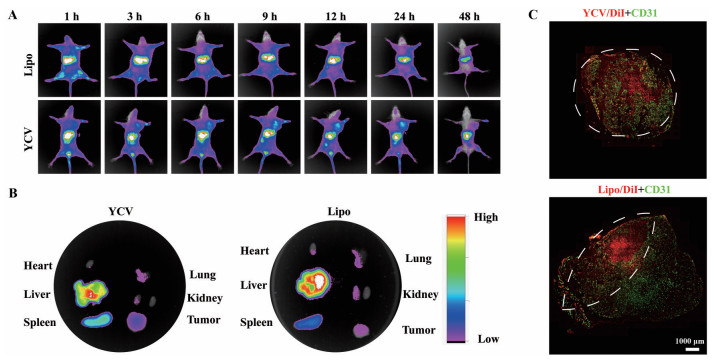
|
Figure 7 In vivo biodistribution of YCV. A: Near-infrared light (NIR) fluorescence imaging of tumor-bearing mice after intravenous injection with YCV and Lipo, respectively; B: The corresponding fluorescence intensity of tumor and major organs at 24 h post-injection; C: Fluorescence imaging of tumor tissue slices at 24 h post-injection of YCV and Lipo. Red color represented DiI and green color means CD31 (tumor vessels). The penetration area of YCV and Lipo were marked by white broken lines |
使用DiI红色荧光染料标记Lipo与YCV, CD31抗体对肿瘤血管进行标记, 进一步考察其在体内肿瘤组织中的分布(图 7C)。Lipo仅分布在肿瘤组织浅表面, 而YCV则更多、更均匀地分布在整个肿瘤组织中。因此, 与Lipo相比, YCV在肿瘤组织中具有更强的深部渗透能力, 可能的原因是YCV具有一定的自变形能力, 能够深入到深部肿瘤组织, 实现了DOX的肿瘤深部递送。
4.2 YCV/DOX的体内抗肿瘤活性研究不同制剂体内抗肿瘤效果如图 8所示。与对照组相比, Lipo组荷瘤小鼠的相对瘤体积无显著性差异, 而给予YCV后相对瘤体积则有所减小, 可能YCV与其母体酵母细胞相似, 具有一定的增强机体免疫能力的作用(图 8A)。当给予不同DOX制剂后, 肿瘤的生长都有不同程度的抑制。游离DOX组相对瘤体积为4.10 ± 0.37, Lipo/DOX组相对瘤体体积为2.87 ± 0.30, YCV/DOX组相对瘤体体积为1.79 ± 0.29, 与对照组(7.58 ± 0.46) 相比均有显著性差异(P < 0.001), 说明DOX具有一定的抗肿瘤作用。而YCV/DOX组表现出最强的抗肿瘤效果, 主要归因于YCV/DOX制剂中YCV的肿瘤靶向滞留和变形运动能力促进了DOX的肿瘤蓄积和深部递送效率。

|
Figure 8 In vivo antitumor effects of YCV/DOX. Relative tumor volume (A), tumor weight (B) and tumor inhibition rate (C) of tumor-bearing mice with different treatments vs control group. n = 5, |
治疗周期结束后, 各组小鼠肿瘤的重量和相应的抑瘤率如图 8B、C所示。经过2周的治疗周期, 对照组小鼠的瘤重约1.7 g, Lipo组约为1.6 g, 与对照组相比无显著性差异(P > 0.05)。YCV组瘤重约1.25 g, 抑瘤率为25.6% (P < 0.01), 可能是因为YCV增强免疫的作用[27-33]。给予不同DOX制剂后, 从游离DOX的0.88 g降至YCV/DOX组的0.56 g, 抑瘤率达67.4% (P < 0.001), 不仅归因于纳米载体的肿瘤靶向性, 还依靠YCV自身的肿瘤深部渗透能力将DOX递送至肿瘤深部的作用。对各组小鼠肿瘤组织的石蜡切片进行H&E和TUNEL染色(图 8D)。H&E染色结果显示, 对照组和Lipo细胞核完整饱满, 数量较多。给予YCV后细胞核有一定程度的皱缩。不同DOX制剂作用后, 肿瘤细胞的细胞核呈现不同程度的皱缩和数量减少。YCV/DOX组中细胞核固缩最严重, 且细胞核大幅度减少, 肿瘤细胞死亡率最高。TUNEL结果显示, 对照组几乎无绿色荧光, Lipo组有较弱绿色荧光, 可能是因为Lipo浓度较高, 对肿瘤细胞有微弱的毒性。与Lipo组相比, YCV组绿色荧光强度明显增强, 可能是YCV能增强机体免疫力, 增加免疫细胞对肿瘤细胞的杀伤作用。不同DOX制剂作用后肿瘤细胞内绿色荧光呈现不同程度的增强, 其中YCV/DOX组中绿色荧光最强, 细胞核受损最严重, 说明YCV/DOX在体内具有最强的肿瘤细胞杀伤能力。
4.3 YCV/DOX的体内生物安全性考察治疗结束后取各组小鼠的心、肝、脾、肺和肾组织制成石蜡切片, 进行H&E染色, 结果如图 9所示。不同制剂组小鼠肝静脉窦完整, 肝脏细胞紧绕肝静脉窦有序排列; 脾小节完整, 脾细胞正常; 肺泡大, 没有皱缩; 肾小球完整, 肾小管上皮细胞核完好。游离DOX组的心脏切片显示有严重心肌纤维分解和心肌细胞损伤; Lipo/DOX组有轻微心肌损伤, 而空白载体YCV和YCV/DOX组心肌细胞完整且排列有序, 无明显的心肌毒性, 说明YCV不仅自身具有良好的生物安全性, 还可以降低DOX的心脏毒性, 提高化疗效果。
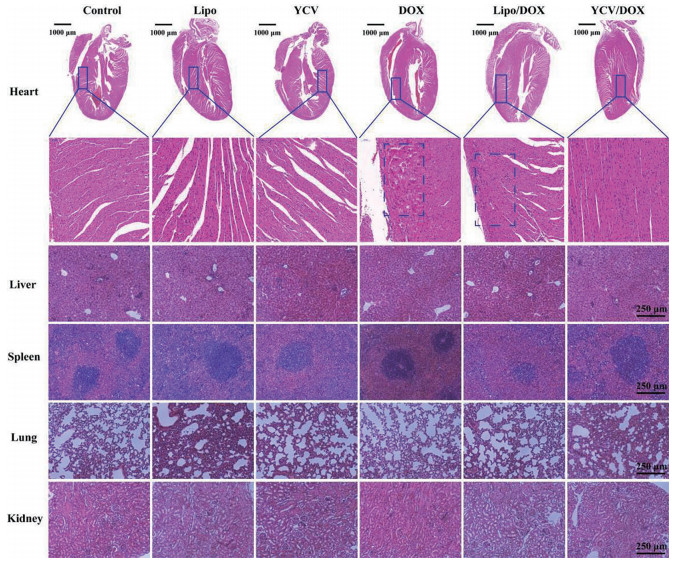
|
Figure 9 H&E staining of main organs from mice with different treatments |
化疗作为临床最常用的肿瘤治疗手段, 因常用剂量较大而具有较强的不良反应。纳米载体的出现一定程度上降低了药物的使用剂量, 提高了药物的肿瘤靶向滞留能力, 如脂质体已被批准用于临床。但多柔比星脂质体等药物在到达肿瘤后也主要被限制在肿瘤血管的周围, 严重限制了药物在肿瘤组织的深部渗透。研究表明, 基质应力松弛使细胞囊泡轻松逃离ECM, 而刚性基质增加囊泡的波动转运。刚度和应力松弛的结合极大地提高了囊泡的转运能力。囊泡还通过AQP1 (aquaporin-1) 进行水渗透, 通过改变囊泡体积使其更容易变形, 从而使其摆脱限制。细胞囊泡的脂质成分和细胞骨架蛋白cytospin-A也可能影响其转运。因此, 有生物学功能的细胞囊泡可主动渗透肿瘤ECM转运药物[34, 35]。而且, 细胞摄取过程是能量依赖的。纳米粒在细胞摄取过程中容易受到细胞膜的压力和粒子与细胞膜之间的范德华力的影响而发生形变。形态变化可以减少内化过程中细胞膜的变形和相应的能量, 从而促进其被细胞摄取[36-39]。
本研究选取了易于大规模培养、生物安全性高的天然酿酒酵母细胞作为生物囊泡来源, 提取YCV并高效装载一线抗肿瘤药物DOX, 构建可自主向肿瘤深部渗透的YCV/DOX纳米体系。该体系具有显著的pH敏感释药能力。4T1细胞对YCV的摄取呈现以小窝蛋白介导的时间依赖性内化, 且在溶酶体中释放DOX, 发挥杀伤肿瘤细胞作用。更重要的是, 与脂质体相比, YCV具有更强的肿瘤组织渗透能力, 推测其机制可能为YCV保留了酵母细胞良好的形变能力。通过进一步的体内实验发现, 相比脂质体, YCV/DOX具有更强的肿瘤积累和更强的肿瘤组织深层次渗透能力, 进而发挥更强的抗肿瘤作用。此外, 体内外抗肿瘤活性研究表明, YCV可提高DOX的抗肿瘤效率; 体内生物安全性评价结果表明YCV自身具有良好的生物安全性, 可显著降低DOX心脏毒性。
本研究从体内外水平初步探索了YCV的肿瘤渗透能力, 以DOX为药物模型, 考察了药物包封率、药物释放特征、体内外抗肿瘤活性和体内分布等, 为酵母囊泡递送肿瘤药物提供了依据。
作者贡献: 史进进和张振中提出实验研究的整体思路; 许丽华和刘军杰负责主要实验操作与数据处理; 史进进、刘军杰、赵秀和许丽华负责文章的撰写; 张开翔、王翼扬和许丽华负责协助体内药效相关实验的操作及数据采集、分析。
利益冲突: 全体作者声明不存在任何利益冲突。
| [1] |
Gao M, Fu J, Wang X. Major progress in tumor accumulation and penetration of nanomedicine[J]. Acta Pharm Sin (药学学报), 2021, 56: 138-145. |
| [2] |
Hu C, Gao H. Advances in tumor microenvironment responsive and regulatory drug delivery system[J]. Acta Pharm Sin (药学学报), 2020, 55: 1520-1527. |
| [3] |
Wang Y, Xie Y, Li J, et al. Tumor-penetrating nanoparticles for enhanced anticancer activity of combined photodynamic and hypoxia-activated therapy[J]. ACS Nano, 2017, 11: 2227-2238. DOI:10.1021/acsnano.6b08731 |
| [4] |
Lin X, Liu S, Zhang X, et al. An ultrasound activated vesicle of janus Au-MnO nanoparticles for promoted tumor penetration and sono-chemodynamic therapy of orthotopic liver cancer[J]. Angew Chem Int Ed, 2019, 58: 2-9. DOI:10.1002/anie.201813331 |
| [5] |
Jin H, Zhu T, Huang X, et al. ROS-responsive nanoparticles based on amphiphilic hyperbranched polyphosphoester for drug delivery: light-triggered size-reducing and enhanced tumor penetration[J]. Biomaterials, 2019, 211: 68-80. DOI:10.1016/j.biomaterials.2019.04.029 |
| [6] |
Dai L, Li K, Li M, et al. Size/charge changeable acidity-responsive micelleplex for photodynamic-improved PD-L1 immunotherapy with enhanced tumor penetration[J]. Adv Funct Mater, 2018, 28: 1707249. DOI:10.1002/adfm.201707249 |
| [7] |
Ji T, Ding Y, Zhao Y, et al. Peptide assembly integration of fibroblast-targeting and cell-penetration features for enhanced antitumor drug delivery[J]. Adv Mater, 2015, 27: 1865-1873. DOI:10.1002/adma.201404715 |
| [8] |
Kim J, Jo C, Lim WG, et al. Programmed nanoparticle-loaded nanoparticles for deep-penetrating 3D cancer therapy[J]. Adv Mater, 2018, 30: 1707557. DOI:10.1002/adma.201707557 |
| [9] |
Nagahama H, Nakazaki M, Sasaki M, et al. Preservation of interhemispheric cortical connections through corpus callosum following intravenous infusion of mesenchymal stem cells in a rat model of cerebral infarction[J]. Brain Res, 2018, 1695: 37-44. DOI:10.1016/j.brainres.2018.05.033 |
| [10] |
Denardo DG, Ruffell B. Macrophages as regulators of tumour immunity and immunotherapy[J]. Nat Rev Immunol, 2019, 19: 369-382. |
| [11] |
Kim HY, Kim TJ, Kang L, et al. Mesenchymal stem cell-derived magnetic extracellular nanovesicles for targeting and treatment of ischemic stroke[J]. Biomaterials, 2020, 243: 119942. DOI:10.1016/j.biomaterials.2020.119942 |
| [12] |
Wang P, Wang H, Huang Q, et al. Exosomes from M1-polarized macrophages enhance paclitaxel antitumor activity by activating macrophages-mediated inflammation[J]. Theranostics, 2019, 9: 1714-1727. DOI:10.7150/thno.30716 |
| [13] |
Yang L, Zhai Y, Hao Y, et al. The regulatory functionality of exosomes derived from hUMSCs in 3D culture for Alzheimer's disease therapy[J]. Small, 2020, 16: e1906273. DOI:10.1002/smll.201906273 |
| [14] |
Drew D, Kim H. Large-scale production of membrane proteins in Saccharomyces cerevisiae: using a green fluorescent protein fusion strategy in the production of membrane proteins[J]. Methods Mol Biol, 2012, 866: 209-216. |
| [15] |
Wang G, Hu W, Chen H, et al. Cocktail strategy based on NK cell-derived exosomes and their biomimetic nanoparticles for dual tumor therapy[J]. Cancers, 2019, 11: 1560. DOI:10.3390/cancers11101560 |
| [16] |
Fu WY, Lei CH, Liu SW, et al. CAR exosomes derived from effector CAR-T cells have potent antitumour effects and low toxicity[J]. Nat Commun, 2019, 10: 4355. DOI:10.1038/s41467-019-12321-3 |
| [17] |
Cao M, Yan H, Han X, et al. Ginseng-derived nanoparticles alter macrophage polarization to inhibit melanoma growth[J]. J Immunother Cancer, 2019, 7: 326. DOI:10.1186/s40425-019-0817-4 |
| [18] |
Lee R, Ko HJ, Kim K, et al. Anti-melanogenic effects of extracellular vesicles derived from plant leaves and stems in mouse melanoma cells and human healthy skin[J]. J Extracell Vesicles, 2020, 9: 1703480. DOI:10.1080/20013078.2019.1703480 |
| [19] |
Bland CL, Byrne-Hoffman CN, Fernandez A, et al. Exosomes derived from B16F0 melanoma cells alter the transcriptome of cytotoxic T cells that impacts mitochondrial respiration[J]. FEBS J, 2018, 285: 1033-1050. DOI:10.1111/febs.14396 |
| [20] |
Park J, Lee H, Youn YS, et al. Tumor-homing pH-sensitive extracellular vesicles for targeting heterogeneous tumors[J]. Pharmaceutics, 2020, 12: 372. DOI:10.3390/pharmaceutics12040372 |
| [21] |
Kim OY, Park HT, Dinh NTH, et al. Bacterial outer membrane vesicles suppress tumor by interferon-gamma-mediated antitumor response[J]. Nat Commun, 2017, 8: 626. DOI:10.1038/s41467-017-00729-8 |
| [22] |
Lin Y, Zhang C, Xiang P, et al. Exosomes derived from HeLa cells break down vascular integrity by triggering endoplasmic reticulum stress in endothelial cells[J]. J Extracell Vesicles, 2020, 9: 1722385. DOI:10.1080/20013078.2020.1722385 |
| [23] |
Hudson LE, Mcdermott CD, Stewart TP, et al. Characterization of the probiotic yeast Saccharomyces boulardii in the healthy mucosal immune system[J]. PLoS One, 2016, 11: e0153351. DOI:10.1371/journal.pone.0153351 |
| [24] |
Seif M, Philippi A, Breinig F, et al. Yeast (Saccharomyces cerevisiae) polarizes both M-CSF- and GM-CSF-differentiated macrophages toward an M1-like phenotype[J]. Inflammation, 2016, 39: 1690-1703. DOI:10.1007/s10753-016-0404-5 |
| [25] |
Gujrati V, Lee M, Ko YJ, et al. Bioengineered yeast-derived vacuoles with enhanced tissue-penetrating ability for targeted cancer therapy[J]. Proc Natl Acad Sci U S A, 2016, 113: 710-715. DOI:10.1073/pnas.1509371113 |
| [26] |
Kutralam-Muniasamy G, Flores-Cotera LB, Perez-Guevara F. Potential of yeast secretory vesicles in biodelivery systems[J]. Drug Discov Today, 2015, 20: 659-666. DOI:10.1016/j.drudis.2015.03.014 |
| [27] |
Marar C, Starich B, Wirtz D. Extracellular vesicles in immunomodulation and tumor progression[J]. Nat Immunol, 2021, 22: 560-570. DOI:10.1038/s41590-021-00899-0 |
| [28] |
Davis C, Savitz SI, Satani N. Mesenchymal stem cell derived extracellular vesicles for repairing the neurovascular unit after ischemic stroke[J]. Cells, 2021, 10: 767-790. DOI:10.3390/cells10040767 |
| [29] |
Kim OY, Park HT, Thi N, et al. Bacterial outer membrane vesicles suppress tumor by interferon-γ-mediated antitumor response[J]. Nat Commun, 2017, 8: 626-634. |
| [30] |
Liu DQ, Lu S, Zhang L, et al. A biomimetic yeast shell vaccine coated with layered double hydroxides induces a robust humoral and cellular immune response against tumors[J]. Nanoscale Adv, 2020, 2: 3494-3506. DOI:10.1039/D0NA00249F |
| [31] |
Kroll F, Putarov TC, Zaine L, et al. Active fractions of mannoproteins derived from yeast cell wall stimulate innate and acquired immunity of adult and elderly dogs[J]. Anim Feed Sci Technol, 2020, 261: 114392. DOI:10.1016/j.anifeedsci.2020.114392 |
| [32] |
Stein K, Winters C, Chiang HL. Vps15p regulates the distribution of cup-shaped organelles containing the major eisosome protein Pil1p to the extracellular fraction required for endocytosis of extracellular vesicles carrying metabolic enzymes[J]. Biol Cell, 2017, 109: 190-209. DOI:10.1111/boc.201600060 |
| [33] |
Ingato D, Edson JA, Zakharian M, et al. Cancer cell-derived, drug-loaded nanovesicles induced by sulfhydryl-blocking for effective and safe cancer therapy[J]. ACS Nano, 2018, 12: 9568-9577. DOI:10.1021/acsnano.8b05377 |
| [34] |
Lenzini S, Bargi R, Chung G, et al. Matrix mechanics and water permeation regulate extracellular vesicle transport[J]. Nat Nanotechnol, 2020, 15: 217-223. DOI:10.1038/s41565-020-0636-2 |
| [35] |
Liang QL, Bie NN, Yong TY, et al. The softness of tumour-cell-derived microparticles regulates their drug-delivery efficiency[J]. Nat Biomed Eng, 2019, 3: 729-740. |
| [36] |
Teng Z, Wang C, Tang Y, et al. Deformable hollow periodic mesoporous organosilica nanocapsules for significantly improved cellular uptake[J]. J Am Chem Soc, 2018, 140: 1385-1393. |
| [37] |
Peng X, Wang Q, Zhang H, et al. Small-sized deformable hollow mesoporous organosilica nanocapsules with improved cellular uptake[J]. J Porous Mater, 2020, 27: 1783-1789. |
| [38] |
Sun H, Wong EHH, Yan Y, et al. The role of capsule stiffness on cellular processing[J]. Chem Sci, 2015, 6: 3505-3514. |
| [39] |
Chen Y, Li X, Wang M, et al. Virus-inspired deformable mesoporous nanocomposites for high efficiency drug delivery[J]. Small, 2020, 16: e1906028. |
 2022, Vol. 57
2022, Vol. 57


