近年来, 光热治疗在恶性肿瘤的治疗中体现出重要的价值。光热治疗是利用特定的激发光照射, 使光热剂发生光热转换效应, 使靶部位的温度达到临界治疗温度(41~48 ℃甚至更高), 从而消融肿瘤的一种治疗手段[1]。光热治疗作为一种局部治疗方式, 具有不良反应小、治疗效果明显等独特优势[2]。目前, 光热治疗或光热联合疗法在三阴性乳腺癌和黑色素瘤等多种肿瘤模型中均表现出良好的抗肿瘤效果, 具有广阔的应用前景[3]。
IR-780是一种重要的花菁类的小分子光热剂, 其在近红外(700~1 000 nm) 具有较高的光热转化效率, 在近年来的肿瘤光热治疗被广泛使用[4]。IR-780分子是一个大的π共扼体系, 这种基本结构特征决定了染料的主要吸收在700~1 000 nm范围, 由于IR-780在近红外区存在吸收, 激光照射后, IR-780电子的能量增加, 会发生电子跃迁, 由基态跃迁至单线激发态, 当电子由单线激发态回落至基态时, 激发态的一些能量可以通过振动弛豫或其他非辐射跃迁途径转化为热。如果组织内的产热速率超过组织散热速率, 则组织温度会逐渐升高, 从而消融肿瘤细胞[5]。同时, 其具有明显的疏水性, 便于被多种纳米载体, 如聚合物胶束、脂质体和白蛋白纳米粒等进行包载实现对IR-780的肿瘤靶向性递送。
炎症是影响肿瘤发生发展的重要因素[6]。在1863年, Rudolfville Leopard首次提出了炎症与癌症密不可分的观点[7]。多项研究表明[8, 9], 炎性细胞因子和趋化因子通常在肿瘤细胞中过度表达, 比如白细胞介素-6 (interleukin-6, IL-6) 和肿瘤坏死因子-α (tumor necrosis factor-α, TNF-α) 等的分泌可构成肿瘤炎性微环境并促进肿瘤的发展。当光热治疗诱导癌细胞坏死时, 会破坏质膜的完整性, 从而导致炎性细胞因子大量释放[10]。Xie等[11, 12]研究表明, 光热治疗能提高TNF-α和IL-6等细胞因子水平。这些因子通过激活残留癌细胞中的促存活基因, 诱导对后续治疗的抵抗[13-15]。此外, 炎性细胞因子可促使中性粒细胞迁移到肿瘤, 进一步产生炎症反应, 促进肿瘤的再生与转移[16-19]。由此可见, 开发在增强光热治疗效果的同时抑制光热治疗诱导炎症反应的癌症治疗策略, 对提高肿瘤光热治疗效果至关重要。
18β-甘草次酸(18β-GA) 是由甘草酸水解脱去糖酸链而形成的五环三萜类化合物[20], 其在三阴性乳腺癌、黑色素瘤及结肠癌等多种肿瘤模型中都表现出明确的抗肿瘤疗效, 是一种具有良好抗肿瘤作用的天然产物[21-23]。文献[24-26]表明, 18β-GA可下调多种细胞的IL-6和TNF-α等炎性因子的分泌, 从而发挥抗炎活性。因此, 在采用光热疗法消融肿瘤的同时联用18β-GA抑制光热所引发的炎性反应的策略有望改善目前光热疗法受到炎性反应制约的现状, 提升肿瘤光热治疗的效率。
与传统的治疗手段相比, 纳米技术是目前受到广泛重视、且具有广阔前景的抗肿瘤手段[27], 构建具有协同光热治疗与抗炎功效的肿瘤靶向纳米递药系统对于提高肿瘤治疗效果具有重要的意义。纳米递药系统可利用肿瘤增强的渗透及滞留(enhanced permeability and retention, EPR) 效应富集于肿瘤部位[28, 29]。因此, 为实现IR-780及18β-GA的肿瘤靶向性递送, 如图 1所示, 本研究以还原敏感连接物3, 3'-二硫代二丙酸(DA) 键合疏水性18β-GA和甲氧基-聚乙二醇-氨(mPEG-NH2) 得到还原敏感两亲性聚合物PEG-DA-GA, 并包载光热剂IR-780, 得到还原敏感胶束型纳米粒PDG/IR-780 NPs, 对其进行了理化性质表征并在小鼠4T1原位三阴性乳腺癌模型中初步评价了其抗肿瘤效果。
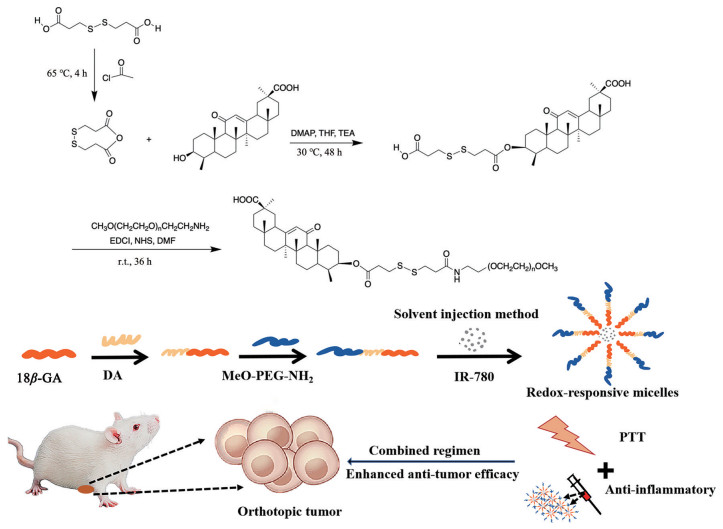
|
Figure 1 Schematic illustration of the construction of redox-responsive polymer micelle PDG/IR-780 NPs and the enhanced anti-tumor efficiency of the combined regimen of IR-780 and 18β-glycyrrhetinic acid (18β-GA). DA: 3, 3'-Dithio-dipropionic acid; Meo-PEG-NH2: Methoxy-PEG-amine; PTT: Photothermal therapy |
试剂与材料 18β-GA、DA、辛二酸(美国Sigma-Aldrich公司); 甲氧基-聚乙二醇-NH2 (北京键凯科技股份有限公司); 1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDCI)、N-羟基琥珀酰亚胺(NHS) (北京百灵威科技有限公司); 四氢呋喃(THF, 超干燥, 安耐吉化学公司); N, N-二甲基甲酰胺(DMF)、三乙胺(TEA) (天津致远化学试剂有限公司); 乙酰氯(上海阿拉丁生化科技股份有限公司)。
主要仪器 微量电子天平(BT 25 S, 德国Sartorius公司); 恒温磁力搅拌器(85-2型, 上海司乐仪器有限公司); 真空冷冻干燥机(FreeZone 2.5L, 美国Labconco公司); 恒温空气摇床(ZHWY-100B, 上海智城医疗仪器厂); 激光粒度仪(Sizer Nano ZS90, 英国Marlvern公司); 多功能酶标仪(Varioskan Flash Multimode Reader, 美国Thermo Fisher公司); 冰冻切片机(CM1950, 德国Leica公司)。
实验细胞 小鼠乳腺癌细胞(4T1) 购自中国科学院典型培养物保藏委员会细胞库, 采用含10%胎牛血清和1%青链霉素混合液的1640培养基, 在37 ℃、含5% CO2的无菌孵箱中进行培养。
实验动物 雌性BALB/c小鼠(18~22 g, 4~6周龄), 购自成都达硕实验动物有限公司, 生产许可证号: SCXK (川) 2020-030, 实验动物质量合格证号: No. 51203500020484。所有动物实验遵循四川大学伦理委员会制定的伦理学要求。
PEG-DA-GA的合成
DA-GA的合成 称取DA 2.8 g, 与28 mL乙酰氯共置于100 mL圆底烧瓶中, 于65 ℃油浴中回流4 h。反应液冷却至室温后, 采用水浴旋蒸除去过量乙酰氯。随后, 将粗产物加入到过量的冷乙醚(100 mL) 中, 静置1 h。抽滤后产物用冷乙醚洗3次, 真空干燥得到酸酐。称取18β-GA 169.7 mg、酸酐300.0 mg和4-二甲氨基吡啶(DMAP) 21.8 mg, 溶解于3 mL THF中并加入酸酐的1.5倍摩尔量TEA, 移入10 mL的圆底烧瓶中, 于30 ℃油浴下, 搅拌反应48 h。反应结束后, 粗产物用硅胶柱层析进行纯化, 通过真空干燥获得产物DA-GA。随后, 将辛二酸(SA) 作为非还原敏感的对照连接物, 采用相同方法合成非还原敏感对照产物SA-GA。
PEG-DA-GA的合成 称取DA-GA 4.0 mg、EDCI 5.8 mg和NHS 3.5 mg, 溶解于2 mL、DMF中, 加入相当于EDCI的1.2倍当量的TEA, 室温搅拌, 反应5~6 h。随后, 称取mPEG-NH2 30.8 mg, 溶解于1 mL DMF后缓慢滴加到上述反应溶液中, 于室温条件下, 搅拌反应36 h。反应结束后, 将反应液缓慢滴入体积比为1∶20的去离子水中, 搅拌30 min后, 转移至透析袋(MWCO 5 000 Da) 中。透析48 h后, 冻干即得产物PEG-DA-GA。随后, 采用相同方法合成非还原敏感的对照产物PEG-SA-GA。
纳米粒的制备 采用溶剂注入法制备胶束型纳米粒。首先, 称取PEG-DA-GA材料5.0 mg, 溶解于100 μL THF, 在搅拌条件下缓慢滴加到20倍体积的磷酸盐缓冲液(PBS, pH 7.4) 中, 室温搅拌30 min以上。随后旋转蒸发除去THF, 并将溶液体积进行浓缩, 即得PEG-DA-GA (PDG) NPs。为进行IR-780的包载, 按照载体材料与IR-780的质量比为55∶1的比例通过上述THF溶剂注入法制备纳米粒, 并通过0.22 μm微孔滤膜进行过滤, 旋转蒸发除去THF, 浓缩溶液体积, 即得PDG/IR-780 NPs。之后, 于激光粒度仪下采用动态光散射(DLS) 法对所制备的纳米粒进行粒径分布情况测定。同法制备非还原敏感对照纳米粒(PSG/IR-780 NPs)。
血清稳定性考察 采用浊度法考察各纳米粒的血清稳定性。将进口胎牛血清(FBS) 经0.22 μm微孔滤膜过滤, 再将制备得到的纳米粒(PDG NPs及PDG/IR-780 NPs) 分别与FBS按体积比1∶1混匀, 并于37 ℃、70 r·min-1摇床中进行孵育, 同时采用去离子水作为空白对照, 将等体积的PBS与FBS进行混匀, 作为阴性对照。在不同时间点(0、2、4、8、12和24 h) 分别取样150 μL置于96孔板中, 于酶标仪750 nm处测定吸光度值(A), 按公式(1) 计算透光率(T), 并绘制透光率曲线。
| $ T\left(\mathrm{\%}\right)={10}^{{A}_{\mathrm{对}\mathrm{照}\mathrm{吸}\mathrm{光}\mathrm{度}}-{A}_{\mathrm{样}\mathrm{品}\mathrm{吸}\mathrm{光}\mathrm{度}}}\times 100\mathrm{\%} $ | (1) |
稳定性考察 将5 mL制备好的纳米粒放置于4 ℃冰箱, 分别于第0、2和7天采用激光粒度仪测定粒径, 以考察各纳米粒的4 ℃稳定性。
溶血性考察 首先, 自健康雌性BALB/c小鼠眼眶取全血0.5 mL, 1 500 r·min-1离心5 min后弃去上清, 得到红细胞沉淀。用PBS (pH 7.4) 洗涤沉淀3次, 再取适量PBS (pH 7.4) 重悬, 即得2%红细胞悬液(每毫升约20 μL红细胞)。用PBS将PDG NPs和PDG/IR-780 NPs稀释, 加入等体积2%红细胞悬液, 充分混匀。以经PBS稀释的红细胞悬液作为阴性对照。在摇床中于37 ℃条件下, 75 r·min-1孵育8 h, 期间于不同时间点(0.5、1、2和3 h) 经1 500 r·min-1离心5 min后取上清液100 μL, 采用酶标仪于540 nm波长下测定A, 按公式(2) 计算溶血率(H)。
| $ H (\%) = A_{样品} / (A_{{\rm{water}}} - A_{{\rm{PBS}}}) × 100\%$ | (2) |
还原敏感性考察 按上述方法制备还原敏感的PDG/IR-780 NPs和作为非还原敏感对照的PSG/IR-780 NPs, 浓度为5 mg·mL-1, 在10 mmol·L-1二硫苏糖醇(DTT) 条件下进行孵育, 12 h后分别取孵育后的PDG/IR-780 NPs与PSG/IR-780 NPs, 于激光粒度仪下测定其粒径分布情况, 以考察其还原敏感性能。
细胞摄取情况考察 按上述方法培养4T1细胞, 以细胞数1×105个/孔接种于6孔板中, 于37 ℃、5% CO2条件下培养24 h以达到合适密度。随后, 弃去培养基, 将细胞在含不同制剂(游离制剂free DiD、还原敏感纳米粒PDG/DiD NPs、非还原敏感纳米粒PSG/DiD NPs) 的无血清培养基中孵育1或3 h, 每孔1 mL培养基。孵育结束后, 将各孔细胞用PBS洗3次, 用0.25%胰蛋白酶进行消化, 于2 000 r·min-1离心3 min, 用PBS洗涤后重悬细胞并进行流式测定。
细胞毒性考察 采用MTT法考察所制备的纳米粒对4T1细胞的细胞毒性。首先, 4T1细胞按照3×103个/孔的密度接种于96孔板, 每孔200 μL培养基, 以不接种细胞的孔作为阴性对照, 置于37 ℃、含5% CO2的细胞培养箱中, 培养24 h。24 h后弃去培养基, 将游离18β-GA、PDG/IR-780 NPs及PSG/IR-780 NPs用无血清培养基稀释为不同浓度, 每孔加入180 μL, 并进行激光照射(808 nm, 0.5 W·cm2, 3 min)。以仅与无血清培养基孵育的细胞孔作为阳性对照。孵育24 h后配制MTT溶液: 称取MTT粉末, 溶解于无菌PBS, 配制为5.0 mg·mL-1, 并采用一次性无菌滤头进行过滤。随后, 每孔加入5.0 mg·mL-1 MTT溶液各20 μL, 继续孵育4 h。之后弃去培养基, 每孔各加入DMSO 150 μL, 于37 ℃摇床, 75 r·min-1下振摇20 min, 在酶标仪570 nm处测定各组A, 并按公式(3) 计算细胞的存活率(CV)。
| $ {\rm{CV}} (\%) = (A_{样品} - A_{阴性对照}) / (A_{阳性对照} - A_{阴性对照}) × 100\% $ | (3) |
4T1原位乳腺肿瘤小鼠模型的建立 培养4T1细胞至细胞融合度为90%时, 消化收集细胞。经细胞计数仪计数后, 调整细胞浓度。采用1%戊巴比妥钠对BALB/c小鼠进行麻醉, 待小鼠的翻正反应消失后, 将小鼠第二乳垫部位的毛发刮净, 按细胞数1×106个/只将4T1细胞悬液接种于小鼠乳垫部位。随后, 隔日观察小鼠肿瘤体积增长情况。
ELISA炎性因子检测 按上述方法建立荷4T1原位乳腺肿瘤的小鼠模型, 待肿瘤体积长至50~100 mm3时, 将小鼠随机分为4组: PBS、PSG NPs、PSG/IR-780 NPs和PDG/IR-780 NPs, 并进行给药及激光照射(808 nm、0.5 W·cm2, 3 min, IR-780, 0.5 mg·kg-1), 每隔2天给药1次, 共给药4次。给药结束3天后, 收集各组小鼠的肿瘤组织, 加入pH 7.4的PBS, 进行组织匀浆。随后, 于3 000 r·min-1下离心20 min。收集上清, 并采用TNF-α及IL-6 ELISA试剂盒进行测定。
抗肿瘤治疗实验 按上述方法建立荷4T1原位乳腺肿瘤的小鼠模型, 待肿瘤体积长至50~100 mm3时, 将小鼠随机分为5组: PBS、free GA、PDG NPs、PSG/IR-780 NPs和PDG/IR-780 NPs, 并进行给药及激光照射(808 nm、0.5 W·cm2, 3 min, IR-780, 0.5 mg·kg-1), 每隔2天给药1次, 共给药4次。同时, 隔天监测并记录各组小鼠的肿瘤体积和体重的变化情况。在第24天时, 处死各组小鼠并收集肿瘤组织, 进行拍照及称重。
统计学分析 使用GraphPad Prism 6.0软件进行分析, 数据用
按照上述步骤合成DA-GA材料, 称取18β-GA及DA-GA样品粉末各5.0 mg, 分别溶于100 μL甲醇, 采用红外光谱仪对其进行红外光谱测定, 结果如图 2所示。在GA的红外光谱(图 2A) 中, 于1 645.36 cm-1处出现羧基峰为明显的GA特征峰。在DA-GA的红外光谱(图 2B) 中, 出现明显的GA特征峰, 同时在1 731.14 cm-1处也出现明显的酯基峰为DA特征峰, 表明DA-GA合成成功。另外, mPEG-NH2的红外光谱如图 2C所示。对比图 2B中的DA-GA及图 2C中的mPEG-NH2的红外光谱图, 在图 2D中可明显看到DA-GA在1 731.14的特征峰及在1 089.24 cm-1处为基团CH2CH2O中碳碳不对称伸缩振动的强吸收峰为mPEG-NH2特征峰, 表明PEG-DA-GA材料的成功合成。
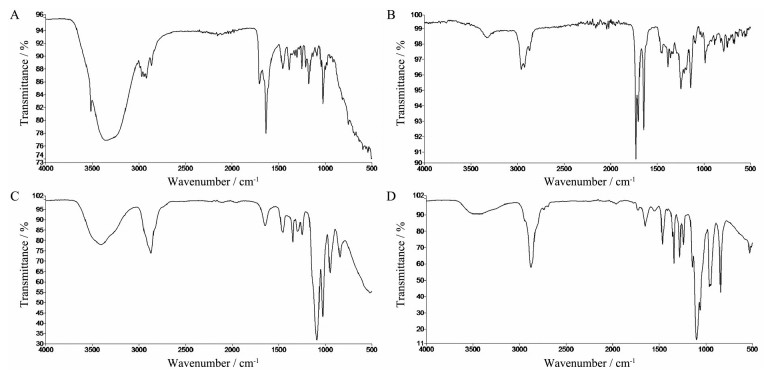
|
Figure 2 Infrared spectrum of GA (A), DA-GA (B), PEG (C) and PEG-DA-GA (D), respectively |
首先, 以THF为溶剂, 采用溶剂注入法制备PDG NPs及PDG/IR-780 NPs。随后, 采用马尔文激光粒度仪经DLS法测定各纳米粒的粒径分布情况。如表 1所示, PDG NPs的粒径为75.9 ± 4.3 nm, 多分散指数(PDI) 为0.194 ± 0.098。包载IR-780后, PDG/IR-780 NPs的粒径为80.2 ± 5.3 nm, PDI为0.215 ± 0.079, 与PDG NPs相比, 粒径略有增加。从图 3的粒径分布图可知, 所制备的PDG NPs及PDG/IR-780 NPs的粒径较为均一。
|
Table 1 Particle size distribution of PDG NPs and PDG/IR-780 NPs (n = 3, |
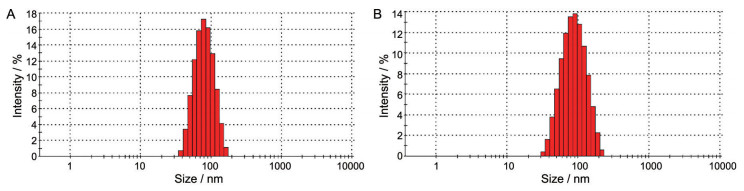
|
Figure 3 The particle size distribution of PDG NPs (A). The particle size distribution of PDG/IR-780 NPs (B) |
通过浊度法及粒径法评价了所制备的PDG NPs及PDG/IR-780 NPs在50% FBS中的稳定性。结果分别如图 4A、B所示, PDG NPs和PDG/IR-780 NPs与50% FBS孵育后, 在24 h内, 透光率始终保持在90%以上; 在50% FBS中孵育24 h, 粒径均无明显变化, 表明所制备纳米粒均具有良好的血清稳定性。
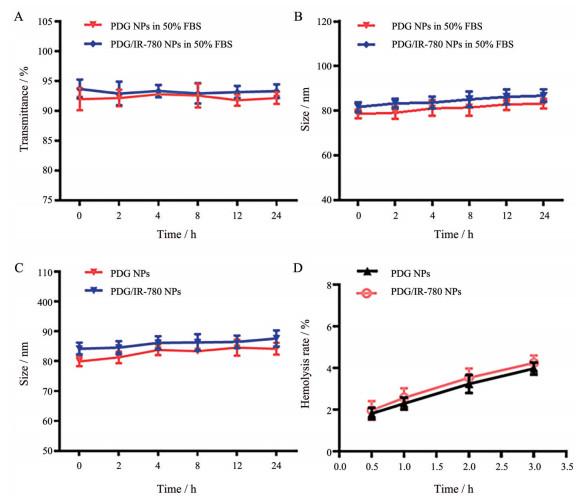
|
Figure 4 A: Determination of the serum stability of different NPs in 50% FBS using turbidimetric method. B: The particle size variation of PDG NPs and PDG/IR-780 NPs at different time points after stored under 4 ℃. C: The hemolysis rates of PDG NPs and PDG/IR-780 NPs at various time points. n = 3, |
进一步考察了纳米粒的4 ℃稳定性。实验结果如图 4C所示, 在4 ℃环境下, PDG NPs和PDG/IR-780 NPs在24 h内的粒径基本无明显变化, 表明纳米粒在4 ℃下均有良好的稳定性。
PSG/IR-780 NPs及PDG/IR-780 NPs的溶血率随时间变化的曲线如图 4D所示, 结果显示2种纳米粒在3 h内的溶血率均低于5%, 在体外未观察到明显溶血[30]。
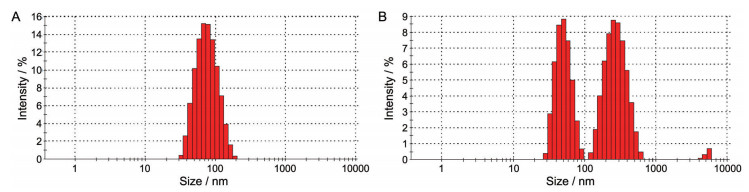
4 PDG/IR-780 NPs的还原敏感降解性由于肿瘤细胞内存在丰富的谷胱甘肽(glutathione, GSH) 2~10 mmol·L-1, 因此, 可利用该特征设计还原敏感的纳米载体, 从而促进药物的释放及抗肿瘤疗效。研究表明, GSH可通过巯基与二硫键之间的交换反应使含有二硫键的还原敏感连接物DA被切断, 从而促进含DA的纳米载体的解体。本实验中, 采用10 mmol·L-1 DTT来模拟细胞内的还原敏感环境, 然后考察还原敏感的PDG/IR-780 NPs及对照组非还原敏感的PSG/IR-780 NPs的降解情况。结果如图 5所示, 图 5A中非还原敏感PSG/IR-780 NPs在10 mmol·L-1 DTT环境中孵育后粒径分布保持均一, 表明还原敏感条件无法促进PSG/IR-780 NPs的解体, 而在图 5B中10 mmol·L-1 DTT孵育后, PDG/IR-780 NPs的粒径分布发生明显变化, 表明PDG/IR-780 NPs在还原敏感环境中发生了解体, 且其还原敏感特性是由具有二硫键的连接物DA所导致的。从表 2中可见, PDG/IR-780 NPs组的PDI发生明显增大, 说明其具有还原敏感的特性, 而因为还原敏感组降解后粒径有大有小, 所以平均粒径仅增加了几十纳米。
|
Figure 5 A: The particle size distribution of PSG/IR-780 NPs after incubated in 10 mmol·L-1 dithiothreitol (DTT) environment. B: The particle size distribution of PDG/IR-780 NPs after incubated in 10 mmol·L-1 DTT environment |
|
Table 2 Particle size distribution of PDG NPs and PDG/IR-780 NPs (n = 3, |
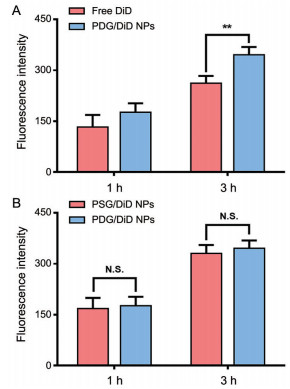
选用三阴性乳腺癌4T1细胞为模型细胞, 考察其对不同制剂的摄取情况。如图 6A所示, 与free DiD组相比, 在3 h时PDG/DiD NPs组的荧光强度明显提高, 表明PDG NPs能显著促进游离药物进入4T1细胞。如图 6B所示, 非还原敏感的PSG/DiD NPs与还原敏感的PDG/DiD NPs的细胞摄取水平在1及3 h时均无明显差异, 表明PSG NPs与PDG NPs的入胞能力相近。
|
Figure 6 The cell uptake assay of free DiD, redox-responsive PDG/DiD NPs and non-redox-responsive PSG/DiD NPs under flow cytometry. n = 3, |
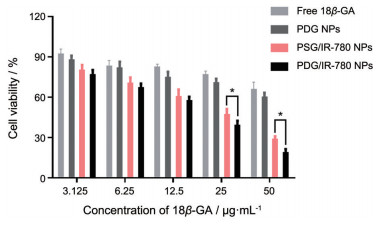
通过MTT实验考察不同制剂对4T1细胞的细胞毒性。实验结果如图 7所示, 各给药组的细胞存活率均随给药浓度的增加而降低。还原敏感PDG/IR-780 NPs组的细胞存活率显著低于非还原敏感的PSG/IR-780 NPs组, 表明该还原敏感纳米粒可响应胞内高GSH水平释放药物, 促进对4T1细胞的杀伤。PDG/IR-780 NPs在18β-GA质量浓度为3.125 μg·mL-1时, 细胞的存活率为(77.30 ± 2.38) %。当18β-GA质量浓度升高至50 μg·mL-1后, 细胞的存活率降低为(19.29 ± 1.80) %。非还原敏感的PSG/IR-780 NPs组不具还原敏感能力, 难以有效释放药物杀伤肿瘤细胞, 因此4T1细胞的细胞存活率更高, 在18β-GA质量浓度为50 μg·mL-1时, 细胞的存活率为(29.30 ± 1.37) %。
|
Figure 7 The cell viability of 4T1 cells after treated with various formulations detected by MTT assay. n = 3, |
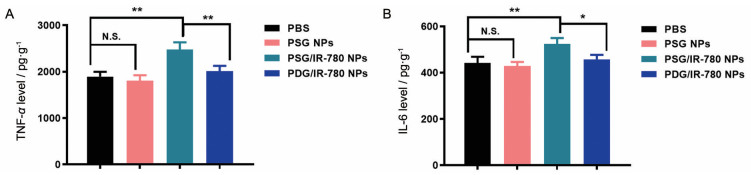
经PSG/IR-780 NPs给药及激光照射后, 肿瘤部位的炎性因子TNF-α及IL-6的分泌水平明显上升(图 8)。同时, 与PBS组相比, PSG NPs组的TNF-α和IL-6的分泌水平无明显变化, 表明光热是引起TNF-α和IL-6上调的主要原因。此外, PDG/IR-780 NPs组的TNF-α和IL-6的分泌水平与PSG/IR-780 NPs组相比显著性下降, 表明PDG/IR-780 NPs由还原敏感特性释放的GA能有效缓解光热治疗所导致的炎症反应。
|
Figure 8 ELISA results about the inflammatory factors of tumor necrosis factor-α (TNF-α) and interleukin-6 (IL-6) after various treatments. n = 3, |
为考察PDG NPs对疏水性药物的肿瘤靶向递送能力, 采用DiD作为荧光探针, 以尾静脉注射方式进行给药, 并于24 h后处死小鼠, 收集小鼠的肿瘤组织, 进行冰冻切片考察。肿瘤冰冻切片的共聚焦成像结果如图 9所示, 在24 h时, free DiD组的肿瘤冰冻切片中DiD的荧光十分微弱, 表明游离DiD难以有效蓄积于肿瘤组织。同时, PDG/DiD NPs在肿瘤组织中具有很强的荧光分布, 这是由于乳腺癌具有比较明显的EPR效应[31], PDG NPs可利用EPR效应被动靶向分布至肿瘤部位。上述结果表明, PDG NPs可有效提高疏水药物在4T1原位肿瘤组织中的分布。
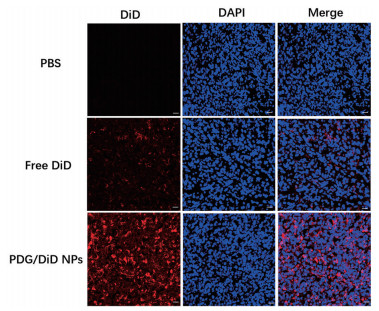
|
Figure 9 The fluorescence distribution of various formulations in the frozen sections of 4T1 tumors observed under confocal microscope. Scale bar represents 20 μm |
建立4T1原位乳腺癌小鼠模型, 以考察不同制剂的抗肿瘤效果。图 10A表明, PBS组小鼠的肿瘤体积增长速度最快。同时, 图 10B、C也表明, free 18β-GA对肿瘤增殖虽有一定抑制作用, 但效果不佳。将18β-GA载于胶束后, 对肿瘤的抑制效果有所提升, 这可能是因为PDG NPs能通过EPR效应促进对疏水性18β-GA的肿瘤靶向递送所致。另外, 相比于非还原敏感的PSG/IR-780 NPs组, 还原敏感的PDG/IR-780 NPs组的肿瘤抑制效果显著提升, 相较于其他组表现出了最佳抗肿瘤效果, 这可能是PDG/IR-780的还原敏感特性促进药物释放所致。图 10D中的肿瘤重量结果同样表明PDG/IR-780 NPs具有最佳的抗肿瘤效果。此外, 由图 10E中小鼠体重变化情况可知, 各制剂组小鼠体重均呈缓慢上升趋势, 初步表明各制剂对荷瘤小鼠无明显不良反应。
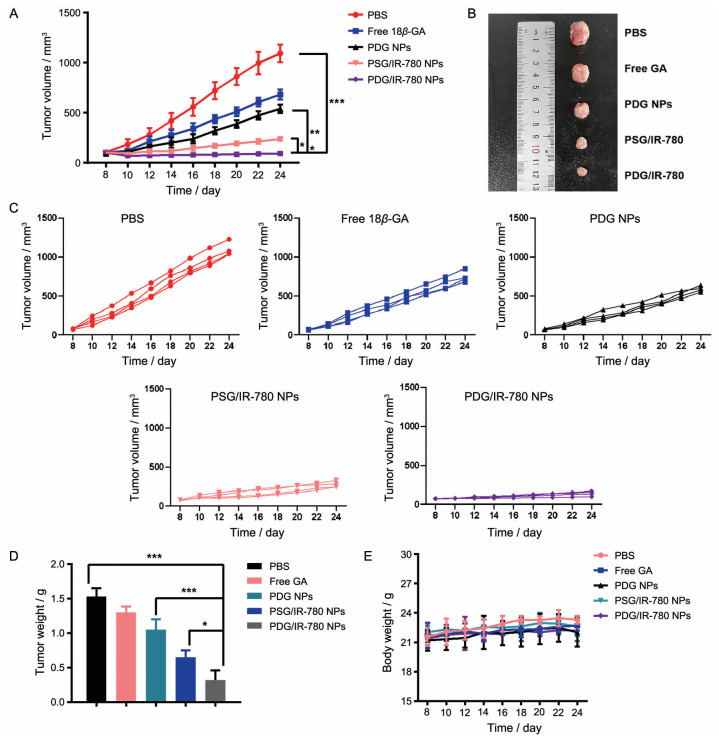
|
Figure 10 A: The tumor growth curves of mice in various groups. B: The tumor photos of mice in various groups after therapy. C: The tumor volume growth curve of mice in PBS group, free 18β-GA group, PDG NPs group, PSG/IR-780 NPs group and PDG/IR-780 NPs group, respectively. D: The tumor weight of mice in various groups at the end of therapy. E: The change curves of the body weight of mice during therapy. n = 3, |
进一步通过对肿瘤组织进行H&E染色和TUNEL染色, 考察各制剂组肿瘤细胞的凋亡和组织的坏死情况。如图 11所示, PDG/IR-780 NPs组的肿瘤切片中可观察到最大面积的细胞坏死区域和最明显的细胞凋亡现象, 表明PDG/IR-780 NPs具有最强的杀伤肿瘤细胞的能力。
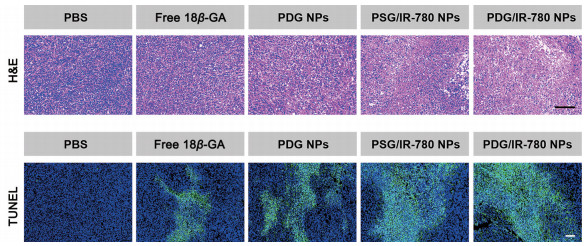
|
Figure 11 H&E staining and TUNEL staining results of tumor tissue sections in various groups at the end of therapy. Scale bars represent 100 μm (H&E) and 50 μm (TUNEL), respectively |
对各组小鼠的主要脏器经石蜡切片后进行H&E染色, 以考察各制剂(PBS、18β-GA、PDG NPs、PSG/IR-780 NPs、PDG/IR-780 NPs) 对荷瘤小鼠主要脏器的毒性情况。结果表明, 各组制剂与PBS组相比无明显差异, 说明各制剂组的小鼠的心、肝、脾、肺及肾均未出现明显的病理变化, 初步表明各制剂对荷瘤小鼠未产生明显的不良反应。
结论本课题以还原敏感连接物DA键合疏水性抗炎药物18β-GA和亲水片段mPEG-NH2得到还原敏感两亲性聚合物, 并包载光热剂IR-780, 制备得到还原敏感胶束性纳米粒PDG/IR-780 NPs。随后, 对该纳米粒进行了表征、基本性质考察及体内外抗肿瘤实验。实验结果表明, 本课题构建的PDG/IR-780 NPs稳定性良好, 体外无明显溶血, 具有明显的还原敏感降解能力, 体外能显著降低4T1细胞存活率, 且能提高疏水性药物的肿瘤组织分布, 并通过光热剂IR-780与18β-GA的联用策略在三阴性乳腺癌4T1肿瘤模型中体现出良好的抑瘤效果。本课题构建的PDG NPs, 可为多种类型的疏水性药物提供一种通用的还原敏感性纳米递送平台。同时, 本课题针对光热疗法受炎症反应制约的现状, 提出将光热剂IR-780及抗炎药物18β-GA进行共递送的抗肿瘤策略, 为高效的肿瘤光热治疗提供了更多的可能。
作者贡献: 白文静负责实验设计和开展, 以及论文撰写; 夏春玉和李曼参与实验设计; 卢正则参与论文修改; 何勤进行实验评估和指导。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Muhanna N, Jin S, Huynh E, et al. Photo-theranostic porphyrin nanoparticles enable visualization and targeted treatment of head and neck cancer in clinically relevant models[J]. Theranostics, 2015, 5: 1428-1443. DOI:10.7150/thno.13451 |
| [2] |
Yang D, Choi W, Yoon H, et al. Real-time phase-contrast imaging of photothermal treatment of head and neck squamous cell carcinoma: an in vitro study of macrophages as a vector for the delivery of gold nanoshells[J]. Biomed Opt, 2012, 17: 128003. DOI:10.1117/1.JBO.17.12.128003 |
| [3] |
Zheng H, Siddharth S, Parida S, et al. Tumor microenvironment: key players in triple negative breast cancer immunomodulation[J]. Cancers, 2021, 13: 3357. DOI:10.3390/cancers13133357 |
| [4] |
Wang Y, Liu T, Zhang E, et al. Preferential accumulation of the near infrared heptamethine dye IR-780 in the mitochondria of drug-resistant lung cancer cells[J]. Biomaterials, 2014, 35: 4116-4124. DOI:10.1016/j.biomaterials.2014.01.061 |
| [5] |
Yuan A, Wu J, Tang X, et al. Application of near-infrared dyes for tumor imaging, photothermal, and photodynamic therapies[J]. J Pharm Sci, 2013, 102: 6-28. DOI:10.1002/jps.23356 |
| [6] |
Zhang L, Zhang Y, Xue Y, et al. Transforming weakness into strength: photothermal-therapy-induced inflammation enhanced cytopharmaceutical chemotherapy as a combination anticancer treatment[J]. Adv Mater, 2019, 31: 1805936. |
| [7] |
Balkwill F, Charles KA, Mantovani A, et al. Smoldering and polarized inflammation in the initiation and promotion of malignant disease[J]. Cancer Cell, 2005, 7: 211-217. DOI:10.1016/j.ccr.2005.02.013 |
| [8] |
Jin K, Luo ZM, Zhang B, et al. Biomimetic nanoparticles for inflammation targeting[J]. Acta Pharm Sin B, 2018, 8: 23-33. DOI:10.1016/j.apsb.2017.12.002 |
| [9] |
Guo YW, Zhang XY, Zhao ZY, et al. NF-κB/HDAC1/SREBP1c pathway mediates the inflammation signal in progression of hepatic steatosis[J]. Acta Pharm Sin B, 2020, 10: 825-836. DOI:10.1016/j.apsb.2020.02.005 |
| [10] |
Melamed JR, Edelstein RS, Day ES. Elucidating the fundamental mechanisms of cell death triggered by photothermal therapy[J]. ACS Nano, 2015, 9: 6-11. DOI:10.1021/acsnano.5b00021 |
| [11] |
Xie X, Gao W, Hao J, et al. Self-synergistic effect of prussian blue nanoparticles for cancer therapy: driving photothermal therapy and reducing hyperthermia-induced side effects[J]. Nanobiotechnology, 2021, 19: 126. DOI:10.1186/s12951-021-00819-2 |
| [12] |
Yu QW, Tang X, Zhao W, et al. Mild hyperthermia promotes immune checkpoint blockade-based immunotherapy against metastatic pancreatic cancer using size-adjustable nanoparticles[J]. Acta Biomater, 2021, 7: 244-256. |
| [13] |
Balkwill F, Mantovani A. Inflammation and cancer: back to virchow[J]. Lancet, 2001, 357: 539-545. DOI:10.1016/S0140-6736(00)04046-0 |
| [14] |
Germano G, Allavena P, Mantovani A. Cytokines as a key component of cancer-related inflammation[J]. Cytokine, 2008, 43: 374-379. DOI:10.1016/j.cyto.2008.07.014 |
| [15] |
Elinav E, Nowarski R, Thaiss CA, et al. Inflammation-induced cancer: crosstalk between tumours, immune cells and microorganisms[J]. Nat Rev Cancer, 2013, 13: 759. DOI:10.1038/nrc3611 |
| [16] |
Fedyaeva AV, Stepanov AV, Lyubushkina IV, et al. Heat shock induces production of reactive oxygen species and increases inner mitochondrial membrane potential in winter wheat cells[J]. Biochemistry, 2014, 79: 1202-1210. |
| [17] |
Slimen IB, Najar T, Ghram A, et al. Reactive oxygen species, heat stress and oxidative-induced mitochondrial damage. A review[J]. Int J Hypertherm, 2014, 30: 513-523. DOI:10.3109/02656736.2014.971446 |
| [18] |
Greten FR, Eckmann L, Greten TF, et al. IKKβ links inflammation and tumorigenesis in a mouse model of colitis-associated cancer[J]. Cell, 2004, 118: 285-296. DOI:10.1016/j.cell.2004.07.013 |
| [19] |
Tang Y, Hua SC. Immunological approaches towards cancer and inflammation: a cross talk[J]. Front Immunol, 2018, 9: 563. DOI:10.3389/fimmu.2018.00563 |
| [20] |
Hasan SK, Khan R, Ali N, et al. 18β Glycyrrhetinic acid alleviates 2-acetylaminofluorene-induced hepatotoxicity in Wistar rats: role in hyperproliferation, inflammation and oxidative stress[J]. Human Exp Toxicol, 2015, 34: 628-641. DOI:10.1177/0960327114554045 |
| [21] |
Ni YF, Kuai JK, Lu ZF, et al. Glycyrrhizin treatment is associated with attenuation of lipopolysaccharide-induced acute lung injury by inhibiting cyclooxygenase-2 and inducible nitric oxide synthase expression[J]. J Surgical Res, 2011, 165: e29-e35. DOI:10.1016/j.jss.2010.10.004 |
| [22] |
Mahmoud AM, Al Dera HS. 18β-Glycyrrhetinic acid exerts protective effects against cyclophosphamide-induced hepatotoxicity: potential role of PPARgamma and Nrf2 up-regulation[J]. Genes Nutr, 2015, 10: 41. DOI:10.1007/s12263-015-0491-1 |
| [23] |
Jayasooriya RG, Dilshara MG, Park SR, et al. 18β-Glycyrrhetinic acid suppresses TNF-α induced matrix met-alloproteinase-9 and vascular endothelial growth factor by suppressing the Akt-dependent NF-κB pathway[J]. Toxicol In Vitro, 2014, 28: 751-758. DOI:10.1016/j.tiv.2014.02.015 |
| [24] |
Richard SA. Exploring the pivotal immunomodulatory and anti-inflammatory potentials of glycyrrhizic and glycyrrhetinic acids[J]. Mediators Inflamm, 2021. DOI:10.1155/2021/6699560 |
| [25] |
Wang YM, Du GQ. Glycyrrhizic acid prevents enteritis through reduction of NF-κB p65 and p38MAPK expression in rat[J]. Mol Med Rep, 2016, 13: 3639-3646. DOI:10.3892/mmr.2016.4981 |
| [26] |
Liu Z, Zhong JY, Gao EN, et al. Effects of glycyrrhizin acid and licorice flavonoids on LPS-induced cytokines expression in macrophage[J]. Chin J Chin Mater Med (中国中药杂志), 2014, 39: 3841-3845. |
| [27] |
Yin XL, Zhang B, Liu YJ, et al. Advances in polymer-drug conjugated micelles in the delivery of anticancer drugs[J]. Acta Pharm Sin (药学学报), 2016, 51: 710-716. |
| [28] |
Tang JJ, Mei L, Yu QW, et al. Construction of self-assembled micelles containing indocyanine green and polyxorubicin and evaluation of its antitumor and metastasis in vitro[J]. Acta Pharm Sin (药学学报), 2017, 52: 1933-1941. |
| [29] |
Venkatesan P, Puvvada N, Dash R, et al. The potential of celecoxib-loaded hydroxyapatite-chitosan nanocomposite for the treatment of colon cancer[J]. Biomaterials, 2011, 32: 3794-3806. |
| [30] |
Maeda H, Nakamura H, Fang J. The EPR effect for macromolecular drug delivery to solid tumors: improvement of tumor uptake, lowering of systemic toxicity, and distinct tumor imaging in vivo[J]. Adv Drug Deliv Rev, 2013, 65: 71. DOI:10.1016/j.addr.2012.10.002 |
| [31] |
Yhee JY, Son S, Son S, et al. The EPR effect in cancer therapy[M]//Bae Y, Mrsny R, Park K (eds). Cancer Targeted Drug Delivery. New York: Springer, 2013.
|
 2022, Vol. 57
2022, Vol. 57


