高通量筛选及组合化学技术的出现推动了新药开发的进展, 同时也暴露了那些具有潜在成药性的化合物存在的问题。据统计, 在新药开发过程中, 超过40%的药物水溶性差, 导致口服给药后的吸收波动大、生物利用度低。这些问题在临床应用上都面临着巨大的挑战[1, 2]。
随着纳米晶体在化工、印刷、食品和生物等行业的广泛应用, 20世纪末, 纳米晶体技术在制药业也逐渐得到应用。近年来, 国内外学者对于药物纳米晶体的研究也越来越多, 且已有纳米晶体药物上市[3]。通过降低原料药的粒径来改变药物的理化性质, 这为改善水难溶性药物的溶解性提供了新的思路。在降低药物粒径的技术中, 纳米技术的开发与应用发挥着重要作用。本文介绍了药物纳米晶体的制备方法与应用, 分析了不同制备方法的优缺点, 讨论了药物纳米晶体从实验室制备到产业化放大过程中需要注意的问题, 最后, 对药物纳米晶体研究领域存在的问题以及相应的解决思路进行了总结与展望。
1 药物纳米晶体的研究意义国际上常用的药物分类系统包括生物药剂学分类系统(biopharmaceutic classification system, BCS) 和药物可开发性分类系统(developability classification system, DCS) 两大类。BCS分类系统又根据药物的溶解度和膜渗透性再分为四类, 分别为Ⅰ类(高溶解度和高渗透性)、Ⅱ类(低溶解度和高渗透性)、Ⅲ类(高溶解度和低渗透性) 和Ⅳ类(低溶解度和低渗透性)[4]。2010年, Butler等[5]在BCS分类系统基础上提出了针对口服药物的DCS分类系统, 这一分类系统更能体现药物的溶解度对其体内吸收的影响。依照DCS分类原则, 又将溶解度低但高渗透性的化合物分为DCS IIa类和DCS IIb类。对于DCS IIa类化合物, 可以通过调节其溶解速率使其完全吸收, 这源于其高渗透率补偿的结果; 对于DCS IIb类化合物, 由于其溶解性差, 导致其体内吸收受到限制, 因此, 必须先设法将其溶解, 否则不会被完全吸收[6]。一般情况下, BCS Ⅱ类和Ⅳ类药物常被作为药物纳米晶体研究的模型药物。
药物纳米晶体泛指粒径小于1 000 nm的药物分子聚集体, 一般存在于混悬液中, 可通过冷冻干燥、喷雾干燥或流化床等技术将其固化后用于胶囊、片剂及其他固体剂型。对于这些剂型, 相应的给药途径有口服、注射和肺部吸入等[7]。根据Noyes-Whitney公式(1) 和Ostwald-Freundlich公式(2), 降低药物粒径能够增大药物表面积, 从而提高药物在水中的溶解度和溶出速率[8, 9]。
| $ \frac{d C}{d t}=K_{D} A \times\left(C_{S}-C_{T}\right) $ | (1) |
其中, dC/dt为溶出速度; KD为溶出常数; A为药物的表面积; CS为饱和溶解度; CT为药物浓度。
| $ \log \frac{C_{S}}{C_{\alpha}}=\frac{2 \sigma V}{2.303 R T \rho r} $ | (2) |
其中, CS是饱和溶解度; Cα是药物的溶解度; σ是物质的界面张力; V是颗粒材料的摩尔体积; R是气体常数; T是温度; ρ是密度; r是颗粒半径。
不溶性药物固体颗粒均匀地分散在水性介质中形成的纳米混悬液是一种亚稳态胶体分散系统, 通常需要加入表面活性剂或聚合物作稳定剂[2, 10]。药物纳米晶体的载药量最高甚至能达到100%, 远高于固体分散剂和脂质体等其他纳米制剂, 因此, 可以减少因使用辅料而带来的潜在毒性。疏水性药物制成纳米晶体, 通过提高药物在水中的溶解度来降低用药剂量并促进药物吸收[11]。药物纳米晶体口服进入消化道后, 多数情况下要经历先溶解再以分子形式被吸收这一过程, 也可以通过内吞途径(endocytosis) 进入细胞, 这种方式有利于药物通过肠膜转运或通过被M细胞介导的途径吸收进入淋巴管。药物纳米晶体进入细胞后可能会经历胞吞、胞吐或在细胞内运输, 只有通过内部介质传输释放到细胞外后才能增加药物的吸收[12, 13]。另外, 药物纳米晶体还具有广泛适用性, 当药物分子不能形成盐、分子质量大或具有较高的油水分配系数时, 可以通过制备药物纳米晶体解决溶解度差的问题[14]。
纳米混悬液普遍适用于水难溶性药物, 基于药物纳米晶体上市的剂型以片剂和胶囊为主[15, 16]。Zhang等[16]利用高压均质技术制备了洛伐他汀纳米晶体, 并与片剂用的赋形剂混合后, 压制成洛伐他汀速释片和缓释片。Liu等[15]采用湿磨法制备了美洛昔康纳米晶体, 将其固化后装入胶囊, 与原料药的胶囊相比, 其溶出速率明显加快。制剂研究中使用的赋形剂可以帮助药物的纳米晶体充分发挥其自身的优势, 如改善药物的溶解、释放和体内吸收。
2 药物纳米晶体的制备方法依据粒径降低的原理, 制备纳米晶体的方法分为top-down和bottom-up法, 还有将两种技术进行组合的制备方法, 见图 1所示。表 1总结了top-down和bottom-up两种技术各自的优缺点。
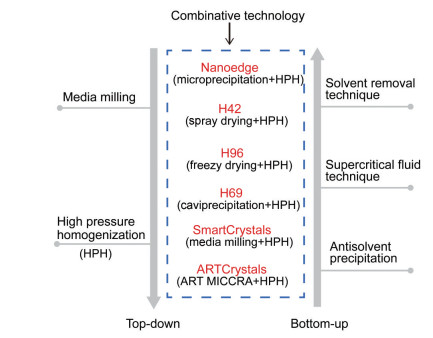
|
Figure 1 Schematic illustration on the preparation methods of drug nanocrystals for poorly water soluble drugs. ART MICCRA: A high speed rotor-stator system |
| Table 1 Advantages and disadvantages of top-down and bottom-up technology in the preparation of drug nanocrystals |
利用top-down技术制备药物纳米晶体, 其原理是依靠制备过程中产生的碰撞力、剪切力和空化作用将大颗粒物质的粒径降低至纳米级, 这一技术主要包括介质研磨法(media milling)[17]和高压均质法(high pressure homogenization, HPH)[18, 19]。介质研磨法使用的设备包括行星式球磨机和搅拌式球磨机, 其结构如图 2和图 3所示, 前者投药量少, 一般适用于小批量的实验室研究; 后者的研磨腔体积大, 研磨效率也高, 适用于放大生产[20, 21]。根据均质化原理, 高压均质法可分为微流化技术(IDD-PTM) 和活塞裂隙均化技术(DissocubesTM)。高压均质法制备的纳米晶体, 其粒子大小取决于均质压力、循环次数、温度及药物的理化性质。Zhang等[22]以100 MPa的均质压力循环15次, 得到了粒径为170.86 nm的大黄酸纳米混悬液。高压均质法不适用于硬度太大的药物, 必要时, 还需要与其他方法如反溶剂沉淀法和介质研磨法联合使用, 以便制备粒径适宜的药物纳米晶体[23, 24]。
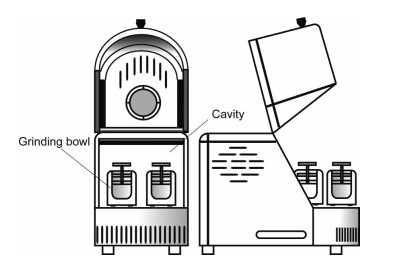
|
Figure 2 Schematic illustration on the structure of planetary ball mill machine |

|
Figure 3 Schematic illustration on the structure and working mechanism of stirring ball mill in preparation of drug nanocrystals |
Bottom-up技术包括反溶剂沉淀法(anti-solvent precipitation)[25]、超临界流体技术(supercritical fluid technique)[26]和去除溶剂法(solvent removal technique)[1, 27], 其中最常用的方法为反溶剂沉淀法。如图 4所示, 用反溶剂沉淀法制备药物纳米晶体时, 先将药物溶解在其良性溶剂中, 通常制备成饱和溶液, 然后再将所得溶液滴入含有稳定剂的药物不良溶剂中, 依靠产生的过饱和现象使药物晶体析出。药物的良溶剂与不良溶剂必须互溶, 以保证通过控制滴加速度和滴加量来达到过饱和状态。通过超声辅助和超重力控制等过程也有利于提高混合效率和析晶速度。反溶剂沉淀法制备药物纳米晶体的成本低、晶体的粒度小和粒径分布均匀, 适用于实验室研究。但是, 如果残留的有机溶剂不能完全除去, 会对人体产生危害。因此, 此法难以在工业化规模推广[2, 27]。
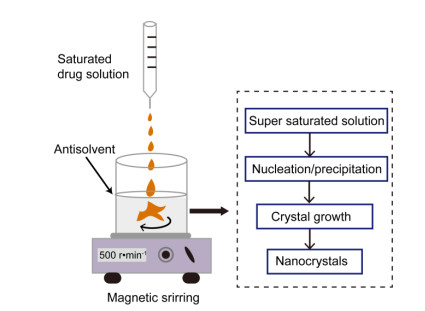
|
Figure 4 Schematic illustration on the preparation of drug nanocrystals by anti-solvent precipitation method |
原料药的初始粒径多位于几十至几百微米之间, 粒径过大的原料一般需要经过预处理。在制备药物纳米晶体时, 将两种方法结合起来能缩短粒径降低所需的时间。常见的组合技术有NanoedgeTM, 该技术将反溶剂沉淀法与高压均质法相结合, 用反溶剂沉淀法先降低药物粒径, 防止高压均质过程中粒子太大堵塞流路。组合技术还包括H42、H69、H96、SmartCrystals®和ARTcrystal®等, 具体的组合搭配见表 2[28-44]。
| Table 2 The types of combinative technology and their application in the preparation of drug nanocrystals |
为了防止药物纳米晶体制备过程中由于表面自由能增大而使粒子聚集或长大, 在top-down和bottom-up法制备时都需要加入稳定剂, 其种类包括高分子聚合物和表面活性剂。稳定剂的作用机制有两种, 分别是电荷相斥原理和空间位阻效应。两种稳定剂都需要吸附在药物粒子表面, 当两个颗粒相互靠近时, 吸附在颗粒表面的高分子聚合物型稳定剂借助其所产生的渗透压来促使颗粒分开; 带电荷的稳定剂, 无论是高分子聚合物还是表面活性剂, 都可以通过同性相斥作用来防止颗粒团聚[1, 27], 相应的工作原理如图 5所示。
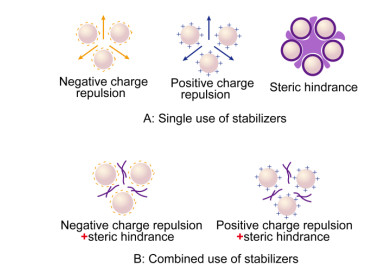
|
Figure 5 Schematic illustration on the stabilizing mechanism of different stabilizers to prevent the agglomeration of drug nanocrystals either by single or by combined use |
如何选择稳定剂, 目前还没有统一标准。稳定剂的稳定效率由多种因素决定, 包括: 稳定剂的分子质量、稳定剂溶液的黏度和浓度, 以及稳定剂与药物之间的亲和力。稳定剂的用量过少, 起不到抑制颗粒生长的作用, 用量过大又会产生增溶作用。除单一稳定剂外, 还可以将两种或两种以上稳定剂混合使用, 通过空间位阻与电荷相斥两种机制, 获得粒径更小、稳定性更高的药物纳米晶体[20, 45]。
3.1 静电排斥作用在混悬液中, 粒子间的相互作用由Derjaguin、Landau、Verwey和Overbeek四位科学家提出, 简称为DLVO理论。DLVO理论将粒子间的相互作用分为静电斥力与范德华力[46]。静电稳定是基于带电胶体粒子之间的库仑力, 带有电荷的表面活性剂吸附在药物表面形成双电层产生排斥作用, 混悬液的zeta电位的绝对值在15~30 mV左右时稳定性较好。带电荷的稳定剂如十二烷基硫酸钠(sodium dodecyl sulfate, SDS) 和脱氧胆酸钠(sodium deoxycholate, NaDC) 已经得到广泛应用。需要注意的是, 带电荷的离子型表面活性剂能通过形成胶束, 将药物溶解在其中并改变药物晶体的结构。带电荷的离子型稳定剂仅在水相中有效, 此时, 也还受到pH环境的影响。而在干燥条件下, 因不能保持电离状态而失去作用[47]。带电荷的离子型稳定剂与空间位阻型聚合物联合使用稳定效果更好。
Ma等[20]采用球磨法制备了阿齐沙坦纳米晶体, 并考察了8种稳定剂单独或复合使用对所得药物晶体的粒径和粒径分布的影响。这8种稳定剂分别是: 离子型表面活性剂SDS和NaDC、非离子表面活性剂泊洛沙姆F68和Tween 80、聚合物维生素E聚乙二醇琥珀酸酯(TPGS)、聚乙烯吡咯烷酮(polyvinyl pyrrolidone, PVP) K30及羟丙基甲基纤维素(hydroxypropyl methyl cellulose, HPMC) E5和E50。稳定剂单独使用时, 泊洛沙姆F68的效果最好, 可以得到粒径为485.3 nm的药物晶体, 将其与NaDC联合使用, 晶体的粒径降至360 nm, 并且zeta电位的绝对值达到了22.2 mV, 稳定效果显著提高, 这与NaDC的静电斥力有密切关系。
3.2 空间位阻效应空间位阻型稳定作用是基于颗粒之间存在的物理屏障, 一般由长链聚合物在药物颗粒表面形成的吸附层构成。屏障层不仅需要能牢固吸附在药物颗粒表面, 还要与溶剂有较好的亲和性, 以使分子链得以充分伸展, 防止粒子聚集。对于水难溶性药物, 可以首选两亲性稳定剂, 因为它还能增加药物的润湿性。嵌段共聚物泊洛沙姆、Soluplus®及高分子材料HPMC、TPGS、PVP等均具有空间稳定作用。非离子表面活性剂也可以通过空间位阻效应来起到稳定剂作用, 例如Tween 80。与聚合物相比, 非离子表面活性剂通常比链长相同的聚合物具有更高的吸附力。空间位阻稳定剂在水相与非水相中均能发挥作用, 由于温度会影响分子的迁移率, 因此, 这类稳定剂对温度具有一定的敏感性[48, 49]。
Oktay等[50]在制备氟比洛芬纳米混悬液时, 考察了PVP K30、HPMC、Tween 80和癸基葡萄糖苷4种稳定剂的效能。其中, PVP K30和HPMC属于高分子聚合物, Tween 80和癸基葡萄糖苷属于非离子型表面活性剂。以粒度、粒度分布和zeta电位为评价指标, 在经过为期1个月的稳定性考察后发现, 癸基葡萄糖苷的稳定效果最好, 氟比洛芬纳米混悬液的以上参数没有出现大幅度波动。
4 药物纳米晶体的产业化 4.1 实验室试制与量化生产的一致性采用bottom-up法制备药物纳米晶体, 在实验室阶段相对简单, 不需要用到复杂的设备, 但在工业化生产中, 首先要考虑的是机械化生产装备。Bottom-up法制备药物纳米晶体的原理是通过两相混合时产生的过饱和现象, 而在产业化规模实施这一过程, 不仅要有配套的专用设备, 还需要严格控制工艺, 这也是该法尚未实现产业化的原因之一。采用top-down法制备药物纳米晶体, 不论是实验室阶段, 还是中试放大和产业化过程, 所用设备的工作原理都一样。介质研磨法制备药物纳米晶体的工作模式有批量生产和连续化生产两种[18, 51]。工作模式的不同也会导致最终结果产生差异。为了使实验室阶段的结果能顺利放大至产业化规模并保持产品质量的一致性, 需要严格控制的参数有研磨机的转速和研磨时间[52]。
Lestari等[52]用湿磨法分别制备了姜黄素和橙皮苷两种药物纳米混悬液。实验室规模的处理量为6 g, 中试放大时的处理量为2 kg, 两种规模下所用稳定剂的种类及用量均相同。在实验室规模下, 以900 r·min-1的转速研磨5 h后, 两种药物的粒径均达到了151~190 nm这一目标粒径。而在中试放大过程, 当转速提升至2 000 r·min-1时, 在批量模式下, 降低至目标粒径所需时间仅需1.5 h左右, 研磨时间缩短至原来的1/3左右。而在连续化模式下, 达到目标粒径所需的研磨时间仍需要3~4 h。
介质研磨法既适用于实验室试制, 也适用于产业化规模, 具有良好的可伸缩性, 从实验室规模的结果可以预测出产业化条件下的结果。随着处理量的增大, 对能耗的需求也相应增加, 因此, 需要通过设备参数的调整来实现其产品质量的一致性。此外, 设备参数的调整, 还可以提高生产效率和改善产品质量, 甚至得到粒径更小的药物纳米晶体。
4.2 生产过程中药物的稳定性混悬液中的纳米晶体药物可以通过加入稳定剂来保持其物理稳定性。而长期储存期间发生的水解和氧化等化学不稳定性问题更应当加以关注。目前对于药物纳米晶体稳定性的研究较少, 在已有的研究中也仅涉及了为期1个月的短期稳定性。若要实现纳米晶体药物的产业化, 就必须进行必要的药代动力学、毒理学及其他的临床前研究, 此时, 所使用的样品必须满足不同温度下的长期稳定性考察。长期稳定性的研究结果也可以用于预测产品的保质期。
Al Shaal等[43]采用SmartCrystals技术(湿法研磨+高压均质) 对小试与中试规模生产的芹菜素纳米晶体的稳定性在4 ℃、室温及40 ℃条件下进行了6个月的考察, 结果表明, 3种储存条件下粒径与粒径分布均没有发生显著变化。
另外, 考虑到纳米晶体药物的长期稳定性, 一般会将其混悬液进行固化处理, 常用的方法有喷雾干燥法和冷冻干燥法。通过冷冻干燥固化混悬液时, 需要加入蔗糖、海藻糖、甘露醇和甘油等材料作为冷冻保护剂, 其作用是保护纳米晶体, 使其粒径及粒径分布等质量指标在冻干前后不发生较大变化。此外, 冻干保护剂也可以使纳米晶体获得良好的再分散性, 以便于后期的制剂加工[1]。
4.3 生产成本增加与生产效益纳米晶体药物大规模生产时的成本增加表现在设备购置、能量消耗及物料消耗等过程。Bottom-up法制备药物纳米晶体时要使用大量有机溶剂, 并在最后阶段还要将其从产品中去除, 否则, 残留的溶剂会影响产品的安全性, 而去除这些有机溶剂的技术成本和物耗成本最终都将计入生产成本。此外, 大量有机溶剂排放还会造成环境污染, 环境成本应该是bottom-up法迄今还未被产业化应用的另一个重要原因[2]。Top-down法不仅能耗高, 对设备的性能要求也很高, 此外, 还需要符合良好生产质量规范(good manufacturing practice, GMP) 要求。以上这些因素都会增加纳米晶体药物的制备成本, 因此, 在工业化生产中需要认真考虑。
5 纳米晶体药物的剂型开发与应用基于药物纳米晶体开发的制剂有混悬剂、片剂、胶囊剂及注射剂等, 可以口服也可以经注射、肺部吸入、滴鼻和滴眼等途径应用[53]。这些制剂使用后, 可以促进药物的胃肠道吸收或在注射部位形成药物储库, 以此改善药物的药代动力学和体内的组织靶向性分布特性, 为获得更好的药效学奠定基础。
5.1 基于纳米晶体制剂的体外溶出与药代动力学性能的改善生物利用度是评价口服制剂的一个重要指标, 难溶性药物在体内吸收差和生物利用度低的主要原因是其水中溶解度低。制成纳米晶体后, 药物的粒径降低可以改善其水中溶解度, 加快体外溶出并最终促进药物在消化道内吸收。Liu等[54]制备了平均粒径为312 nm的西尼地平混悬液。溶解度考察结果显示, 纳米混悬液中的药物质量浓度高达16.36 μg·mL-1, 而原料粗粉仅为0.3 μg·mL-1, 增加了近55倍。原料药的纳米化还改善了药物的体外溶出特性, 纳米混悬液在5 min内的释药量超过了70%, 而粗粉与稳定剂的物理混合物在60 min仅溶出30%。大鼠灌胃给药后的药代动力学结果表明, 与市售品相比, 纳米混悬液组的Cmax提高了1.65倍, AUC0-24 h提高了2.17倍。
Guo等[55]制备了瑞巴派特纳米混悬液, 并将干燥固化后的药物纳米晶体与辅料混合后制成片剂, 最后, 考察了自制片和市售片经大鼠灌胃给药后的药代动力学。结果表明, 自制片的tmax为1.67 h, 而市售片的tmax为1.08 h。自制片的Cmax为543.4 ng·mL-1, 较市售片的281.5 ng·mL-1高出近1倍。自制片的AUC0-24 h为2 622.3 ng·min·mL-1, 而市售片仅为1 187.4 ng·min·mL-1。需要指出的是, 大鼠灌胃用的药物是经研磨并过100目筛的细粉, 药代动力学的结果应当是基于药物的混悬剂。
Wang等[56]制备了葛根素纳米晶体混悬液, 并以其溶液剂为参比, 考察了经比格犬静脉注射后的药代动力学。由于药物纳米晶体的缓释性, 葛根素纳米晶体的Cmax仅为7.61 mg·L-1, 低于溶液剂的8.85 mg·L-1, 有显著性差异(P < 0.05)。纳米晶体的Cmax虽然较低, 但其AUC0-∞却高达35.54 mg·h·L-1, 较溶液剂的17.38 mg·h·L-1高出1倍, 两组结果有极显著性差异(P < 0.01)。
5.2 基于纳米晶体制剂的定位给药与药物的靶向分布药物纳米晶体的给药途径灵活, 这一优势不仅使用方便, 还表现在静脉注射后药物的靶向分布, 以及经肌肉、皮下或穴位注射后在给药部位形成的高浓度药物储库, 鼻腔给药和肺部吸入也有利于局部疾病的治疗。治疗窗较小的抗肿瘤药物, 定位注射给药能使病变部位获得超高的药物浓度, 这是传统的口服或静脉给药所无法达到的。病变部位的药物浓度高而同时非病变部位的药物浓度又低, 这一结果既可以提高药物的治疗效果, 同时还能降低药物的全身毒性。
艾滋病毒宿主于脾、肺和胸腺, 为了提高抗艾滋病药物奈韦拉平的疗效, Shegokar等[57]制备了粒径为457 nm的混悬剂, 以期将更多药物递送至易被病毒感染的器官或组织中。纳米混悬剂与溶液剂经静脉给药后, 两组心、肝、脾、血液、淋巴及胸腺中的AUC0-24 h比值都超过了1。在艾滋病毒易于感染的肝脏和胸腺中, 纳米混悬液组与溶液剂的AUC0-24 h比值更高, 分别是1.77和4.22。遗憾的是, 在同样易于感染的肺部, 两组的比值仅为0.62, 此结果说明, 药物的纳米晶体经静脉注射更难达到肺部。
二甲氧基雌二醇(2-methoxyestradiol, 2-ME) 的水溶性低, 肝首过效应也大, 不适合口服给药。Shen等[58]采用纳米沉淀联合高频超声技术(nanoprecipitation + high-frequency ultrasonication technique) 制备了粒径为168.4 nm的混悬剂, 并以溶液剂为参比考察了静脉注射后大鼠体内的药物分布特性。结果表明, 纳米混悬液与溶液相比, 药物在心、肝、脾、肾和脑中的分布都明显减少, 而唯独在肺部的分布有明显增加, 两者的比值为1.81。2-ME在肺部浓度高于其他组织, 原因有两点: 其一, 2-ME是雌二醇的一种内源性代谢物。由于肺部有雌二醇受体, 推测2-ME与雌二醇受体也有一定亲和力; 其二, 与其粒径较小也有关, 粒径为168.4 nm的药物晶体在血液中循环时可以逃避网状内皮系统的识别与吞噬。可以推测, 如果2-ME纳米混悬液的粒径与奈韦拉平相当, 也在457 nm左右, 此时, 经静脉注射给药后, 即便其对肺泡的特殊亲和力没有丝毫降低, 也难逃脱被肝、脾和淋巴组织巨噬细胞或多或少吞噬的命运, 而减少最终达到肺部的药量[59]。与溶液相比, 纳米混悬液组在肺部药物浓度更高的另一个原因是, 溶液组的药物以单分子(unimolecular) 与肺泡接触, 而纳米混悬液中的药物以多分子(multiple molecules) 与肺泡接触, 接触量更大, 相应的吸收也更多。此外, 制备纳米混悬液时加入的磷脂, 不仅起到稳定剂作用, 还能降低肺泡的表面张力, 后者在一定程度上也有利于药物向肺泡扩散吸收。
Hu等[60]制备了3种不同粒径的醋酸姜黄素(CA) 纳米晶体, 考察了药物在肺部的吸收特性, 发现晶体粒径与肺部药物的Cmax和AUC0-t都有密切关系。粒径为123.7 nm时, AUC0-t为20 400 μg·h·mL-1, 分别为粒径566.2和1 120 nm的1.58倍和7.6倍, 这归功于小粒径纳米晶体的药物峰浓度更高及在肺部的驻留时间更长。CA是姜黄素的前体药物, 转化成为姜黄素后才能发挥药效。随着粒径降低, 由CA转化为姜黄素的量也都在增加, 粒径从1 120 nm到566.2 nm, 再到123.7 nm, 由CA转化来的姜黄素的AUC0-t值分别为78.5、560和1 980 μg·h·mL-1。而进一步分析则发现, 粒径变化导致CA转化为姜黄素的转化率(AUCcurcumin to AUCCA) 出现了明显差异。粒径依次从123.7 nm到566.2 nm, 再到1 120 nm, 相应的转化率分别为9.7%、4.35%和2.94%。对此, 合理的推测是, 只有溶液状态的CA才能转化成姜黄素。粒径为123.7 nm的药物晶体, 溶解度应当最大, 液态药物的比例也因此最高, 由CA转化为姜黄素的转化率也最高。
未经修饰的药物纳米晶体经静脉注射后在特定器官/组织内的定向富集, 是源于其空间尺度或形态结构与机体特定组织的生理学或病理学特性相互作用的结果。依靠网状内皮系统丰富的肝、脾和淋巴等组织将特定粒径的微粒当作外源性异物吞噬, 可以实现药物的被动靶向递送[61]。然而, 除了2-ME这样为数不多有幸在肺部或其他器官/组织拥有其特异受体的药物[58], 其他纳米晶体要想实现药物的主动靶向递送, 则需要将单个或多个靶向配体键合在其表面, 借助配体导向来实现药物的靶向递送[62, 63]。
5.3 基于纳米晶体的药效学效果提升药效的产生具有剂量依赖性, 血液或靶位的药物浓度越高, 相应的疗效也越好。基于纳米晶体开发的新型药物制剂, 口服给药后能促进其消化道吸收; 静脉注射给药后能延长药物在血液中的循环时间; 肌肉或皮下注射能在给药部位长时间维持较高的药物浓度。因此, 纳米晶体药物的药效学效果提高也是显而易见的。
辛伐他汀(simvastatin, Sim) 能使血液中升高的总胆固醇(TC) 和甘油三酯(TG) 水平降低, 此外, 还能提高血液中高密度脂蛋白(HDL) 水平, 这有利用加速清除外周细胞中的胆固醇, 或通过转运将其返回肝脏, 而降低血液中的总胆固醇水平。为提高辛伐他汀的功效, Chavhan等[64]用介质研磨法制得了辛伐他汀的纳米粉(Sim-NS), 粒径为250.8 nm; 此外, 还用超临界流体抗溶剂法制备了其微粉(Sim-SAS), 粒径为16.54 μm; 原料粗粉(PD) 的粒径为71.3 μm。用高脂饲料喂养大鼠, 使其血液中的TC和TG升高后, 再用辛伐他汀进行治疗。连续7天灌胃后, 对TC这一指标, Sim-NS组降低了23.05%, Sim-SAS组降低了8.11%, PD组仅降低了2.39%。对TG这一指标, 第4天时, Sim-NS组的降低幅度达到7.5%, 显著高于PD组。对于血液中的HDL水平, 第14天的结果显示, Sim-NS组升高了6.7%, Sim-SAS组升高了6.7%, 而PD组仅升高3.7%。辛伐他汀纳米化后出现此结果并不难理解, 药代动力学显示, Sim-NS组的AUCtotal为58.42 ng·h·mL-1, Sim-SAS组为33.5 ng·h·mL-1, 而PD组仅21.469 ng·h·mL-1, 纳米化处理后其生物利用度提高了1.7倍。这一结果源于溶解度的改善, 从Sim-NS到Sim-SAS和PD, 对应的溶解度分别是: 1.835、0.614和0.548 mg·mL-1。
水难溶药物的纳米粉, 由于溶解度的改善促进了其消化道吸收, 改善了口服给药后相应的药代动力学和药效学[65]。对于其他途径给药后, 纳米晶体制剂依然可以通过相应的方式显示其优势。咪唑安定(midazolam, MDZ) 是一种镇静药, 但水溶性差限制了其应用, Zhang等[66]用研磨法制备了咪唑安定纳米晶体, 肌肉注射后的抗惊厥效果表明, 咪唑安定纳米混悬液组(MDZ/NCs) 的半数有效剂量(ED50) 仅为0.017 mg·kg-1, 而其溶液组(MDZ/S) 的ED50则为0.43 mg·kg-1, 纳米混悬液组显示出更好的药效学特性。
水难溶药物纳米晶体的制备与应用中所显现的优势, 也促使研究者在更深层次去思考这样的问题, 即: 在未来的研究中, 通过何种实验设计及采用什么样的措施, 能使这一新剂型发挥更好的临床疗效。
研究药物纳米晶体口服用药的药代动力学和药效学时, 常以其原料药作参比, 得出的结论是, 药物的纳米晶体能更好的吸收, 相对生物利用度更高。可以设想: 如果药物晶体的粒径再进一步降低, 药物的吸收改善又会是一种什么样的结果?以药效学和毒理学为评价指标, 药物晶体此时的极限最小粒径是多少?
考察药物纳米晶体静脉注射后的药代动力学和药效学时, 所用的参比一般是其溶液剂, 得出的结论是, 药物的纳米晶体具有缓释性, 相对生物利用度更高, 疗效更好。可以设想: 如果药物晶体的粒径再进一步增大, 更好的缓释性能又将对其药代动力学和药效学带来怎样的影响?以药物疗效及其毒理学作为评价指标, 静脉注射给药时, 药物晶体此时的极限最大粒径将是多少?同样的疑问也适合于除口服和注射给药以外的其他给药途径。
6 结语与展望采用纳米晶体技术提高水难溶药物的溶解度, 并进而解决这类药物口服吸收不完全和生物利用度低的问题, 在基础研究和新产品开发方面已经取得了一些令人鼓舞的成果。同时, 也看到了这一研究领域存在的突出问题。例如, 基于纳米晶体开发上市的新药数量在减少, 且上市周期间隔也在延长。在此, 基于疗效提高和毒性降低这一评价药物制剂的永恒原则, 对药物纳米晶体未来的研究工作提出几点建议: 首先, 纳米药物晶体的出现及其立身之本是粒径降低后所表现出的溶解度提高, 并进而促进药物吸收和改善生物利用度。因此, 应当沿着粒径降低的思路, 通过工艺优化、稳定剂的合理选择与搭配, 以及选用性能更为优良的设备, 以获得粒径更小的药物纳米晶体并对其性能进行综合评价; 其次, 考察口服给药以外的其他途径应用后药物的体内命运和疗效。例如, 采用杂化药物纳米晶体(hybrid drug nanocrystal) 技术, 借助荧光示踪技术观察静脉给药后药物的组织分布动力学。还可以对药物晶体进行表面修饰或采用聚合物进行包裹, 以实现药物在体内的长循环或实现更好的组织靶向性分布; 最后, 基于药物的理化性质和目标剂型的特点, 在传统的喷雾干燥技术之外, 采用新型的喷雾冷冻干燥等新型干燥技术对混悬液浆料进行固化干燥, 更好地保留热敏药物的活性, 以满足不同剂型加工的需要。
归根结底, 药物纳米晶体只是制剂产品开发过程中一个中间态的微粉, 还需要根据目标疾病的特点, 依靠药剂学工作者、制药工程师、基础医学工作者及临床医生的通力合作, 设计并制备性能优良的制剂产品, 才能最大限度地发挥其临床疗效。
作者贡献: 刘晓雪主要负责论文的撰写、图形的绘制、格式的修改及论文投稿; 龚俊波和魏振平主要负责论文的构思、撰写、修改及校正。
利益冲突: 本论文中不涉及任何利益冲突。
| [1] |
Al-Kassas R, Bansal M, Shaw J. Nanosizing techniques for improving bioavailability of drugs[J]. J Control Release, 2017, 260: 202-212. DOI:10.1016/j.jconrel.2017.06.003 |
| [2] |
Du J, Li XG, Zhao HX, et al. Nanosuspensions of poorly water-soluble drugs prepared by bottom-up technologies[J]. Int J Pharm, 2015, 495: 738-749. DOI:10.1016/j.ijpharm.2015.09.021 |
| [3] |
Yue PF, Liu Y, Xie J, et al. Review and prospect on preparation technology of drug nanocrystals in the past thirty years[J]. Acta Pharm Sin (药学学报), 2018, 54: 629-637. |
| [4] |
Khadka P, Ro J, Kim H, et al. Pharmaceutical particle technologies: an approach to improve drug solubility, dissolution and bioavailability[J]. Asian J Pharm Sci, 2014, 9: 304-316. DOI:10.1016/j.ajps.2014.05.005 |
| [5] |
Butler JM, Dressman JB. The developability classification system: application of biopharmaceutics concepts to formulation development[J]. J Pharm Sci, 2010, 99: 4940-4954. DOI:10.1002/jps.22217 |
| [6] |
Rosenberger J, Butler J, Muenster U, et al. Application of a refined developability classification system[J]. J Pharm Sci, 2019, 108: 1090-1100. DOI:10.1016/j.xphs.2018.10.044 |
| [7] |
Dai MM, Zhang YY, Wang SH, et al. Research progress in nanocrystal drug preparation technology[J]. China Powder Sci Technol (中国粉体技术), 2019, 25: 56-62. |
| [8] |
Junyaprasert VB, Morakul B. Nanocrystals for enhancement of oral bioavailability of poorly water-soluble drugs[J]. Asian J Pharm Sci, 2015, 10: 13-23. DOI:10.1016/j.ajps.2014.08.005 |
| [9] |
Fontana F, Figueiredo P, Zhang P, et al. Production of pure drug nanocrystals and nano co-crystals by confinement methods[J]. Adv Drug Deliv Rev, 2018, 131: 3-21. DOI:10.1016/j.addr.2018.05.002 |
| [10] |
Wang YC, Zheng Y, Zhang L, et al. Stability of nanosuspensions in drug delivery[J]. J Control Release, 2013, 172: 1126-1141. DOI:10.1016/j.jconrel.2013.08.006 |
| [11] |
Patel VR, Agrawal YK. Nanosuspension: an approach to enhance solubility of drugs[J]. J Adv Pharm Technol Res, 2011, 2: 81-87. DOI:10.4103/2231-4040.82950 |
| [12] |
Liu JL, Tu LX, Cheng M, et al. Mechanisms for oral absorption enhancement of drugs by nanocrystals[J]. J Drug Deliv Sci Technol, 2020, 56: 101607. DOI:10.1016/j.jddst.2020.101607 |
| [13] |
Fu Q, Sun J, Ai XY, et al. Nimodipine nanocrystals for oral bioavailability improvement: role of mesenteric lymph transport in the oral absorption[J]. Int J Pharm, 2013, 448: 290-297. DOI:10.1016/j.ijpharm.2013.01.065 |
| [14] |
Jacob S, Nair AB, Shah J. Emerging role of nanosuspensions in drug delivery systems[J]. Biomater Res, 2020, 24: 3. DOI:10.1186/s40824-020-0184-8 |
| [15] |
Liu T, Yu XX, Yin HP. Study of top-down and bottom-up approaches by using design of experiment (DoE) to produce meloxicam nanocrystal capsules[J]. AAPS PharmSciTech, 2020, 21: 79. DOI:10.1208/s12249-020-1621-7 |
| [16] |
Zhang X, Zhao J, Guan J, et al. Exploration of nanocrystal technology for the preparation of lovastatin immediate and sustained release tablets[J]. J Drug Deliv Sci Technol, 2019, 50: 107-112. DOI:10.1016/j.jddst.2019.01.018 |
| [17] |
Stahr PL, Grewal R, Eckert GP, et al. Investigating hesperetin nanocrystals with tailor-made sizes for the prevention and treatment of Alzheimer's disease[J]. Drug Deliv Transl Res, 2021, 11: 659-674. DOI:10.1007/s13346-020-00888-0 |
| [18] |
Srivalli KMR, Mishra B. Drug nanocrystals: a way toward scale-up[J]. Saudi Pharm J, 2016, 24: 386-404. DOI:10.1016/j.jsps.2014.04.007 |
| [19] |
Dhaval M, Makwana J, Sakariya E, et al. Drug nanocrystals: a comprehensive review with current regulatory guidelines[J]. Curr Drug Deliv, 2020, 17: 470-482. DOI:10.2174/1567201817666200512104833 |
| [20] |
Ma JJ, Yang YX, Sun YH, et al. Optimization, characterization and in vitro/vivo evaluation of azilsartan nanocrystals[J]. Asian J Pharm Sci, 2017, 12: 344-352. DOI:10.1016/j.ajps.2016.09.008 |
| [21] |
Monteiro A, Afolabi A, Bilgili E. Continuous production of drug nanoparticle suspensions via wet stirred media milling: a fresh look at the Rehbinder effect[J]. Drug Dev Ind Pharm, 2013, 39: 266-283. DOI:10.3109/03639045.2012.676048 |
| [22] |
Zhang YL, Yu HY, Huang T. Preparation and in vivo pharmacokinetics of rhein nanosuspensions[J]. Chin Tradit Pat Med (中成药), 2020, 42: 2829-2834. |
| [23] |
Goswami N, Patel RP. Development, characterization and evaluation of nanocrystals of nitrofurantoin[J]. Int J Pharma Bio Sci, 2020, 11: 2718-2726. |
| [24] |
Oktay AN, Ilbasmis-Tamer S, Celebi N. The effect of critical process parameters of the high pressure homogenization technique on the critical quality attributes of flurbiprofen nanosuspensions[J]. Pharm Dev Technol, 2019, 24: 1278-1286. DOI:10.1080/10837450.2019.1667384 |
| [25] |
Mishra B, Sahoo J, Dixit PK. Enhanced bioavailability of cinnarizine nanosuspensions by particle size engineering: optimization and physicochemical investigations[J]. Mater Sci Eng C Biol Supl, 2016, 63: 62-69. DOI:10.1016/j.msec.2016.02.046 |
| [26] |
Chinthaginjala H, Ahad HA, Reddy PG, et al. Nanosuspension as promising and potential drug delivery: a review[J]. Int J Life Sci Pharm Res, 2021, 11: 59-66. |
| [27] |
Sinha B, Muller RH, Moschwitzer JP. Bottom-up approaches for preparing drug nanocrystals: formulations and factors affecting particle size[J]. Int J Pharm, 2013, 453: 126-141. DOI:10.1016/j.ijpharm.2013.01.019 |
| [28] |
Yuan Q, Wang YL, Song RF, et al. Study on formulation, in vivo exposure, and passive targeting of intravenous itraconazole nanosuspensions[J]. Front Pharmacol, 2019, 10: 225. DOI:10.3389/fphar.2019.00225 |
| [29] |
Li YJ, Hong JY, Li HW, et al. Genkwanin nanosuspensions: a novel and potential antitumor drug in breast carcinoma therapy[J]. Drug Deliv, 2017, 24: 1491-1500. DOI:10.1080/10717544.2017.1384519 |
| [30] |
Soliman KA, Ibrahim HK, Ghorab MM. Effects of different combinations of nanocrystallization technologies on avanafil nanoparticles: in vitro, in vivo and stability evaluation[J]. Int J Pharm, 2017, 517: 148-156. DOI:10.1016/j.ijpharm.2016.12.012 |
| [31] |
Jain S, Patel K, Arora S, et al. Formulation, optimization, and in vitro-in vivo evaluation of olmesartan medoxomil nanocrystals[J]. Drug Deliv Transl Res, 2017, 7: 292-303. DOI:10.1007/s13346-016-0355-2 |
| [32] |
Raju A, Reddy AJ, Satheesh J, et al. Preparation and characterisation of nevirapine oral nanosuspensions[J]. Indian J Pharm Sci, 2014, 76: 62-71. |
| [33] |
Zakir F, Sharma H, Kaur K, et al. Nanocrystallization of poorly water soluble drugs for parenteral administration[J]. J Biomed Nanotechnol, 2011, 7: 127-129. DOI:10.1166/jbn.2011.1234 |
| [34] |
Moschwitzer J, Muller RH. New method for the effective production of ultrafine drug nanocrystals[J]. J Nanosci Nanotechnol, 2006, 6: 3145-3153. DOI:10.1166/jnn.2006.480 |
| [35] |
Liu T, Müller RH, Möschwitzer JP. Systematical investigation of a combinative particle size reduction technology for production of resveratrol nanosuspensions[J]. AAPS PharmSciTech, 2016, 18: 1683-1691. |
| [36] |
Salazar J, Müller RH, Möschwitzer JP. Application of the combinative particle size reduction technology H42 to produce fast dissolving glibenclamide tablets[J]. Eur J Pharm Sci, 2013, 49: 565-577. DOI:10.1016/j.ejps.2013.04.003 |
| [37] |
Li Y, Wang Y, Yue PF, et al. A novel high-pressure precipitation tandem homogenization technology for drug nanocrystals production--a case study with ursodeoxycholic acid[J]. Pharm Dev Technol, 2014, 19: 662-670. DOI:10.3109/10837450.2013.819015 |
| [38] |
Sinha B, Muller RH, Moschwitzer JP. Can the cavi-precipitation process be exploited to generate smaller size drug nanocrystal?[J]. Drug Dev Ind Pharm, 2021, 47: 235-245. DOI:10.1080/03639045.2020.1871004 |
| [39] |
Sinha B, Muller RH, Moschwitzer JP. Systematic investigation of the cavi-precipitation process for the production of ibuprofen nanocrystals[J]. Int J Pharm, 2013, 458: 315-323. DOI:10.1016/j.ijpharm.2013.10.025 |
| [40] |
Kalvakuntla S, Deshpande M, Attari Z, et al. Preparation and characterization of nanosuspension of aprepitant by H96 process[J]. Adv Pharm Bull, 2016, 6: 83-90. DOI:10.15171/apb.2016.013 |
| [41] |
Demir H, Gulsun T, Sener E, et al. Preparation and characterization of rivaroxaban nanocrystals prepared by combination of wet ball milling and high pressure homogenization methods[J]. Lat Am J Pharm, 2018, 37: 2482-2490. |
| [42] |
Hatahet T, Morille M, Hommoss A, et al. Dermal quercetin smartCrystals®: formulation development, antioxidant activity and cellular safety[J]. Eur J Pharm Biopharm, 2016, 102: 51-63. DOI:10.1016/j.ejpb.2016.03.004 |
| [43] |
Al Shaal L, Muller RH, Rs Shegokar. SmartCrystal combination technology--scale up from lab to pilot scale and long term stability[J]. Pharmazie, 2010, 65: 877-884. |
| [44] |
Scholz P, Arntjen A, Müller RH, et al. ARTcrystal® process for industrial nanocrystal production—optimization of the ART MICCRA pre-milling step[J]. Int J Pharm, 2014, 465: 388-395. DOI:10.1016/j.ijpharm.2014.02.026 |
| [45] |
Li F, Li LS, Wang SN, et al. Improved dissolution and oral absorption by co-grinding active drug probucol and ternary stabilizers mixtures with planetary beads-milling method[J]. Asian J Pharm Sci, 2019, 14: 649-657. DOI:10.1016/j.ajps.2018.12.001 |
| [46] |
Gigliobianco MR, Casadidio C, Censi R, et al. Nanocrystals of poorly soluble drugs: drug bioavailability and physicochemical stability[J]. Pharmaceutics, 2018, 10: 134. DOI:10.3390/pharmaceutics10030134 |
| [47] |
Peltonen L, Hirvonen J. Pharmaceutical nanocrystals by nanomilling: critical process parameters, particle fracturing and stabilization methods[J]. J Pharm Pharmacol, 2010, 62: 1569-1579. DOI:10.1111/j.2042-7158.2010.01022.x |
| [48] |
Chang TL, Zhan HL, Liang D, et al. Nanocrystal technology for drug formulation and delivery[J]. Front Chem Sci Eng, 2015, 9: 1-14. DOI:10.1007/s11705-015-1509-3 |
| [49] |
Tuomela A, Hirvonen J, Peltonen L. Stabilizing agents for drug nanocrystals: effect on bioavailability[J]. Pharmaceutics, 2016, 8: 16. DOI:10.3390/pharmaceutics8020016 |
| [50] |
Oktay AN, Ilbasmis-Tamer S, Karakucuk A, et al. Screening of stabilizing agents to optimize flurbiprofen nanosuspensions using experimental design[J]. J Drug Deliv Sci Technol, 2020, 57: 101690. DOI:10.1016/j.jddst.2020.101690 |
| [51] |
Moschwitzer JP. Drug nanocrystals in the commercial pharmaceutical development process[J]. Int J Pharm, 2013, 453: 142-156. DOI:10.1016/j.ijpharm.2012.09.034 |
| [52] |
Lestari MLAD, Muller RH, Moschwitzer JP. The scalability of wet ball milling for the production of nanosuspensions[J]. Pharm Nanotechnol, 2019, 7: 147-161. DOI:10.2174/2211738507666190401142530 |
| [53] |
Gao L, Liu GY, Ma JL, et al. Drug nanocrystals: in vivo performances[J]. J Control Release, 2012, 160: 418-430. DOI:10.1016/j.jconrel.2012.03.013 |
| [54] |
Liu Q, Mai YP, Gu XS, et al. A wet-milling method for the preparation of cilnidipine nanosuspension with enhanced dissolution and oral bioavailability[J]. J Drug Deliv Sci Technol, 2020, 55: 101371. DOI:10.1016/j.jddst.2019.101371 |
| [55] |
Guo Y, Wang YJ, Xu L. Enhanced bioavailability of rebamipide nanocrystal tablets: formulation and in vitro/in vivo evaluation[J]. Asian J Pharm Sci, 2015, 10: 223-229. DOI:10.1016/j.ajps.2014.09.006 |
| [56] |
Wang YC, Ma Y, Ma YY, et al. Formulation and pharmacokinetics evaluation of puerarin nanocrystals for intravenous delivery[J]. J Nanosci Nanotechnol, 2012, 12: 6176-6184. DOI:10.1166/jnn.2012.6436 |
| [57] |
Shegokar R, Singh KK. Nevirapine nanosuspensions for HIV reservoir targeting[J]. Pharmazie, 2011, 66: 408-415. |
| [58] |
Shen GP, Wang QY, Zhang QQ, et al. Tissue distribution of 2-methoxyestradiol nanosuspension in rats and its antitumor activity in C57BL/6 mice bearing lewis lung carcinoma[J]. Drug Deliv, 2012, 19: 327-333. DOI:10.3109/10717544.2012.721142 |
| [59] |
Yang YF, Xie XY, Yang Y, et al. A review on the influences of size and surface charge of liposome on its targeted drug delivery in vivo[J]. Acta Pharm Sin (药学学报), 2013, 48: 1644-1650. |
| [60] |
Hu X, Yang FF, Wei XL, et al. Curcumin acetate nanocrystals for sustained pulmonary delivery: preparation, characterization and in vivo evaluation[J]. J Biomed Nanotechnol, 2017, 13: 99-109. DOI:10.1166/jbn.2017.2326 |
| [61] |
Ji YB, Liu B, Yu RQ, et al. Preparation of disulfiram naonosuspensions and their anti-tumor efficacy in vitro and in vivo[J]. Acta Pharm Sin (药学学报), 2019, 54: 565-573. |
| [62] |
Talekar M, Ganta S, Amiji M, et al. Development of PIK-75 nanosuspension formulation with enhanced delivery efficiency and cytotoxicity for targeted anti-cancer therapy[J]. Int J Pharm, 2013, 450: 278-289. DOI:10.1016/j.ijpharm.2013.04.057 |
| [63] |
Lu Y, Li Y, Wu W. Injected nanocrystals for targeted drug delivery[J]. Acta Pharm Sin B, 2016, 6: 106-113. DOI:10.1016/j.apsb.2015.11.005 |
| [64] |
Chavhan S, Joshi G, Petkar K, et al. Enhanced bioavailability and hypolipidemic activity of simvastatin formulations by particle size engineering: physicochemical aspects and in vivo investigations[J]. Biochem Eng J, 2013, 79: 221-229. DOI:10.1016/j.bej.2013.08.007 |
| [65] |
Xia YM, Chen H, Ye TJ, et al. Investigations of solid states for flavonoids from traditional Chinese medicine[J]. Acta Pharm Sin (药学学报), 2019, 54: 1190-1199. |
| [66] |
Zhang X, Li ZG, Gao J, et al. Preparation of nanocrystals for insoluble drugs by top-down nanotechnology with improved solubility and bioavailability[J]. Molecules, 2020, 25: 1080. DOI:10.3390/molecules25051080 |
 2021, Vol. 56
2021, Vol. 56


