2. 山东中医药大学药学院, 山东 济南 250355;
3. 上海交通大学附属儿童医院药学部, 上海 200062
2. College of Pharmacy, Shandong University of Traditional Chinese Medicine, Jinan 250355, China;
3. Department of Pharmacy, Children's Hospital Affiliated to Shanghai Jiao Tong University, Shanghai 200062, China
恶性黑色素瘤(malignant melanoma, MM) 是一种高度侵袭和极易转移的恶性肿瘤, 近年来已成为所有恶性肿瘤中发病率增长最快的肿瘤[1]。目前, 只有早期黑色素瘤可采用手术方式切除治疗, 对于中晚期的黑色素瘤尚无有效治疗手段。黑色素瘤的药物治疗主要包括化疗、生物治疗及免疫治疗等。针对黑色素瘤治疗的一线化疗药物, 除达卡巴嗪及常规化疗药物外, 近年来再无新的化学药物问世。5-氟尿嘧啶等常规的化疗药物不良反应较大, 且总有效率只有10%~15%。新的BRAF抑制剂威罗菲尼(vemurafenib)、有丝分裂原活化蛋白激酶(mitogen-activated extracellular signal regulated kinase, MEK) 抑制剂曲美替尼(trametinib) 单独使用6~7个月后均会出现严重的耐药性。2014年美国食品药品监督管理局(Food and Drug Administration, FDA) 批准了BRAF-MEK靶向联合疗法, 但药物作用时间只延长了4个月左右, 远远不能满足黑色素瘤的有效治疗[2]。目前肿瘤免疫治疗方法备受关注, 但免疫治疗的效果和安全性尚待进一步考察, 且治疗费用昂贵[3]。因此, 国内外许多学者都将寻找治疗黑色素瘤药物聚焦到中药和天然产物上, 希望找到新的突破口。中药雷公藤及其衍生物则是近年来研究的热点。
传统中医药理论认为, 黑色素瘤属中医“黑疔”、“疠疽”范畴, 其主要病机为虚、毒、痰、瘀4个方面。在临床治疗中, 以“扶正祛邪、清热解毒、活血化瘀”为主要治则。中药雷公藤具有祛风除湿、活血通络、消肿止痛、杀虫解毒等功效。雷公藤甲素(triptolide, TPL) 是雷公藤的主要活性成分, 具有抗炎、镇痛、抗肿瘤等作用。雷公藤甲素及其衍生物minnelide在美国已完成了对胃癌的Ⅰ期临床试验和对胰腺癌的Ⅱ期临床试验, 是目前研究的热点化合物[4]。课题组的前期研究也表明, TPL具有显著的抗肿瘤效果, 但其本身存在水溶性差、不良反应大等问题, 严重限制了其临床应用[5-7]。
近年来, 仿生纳米载体在药物靶向递送中表现出独特的优势。其中外泌体(exosome, Exo) 是一类粒径在50~200 nm的细胞分泌囊泡, 可由多种类型细胞产生, 存在于大多数体液中。作为天然的纳米级囊泡, 外泌体具有毒性小、免疫原性低、靶向归巢能力强和可包载的物质种类多等特点, 使其成为具有潜力的药物递送载体[8-10]。利用这一特点, 本研究以肿瘤细胞来源的外泌体作为TPL的递药载体, 利用其天然的归巢特性将药物靶向递送至肿瘤部位, 选择适当的靶点对其进行表面修饰, 可进一步增强其靶向性, 改善药物的体内分布。
与正常细胞相比, 叶酸(folic acid, FA) 受体在上皮恶性组织中过度表达。研究表明, 人、鼠黑色素瘤的原发灶及转移灶中均过表达叶酸受体, 但在正常细胞表面则低表达或未表达[11]。叶酸廉价易得、无毒、非免疫原性, 且与叶酸受体具有高度的亲和力, 将其作为靶头连接到药物载体上, 可介导叶酸修饰的给药系统通过胞吞作用等途径摄入细胞[12-14]。因此, 本研究在前期研究基础上, 采用叶酸对黑色素瘤细胞分泌的外泌体进行修饰, 制备双靶向纳米给药系统FA-Exo/TPL, 将药物靶向递送到黑色素瘤细胞, 实现增效减毒的目的。
材料与方法药品与试剂 TPL (纯度≥ 98%, 上海源叶生物科技有限公司); 胰酶、DMEM培养液、胎牛血清、双抗(Gibco公司); 磷酸盐缓冲盐(PBS, Hyclone公司); DSPE-PEG2000-FA (西安瑞禧生物科技有限公司); RIPA裂解液、BCA (bicinchoninic acid)试剂盒(Beyotime公司); PKH67试剂盒(Sigma-Aldrich公司); DAPI (4', 6-diamidino-2-phenylindole) 试剂盒(Solarbio公司); CCK-8试剂盒(cell counting kit-8, Biosharp公司); DiR荧光探针、Annexin V-APC/7-AAD凋亡试剂盒(上海懋康生物科技有限公司); TUNEL (terminal deoxynucleotidyl transferase-mediated dUTP-biotin nick end labeling assay) 试剂盒(Roche公司); 甲醇为色谱纯, 水为超纯水, 其余试剂为分析纯。
细胞与实验动物 人恶性黑色素瘤细胞株A375购自ATCC (America Type Culture Collection)。BALB/c裸鼠, 购自上海市斯莱克实验动物有限公司[许可证号码: SCXK (沪) 2017-0005], 20 ± 2 g, 雄性。所有动物实验经复旦大学附属肿瘤医院实验动物伦理委员会批准, 实验动物使用许可证号: SYXK (沪) 2020-0006。
FA-Exo/TPL外泌体靶向给药系统的制备 采用梯度离心法分离A375细胞来源的外泌体[15]: A375细胞长至60%融合状态时, 加入无外泌体血清的培养基继续培养至85%融合状态, 收集A375细胞上清, 依次经过以下离心条件操作: 300 ×g、10 min; 2 000 ×g、10 min; 10 000 ×g、30 min; 120 000 ×g、70 min, 2次, 将沉淀物重悬于PBS中, 即得Exo悬液。
采用共孵育法制备FA-Exo外泌体靶向递送载体[16]: 利用BCA试剂盒测定制备的Exo的总蛋白浓度, 以Exo∶DSPE-PEG2000-FA (20 mg·mL-1) = 20∶1 (w/w) 的比例混合均匀, 并于室温条件下共孵育1 h, 将混合物于120 000 ×g、4 ℃下离心70 min, 除去游离的DSPE-PEG2000-FA, 将离心沉淀物用预冷PBS重悬, 即得靶向载体FA-Exo。
采用超声法制备FA-Exo/TPL外泌体靶向给药系统[17, 18]: 将TPL的二甲基亚砜(dimethyl sulfoxide, DMSO) 溶液(1 mg·mL-1) 和FA-Exo载体溶液置于探头超声仪中进行超声处理。超声仪参数设置为: 20%振幅, 30 s开/关, 6个循环, 共持续3 min, 每个循环之间有2 min的冷却时间。经超声处理的混合物于37 ℃下静置0.5 h, 4 ℃下静置1 h, 以恢复外泌体膜结构, 于120 000 ×g、4 ℃条件下离心70 min, 除去上清液, 将离心沉淀物采用预冷PBS重悬, 即得外泌体靶向给药系统FA-Exo/TPL。以载体对药物的包封率(encapsulation efficiency, EE) 和载药量(drug loading, DL) 为主要指标, 将FA-Exo (总蛋白量) 和TPL的质量比分别设置为15∶1、10∶1、5∶1、1∶1、1∶5、1∶10和1∶15, 优选FA-Exo和TPL的用量。采用同样的方法制备Exo/TPL。
包封率和载药量测定 按上述方法制备和分离FA-Exo/TPL, 收集上清液, 采用HPLC法测定未被包载的游离TPL浓度[7], 同时在下层沉淀物中加入甲醇, 溶解, 10 000 ×g离心10 min, 测定载入外泌体中的TPL含量, 根据以下公式(1)、(2) 计算FA-Exo/TPL的包封率(EE) 和载药量(DL)。
| $ {\rm{EE}} = (W_{\rm{total}} - W_{\rm{free}}) / W_{\rm{total}} × 100\% $ | (1) |
| $ {\rm{DL}} = W_{\rm{e}} / (W_{\rm{m}} + W_{\rm{e}}) × 100\% $ | (2) |
其中, Wtotal、Wfree、We、Wm分别为制备过程中加入药物总质量、未能包载的游离药物质量、包封于外泌体内的药物质量、外泌体载体的质量。
FA-Exo/TPL粒径、电位和形态学考察 利用纯化水稀释FA-Exo/TPL, 利用激光粒度仪测定其粒径、粒径分布和电位。取5 μL悬液于铜网上, 滴加醋酸双氧铀液负染, 于室温干燥后, 采用透射电镜观察拍摄其形态结构。
Western blot验证外泌体表面蛋白 取制备的Exo和FA-Exo/TPL悬液, 加入RIPA裂解液使外泌体裂解, 提取的蛋白经SDS-PAGE分离、转膜、牛血清白蛋白(BSA) 封闭、洗膜后, 分别加入稀释的CD63、CD9和TSG101一抗, 孵育、洗膜后, 加入辣根过氧化物酶标记的山羊抗兔二抗, 并采用ECL化学发光试剂盒测定外泌体表面特征蛋白的表达情况。
A375细胞对FA-Exo/TPL的摄取情况 将A375细胞接种于共聚焦培养皿中, 待细胞长至融合状态后, 吸去培养基, 分别加入经PKH67标记的FA-Exo/TPL和Exo/TPL, 继续孵育4 h, 弃去培养基并洗涤细胞, 依次加入4%多聚甲醛固定细胞, DAPI溶液深染细胞核, 抗荧光淬灭封片液封片, 用激光共聚焦显微镜观察并拍照分析A375细胞对FA-Exo/TPL和Exo/TPL的摄取情况。
FA-Exo/TPL对A375细胞增殖的影响 将A375细胞接种于96孔板中, 细胞长至融合状态后, 实验组分别加入100 μL不同浓度的Exo、FA-Exo、Exo/TPL、TPL和FA-Exo/TPL溶液, Exo和FA-Exo组中的总蛋白质量浓度依次为5、25、50、100、200 μg·mL-1, Exo/TPL、TPL和FA-Exo/TPL组的药物质量浓度依次为5、25、50、100、200 ng·mL-1, 对照组细胞不加制剂, 空白组中只含有培养基(n = 8)。继续孵育24 h后, 分别于每个培养孔中加入CCK-8试剂10 μL, 室温条件下继续孵育2 h, 利用酶标仪测定各孔的吸光度值, 并根据以下公式(3) 计算不同实验组细胞的存活率, 其中As为实验组吸光度、Ab为空白组吸光度、Ac为对照组吸光度。
| $ 细胞存活率 = [(\rm{As-Ab})/(\rm{Ac-Ab})]×100\% $ | (3) |
FA-Exo/TPL对A375细胞凋亡的影响 将A375细胞接种于12孔板中, 细胞长至融合状态后, 分别加入FA-Exo、Exo/TPL、TPL和FA-Exo/TPL (FA-Exo组中外泌体蛋白总质量浓度为50 μg·mL-1; Exo/TPL组、TPL组和FA-Exo/TPL组中TPL质量浓度均为50 ng·mL-1), 继续培养6 h, 采用流式细胞仪检测不同处理组的凋亡图谱, 并分析早、晚期细胞凋亡率和坏死率。
人恶性黑色素瘤裸鼠移植瘤模型的建立 取对数生长期的A375细胞, 胰酶消化、离心后, 加入预冷的DMEM培养基, 调整细胞数为每毫升2.5×107个。于裸鼠右腋窝处皮下接种200 μL细胞悬液, 待肿瘤长至一定体积后, 用于后续实验。
FA-Exo/TPL的体内靶向性考察 按照上述方法构建荷瘤裸鼠模型, 待肿瘤长至500 mm3左右时用于考察FA-Exo/TPL的体内靶向性。37 ℃下, 将DiR稀释液(1 mmol·L-1) 与制备的FA-Exo/TPL和Exo/TPL按1∶1的比例混合(按外泌体总蛋白量), 15 min后, 于120 000 ×g条件下离心1 h除去多余DiR, PBS重悬, 即得DiR荧光探针标记的FA-Exo/TPL和Exo/TPL。将其分别通过尾静脉注射至荷瘤裸鼠体内, 给药0.5、2、4、8、24 h时, 用异氟烷麻醉, 在750 nm/780 nm波长处, 利用小动物活体成像系统[型号: IVIS Lumina S5; 珀金埃尔默企业管理(上海) 有限公司] 考察荧光信号的强度变化和体内分布, 评价经叶酸修饰后的外泌体FA-Exo/TPL的肿瘤靶向性。
FA-Exo/TPL体内抑瘤效果 按照上述方法构建荷瘤裸鼠模型, 待肿瘤长至100 mm3左右时, 将模型动物随机分为5组(n = 6): 生理盐水组、FA-Exo、TPL、Exo/TPL和FA-Exo/TPL组。TPL、Exo/TPL和FA-Exo/TPL组中, 按TPL计算, 给药剂量为0.6 mg·kg-1; FA-Exo组外泌体给药剂量为6 μg·kg-1 (按总蛋白计)。第1次给药记为0天, 每2天给药1次, 共给药14天(共给药8次)。每次给药后称量裸鼠的体重, 测量肿瘤组织的长径(a)、短径(b), 并计算肿瘤体积[V, V = (a×b2)/2], 绘制裸鼠的体重和肿瘤组织生长变化曲线图。第15天, 处死裸鼠, 剥离肿瘤组织、称重、计算抑瘤率(抑瘤率= (对照组平均质量- 实验组平均质量)/对照组平均质量× 100%), 并进行苏木素- 伊红(hematoxylin-eosin, HE) 和TUNEL染色, 考察各给药组的抑瘤情况。同时取心、肝、脾、肺、肾组织, 进行HE染色, 考察各给药组的生物安全性。剩余的荷瘤裸鼠(n = 6) 继续饲养, 记录其自然死亡或者瘤体积大于2 000 mm3的时间, 绘制生存曲线。
统计学分析 所有数据均以平均数±标准差(
结果如图 1所示。图 1A、B粒径和透射电镜结果显示, 提取的外泌体粒径为100 nm左右, 形态呈茶托样的双层膜结构。BCA试剂盒测得的总蛋白质量浓度为4.98 ± 0.19 mg·mL-1。经叶酸修饰后的靶向载体FA-Exo, 其形态和粒径无明显变化。而电位结果显示, Exo为-25.14 ± 0.79 mV, FA-Exo降为-39.73 ± 0.32 mV, 载药后, Exo/TPL与FA-Exo/TPL与各自不载药的空白载体无显著性差异, Exo/TPL和FA-Exo/TPL的电位分别是-25.52 ± 0.65 mV和-38.03 ± 1.43 mV, 表明FA成功连接到Exo表面。图 1C为不同FA-Exo和TPL质量比制备的FA-Exo/TPL的包封率和载药量, 结果表明FA-Exo总蛋白含量与TPL的质量比为1∶1时, 具有较高的包封率和载药量, 分别为56.39% ± 1.09%和36.06% ± 0.44%。载药后的形态、粒径结果表明(图 1A、B), 超声法载药制备的Exo-TPL和FA-Exo/TPL外泌体给药系统仍保持原有的形态结构, 但粒径有所变大, 为110 nm左右。图 1D结果表明, 经叶酸靶向修饰和载药后, 并未影响标记蛋白CD9、CD63以及TSG101的表达。
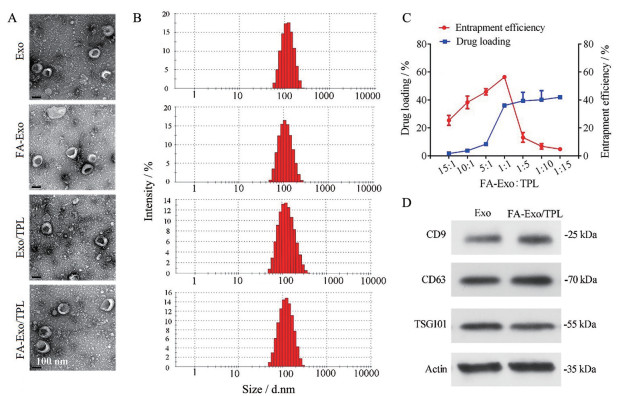
|
Figure 1 The characterization of Exo drug delivery systems. A, B: The morphology (A) and size distribution (B) of Exo, FA-Exo, Exo/TPL, and FA-Exo/TPL; C: The drug loading and encapsulation efficiency of FA-Exo/TPL; D: The expression of CD9, CD63, and TSG101 of Exo and FA-Exo/TPL. Scale bar: 100 nm. n = 3, |
药物被靶细胞有效摄取是其发挥疗效的前提, 本实验利用激光共聚焦显微镜考察PKH67标记的Exo/TPL和FA-Exo/TPL的胞内摄取情况。图 2A为FA-Exo/TPL和Exo/TPL与A375细胞共孵育4 h后的入胞分布。图中蓝色代表深染的A375细胞核, 绿色代表PKH67标记的外泌体膜, Merge图为蓝色和绿色荧光的叠加效果图。结果显示, 绿色荧光主要分布在细胞质中, 表明Exo/TPL和FA-Exo/TPL均可被A375细胞摄取。图 2B为FA-Exo/TPL和Exo/TPL与A375细胞共孵育后, 细胞内的平均荧光强度, 表明经叶酸修饰后, 外泌体给药系统更容易被靶细胞摄取, 这可能是由于A375细胞高表达的叶酸受体对叶酸修饰的外泌体有更强的亲和性, 从而增强了细胞摄取。
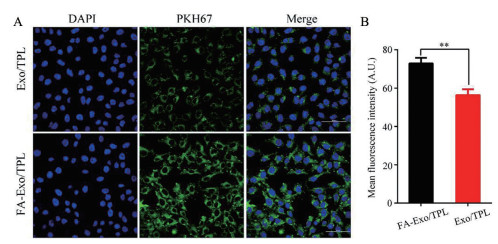
|
Figure 2 Cellular internalization of Exo drug delivery systems. A: Confocal laser scanning microscope images of FA-Exo/TPL and Exo/TPL uptake by A375 cells. Blue: A375 cell nucleus; Green: PKH67-labelled Exo and FA-Exo; B: The mean fluorescence intensity of cells treated with FA-Exo/TPL and Exo/TPL, respectively. Scale bar: 100 nm. n = 3, |
图 3为不同处理组对A375细胞增殖的影响结果。结果表明, 制备的外泌体Exo及经叶酸修饰的外泌体FA-Exo具有良好的生物相容性, 几乎没有细胞毒性。含药组均表现出浓度依赖的细胞毒作用, 以TPL计算, Exo/TPL、TPL和FA-Exo/TPL的半抑制浓度值(half maximal inhibitory concentration, IC50) 分别为60.27、45.54和27.79 ng·mL-1, 表明将TPL包载于Exo中可降低药物本身抑制肿瘤细胞增殖的作用。而将TPL包载于FA-Exo后, 可显著增强TPL细胞毒作用, 可能是由于游离药物组的药物依靠被动运输进入细胞, 可起到快速杀伤肿瘤细胞的作用, 包载于外泌体后增强了其生物相容性, 而经靶向修饰后, 增强了载体与细胞间的相互作用, 易被受体细胞摄取, 药物可在细胞内累积, 从而增强了其抑制A375细胞增殖的作用。
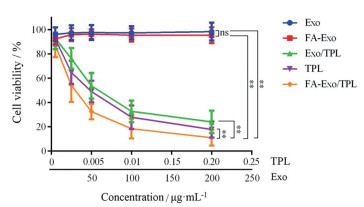
|
Figure 3 The viability of A375 cells after treatment with different concentrations of Exo, FA-Exo, Exo/TPL, TPL, and FA-Exo/TPL. The "TPL" in horizontal axis means the TPL concentration in TPL, Exo/TPL, and FA-Exo/TPL groups; The "Exo" in horizontal axis means the total protein concentration of Exo in Exo and FA-Exo groups. n = 8, |
A375细胞经FA-Exo、Exo/TPL、TPL和FA-Exo/TPL诱导凋亡的结果如图 4所示, FA-Exo组与对照组相比无显著性差异(P > 0.05), 表明FA-Exo没有凋亡诱导作用(图 4A、B)。而图 4C~E显示, Exo/TPL、TPL和FA-Exo/TPL组的细胞出现不同程度的早期凋亡(Q2)、晚期凋亡和坏死(Q3), 且总凋亡率(Q2 + Q3) 依次增加(图 4F)。与Exo/TPL和TPL组相比, FA-Exo/TPL组的细胞凋亡率最高(P < 0.001), 可能与叶酸和细胞表面的叶酸受体相互作用, 增强了肿瘤细胞对TPL的摄取有关, 与细胞增殖实验结果一致。
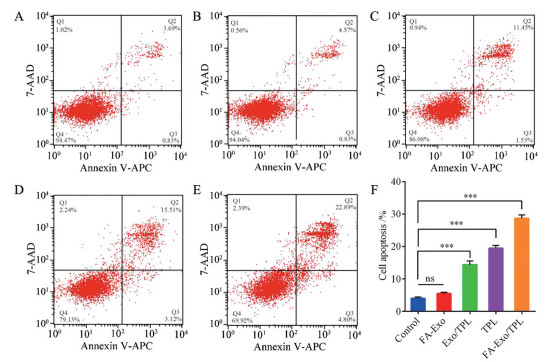
|
Figure 4 Cell apoptosis induced by different treatments for 6 h. A-E: The flow cytometry analysis of A375 cells apoptosis induced by DMEM (A), FA-Exo (B), Exo/TPL (C), TPL (D), and FA-Exo/TPL (E); F: The cells apoptosis rate of different groups. n = 3, |
为考察FA-Exo/TPL的靶向性和体内分布, 构建了黑色素瘤裸鼠模型。给药后, 利用小动物活体系统观察DiR标记的Exo/TPL和FA-Exo/TPL随时间在体内的动态分布情况。图 5结果显示, Exo/TPL和FA-Exo/TPL在肿瘤部位有不同程度的蓄积, 与Exo/TPL组相比, FA-Exo/TPL组随着时间的延长, 表现出更强的肿瘤靶向性, 且在给药4 h时表现出最大的肿瘤部位积累, 随后被代谢出体外, 给药24 h后, FA-Exo/TPL组肿瘤部位的荧光强度仍显著高于Exo/TPL组, 表明经叶酸修饰后, 增强了外泌体给药系统的肿瘤靶向性。肿瘤处的增强渗透和滞留效应(enhanced permeation and retention effect, EPR) 以及肿瘤细胞来源的外泌体的天然归巢特性, 使得Exo/TPL具有一定的肿瘤靶向能力[19]; 根据肿瘤细胞表面高表达叶酸受体的特点, 制备的FA-Exo/TPL进一步增强了与肿瘤细胞的相互作用, 改变外泌体的体内分布特性, 延长了体内半衰期, 实现在肿瘤部位的靶向蓄积, 从而增强药物的抑瘤作用。
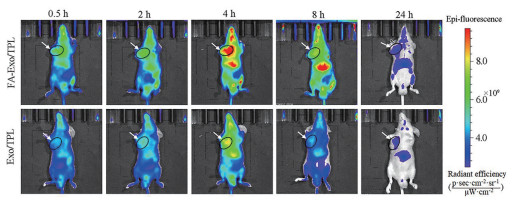
|
Figure 5 Real-time fluorescence images of tumor bearing-mice treating with DiR-labelled Exo/TPL and FA-Exo/TPL at different time. The black circle and white arrow indicate the location of the tumor |
通过考察给药期间肿瘤生长趋势以及给药结束后的瘤重, 分析FA-Exo/TPL在体内抑瘤作用中的优势。图 6A显示, 给药8次后, FA-Exo组与对照组的瘤体积无显著性差异(P > 0.05)。而含药组有不同程度的抑瘤作用: 对照组、TPL组和Exo/TPL组肿瘤体积分别是FA-Exo/TPL组的4.98、3.83和2.30倍。图 6B表明, 给药结束后, FA-Exo/TPL组瘤重最小, TPL组、Exo/TP组和FA-Exo/TPL组的抑瘤率分别是20.97%, 53.69%和78.82%。图 6C肿瘤HE结果显示, 与对照组和FA-Exo组相比, 经TPL、Exo/TPL和FA-Exo/TPL处理后, 肿瘤组织出现不同程度的病理损伤, 包括出血点、坏死灶、核固缩、核破裂等, 其中FA-Exo/TPL组肿瘤组织损伤最为明显。图 6C为TUNEL免疫荧光结果, 其中蓝色代表深染的细胞核, 绿色代表凋亡的细胞, 结果显示, 对照组和FA-Exo组细胞凋亡量较少, TPL组、Exo/TPL组和FA-Exo/TPL组肿瘤细胞凋亡量逐渐增加。以上结果证明FA-Exo/TPL纳米靶向给药系统通过对肿瘤的病理损伤、诱导凋亡等途径有效抑制黑色素瘤恶性增殖。
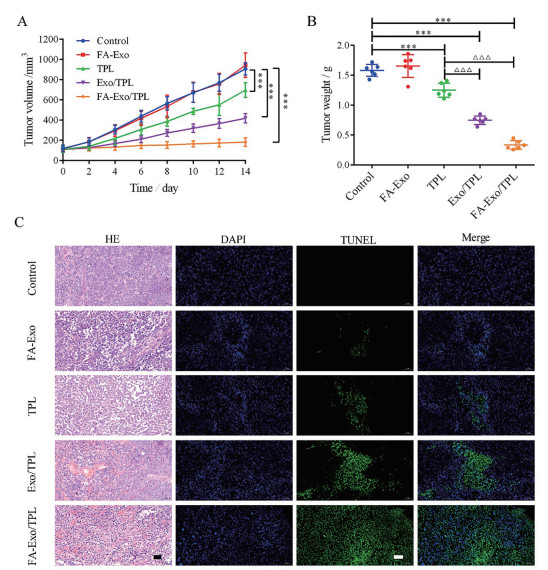
|
Figure 6 Therapeutic efficacy of FA-Exo/TPL in vivo. A: The tumor volume curves of nude mice with different treating during the experiment; B: The weight of tumors dissected from nude mice after administration; C: Representative images of HE and TUNEL staining of tumor section. Blue fluorescence: A375 cell nucleus; Green fluorescence: Apoptotic cells. Scale bar: 50 μm. n = 6, |
生物安全性是给药系统评价的重要指标之一。本研究通过在给药过程中实时检测荷瘤裸鼠的体重变化、给药后机体重要器官的病理学切片以及生存期, 考察FA-Exo/TPL的生物安全性。图 7A显示, TPL组裸鼠在给药后期体重出现下降的趋势, 裸鼠精神萎靡, 表明直接静脉注射TPL溶液会引起严重的系统毒性。Exo/TPL组和FA-Exo/TPL组裸鼠体重均稳定增长, 说明外泌体给药系统机体耐受性好, 无明显的系统毒性。图 7B重要器官的HE切片结果显示, TPL有一定的心脏毒性和肝肾毒性, 主要表现为心肌间质充血扩张, 肝细胞索排列紊乱, 肾小管球毛细血管内皮细胞肿胀等[5], 而其他各组器官均无明显的病理损伤。为考察其长期安全性, 给药2周后, 观察荷瘤裸鼠的肿瘤变化以及动物生存情况。采用Kaplan-Meier检验, 分析荷瘤裸鼠的生存期, 统计结果表明, 对照组和Exo组中位生存期均为25天, TPL组、Exo/TPL组和FA-Exo/TPL组分别为28、37和46天, 表明FA-Exo/TPL外泌体靶向给药系统能显著延长荷瘤裸鼠的生存时间。体内安全性结果表明, 外泌体作为药物载体具有良好的生物相容性, 包载药物后, 在提高抑瘤效果的同时能显著降低药物对机体的不良反应。
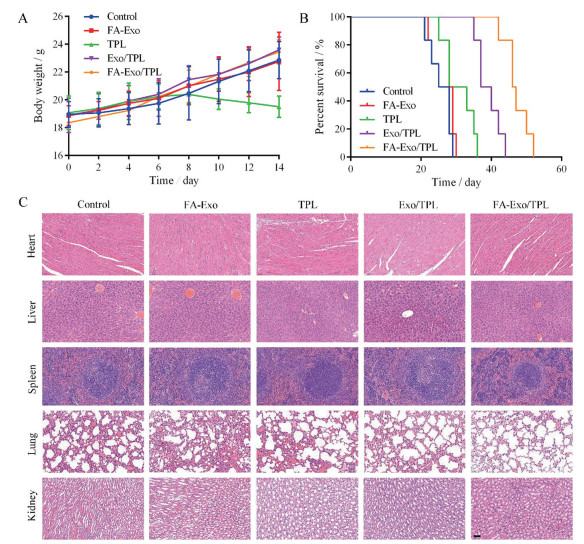
|
Figure 7 The biosafety evaluation of FA-Exo/PTL. A: The body weight of tumor bearing-mice during experiment; B: The Kaplan-Meier survival curves of the mice with different treatment; C: HE photomicrographs of heart, liver, spleen, lung, and kidney (×200), Scale bar: 50 μm. n = 6, |
TPL是中药雷公藤的主要活性成分, 前期研究发现其具有显著的抗恶性黑色素瘤细胞的活性, 但存在水溶性差、对机体的不良反应大等问题。利用纳米给药系统将TPL包载于脂质体、聚合物胶束、纳米粒等在增加TPL的溶解性、实现靶向递送、延长体内循环时间、降低药物不良反应等方面表现出良好的应用前景[20, 21], 但人工合成的纳米材料存在难以降解、易被网状内皮系统清除, 而且TPL纳米给药系统给药后到达肿瘤部位需要克服血液、肿瘤组织、肿瘤细胞和细胞内转运等屏障限制靶向递送效果[22, 23]。而本研究采用肿瘤细胞来源的外泌体作为递送载体, 具有免疫原性低、生物相容好的特点, 更重要的是, A375细胞本身来源的外泌体作为药物载体, 给药后具有天然的靶向归巢作用, 经FA修饰后可进一步增强其靶向递药能力, 是一种优良的天然药物载体。
本研究利用肿瘤外泌体靶向归巢的特点, 以黑色素瘤细胞来源的外泌体为载体, 同时以黑色素瘤细胞表面高表达的叶酸受体为靶点, 制备叶酸修饰的外泌体FA-Exo, 并包载TPL, 制备双靶向外泌体靶向给药系统FA-Exo/TPL。理化性质表征结果表明, 本研究从肿瘤细胞培养上清液中成功分离出外泌体, 在体外靶向、抑制肿瘤细胞增殖和促进细胞凋亡的实验基础上, 进一步构建了荷瘤裸鼠模型考察其体内作用, 结果表明构建的FA-Exo/TPL具有良好的体内靶向性、抑瘤效果和生物安全性。
本研究中, TPL和Exo/TPL的体内外抑瘤效果出现不一致的结果。在体外实验中, TPL的作用效果强于Exo/TPL, 而在体内评价中, Exo/TPL的抑瘤作用明显优于TPL溶液。这可能是由于, 在体外细胞实验中, 游离的TPL分子通过被动扩散进入肿瘤细胞, 起到快速杀伤肿瘤细胞的作用[5]。而在体内评价中, Exo/TPL纳米给药系统具有天然的靶向作用, 可降低网状内皮系统对其的捕获, 延长药物的半衰期, 将TPL靶向递送至肿瘤组织, 使其在肿瘤部位蓄积, 对肿瘤表现出更好的抑制效果[24]。本研究制备的外泌体给药系统将为中药抗肿瘤、难溶性药物的靶向递送以及外泌体作为药物载体抗恶性黑色素瘤探究提供新的思路。
作者贡献: 顾永卫负责实验操作、数据处理和初稿撰写; 姜良弟负责细胞培养和外泌体提取; 杜月负责荷瘤裸鼠的建立和饲养; 李爱雪负责数据核对和分析; 刘继勇负责课题的设计和指导。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Pavri SN, Clune J, Ariyan S, et al. Malignant melanoma: beyond the basics[J]. Plast Reconstr Surg, 2016, 138: 330e-340e. DOI:10.1097/PRS.0000000000002367 |
| [2] |
Wang M, Yuan SM. Progress of biotherapy in malignant melanoma[J]. China Cancer (中国肿瘤), 2017, 26: 555-560. |
| [3] |
McQuade JL, Daniel CR, Hess KR, et al. Association of body-mass index and outcomes in patients with metastatic melanoma treated with targeted therapy, immunotherapy, or chemotherapy: a retrospective, multicohort analysis[J]. Lancet Oncol, 2018, 19: 310-322. DOI:10.1016/S1470-2045(18)30078-0 |
| [4] |
Noel P, Von Hoff DD, Saluja AK, et al. Triptolide and its derivatives as cancer therapies[J]. Trends Pharmacol Sci, 2019, 40: 327-341. DOI:10.1016/j.tips.2019.03.002 |
| [5] |
Jiang LD, Gu YW, Du Y, et al. Engineering exosomes endowed with targeted delivery of triptolide for malignant melanoma therapy[J]. ACS Appl Mater Interfaces, 2021, 13: 42411-42428. DOI:10.1021/acsami.1c10325 |
| [6] |
Gu YW, Tang XM, Yang M, et al. Transdermal drug delivery of triptolide-loaded nanostructured lipid carriers: preparation, pharmacokinetic, and evaluation for rheumatoid arthritis[J]. Int J Pharm, 2019, 554: 235-244. DOI:10.1016/j.ijpharm.2018.11.024 |
| [7] |
Gu Y, Yang M, Tang X, et al. Lipid nanoparticles loading triptolide for transdermal delivery: mechanisms of penetration enhancement and transport properties[J]. J Nanobiotechnology, 2018, 16: 68. DOI:10.1186/s12951-018-0389-3 |
| [8] |
Yang B, Chen Y, Shi J. Exosome biochemistry and advanced nanotechnology for next-generation theranostic platforms[J]. Adv Mater, 2019, 31: e1802896. DOI:10.1002/adma.201802896 |
| [9] |
Zhao X, Wu D, Ma X, et al. Exosomes as drug carriers for cancer therapy and challenges regarding exosome uptake[J]. Biomed Pharmacother, 2020, 128: 110237. DOI:10.1016/j.biopha.2020.110237 |
| [10] |
Qiao L, Hu SQ, Huang K, et al. Tumor cell-derived exosomes home to their cells of origin and can be used as Trojan horses to deliver cancer drugs[J]. Theranostics, 2020, 10: 3474-3487. DOI:10.7150/thno.39434 |
| [11] |
Sánchez-del-Campo L, Montenegro MF, Cabezas-Herrera J, et al. The critical role of alpha-folate receptor in the resistance of melanoma to methotrexate[J]. Pigment Cell Melanoma Res, 2009, 22: 588-600. DOI:10.1111/j.1755-148X.2009.00586.x |
| [12] |
Ogbodu RO, Ndhundhuma I, Karsten A, et al. Photodynamic therapy effect of zinc monoamino phthalocyanine-folic acid conjugate adsorbed on single walled carbon nanotubes on melanoma cells[J]. Spectrochim Acta A Mol Biomol Spectrosc, 2015, 137: 1120-1125. DOI:10.1016/j.saa.2014.09.033 |
| [13] |
Liu Q, Xu N, Liu L, et al. Dacarbazine-loaded hollow mesoporous silica nanoparticles grafted with folic acid for enhancing antimetastatic melanoma response[J]. ACS Appl Mater Interfaces, 2017, 9: 21673-21687. DOI:10.1021/acsami.7b05278 |
| [14] |
Majidi FS, Mohammadi E, Mehravi B, et al. Investigating the effect of near infrared photo thermal therapy folic acid conjugated gold nano shell on melanoma cancer cell line A375[J]. Artif Cells Nanomed Biotechnol, 2019, 47: 2161-2170. DOI:10.1080/21691401.2019.1593188 |
| [15] |
Shao H, Im H, Castro CM, et al. New technologies for analysis of extracellular vesicles[J]. Chem Rev, 2018, 118: 1917-1950. DOI:10.1021/acs.chemrev.7b00534 |
| [16] |
Jing T. Construction of Tumor-targeted Exosomes with Co-loading of Docetaxel and siPLK1 and Their Anti-prostate Cancer Effects (共载多西紫杉醇和siPLK1的肿瘤靶向外泌体构建及其抗前列腺癌作用研究) [D]. Shanghai: Navy Military Medical University, 2019.
|
| [17] |
Kim MS, Haney MJ, Zhao Y, et al. Development of exosome-encapsulated paclitaxel to overcome MDR in cancer cells[J]. Nanomedicine, 2016, 12: 655-664. DOI:10.1016/j.nano.2015.10.012 |
| [18] |
Lin Q, Qu MK, Zhou BJ, et al. Exosome-like nanoplatform modified with targeting ligand improves anti-cancer and anti-inflammation effects of imperialine[J]. J Control Release, 2019, 311-312: 104-116. DOI:10.1016/j.jconrel.2019.08.037 |
| [19] |
Kalyane D, Raval N, Maheshwari R, et al. Employment of enhanced permeability and retention effect (EPR): nanoparticle-based precision tools for targeting of therapeutic and diagnostic agent in cancer[J]. Mater Sci Eng C Mater Biol Appl, 2019, 98: 1252-1276. DOI:10.1016/j.msec.2019.01.066 |
| [20] |
Li T, Huang G, Song SL. Anti-tumor mechanism of triptolide and its new drug delivery system[J]. Acta Chin Med (中医学报), 2021, 36: 1452-1456. |
| [21] |
Xu H, Liu B. Triptolide-targeted delivery methods[J]. Eur J Med Chem, 2019, 164: 342-351. DOI:10.1016/j.ejmech.2018.12.058 |
| [22] |
Luo RR, Shi JF, Chen L, et al. Research progress on triptolide functionalized nanoparticulate drug delivery systems for tumor treatment[J]. China J Chin Mater Med (中国中药杂志), 2019, 44: 4566-4572. |
| [23] |
Viegas J, Praça F, Kravicz M, et al. Therapeutic applications and delivery systems for triptolide[J]. Drug Deliv Transl Res, 2020, 10: 1584-1600. DOI:10.1007/s13346-020-00827-z |
| [24] |
Li S, Wu YJ, Ding F, et al. Engineering macrophage-derived exosomes for targeted chemotherapy of triple-negative breast cancer[J]. Nanoscale, 2020, 12: 10854-10862. DOI:10.1039/D0NR00523A |
 2021, Vol. 56
2021, Vol. 56


