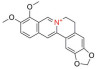
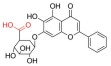
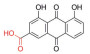
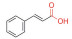
史记言: “神农氏尝百草, 始有医药”。追溯中药的发展历史可以发现: “世间百草皆入药”, 中药是人类在逐步认识自然和总结实践经验过程中的智慧产物。传统中医药是中华民族数千年来的智慧结晶, 随着技术的发展和进步, 对中药活性成分的提取分离、鉴定、药理活性、分析和制剂等方面均展开了深入的研究, 现代中药具有更广泛的应用。根据中药活性成分的结构可将其划分为黄酮、生物碱、萜类、醌类和多酚类等。目前已有多种中药活性单体被应用于临床疾病, 包括心血管疾病、皮肤病、消化道疾病、糖尿病及恶性肿瘤等。
中药作为现代医学的辅助和补充, 在世界范围内正受到越来越多的关注。中药正在为迈向现代化作出巨大的努力, 试图弥合中药与西药之间的差距。单一中药含有成千上百种化合物, 并且中药方剂“君臣佐使”的配伍原则指导不同药材的联合使用。但中药和西药在疾病治疗原理上是相通的, 即纠正紊乱的功能障碍网络, 恢复正常生理状态, 使机体重新平衡, 因此中药中的有效成分与其靶点之间的关系应该是连接中药和现代医学的关键因素。
在分子水平上, 中药方剂是多成分且多靶点的制剂, 作用机制也多种多样, 起效机制包括: 裂解特定细菌的细胞膜而起到抗菌效果, 调控前列腺素E2释放的不同关键环节产生抗炎作用[1], 作用于血管紧张素Ⅱ 1型受体、血管紧张素转化酶2和信号转导与转录激活因子3等协同治疗心血管疾病, 通过阻断肿瘤细胞增殖的周期、抗血管生成、激活机体的免疫反应等发挥抗肿瘤作用等。中药活性成分同时具有多种功效, 单一成分可作用于不同环节的不同靶点, 如萜类药物雷公藤甲素既可用于多种癌症治疗, 还具有镇痛、抗炎和免疫调节活性; 黄酮类药物黄芩苷具有解热、抗炎、抗菌、抗氧化和抗肿瘤活性; 生物碱类药物小檗碱具有抗菌、抗炎、抗糖尿病和抗肿瘤活性[2]。醌类药物大黄酸具有保肝、抗炎、抗氧化、抗癌和抗菌活性; 多酚类药物姜黄素具有很好的抗氧化、抗炎、伤口愈合、抗菌和抗肿瘤活性[3]。
尽管中药可通过其复杂的成分和靶点对疾病起到预防和治疗作用, 却也存在一些不足之处, 如中药制剂类型比较单一, 并且其中的大多数有效成分溶解度差、生物利用度低, 这些问题限制了中药的药效[4]。目前中药提取成分的成药性仍较差, 因此高效且安全的递送中药活性分子是提升其药效的关键。针对不同的药物性质和给药需求, 胶束、脂质体、微乳、聚合物纳米粒、纳米晶和混悬剂等纳米药物递送系统层出不穷, 可满足口服、注射或外用等不同的给药途径[5]。
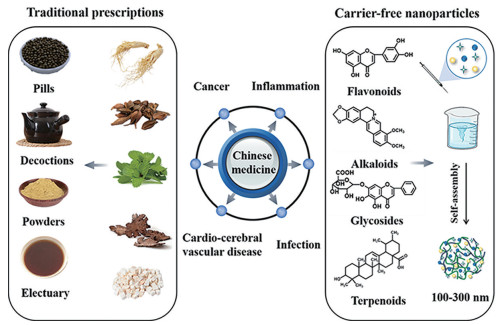
1 中药纳米制剂的优势在医学领域, 纳米技术有望解决一些与传统治疗药物相关的问题, 包括水溶性差、缺乏靶向性、非特异性分布、全身毒性强等问题。将治疗药物制备成具有最佳尺寸(10~1 000 nm) 的纳米粒, 可以增加其溶解度, 延长药物在体内的半衰期, 改善生物分布, 并降低免疫原性; 还可以通过调整纳米粒的粒径大小、形态和表面性质等来改善纳米粒的物理化学性质[6]。正因为纳米制剂的这些优势, 目前已有越来越多的从中药中提取的活性成分被用于制备纳米制剂。众所周知, 中药主要是以汤剂的形式来服用, 但由于中药的有效成分复杂, 可能会引起不同程度的不良反应, 研究者们利用纳米技术将这些有效成分制成纳米制剂, 有效改善了中药的这些局限性(图 1)。
|
Figure 1 Schematic diagram of Chinese herbal compound preparations and carrier-free nanoparticles. The strategy based on self-assembly of active ingredients from Chinese medicine has opened up a new application field for the modernization of Chinese medicine, which is expected to improve the therapeutic effect of Chinese medicine |
目前纳米递送系统用于单一中药活性分子递送的研究较多, 对中药复方的报道较少, 主要原因在于众多中药复方成分的理化性质差异较大, 纳米载体难以满足复方药物的共载[7]。越来越多的研究[8, 9]证明中药活性分子之间可通过自组装形成纳米粒, 目前已有一系列基于中药活性分子自组装的纳米制剂的研究成果出现, 通过这种自组装技术可克服中药提取成分在应用上的局限性。这种纯天然产物自组装纳米粒具有以下优势: 无需载体, 不良反应小; 载药能力好, 药代动力学好; 可抑制多药耐药性; 发挥协同治疗作用, 在相同剂量下, 疗效优于游离药物治疗组; 可用于构建诊断和治疗的一体化智能纳米系统[10]。作为一个新兴领域, 目前对天然产物自组装体的研究主要集中在探索新的药物自组装体和中药活性分子自组装前后的生物活性对比。
2 自组装作用力自组装是指分子或分子聚集体通过氢键、范德华力、π-π堆积、静电作用和配位键等非共价键的弱相互作用, 通过加合效应和协同作用形成稳定的、具有特定结构的自组装体系, 尤其是分子间氢键, 自组装作用力主要由氢键之间或氢键与其他非共价键的协同作用所构成。分子之间通过氢键作用力结合时, 可形成单一氢键和多重氢键, 氢键的多重性越强, 分子之间的结合能和稳定性越强[11]。有研究发现[12], 由于中药提取成分具有结构多样性, 一些天然中药分子具有自组装特性, 可与其他分子通过非静电作用力组装起来。自组装纳米药物制备步骤简单, 并具有高载药量, 而且可在没有任何载体的情况下实现药物的高度稳定递送。目前常见的具有自组装特性的中药天然小分子主要包括: 三萜、类固醇、糖苷、多肽类和蒽醌类等。这些天然产物可在不同溶剂的界面自组装形成纳米粒。表 1列举了目前已报道具有自组装特性的纯天然中药分子及其自组装机制。
| Table 1 Common active molecules from Chinese medicines in self-assembly nanoparticles |
中药自组装纳米制剂的优势突出, 越来越多的科研工作者对这方面展开相关研究。下文将主要概述目前已有的具有抗肿瘤和抗菌等效果的中药天然产物自组装纳米制剂, 并总结这些纳米制剂的组装机制以及在疾病治疗中发挥的协同效应。
3.1 中药自组装纳米粒在抗菌方向的应用小檗碱属于异喹啉生物碱, 主要存在于黄连和黄柏中。小檗碱可增加细胞膜的通透性, 与脱氧核糖核酸(deoxyribonucleic acid, DNA) 相互结合而起到抗菌作用。金葡菌对小檗碱十分敏感, 浓度为0.05 mmol·L-1的小檗碱对金葡菌的抑制率可达76.07% ± 6.00%[13]。在临床上小檗碱被广泛用于治疗细菌性腹泻, 且不易产生耐药性。然而小檗碱水溶性较差, 有不易耐受的苦味, 为了提高小檗碱的溶解度和生物利用度, 小檗碱常与其他中药活性分子自组装成纳米制剂用于抗菌治疗。小檗碱上的季铵离子和苯环结构可与其他天然产物尤其是黄酮类化合物组装成粒径适宜的纳米粒, 协同发挥抗菌作用; 同时可降低不良反应, 减弱苦味。由于小檗碱具有优异的抗菌性能及自组装能力, 当前中药制剂抗菌方向的应用探索主要是基于小檗碱的中药复方纳米制剂。
3.1.1 小檗碱和黄芩苷传统的葛根芩连汤主要含有黄连、黄芩、葛根、炙甘草, 是用来治疗湿热所致的急性腹泻和痢疾的经典方剂[14]。黄芩的主要成分黄芩苷可通过下调金葡菌细胞中的半胱氨酸蛋白酶-9的表达, 从而抑制其活性[15]。Li等[13]通过研究这一方剂的主要活性成分, 成功地将黄芩苷和小檗碱以1∶1的摩尔比组装成稳定的纳米粒。小檗碱与黄芩苷在水溶液中形成自组装体的主要驱动力是小檗碱中的季铵离子和黄芩苷中的羧基之间形成的静电作用。二者形成一维结构后, 在氢键作用下继续形成三维纳米结构。研究发现, 组装后形成的凝胶型自组装体的抗菌活性有所增强, 小檗碱的半衰期延长, 不良反应降低, 苦味减弱。
3.1.2 小檗碱和大黄酸古代《素问病机气宜保命集》讲到“单用一味大黄治疗湿热积滞的痢疾即可见效, 或与黄连、黄芩、白芍等同用”。大黄酸是存在于大黄中的一种亲脂蒽醌类化合物, 常与氨苄西林(ampicillin) 或苯唑西林(oxacillin) 等抗生素联合使用, 可对耐甲氧西林金葡菌(methicillin-resistant Staphylococcus aureus, MRSA) 发挥协同抗菌作用。大黄酸主要通过抑制金葡菌线粒体的呼吸链电子传递, 同时抑制细菌的DNA复制, 干扰蛋白质合成, 从而抑制细菌生长[16]。Tian等[17]构建小檗碱和大黄酸自组装纳米给药系统以提高对金葡菌的抑菌活性。文中结合X射线单晶衍射与核磁共振等表征手段, 揭示了纳米粒的内部堆积结构及形成机制: 小檗碱和大黄酸首先通过异喹啉环和蒽环之间的π-π堆积以及静电作用形成基本单元; 在不同基本单元的大黄酸分子间可形成氢键从而构建层状骨架, 即大黄酸之间形成层状骨架; 小檗碱嵌入层状骨架中, 两者在摩尔比为1∶1时可形成结构稳定的纳米组装体。由于大黄酸的蒽醌环对膜有很强的亲和力, 导致纳米粒可黏附在细菌表面, 并在细菌的细胞膜上解体, 释放小檗碱和大黄酸, 进一步影响细菌的生理功能和结构完整性, 致其死亡。
3.1.3 小檗碱和肉桂酸黄连和肉桂是《韩氏医通》中提过的一味中药, 主要用于治疗心肾不交而导致的失眠[18]。近代明医张锡纯在《医学衷中参西录》中针对这两味药提出: “治下痢服前药未痊愈者, 若下痢已数日, 亦可运用此汤。”并证实该中药复方可用于调节肠道菌群。受临床药物组合的启发, Huang等[19]提出了基于植物来源的天然产物的自组装体可用于克服细菌耐药性的治疗策略。来源于肉桂的肉桂酸具有抗氧化、抗菌、抗癌、抗炎和抗糖尿病的特性, 可提供电子, 与自由基反应形成稳定的产物来终止自由基链式反应。小檗碱和肉桂酸分子的羧基、芳香环和共轭结构参与了纳米粒的自组装过程。在这一过程中, 肉桂酸的羰基可与小檗碱的氮原子形成氢键, 同时两个分子的芳香环形成π-π堆积结构。不需使用任何载体和附加剂, 具有良好的连续释药能力和生物相容性。小檗碱和肉桂酸能够以1∶1的摩尔比通过溶剂沉淀法形成稳定纳米粒, 该纳米制剂体内外毒性很小, 可以应对多耐药的金葡菌。相比诺氟沙星、阿莫西林、四环素这些一线抗生素, 该自组装体有更高的抑制活性和更强的细胞膜清除能力。该自组装体能自发地吸附于细菌表面, 渗入细胞, 攻击多耐药的金葡菌。这种定向自组装模式可能是一种有希望的替代治疗策略, 以面对MRSA感染的威胁。
3.1.4 小檗碱和鼠李糖脂小檗碱不仅对金葡菌具有较好的杀伤作用, 还可通过抑制N-乙酰转移酶和脲酶的活性来杀死幽门螺杆菌, 从而缓解胃炎和胃癌。此外, 小檗碱亦调节细胞内Ca2+水平、清除自由基, 从而减少黏膜炎症。更重要的是, 小檗碱作为一种天然抗菌剂, 还可以抑制微生物黏附以及生物膜的生长。鼠李糖脂(rhamnolipids) 是一种由铜绿假单胞菌分泌的阴离子表面活性剂, 它不仅可通过阻止细菌的黏附而阻碍生物膜的形成, 还能显著破坏已形成的生物膜。Shen等[20]合成了一系列烷基修饰的小檗碱衍生物。由于烷基的存在, 小檗碱衍生物具有更高的疏水性, 对幽门螺杆菌有更高的抗菌效率。这些小檗碱衍生物可与鼠李糖脂组装成稳定的纳米粒, 通过分子动力学模拟的手段证实其自组装驱动力为静电和疏水相互作用力。当小檗碱衍生物与鼠李糖脂的质量比为1∶4时, 所形成的纳米粒的尺寸最佳, 多分散指数最小。并且该纳米粒具有强亲水性, 因而可成功穿透黏液层但不与黏蛋白相互作用。经验证, 该纳米粒可显著破坏浮游幽门螺杆菌的胞外聚合物并根除幽门螺杆菌生物膜, 同时还可抑制幽门螺杆菌在生物表面和非生物表面上的黏附。
3.2 中药自组装纳米制剂在抗肿瘤方向的应用中药活性分子具有有效的抗癌作用, 且一定程度上可减轻化疗的不良反应。中药制剂在抗肿瘤方向的优势为: 通常含有多种活性成分, 可同时作用于多个靶点, 产生相加或协同作用。中药制剂的抗肿瘤作用的机制主要可归纳为以下几个方面: ①提高免疫细胞如T细胞(胸腺依赖性淋巴细胞, thymus dependent lymphocyte)、自然杀伤细胞(NK细胞, natural killer cell) 的活性以杀伤肿瘤细胞的活性; ②直接作用于肿瘤细胞, 抑制肿瘤生长和转移; ③缓解机体因化疗、放疗或手术切除等治疗造成的不良反应或并发症[21]。从中药中分离得到的天然产物由于其化学结构的多样性而成为新药的主要来源[22]。为了最大程度地降低中药的复杂成分引起的治疗上的不确定性, 越来越多的研究者们将中药的有效成分单独提取出来, 通过自组装的手段将中药做成制剂形式, 改善其溶解性和生物利用度低等缺点。近年来以萜类化合物为主的天然产物的自组装特性受到了密切关注, 将中药提取成分通过溶剂沉淀法、乳化挥发法等方法自组装成一系列的稳定且抗肿瘤疗效较好的纳米制剂。
3.2.1 基于萜类化合物的自组装纳米制剂功能性三萜类化合物由于具有不同数量的羟基和羧基, 因此可自发组装形成纳米结构[23]。熊果酸是一种五环三萜类化合物, 存在于许多天然植物中, 目前已有许多研究报道了熊果酸在癌症预防和治疗方面的潜力: 对肿瘤微环境的重塑有很大影响, 在细胞增殖、凋亡和细胞周期调控等活动中可发挥直接作用。值得注意的是, 熊果酸能够以剂量和时间依赖的方式诱导细胞凋亡, 并能阻断乳腺癌、结肠癌、肺癌等癌细胞系的细胞周期[24]。Fan等[25]通过熊果酸分子的自组装来设计了一种无载体的纯纳米药物。这一过程基于熊果酸分子之间的氢键和疏水作用, 可形成粒径在100~200 nm的稳定纳米粒, 载药量高达60%。相比游离熊果酸, 该纳米制剂显著抑制癌细胞的增殖和诱导其凋亡。体内研究表明, 该纳米制剂可显著抑制肿瘤生长, 并对A549细胞(人非小细胞肺癌细胞) 异种移植瘤小鼠具有保护肝脏的作用。免疫分析显示, 熊果酸纳米粒可显著提高A549细胞异种移植肿瘤的小鼠体内的分化抗原4+ (cluster of differentiation 4+, CD4+) T细胞的数量, 调节肿瘤微环境内细胞因子水平, 改善免疫抑制微环境。这种新型的无载体纳米药物平台是一种有前景的提高水不溶性抗癌药物的抗癌效果的策略, 具有免疫治疗的潜力。
除了熊果酸, 许多萜类化合物都具有自组装特性, 茯苓中提取的三萜类化合物——茯苓酸A分子具有碳碳双键、羟基和羧基, 这些分子之间可以通过π-π堆积和氢键等作用力形成自组装纳米粒。Zhi等[12]发现茯苓酸A具有生物活性并可自组装成可注射凝胶。这种注射性能良好的凝胶可在体内缓慢降解, 既可利用自身茯苓酸A分子发挥疗效, 又可与其他药物协同作用发挥抗肿瘤疗效。这种具有生物活性的凝胶传递系统为肿瘤治疗开创了一个新方向, 并表明了天然产物可通过自组装形成生物功能材料的潜在用途。另外, Yang等[26]发现松苓新酸能够通过分子间氢键形成纳米粒, 并且可有效包载亲水性或疏水性药物, 且胃肠渗透性好。这种由低毒性天然材料制成的纳米粒可通过口服给药, 有效递送药物, 用于癌症等疾病治疗。
齐墩果酸是一种广泛存在于植物中的三萜化合物, 对多种肿瘤细胞系都具有抗肿瘤活性。它可在肿瘤生长的各个阶段促进肿瘤细胞的凋亡, 调节肿瘤微环境[27]。甘草次酸是来源于一种可食用的草药甘草, 研究表明其可以通过抗血管生成抑制肿瘤生长[28]。Wang等[29]利用齐墩果酸和甘草次酸不同的抗癌机制, 以及它们的自组装特性, 成功地将齐墩果酸和甘草次酸通过氢键和疏水作用组装, 形成稳定性好、载药量高并具有缓释功能的纳米制剂。此外, 该自组装纳米制剂还可以包载化疗药物紫杉醇进行联合给药, 增强抗肿瘤疗效。同时, 由于齐墩果酸和甘草次酸具有免疫调节功能, 可有效减少紫杉醇引起的肝损伤。
3.2.2 基于紫杉醇的自组装纳米制剂从红豆杉中提取出来的芳香类物质紫杉醇是一种优良的天然抗肿瘤药物, 广泛用于乳腺癌、卵巢癌和肺癌的治疗。但其疏水性强, 严重阻碍了它们的生物利用度, 因此需要药物递送系统的辅助[30]。Wang等[31]利用紫杉醇和熊果酸的抗肿瘤活性以及自组装特性, 将两种药物通过自组装技术制备纳米制剂。该纳米制剂的主要驱动力为氢键和疏水作用, 并发现随着紫杉醇浓度的增大, 纳米粒更趋向于不规则形态且粒径有所增大, 在紫杉醇与熊果酸的摩尔比为1∶4时, 纳米粒呈完整的球形, 并且粒径小于200 nm。这种纳米制剂延长了紫杉醇和熊果酸的血浆半衰期, 有效防止药物在体内快速泄漏。熊果酸具有良好的生物相容性和特异的生物活性。紫杉醇-熊果酸纳米粒不仅体现了紫杉醇的优良抗癌活性, 还保留了熊果酸的抗肿瘤和肝脏保护作用, 两者起到很好的协同作用。总之, 这种“生物活性纳米载体”的概念可以扩展到各种具有自组装功能的活性天然小分子, 并可适用于多种疾病的协同治疗, 在减缓特定药物的严重不良反应方面也有独特的优势。
小檗碱除了具有抗菌、抗病毒、抗糖尿病、抗炎作用以外, 还具有抗肿瘤活性。小檗碱可选择性地积累到癌细胞的线粒体中, 降低线粒体膜电位、上调活性氧水平和诱导线粒体膜通透性改变, 从而杀死肿瘤细胞。小檗碱被证明可诱导细胞周期停滞, 并抑制乳腺癌细胞的磷脂酰肌醇3/蛋白激酶B (phosphatidylinositol 3 kinase/protein kinase B, PI3K/Akt) 信号通路从而诱导细胞凋亡。此外, 研究表明小檗碱也可通过抑制异黏蛋白(metadherin, MTDH) 的表达, 从而抑制乳腺癌细胞的增殖及存活。
Cheng等[32]利用化学合成的方式将紫杉醇和小檗碱通过二硫键连接起来。这种偶联物分子之间可通过疏水作用和π-π堆积作用在水溶液中自组装形成纳米粒。小檗碱可以在肿瘤细胞的线粒体中积累, 抑制肿瘤细胞的生长, 减缓紫杉醇的多重耐药性。该纳米粒可以实现线粒体靶向给药, 减轻耐药性, 并且还能达到控释效果, 提高抗肿瘤的疗效, 尤其是对A549细胞, 纳米粒在与A549细胞共同孵育48 h后, 被测量的拮抗剂的半数抑制浓度(half maximal inhibitory concentration, IC50) 值为0.243 ± 0.014 μmol·L-1。此外, 该纳米制剂对抑制金葡菌也有更好的疗效, 在治疗细菌感染性的肺癌方面也具有很大潜力。
3.2.3 基于表没食子儿茶素没食子酸酯(epicallocatechin gallate, EGCG) 的自组装纳米制剂许多临床前研究发现绿茶中的EGCG对许多疾病有治疗和缓解作用。EGCG具有抗氧化能力, 可保护健康细胞免受因过氧化而引起的损伤。EGCG同时也是一种抗血管生成和抗肿瘤的药物, 可增加肿瘤细胞对化疗药物的敏感性。绿茶的许多抗癌化学特性均是由EGCG介导的, EGCG通过阻滞肿瘤细胞周期, 调控蛋白表达、激活半胱氨酸蛋白酶、抑制癌基因转录因子等从而引起肿瘤细胞凋亡和细胞生长阻滞。EGCG由于其安全性好、成本低和生物利用度高等优点, 在癌症预防和治疗方面具有很大的潜力[33]。
Zhang等[34]将熊果酸和EGCG结合成纳米制剂: 首先熊果酸通过简单的自组装形成纳米粒, 然后在纳米粒表面包覆EGCG, 形成核壳结构。两个药物分子之间的主要作用力是氢键和疏水相互作用。最后在纳米粒表面添加上皮细胞黏附分子(epithelial cell adhesion molecule, EpCAM) 进行修饰, 可增强纳米粒的稳定性和靶向性。纳米粒的粒径随着熊果酸和EGCG的比值的变化而不规则地变化, 通过不同比例验证得出熊果酸与EGCG的最佳摩尔比为10∶1, 此时纳米粒的粒径小且载药量高。熊果酸具有保护肝脏和有效抑制肿瘤生长的优点, 适合肝癌的治疗; EGCG很容易在酸性环境下产生降解, 导致肿瘤组织中药物释放增加, 从而提高抗癌能力。该纳米制剂可在体内激活机体免疫, 有效发挥抗肿瘤作用。该纳米系统具有良好的稳定性、对酸碱度的响应性、协同杀伤肿瘤细胞效应和肝癌细胞的有效摄取。此外, 该纳米制剂具有更显著的免疫刺激功效, 表现为促进白细胞介素-12 (interleukin-12, IL-12) 和干扰素-γ (interferon-γ, IFN-γ) 的分泌、有效激活T细胞的CD4+和CD8+并增强其在肿瘤组织中的浸润。这种双药治疗的协同作用, 可能在未来的临床试验中对肝癌产生免疫治疗的协同诱导作用。
3.3 中药自组装纳米粒在其他疾病上的应用 3.3.1 大黄酸自组装凝胶用于抗神经炎症大黄是很常见的一种中药材, 具有多种药理作用, 包括抗炎、抗菌等。大黄酸作为一种典型的蒽醌化合物, 具有良好的组装特性。Zheng等[35]通过实验证实大黄酸可以通过π-π堆积、氢键等非共价相互作用力自组装成水凝胶。这种水凝胶呈三维结构, 可防止大黄酸过早降解, 具有优异的稳定性、持续释放药物的能力。相比游离药物, 大黄酸超分子水凝胶更容易进入细胞, 达到很好的积聚效果。大黄酸自组装凝胶比游离药物更容易进入细胞, 并产生较好的积聚效果。大黄酸进入细胞后抑制Toll样受体4/核因子-κB (Toll-like receptor 4/nuclear factor-κB, TLR4/NF-κB) 信号通路, 可达到最佳的抗炎效果。从本质上提高了治疗效果, 减少了不良反应。这些特点促使大黄酸水凝胶成为一种有前途的抗神经炎症治疗剂。
3.3.2 木犀草素与铁离子配位自组装用于光热治疗一些天然产物还可与金属离子通过配位作用结合成纳米粒, 用于后续的光热辅助治疗。木犀草素是一种存在于金银花和筋骨草等多种草药的黄酮化合物, 具有多种药理作用, 包括抑制肿瘤、减轻炎症、免疫调节和抑制病毒复制的作用。尽管木犀草素易于从自然界获取, 具有良好的生物相容性和低毒性, 但其溶解性和生物稳定性较差, 因此严重阻碍了其在生物医学中的应用。Liu等[36]将木犀草素和Fe3+以2∶1的摩尔比利用金属离子-配体的配位组装, 形成了稳定的药物递送系统。配位作用是一种中等强度的分子间力, 这种作用力比氢键和范德华力强, 但比共价作用弱, 配位作用力强度可以通过环境条件进行调整。组装之后的纳米制剂不仅提高了木犀草素的溶解度和稳定性, 并且抗氧化稳定性增强。另外, 与Fe3+配位的纳米粒显示出超分子光热效应, 可应用于光热治疗。
4 总结与展望中药制剂在漫长的发展历程中, 药物的性味归经、配伍与禁忌、加工炮制等已形成系统的理论体系, 尤其是煎剂、散剂、丸剂等在民间广泛使用。随着现代科学理论与技术的进步, 中药制剂的制备工艺、治疗功效、质量控制等开展了更深入的研究, 中药制剂得到显著的进步。基于中药活性分子自组装策略的纳米制剂, 利用具有生物活性的天然药物成分, 通过自组装特性本身作为载体, 无需引入其他材料, 提高药物的递送效率的同时发挥药效, 降低不良反应。中药活性分子自组装纳米制剂克服载体材料的局限性, 制备过程简单环保。另外由于天然药物成分具有多种多样的治疗功效, 不同药物分子的自组装纳米制剂可在多种疾病上起到协同作用。
如上所述, 本文总结了基于中药活性分子自组装的纳米制剂及其在治疗各类疾病中的优势。然而, 白玉微瑕, 基于中药活性分子自组装的无载体纳米制剂在临床转化方向依然存在以下缺陷: ①中药复方成分复杂, 然而当前对中药复方制剂的活性成分分离技术并不成熟, 无法鉴定和分离各种有效成分, 这是纳米制剂进一步转化的先决条件, 是当前中药学仍需发展的重点; ②中药复方发挥作用多为多药联合起效, 受限于中药分子自组装特性, 当前纳米制剂仍局限于两药联合, 关于三药乃至多药自组装的报道较少。因此, 中药纳米制剂的治疗效果受限于药物自组装的成分, 是未来需要提升的方向; ③当前中药活性分子之间的自组装的作用力主要基于非共价作用力, 因此中药分子自组装纳米制剂往往存在物理化学稳定性较差的缺陷。如何提升纳米制剂的稳定性将是推动其临床转化的关键之一; ④无载体纳米制剂在疾病治疗中或缺少特异靶向性, 被动靶向效应无法实现纳米制剂在病灶部位的有效积累, 同时受限于生物屏障, 纳米制剂的递送速率仍待提升。针对以上提出的中药纳米制剂的缺陷, 笔者认为随着中药分析手段和分离技术的提升, 纳米制剂的缺陷终将迎刃而解; 针对稳定性方面的缺陷, 可通过加入适量的表面活性剂, 如聚乙二醇、普朗尼克F127等, 以增加纳米粒的物理稳定性; 通过改善纳米粒的粒径、电荷或pH等特性来调节纳米制剂的靶向特性及穿透生物屏障效率。至此, 中药活性分子自组装的纳米制剂的研究方兴未艾, 虽然目前对此方向的研究不够深入, 仍亟待更多的研究人员进行深入的探索, 但是中药纳米制剂的发展将是中药学发展的一个重要分支, 或许是拓展中药临床应用的关键方向。
作者贡献: 冯星星负责综述的撰写与修改; 谢琪负责部分内容的撰写与修改; 杨丛莲负责综述的修改; 孔丽和张志平负责综述的指导与修改。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Yu S, Lu Y. Discussion on action mechanisms of traditional Chinese medicine[J]. Chin J Pharmacol Toxicol (中国药理学与毒理学杂志), 2018, 32: 347-354. |
| [2] |
Guo JH, Ren G, Jiang JD. Research progress on anti-hepatocellular carcinoma of berberine by improving metabolism[J]. Drugs Clin (现代药物与临床), 2018, 33: 703-708. |
| [3] |
Qiao L, Han MS, Gao SJ, et al. Research progress on nanotechnology for delivery of active ingredients from traditional Chinese medicines[J]. J Mater Chem B, 2020, 8: 6333-6351. DOI:10.1039/D0TB01260B |
| [4] |
Yuan P, Guo XC, Zhang JP, et al. Research progress of the exosomes as drug delivery vehicles of Chinese herbal drugs[J]. Acta Pharm Sin (药学学报), 2017, 52: 1667-1672. |
| [5] |
Gao MY, Fu JX, Wang XT. Major progress in tumor accumulation and penetration of nanomedicine[J]. Acta Pharm Sin (药学学报), 2021, 56: 138-145. |
| [6] |
Sun TM, Zhang YS, Pang B, et al. Engineered nanoparticles for drug delivery in cancer therapy[J]. Angew Chem Int Ed Engl, 2014, 53: 12320-12364. |
| [7] |
Zhang Y, Ding CC, Wen L, et al. Core-shell magnetic poly (lactic-co-glycolic acid) nanosystem for tempo-spatially controlled release kinetics of multiple components of traditional Chinese medicine formula[J]. Acta Pharm Sin (药学学报), 2018, 53: 1968-1975. |
| [8] |
Li L, Cui HR, Li T, et al. Synergistic effect of berberine-based Chinese medicine assembled nanostructures on diarrhea-predominant irritable bowel syndrome in vivo[J]. Front Pharmacol, 2020, 11: 121. DOI:10.3389/fphar.2020.00121 |
| [9] |
Tucker IM, Burley A, Petkova RE, et al. Adsorption and self-assembly properties of the plant based biosurfactant, glycyrrhizic acid[J]. J Colloid Interface Sci, 2021, 598: 444-454. DOI:10.1016/j.jcis.2021.03.101 |
| [10] |
Yang MY, Zhao RR, Fang YF, et al. Carrier-free nanodrug: a novel strategy of cancer diagnosis and synergistic therapy[J]. Int J Pharm, 2019, 570: 118663. DOI:10.1016/j.ijpharm.2019.118663 |
| [11] |
Zhang XB, Li M. Recent progress in rod-coil molecules by self-assembly via lateral intermolecular H-bonding[J]. Chin J Org Chem (有机化学), 2009, 29: 528-535. |
| [12] |
Zhi KK, Wang JC, Zhao HT, et al. Self-assembled small molecule natural product gel for drug delivery: a breakthrough in new application of small molecule natural products[J]. Acta Pharm Sin B, 2020, 10: 913-927. DOI:10.1016/j.apsb.2019.09.009 |
| [13] |
Li T, Wang PL, Guo WB, et al. Natural berberine-based Chinese herb medicine assembled nanostructures with modified antibacterial application[J]. ACS Nano, 2019, 13: 6770-6781. DOI:10.1021/acsnano.9b01346 |
| [14] |
Zhang M, Du CH, Li J, et al. Comparative study of Chinese medicine Gegen Qinlian Decoction Piece and boiled powder for the treatment of diabetes based on serum metabolomics[J]. Acta Pharm Sin (药学学报), 2017, 52: 1444-1451. |
| [15] |
Jia F, Ma WW, Zhang XJ, et al. Matrine and baicalin inhibit apoptosis induced by Panton-Valentine leukocidin of Staphylococcus aureus in bovine mammary epithelial cells[J]. J Dairy Sci, 2020, 103: 2731-2742. DOI:10.3168/jds.2019-17619 |
| [16] |
Chen QH, Pi RB, Chen JK. Pharmacology of rhein and advancement in the synthesis of its derivatives[J]. Curr Tradit Med, 2016, 2: 59-69. DOI:10.2174/2215083802666160620131215 |
| [17] |
Tian X, Wang P, Li T, et al. Self-assembled natural phytochemicals for synergistically antibacterial application from the enlightenment of traditional Chinese medicine combination[J]. Acta Pharm Sin B, 2020, 10: 1784-1795. DOI:10.1016/j.apsb.2019.12.014 |
| [18] |
Zhou CZ. Research on the prescription and ratio of drug pair of coptis and cassia coptis and cassia ZHOU Chang-zheng[J]. Qilu Pharm Affairs (齐鲁药事), 2011, 30: 294-295. |
| [19] |
Huang XM, Wang PL, Li T, et al. Self-assemblies based on traditional medicine berberine and cinnamic acid for adhesion-induced inhibition multidrug-resistant Staphylococcus aureus[J]. ACS Appl Mater Interfaces, 2020, 12: 227-237. DOI:10.1021/acsami.9b17722 |
| [20] |
Shen Y, Zou Y, Chen X, et al. Antibacterial self-assembled nanodrugs composed of berberine derivatives and rhamnolipids against Helicobacter pylori[J]. J Control Release, 2020, 328: 575-586. DOI:10.1016/j.jconrel.2020.09.025 |
| [21] |
Liu H, Wang ZY, Zhou YC, et al. Immunomodulation of Chinese herbal medicines on NK cell populations for cancer therapy: a systematic review[J]. J Ethnopharmacol, 2021, 268: 113561. DOI:10.1016/j.jep.2020.113561 |
| [22] |
Wang M, Yu H, Wu R, et al. Autophagy inhibition enhances the inhibitory effects of ursolic acid on lung cancer cells[J]. Int J Mol Med, 2020, 46: 1816-1826. |
| [23] |
Bag BG, Majumdar R. Self-assembly of renewable nano-sized triterpenoids[J]. Chem Rec, 2017, 17: 841-873. DOI:10.1002/tcr.201600123 |
| [24] |
Cargnin ST, Gnoatto SB. Ursolic acid from apple pomace and traditional plants: a valuable triterpenoid with functional properties[J]. Food Chem, 2017, 220: 477-489. DOI:10.1016/j.foodchem.2016.10.029 |
| [25] |
Fan LL, Zhang BC, Xu AC, et al. Carrier-free, pure nanodrug formed by the self-assembly of an anticancer drug for cancer immune therapy[J]. Mol Pharm, 2018, 15: 2466-2478. DOI:10.1021/acs.molpharmaceut.8b00444 |
| [26] |
Yang X, Ma C, Chen ZM, et al. Single small molecule-assembled nanoparticles mediate efficient oral drug delivery[J]. Nano Res, 2019, 12: 2468-2476. DOI:10.1007/s12274-019-2470-0 |
| [27] |
Kayouka M, Hamade A, Saliba E, et al. P-glycoprotein modulates oleanolic acid effects in hepatocytes cancer cells and zebrafish embryos[J]. Chem Biol Interact, 2020, 315: 108892. DOI:10.1016/j.cbi.2019.108892 |
| [28] |
Shi J, Li J, Li J, et al. Synergistic breast cancer suppression efficacy of doxorubicin by combination with glycyrrhetinic acid as an angiogenesis inhibitor[J]. Phytomedicine, 2021, 81: 153408. DOI:10.1016/j.phymed.2020.153408 |
| [29] |
Wang J, Zhao H, Qiao W, et al. Nanomedicine-cum-carrier by co-assembly of natural small products for synergistic enhanced antitumor with tissues protective actions[J]. ACS Appl Mater Interfaces, 2020, 12: 42537-42550. DOI:10.1021/acsami.0c12641 |
| [30] |
Yang H, Gu S, Li J, et al. Synthesis of boron carbonitride nanosheets using for delivering paclitaxel and their antitumor activity[J]. Colloids Surf B Biointerfaces, 2021, 198: 111479. DOI:10.1016/j.colsurfb.2020.111479 |
| [31] |
Wang JC, Zhao HT, Zhi KK, et al. Exploration of the natural active small-molecule drug-loading process and highly efficient synergistic antitumor efficacy[J]. ACS Appl Mater Interfaces, 2020, 12: 6827-6839. DOI:10.1021/acsami.9b18443 |
| [32] |
Cheng Y, Ji YH. Mitochondria-targeting nanomedicine self-assembled from GSH-responsive paclitaxel-ss-berberine conjugate for synergetic cancer treatment with enhanced cytotoxicity[J]. J Control Release, 2020, 318: 38-49. DOI:10.1016/j.jconrel.2019.12.011 |
| [33] |
Singh BN, Shankar S, Srivastava RK. Green tea catechin, epigallocatechin-3-gallate (EGCG): mechanisms, perspectives and clinical applications[J]. Biochem Pharmacol, 2011, 82: 1807-1821. DOI:10.1016/j.bcp.2011.07.093 |
| [34] |
Zhang B, Jiang J, Wu P, et al. A smart dual-drug nanosystem based on co-assembly of plant and food-derived natural products for synergistic HCC immunotherapy[J]. Acta Pharm Sin B, 2021, 11: 246-257. DOI:10.1016/j.apsb.2020.07.026 |
| [35] |
Zheng J, Fan R, Wu HQ, et al. Directed self-assembly of herbal small molecules into sustained release hydrogels for treating neural inflammation[J]. Nat Commun, 2019, 10: 1604. DOI:10.1038/s41467-019-09601-3 |
| [36] |
Liu Y, Zhao L, Shen G, et al. Coordination self-assembly of natural flavonoids into robust nanoparticles for enhanced in vitro chemo and photothermal cancer therapy[J]. Colloids Surf A Physicochem Eng Aspects, 2020, 598: 124805. DOI:10.1016/j.colsurfa.2020.124805 |
 2021, Vol. 56
2021, Vol. 56