橙皮苷(hesperidin, HDN) 是从柑橘类植物中发现的一种黄酮类化合物, 具有广泛的药理活性, 如抗炎[1]、抗氧化[2]、神经保护[3]和抗癌[4]等。然而HDN溶解度低的问题限制了其制剂发展和临床应用[5]。纳米混悬剂主要用于难溶性药物的增溶增效研究, 具有载药量高、辅料用量少和制备简单等优势[6-8]。在目前的研究中, 稳定剂的选择主要局限于化学合成类稳定剂。近年来多项研究报道, 大量合成类稳定剂的使用带来潜在的安全性问题[9-11]。因此, 研究者们将目光转向了生物相容性好的天然物质的开发与应用[12]。
五环三萜皂苷类化合物, 由于其特殊的化学结构, 是天然表面活性剂的重要开发来源之一。近年来, 研究学者尝试将其运用于医药领域, 例如甘草酸[13, 14]和三七总皂苷[15]等。茶皂素(tea saponin, TS) 又称茶皂甙、油茶皂苷, 是从山茶科植物茶树中提取的一种五环三萜皂苷类化合物, 与甘草酸具有相似的化学结构及流变学性质[16, 17]。TS是一种天然的非离子型表面活性剂, 具有乳化、发泡、润湿等优异性能, 广泛应用于化妆品、食品和医药等领域[18]。TS具有广泛的来源、显著的表面活性及良好的生物可降解性, 是一种极具开发前景的表面活性剂。有研究[19]对比了TS、皂树皂苷和Tween 80三种乳化剂的乳化性能, 以TS乳化性能最优, TS稳定的纳米乳液除强酸性、高离子强度条件下均能保持液滴聚集的稳定性, 证明了TS的辅料开发前景。而纳米混悬剂中稳定剂的应用必不可少, 寻找绿色天然的新型稳定剂替代化学合成稳定剂已引起研究学者们的广泛关注, 近年来天然稳定剂的研究与日俱增。TS作为良好的表面活性剂, 具有稳定纳米混悬剂的开发潜力。
因此, 本研究旨在解决传统稳定剂潜在的安全性问题, 开发一种天然高效的绿色纳米制剂, 选择HDN为模型药物, 引入纳米混悬技术, 以天然表面活性剂TS替代传统稳定剂, 制备HDN绿色纳米制剂, 进行制备工艺的研究, 并进一步探究静电斥力是否在TS稳定纳米混悬剂的机制中发挥作用, 为TS的应用建立研究基础。
材料与方法药品与试剂 TS (含量 > 90%, 批号GL20190519)、HDN原料药(含量 > 95%, 批号XC20190816) (西安格林生物科技有限公司); HCl、NaOH和NaCl (分析纯, 成都市科龙化工试剂厂)。
仪器 Nicomp 380ZLS型激光粒度分析仪(美国PSS公司); AH-100D型高压均质机(加拿大ATS公司); C25高剪切分散乳化均质机(上海恒川机械设备有限公司)。
纳米混悬剂的制备 采用高速剪切联合高压均质法制备纳米混悬剂[20]。精密称取100 mg TS溶解于100 mL去离子水中, 超声使其溶解, 得0.1% (w/v) 稳定剂溶液。另精密称取一定量的HDN原料药, 加入稳定剂溶液中, 在一定剪切速度下进行高速剪切数分钟后, 先在低压35 MPa下均质6次, 然后转至高压下循环数次, 即得HDN-NS。
平均粒径、多分散指数的测定 取HDN-NS 0.15 mL, 加去离子水稀释至25 mL, 即HDN-NS稀释约166.7倍, 然后采用粒度分析仪对HDN-NS的粒径和多分散指数(polydispersity index, PI) 进行测定, 实验环境温度为25 ℃, 每组平行测定3次, 取其平均值。
工艺因素考察 以粒径和PI为评价指标, 以HDN为模型药物, 采用单因素实验, 对HDN-NS的制备工艺因素进行考察, 包括药物浓度、剪切转速、剪切时间、均质压力和均质次数。
以TS为稳定剂, 制备得到0.1% (w/v) TS稳定剂溶液, 加入适量HDN原料药混匀后, 于16 000 r·min-1下高速剪切2 min后, 先在低压35 MPa下预均质6次, 然后转至100 MPa下高压均质12次, 考察药物——HDN的浓度(6.0、8.0、10.0和12.0 mg·mL-1) 对HDN-NS的影响。
精密称取HDN原料药0.8 g, 加入0.1% (w/v) TS溶液中, 于不同剪切速度下高速剪切2 min后, 置于低压35 MPa下预均质6次, 然后转至100 MPa下均质12次, 考察剪切速度(10 000、13 000、16 000、19 000和21 000 r·min-1) 对HDN-NS的影响。
精密称取HDN原料药0.8 g, 加入0.1% (w/v) TS溶液中, 于16 000 r·min-1下高速剪切数分钟后, 先置于低压35 MPa下均质6次, 然后再转至100 MPa下均质12次, 考察剪切时间(1、2、3和4 min) 对HDN-NS的影响。
精密称取HDN原料药0.8 g, 加入0.1% (w/v) TS溶液中, 在16 000 r·min-1下高速剪切2 min后, 先置于35 MPa下均质6次, 然后再在一定均质压力下均质12次, 考察均质压力(40、60、80、100和120 MPa) 对HDN-NS的影响。
精密称取HDN原料药0.8 g, 加入0.1% (w/v) 的TS溶液中, 在16 000 r·min-1下高速剪切2 min后, 置于35 MPa下均质6次, 然后在100 MPa下均质数次, 考察均质次数(6、8、10、12、14和16次) 对HDN-NS粒径和PI的影响。
稳定机制研究 考察pH值和离子强度对HDN-NS的影响,TS的临界胶束浓度(critical micelle concentration, CMC) 和不同浓度TS存在下HDN-NS的zeta电位变化, 进行稳定机制研究。
首先配制0.1% (w/v) TS溶液, 然后根据需要用0.1 mol·L-1 NaOH或0.1 mol·L-1 HCl调整TS溶液的pH值, 分别至3、4、5、6、7和8; 再向其中加入HDN原料药1.0 g, 在16 000 r·min-1下高速剪切2 min后, 先在低压35 MPa下均质6次, 然后转至高压100 MPa下均质12次, 考察pH对HDN-NS的影响。
配制0.1% (w/v) 的TS溶液, 根据需要用NaCl调整TS溶液的离子强度, 分别至0.01、0.05、0.10、0.25和0.50 mol·L-1; 再向其中加入HDN原料药0.8 g, 在16 000 r·min-1下高速剪切2 min后, 先在35 MPa下预均质6次, 然后转至100 MPa高压下连续均质12次, 考察离子强度对HDN-NS的影响。
采用光散射法测定TS的CMC值。精密称取TS, 分别配制成浓度为0.5、1.0、1.5、2.0、2.2、2.5、2.8、3.0、3.5、4.0、4.5和5.0 mmol·L-1的TS溶液, 以激光粒度分析仪测定各浓度TS溶液的光散射强度值。以TS浓度(C) 为横坐标, 以光散射强度(I) 为纵坐标, 绘制TS浓度与光散射强度的关系曲线。
取一定量的HDN-NS, 用纯水稀释数倍后, 采用激光粒度分析仪对HDN-NS的zeta电位进行测定, 每组平行测定3次, 取其平均值。为了进一步了解TS的稳定机制, 考察了不同浓度的TS对HDN-NS的zeta电位的影响。
数据分析 采用Excel软件进行数据分析, 以
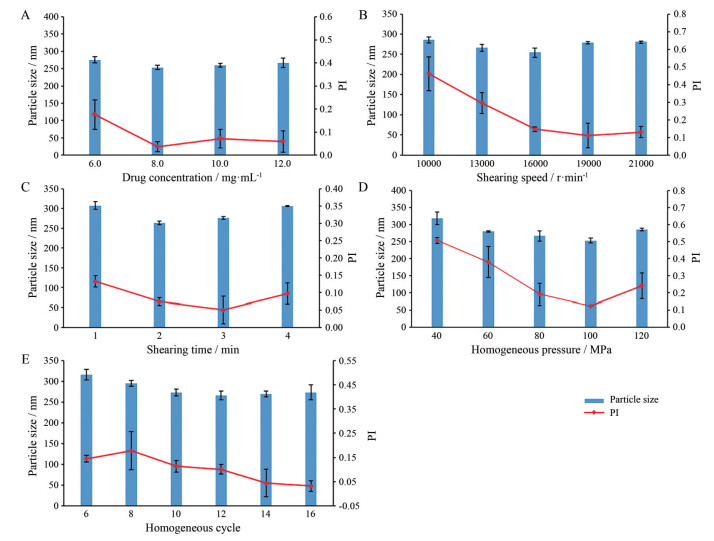
药物浓度的考察结果见图 1A。由图可见, 药物浓度对HDN-NS的影响并不十分显著, 但随着浓度的增加, HDN-NS的粒径和PI均呈现小幅度的变化, 呈现先降低后增大的趋势。当HDN质量浓度为8.0 mg·mL-1时, HDN-NS的粒径为(253.5 ± 5.8) nm, PI为0.036 ± 0.022, 均为最小, 故确定HDN的质量浓度为8.0 mg·mL-1。
|
Figure 1 Effects of drug concentration (A), shearing speed (B), shearing time (C), homogeneous pressure (D) and homogeneous cycle (E) on mean particle size and polydispersity index (PI) of hesperidin nanosuspensions (HDN-NS). n = 3, |
剪切转速的考察结果见图 1B。由图可见, 随着剪切速度的增大, HDN-NS的粒径和PI均呈现先降低后增加的趋势。当剪切速度为16 000 r·min-1时, HDN-NS的粒径为(254.1 ± 11.7) nm, PI为0.147 ± 0.013; 当剪切速度超过16 000 r·min-1时, HDN-NS的粒径呈逐渐增大的趋势, 而PI变化不大, 故确定剪切速度为16 000 r·min-1。
1.3 剪切时间剪切时间的考察结果见图 1C。由图可见, 随着剪切时间的增加, HDN-NS的粒径和PI呈先降低后增加的趋势。在剪切时间为2 min时, 粒径和PI达到最小, 分别为(263.9 ± 4.4) nm和0.074 ± 0.011; 当剪切时间超过2 min时, HDN-NS的粒径和PI均呈现增加的趋势, 这是因为TS的起泡性较强; 当剪切时间过长时, 高速剪切后的粗混悬液会产生大量的气泡, 进而影响进一步的均质操作, 因此粒径有所增大。故综合考虑确定剪切时间为2 min。
1.4 均质压力均质压力的考察结果见图 1D。由图可见, 均质压力对HDN-NS的粒径和PI影响较为显著。随着均质压力的增加, HDN-NS的粒径和PI呈现先减小后增大的趋势。当均质压力过小时, 机械力作用较弱, 无法有效细化药物颗粒, 因此HDN-NS的粒径较大, 且粒径分布较宽; 当均质压力为100 MPa时, HDN-NS的粒径和PI达到最小, 分别为(252.6 ± 7.0) nm和0.124 ± 0.002; 当均质压力超过100 MPa时, HDN-NS的粒径和PI均增大。该现象产生的原因可能是由于TS主要通过吸附于药物表面帮助药物分散和稳定, 当均质压力过大时, 机械作用过强, 会破坏TS对HDN形成的吸附保护层, 使TS不能有效吸附于药物表面, 从而体系稳定性减弱, 粒子间趋于聚集, 导致平均粒径增大; 温度也是影响体系稳定性的重要因素之一, 纳米混悬液的温度随均质压力的增大而升高, 一般均质压力升高50 MPa, 温度约升高10 ℃[21], 更高的温度致使HDN-NS体系稳定性降低, 导致颗粒之间的聚集沉降, 引起纳米混悬剂粒径和PI的增加。因此, 综合考虑选择均质压力为100 MPa。
1.5 均质次数均质次数的考察结果见图 1E。由图可见, 在固定压力下, 增加均质次数, 机械作用时间变长, HDN-NS的粒径和PI均逐渐降低。当均质次数为12次时, HDN-NS的粒径为(266.1 ± 10.5) nm, PI为0.101 ± 0.020; 当均质次数超过12次时, HDN-NS的粒径和PI变化不明显, 呈略微增大的趋势。该现象说明当均质次数过多时, 纳米粒之间反而趋向于重新聚集为大颗粒, 从而导致粒径的增大。此外, 虽然均质压力和均质次数的增加可以在一定程度上降低HDN-NS的粒径, 但是当均质压力和均质次数增加至一定限度后, 粒径将不再随之降低, 达到平台期; 粒径的降低是多因素综合的结果, 这时单纯增加均质压力和均质次数对HDN-NS的粒径不再产生影响, 反而造成能源浪费和仪器损耗[22]。因此, 从节约能源和工作效率角度考虑, 选择均质次数为12次。
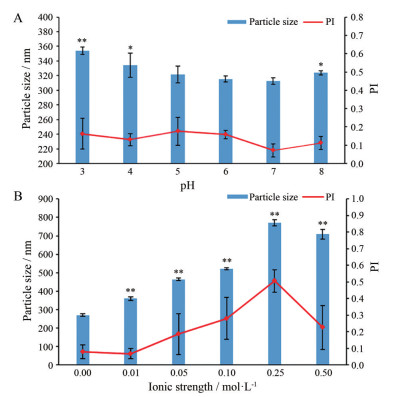
2 稳定机制研究 2.1 pH值对HDN-NS的影响为了探究静电斥力是否参与稳定HDN-NS, 在保持TS浓度(0.1%, w/v) 不变的情况下, 考察溶液pH值对HDN-NS性能的影响, 结果见图 2A。由图可见, pH值对HDN-NS的粒径存在较大影响。当pH值在3~5内HDN-NS的粒径呈逐渐降低的趋势; pH值在5~7内粒径和PI趋于稳定; pH值达到8时HDN-NS的粒径和PI呈上升的趋势, 这是由于TS在碱性条件会水解, 并失去活性。因此, 碱性环境破坏了TS的稳定保护层, 导致粒径增大。TS结构中含有羧基, 溶液的pH值对TS的质子化程度有显著影响。一般来说, 如果静电稳定是减小粒径的主要机制, 则体系pH值的变化也会引起粒径的相应变化, 这是由于TS的质子化程度不同, 电荷密度也不同。空间稳定作用是纳米混悬剂的另一稳定机制。在空间立体稳定机制中, 两性非离子型表面活性剂通过吸附在药物颗粒表面形成吸附层, 使颗粒之间产生空间位阻, 从而维持微粒之间的稳定; 同时, 其亲水部分延伸到分散介质中, 形成较厚的水化膜, 增强空间稳定性[23]。因此, 如果以空间稳定为主导机制, 则粒径对pH值变化不敏感[24]。研究结果表明, 静电斥力参与了TS作为纳米混悬剂潜在稳定剂的稳定机制。
|
Figure 2 Effects of pH (A) and ionic strength (B) on mean particle size and PI of HDN-NS. n = 3, |
为了进一步确定静电斥力参与HDN-NS的稳定机制, 在保持TS浓度(0.1%, w/v) 和体系pH值(6.5) 不变的情况下, 考察溶液离子强度对HDN-NS粒径和PI的影响。一般来说, 离子强度会影响粒子周围双电极层的形成和厚度。如果离子强度的变化对HDN-NS的粒径产生影响, 则能进一步证明静电效应是TS稳定纳米混悬剂的机制之一; 若静电斥力不发挥作用, HDN-NS的粒径则不会产生变化。根据结果(图 2B) 可知, HDN-NS粒径的变化确实与离子强度有关。在纯水体系中, HDN-NS粒径最小。与纯水体系相比, HDN-NS在离子强度为0.01~0.50 mol·L-1的体系范围内, 随着离子强度的增加, 其粒径和PI随之增加; 当离子强度 > 0.1 mol·L-1时, HDN-NS的粒径急剧增大, 这可能是由于溶液中离子的屏蔽作用, 可作为反离子进入双电极层, 导致滑动层变薄, 从而静电稳定效应相对减弱, 导致粒子的粒径显著增加[25]。
此外, 随着体系离子强度的增加, HDN-NS产生不稳定现象, 逐渐出现粒子沉降的趋势, 这可能是由于TS的黏度与溶液的离子强度有很大的关系。当离子强度范围很宽时, TS的固有黏度和离子强度平方根的倒数之间存在线性函数关系。因此, 随着离子强度的增加, TS的黏度降低, 稳定剂更容易从粒子表面逃逸, 导致微粒急剧聚集[24]。综上所述, 静电效应是参与TS稳定纳米混悬剂的机制之一。
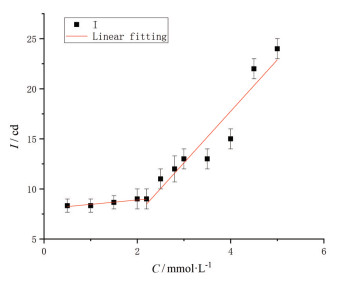
2.3 临界胶束浓度的测定CMC是表面活性剂的一个重要参数。在超过CMC时, 表面活性剂溶液会形成胶束。此时, 其表面张力、黏度和光散射等性质将会发生明显变化。CMC越小, 表面活性剂在界面吸附达到饱和的浓度就越低, 从而发挥增溶和乳化等作用的使用浓度也越低, 其作为乳化剂和增溶剂等的使用浓度也越低。因此, 为了进一步了解TS的稳定原理, 对TS的表面活性进行了测定, 结果见图 3。由图可见, 测得TS的CMC值为2.5 mmol·L-1, 这与文献[26]报道的TS的CMC值(2.242 mmol·L-1) 很接近, 说明该测定结果具有可信度。一般来说, 纳米混悬剂中稳定剂的用量不能超过表面活性剂本身的CMC值, 在该情况下, 稳定剂与纳米晶表面具有较高的亲和力, 从而起到较好的稳定作用; 当用量超过CMC值时, 稳定剂与纳米晶表面的亲和力下降, 从而纳米粒具有聚集和沉降的趋势, 导致制剂产生不稳定现象[27]。纳米混悬液总体上是饱和溶液, 当粒径分布较宽时, 小粒子因溶解度大而不断溶解, 大粒子则摄取小粒子的质量因过饱和而导致粒子晶体生长, 引起粒径的增大, 这一过程被称为奥斯特瓦尔德熟化(Ostwald ripening); 当粒径分布范围较窄时, 则会在一定程度上抑制Ostwald ripening的发生。在本实验的前期研究中, 对比了TS与5种传统稳定剂(SDS、PVP K30、HPMC、P 188、PEG 400) 对HDN-NS的影响, 相较于其他稳定剂而言, 在相同的低浓度下(0.1%, w/v), TS对HDN-NS的稳定效果最好, 粒径和PI最小, 分别为(261.0 ± 2.3) nm和0.037 ± 0.032; 而其他稳定剂不能有效阻止Ostwald ripening引起的粒径增长[28]。本研究TS的最佳用量为0.1% (w/v), 即约0.9 mmol·L-1, 明显低于CMC值。这进一步解释了TS的稳定浓度比传统稳定剂更低的原因。
|
Figure 3 Critical micelle concentration (CMC) of tea saponin (TS). I: Scattering light intensity; C: Concentration of TS. n = 3, |
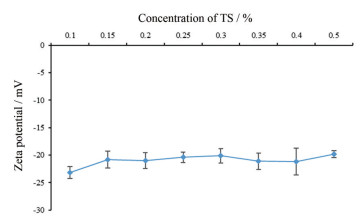
Zeta电位反映了稳定剂对药物颗粒提供的静电斥力的强弱, 可以辅助判断静电斥力在纳米混悬剂中发挥的作用, 也是度量纳米混悬液稳定性的重要因素。因此, 进一步对不同TS浓度下HDN-NS的zeta电位进行了测定, 结果见图 4。由图可见, 当TS浓度为0.1% (w/v) 时, HDN-NS的zeta电位值为(-23.16 ± 1.12) mV, 表明TS可以提供较强的静电斥力。TS具有强电负性的含氧基团, HDN-NS表面的负电位是吸附的皂苷分子上羧酸基团造成[19, 29, 30]。随着TS浓度的变化, HDN-NS的zeta电位变化趋势不明显, 说明zeta电位的变化受TS浓度的影响较小。HDN-NS的zeta电位值为(-23.16 ± 1.12) mV, 表明TS可以提供较强的静电斥力。
讨论本研究对HDN-NS的制备工艺和稳定机制进行了研究, 以探究TS是否能作为纳米混悬剂的一种天然稳定剂, 为TS的进一步应用奠定基础。采用高速剪切联合高压均质法制备HDN-NS。联用技术可以解决成品粒径分布不均匀、容易团聚的问题, 且所得纳米混悬剂的物理稳定性更好[21]。采用单因素实验考察了药物浓度、剪切速度、剪切时间、均质压力和均质次数对HDN-NS的影响。确定药物质量浓度为8.0 mg·mL-1, 剪切转速为16 000 r·min-1, 剪切时间为2 min, 在35 MPa下均质6次, 再在100 MPa下均质12次。
|
Figure 4 Effect of the concentration of TS on zeta potential of HDN-NS. n = 3, |
了解稳定剂对纳米混悬剂的稳定成型机制, 对于新型稳定剂的进一步开发与应用都具有十分重要的意义。通过pH值、离子强度、CMC值和zeta电位等因素的考察确定TS稳定纳米混悬剂的机制。HDN-NS的粒径和PI随体系pH值和离子强度的变化而变化, 证明静电斥力参与TS稳定HDN-NS的机制, 且可以提供较强的静电斥力。一般来说, 在仅存在静电斥力的情况下, zeta电位的绝对值大于30 mV, 该稳定剂就可以维持纳米混悬剂的长期稳定; 在静电斥力结合空间位阻效应同时发挥作用的情况下, 稳定剂提供的zeta电位绝对值大于20 mV, 纳米混悬剂就可以保持长期稳定。有研究报道, 在二元乳化体系中, TS主要通过空间斥力和静电效应共同作用来稳定TS包覆的乳液, 为TS稳定纳米混悬液提供了参考[19]。此外, 作为新型的天然表面活性剂, 甘草酸与TS结构均为五环三萜皂苷类化合物, 二者具有相似的流变学性质(高黏弹性) 和界面性能[16]。甘草酸主要通过静电斥力结合空间作用共同稳定纳米乳及纳米混悬剂[14, 20, 31]。因此, 推测空间斥力可能也参与了TS稳定HDN-NS。在未来的研究中, 将进一步确定空间斥力是否在TS稳定HDN-NS的机制中发挥作用。
综上所述, TS可以作为一种良好的天然稳定剂用于稳定纳米混悬剂。本研究提出了一种简单的策略, 以TS作为一种新型的天然稳定剂制备HDN-NS。TS稳定HDN-NS的粒径分布在200~400 nm。在低浓度的TS存在下, HDN-NS能够实现有效的纳米化, 这归因于TS的良好界面性能和静电效应。相较于常用稳定剂而言, TS的稳定浓度(0.1%, w/v) 要小得多, 是常用稳定剂的10%~30%。因而, 有望降低合成辅料的用量, 从而降低因辅料用量大而带来的安全风险。
作者贡献: 龙家英提出研究思路、设计研究方案、指导实验实施及撰写论文; 李小芳负责课题指导和文章修改; 王娴和邓茂负责制备工艺等实验完成工作; 古环和谢龙负责数据处理与分析; 陈慧娟和代小琳负责稳定机制等实验完成工作。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Guazelli CFS, Fattori V, Ferraz CR, et al. Antioxidant and anti-inflammatory effects of hesperidin methyl chalcone in experimental ulcerative colitis[J]. Chem Biol Interact, 2021, 333: 109315. DOI:10.1016/j.cbi.2020.109315 |
| [2] |
Wunpathe C, Potue P, Maneesai P, et al. Hesperidin suppresses renin-angiotensin system mediated NOX2 over-expression and sympathoexcitation in 2K-1C hypertensive rats[J]. Am J Chin Med, 2018, 46: 751-767. DOI:10.1142/S0192415X18500398 |
| [3] |
Welbat JU, Naewla S, Pannangrong W, et al. Neuroprotective effects of hesperidin against methotrexate-induced changes in neurogenesis and oxidative stress in the adult rat[J]. Biochem Pharmacol, 2020, 178: 114083. DOI:10.1016/j.bcp.2020.114083 |
| [4] |
Kongtawelert P, Wudtiwai B, Shwe TH, et al. Inhibitory effect of hesperidin on the expression of programmed death ligand (PD-L1) in breast cancer[J]. Molecules, 2020, 25: 252. DOI:10.3390/molecules25020252 |
| [5] |
Zheng DY, Deng YT, Xia Y, et al. Fabrication and performance of a spherical cellulose nanocrystal-based hydrophobic drug delivery vehicle using rubber wood[J]. Bioresources, 2019, 14: 7763-7774. DOI:10.15376/biores.14.4.7763-7774 |
| [6] |
Ji YB, Liu B, Yu RQ, et al. Preparation of disulfiram naonosuspensions and their anti-tumor efficacy in vitro and in vivo[J]. Acta Pharm Sin (药学学报), 2019, 54: 565-573. |
| [7] |
Wang JL, Yao JH, Ning Q, et al. Beneficial effects of nanosuspensions of honokiol in mice on high fat diet through suppression of hepatic gluconeogenesis[J]. Acta Pharm Sin (药学学报), 2019, 54: 288-293. |
| [8] |
Kansom T, Sajomsang W, Saeeng R, et al. Fabrication and characterization of andrographolide analogue (3A.1) nanosuspensions stabilized by amphiphilic chitosan derivatives for colorectal cancer therapy[J]. J Drug Deliv Sci Technol, 2019, 54: 101287. DOI:10.1016/j.jddst.2019.101287 |
| [9] |
Heydenreich AV, Westmeier R, Pedersen N, et al. Preparation and purification of cationic solid lipid nanospheres--effects on particle size, physical stability and cell toxicity[J]. Int J Pharm, 2003, 254: 83-87. DOI:10.1016/S0378-5173(02)00688-9 |
| [10] |
Hawkins MJ, Soon-Shiong P, Desai N. Protein nanoparticles as drug carriers in clinical medicine[J]. Adv Drug Deliv Rev, 2008, 60: 876-885. DOI:10.1016/j.addr.2007.08.044 |
| [11] |
Muller RH, Keck CM. Challenges and solutions for the delivery of biotech drugs--a review of drug nanocrystal technology and lipid nanoparticles[J]. J Biotechnol, 2004, 113: 151-170. DOI:10.1016/j.jbiotec.2004.06.007 |
| [12] |
Xuan JJ, Wu XY, Qi JP, et al. Application of natural deep eutectic solvents in pharmaceutics[J]. Acta Pharm Sin (药学学报), 2021, 56: 146-157. |
| [13] |
Chen Y, Liu Y, Xu J, et al. A natural triterpenoid saponin as multifunctional stabilizer for drug nanosuspension powder[J]. AAPS PharmSciTech, 2017, 18: 2744-2753. DOI:10.1208/s12249-017-0756-7 |
| [14] |
Ma Y, Gao Y, Zhao X, et al. A natural triterpene saponin-based Pickering emulsion[J]. Chem A Eur J, 2018, 24: 11703-11710. DOI:10.1002/chem.201801619 |
| [15] |
Xie Y, Ma Y, Xu J, et al. Panax notoginseng saponins as a novel nature stabilizer for poorly soluble drug nanocrystals: a case study with baicalein[J]. Molecules, 2016, 21: 1149. DOI:10.3390/molecules21091149 |
| [16] |
Golemanov K, Tcholakova S, Denkov N, et al. Remarkably high surface visco-elasticity of adsorption layers of triterpenoid saponins[J]. Soft Matter, 2013, 9: 5738-5752. DOI:10.1039/c3sm27950b |
| [17] |
Wan ZL, Sun YG, Ma LL, et al. Responsive emulsion gels with tunable properties formed by self-assembled nanofibrils of natural saponin glycyrrhizic acid for oil structuring[J]. J Agric Food Chem, 2017, 65: 2394-2405. DOI:10.1021/acs.jafc.6b05242 |
| [18] |
Cai JR, Lv JJ. Research progress of natural surfactant tea saponin[J]. China Clean Ind (中国洗涤用品工业), 2018(12): 83-88. |
| [19] |
Zhu Z, Wen Y, Yi J, et al. Comparison of natural and synthetic surfactants at forming and stabilizing nanoemulsions: tea saponin, Quillaja saponin, and Tween 80[J]. J Colloid Interface Sci, 2019, 536: 80-87. DOI:10.1016/j.jcis.2018.10.024 |
| [20] |
Liu LN, Li XF, Zhong L, et al. Preparation of baicalin solid nanocrystal using glycyrrhizic acid as a natural stabilizer[J]. Chin Tradit Herbal Drugs (中草药), 2019, 50: 2057-2064. |
| [21] |
Yuan HL, Yi JM, Zhang CY, et al. Progress in research of preparation technologies and drug-delivery of nanosuspensions[J]. Chin J New Drug (中国新药杂志), 2014, 23: 297-301. |
| [22] |
Zhang J. Studies on TFu-loaded Nanosuspensions (托氟啶纳米混悬剂的研究)[D]. Jinan: Shandong University, 2012.
|
| [23] |
Xu Q, Huang QQ, Wang YL, et al. Progress in physical stability of nanosuspensions[J]. Chin J Pharm (中国医药工业杂志), 2012, 43: 148-152. |
| [24] |
Guan J, Zhang Y, Liu Q, et al. Exploration of alginates as potential stabilizers of nanosuspension[J]. AAPS PharmSciTech, 2017, 18: 3172-3181. DOI:10.1208/s12249-017-0801-6 |
| [25] |
Tang HL, Li XF, Long JY, et al. Preparation of silymarin nanosuspension with glycyrrhizic acid as stabilizer and study of its stabilization mechanism[J]. Chin Tradit Herb Drugs (中草药), 2020, 51: 971-977. |
| [26] |
Jian HL, Liao XX, Zhu LW, et al. Synergism and foaming properties in binary mixtures of a biosurfactant derived from Camellia oleifera Abel and synthetic surfactants[J]. J Colloid Interface Sci, 2011, 359: 487-492. DOI:10.1016/j.jcis.2011.04.038 |
| [27] |
Huang P, Mao KJ, Wang XT, et al. Research progress on stabilizers nanosuspensions[J]. Guangzhou Chem Ind (广州化工), 2016, 44: 7-9, 32. |
| [28] |
Long J, Song J, Zhang X, et al. Tea saponins as natural stabilizers for the production of hesperidin nanosuspensions[J]. Int J Pharm, 2020, 583: 119406. DOI:10.1016/j.ijpharm.2020.119406 |
| [29] |
Uluata S, McClements DJ, Decker EA. Physical stability, autoxidation, and photosensitized oxidation of ω-3 oils in nanoemulsions prepared with natural and synthetic surfactants[J]. J Agric Food Chem, 2015, 63: 9333-9340. DOI:10.1021/acs.jafc.5b03572 |
| [30] |
Böttcher S, Drusch S. Saponins - self-assembly and behavior at aqueous interfaces[J]. Adv Colloid Interface Sci, 2017, 243: 105-113. DOI:10.1016/j.cis.2017.02.008 |
| [31] |
Liao Y, Zhong L, Liu L, et al. Comparison of surfactants at solubilizing, forming and stabilizing nanoemulsion of hesperidin[J]. J Food Eng, 2020, 281: 110000. DOI:10.1016/j.jfoodeng.2020.110000 |
 2021, Vol. 56
2021, Vol. 56


