2. 抗肿瘤天然药物教育部工程研究中心, 黑龙江 哈尔滨 150076;
3. 黑龙江省预防与治疗老年性疾病药物研究重点实验室, 黑龙江 哈尔滨 150076
2. Engineering Research Center of Natural Anti-cancer Drugs, Ministry of Education, Harbin 150076, China;
3. Heilongjiang Key Laboratory of Preventive and Therapeutic Drug Research of Senile Diseases, Harbin 150076, China
非酒精性脂肪肝病(non-alcoholic fatty liver disease, NAFLD) 是指除大量饮酒和其他已明确因素外所致的, 以肝细胞内脂肪过度沉积为主要特征, 伴或不伴炎症为主要病理特征的与遗传、环境、代谢相关的临床病理综合征[1]。近年来, 随着生活水平的提高和饮食结构的改变, NAFLD的发病率迅猛增高, 已成为全球范围内最常见的第一大慢性肝病, 可见于各年龄段, 多数NAFLD患者在氧化应激和炎症反应等因素刺激下会发展为非酒精性脂肪肝炎、肝硬化甚至肝癌[2]。目前, 对于NAFLD的治疗往往在改善部分指标的同时会产生肝功能损害、血清转氨酶升高等不良反应, 未取得理想的治疗效果且复发率高[3]。中医从整体观念辨证论治出发, 提出多成分、多靶点、多环节的特色治疗方案, 在治疗非酒精性脂肪肝病方面显示出巨大的优势, 成为近年研究的热点[4]。
黄芪汤始载于《太平惠民和剂局方》, 由黄芪、甘草两味药组成, 黄芪甘草之比为6∶1。方中黄芪甘温补气生津为君药, 甘草益气补中、清热解毒为臣药, 两药合用, 历来被单独使用, 或取其药对应用于复方之中。现代药理研究亦证明, 黄芪汤具有气虚血淤、肢体劳倦和心中烦悸等诸多功效[5]。近年来对黄芪汤及其活性成分的研究表明, 黄芪汤水提物和黄芪汤注射液对非酒精性脂肪肝、非酒精性脂肪肝炎和肝纤维化有显著的疗效, 可有效地预防肝癌[6-12]。另外, 单体活性成分黄芪甲苷、毛蕊异黄酮、甘草酸及甘草素等也均具有治疗非酒精性脂肪肝或肝纤维化的作用[13-20]。基于中药成分的复杂性及作用的整体性, 黄芪汤可能通过整体调节、多成分、多靶点、多途径发挥作用, 因此需要进行深入的研究。
本文建立了黄芪汤水煎液高效液相指纹图谱, 并利用HPLC-DAD-ELSD联用技术对色谱峰进行指认, 同时基于网络药理学对黄芪汤中多种成分与NAFLD的相互作用关系进行研究, 从整体的角度探讨黄芪汤治疗NAFLD可能的药效物质基础及作用机制, 为该方质量标志物的研究奠定基础, 并为扩大临床应用提供参考依据。
材料与方法仪器 Waters e2695型高效液相色谱仪(Empower色谱工作站, 四元高压梯度泵, 柱温箱, 自动进样系统, 2998型二极管阵列检测器, 2424型蒸发光散射检测器); 旋转蒸发仪(德国IKA公司); AG-245电子分析天平(瑞士Mettler-Toledo公司); FW177中草药粉碎机(天津泰斯特仪器有限公司)。
试药与试剂 对照品: 毛蕊异黄酮葡萄糖苷(批号为U0520010)、甘草苷(批号为12400010)、芒柄花苷(批号为G2990010)、甘草素(批号为T4890010)、毛蕊异黄酮(批号为34410010)、芒柄花素(批号为Q4150010)、异甘草素(批号为N1400010)、甘草酸(批号为3462)、甘草次酸(批号为l6070024)、黄芪甲苷(批号为T0920025)、黄芪皂苷Ⅲ (批号为15110001)、黄芪皂苷Ⅱ (批号为52100010)、异黄芪皂苷Ⅱ (批号为MUST-18111208)、黄芪皂苷Ⅰ (批号为52110010) 和异黄芪皂苷Ⅰ (批号为MUST-18110103) 均购于上海安谱有限公司。毛蕊异黄酮葡萄糖苷、甘草苷、甘草素等15个成分均为黄芪或甘草的主要活性成分[20-24]。所有化合物经高效液相-二极管阵列检测器分析, 纯度均大于98%。乙腈、甲醇(HPLC级, 禹王科技有限公司); 水为超纯水; 其他试剂为分析纯。黄芪和甘草均购自于道地产区或主产区。15批黄芪药材分别采集于甘肃(S1~S5)、内蒙古(S6~S9)、宁夏(S10)、黑龙江(S11) 和山西(S12~S15) 5个产地。15批甘草药材分别采集于甘肃(S1~S8)、内蒙古(S9~S13) 和新疆(S14、S15) 3个产地。经哈尔滨商业大学曲中原教授鉴定分别为豆科植物蒙古黄芪Astragalus membranaceus (Fisch.) Bge. var. mongholicus (Bge.) Hsiao的干燥根、豆科甘草属植物甘草Glycyrrhiza uralensis Fisch.的干燥根及根茎。本实验前期已按照《中国药典》2020年版的检测方法和要求对药材进行检验, 选出优质产地的药材。
色谱条件 色谱柱: 博纳艾杰尔科技Venusil MP C18 (250 mm × 4.6 mm, 5 μm); 柱温: 30 ℃; 流动相: 0.1%甲酸水溶液(A)-0.1%甲酸乙腈(B), 梯度洗脱; 洗脱程序: 0~16 min 16%~20% B, 16~36 min 20%~30% B, 36~60 min 30%~40% B, 60~65 min 40% B, 65~85 min 40% B~96% B, 85~86 min 96%~100% B; 流速: 1 mL·min-1; 进样量: 20 μL; ELSD漂移管温度60 ℃; 增益值130; 供气压力30 psi。
供试品溶液的制备 黄芪汤原方组成为“黄芪六两(蜜), 甘草一两(炙)”。精密称取黄芪(蜜) 72 g、甘草(炙) 12 g置于1 000 mL圆底烧瓶中, 加600 mL蒸馏水, 浸泡过夜12 h, 加热回流提取1 h, 共提取2次。合并上清液并旋干至恒重, S1~S15批黄芪汤浸膏重量依次为26.35 g、25.20 g、19.23 g、18.48 g、19.32 g、19.83 g、16.80 g、17.64 g、20.16 g、21.84 g、19.99 g、24.36 g、18.31 g、18.79 g和22.68 g。以生药量计精密称取样品适量, 用50%甲醇-水溶解并定容于25 mL容量瓶中, 过0.45 μm微孔滤膜, 即得样品。
对照品溶液的制备 精密称取毛蕊异黄酮葡萄糖苷、甘草苷、芒柄花苷、甘草素、毛蕊异黄酮、黄芪甲苷、黄芪皂苷Ⅲ、黄芪皂苷Ⅱ、芒柄花素、异甘草素、甘草次酸、异黄芪皂苷Ⅱ、甘草酸、黄芪皂苷Ⅰ和异黄芪皂苷Ⅰ对照品适量, 精密称定, 加甲醇溶解并稀释, 得到混合对照品溶液。
方法学考察参照峰选择 甘草酸是黄芪汤主要活性物质之一, 其化学性质稳定, 色谱峰保留时间稳定, 峰面积较大, 故以甘草酸为参照峰。
精密度 精密吸取同一供试品溶液(批号为S15), 连续进样6次, 以甘草酸为参照峰。记录各共有峰的相对峰面积和相对保留时间, 分别计算RSD值。
重复性 精密吸取同一供试品溶液(批号为S15), 平行制备6份样品, 依法进样测定, 以甘草酸为参照峰。记录各共有峰的相对峰面积和相对保留时间, 分别计算RSD值。
稳定性 精密吸取同一供试品溶液(批号为S15), 分别在0、4、8、12、24 h进样, 以甘草酸峰为参照峰。在上述色谱条件下进样分析, 记录各共有峰的相对峰面积和相对保留时间, 分别计算RSD值。
黄芪汤指纹图谱的建立及相关性分析 取15批黄芪汤药材, 按“供试品溶液”的制备方法, 在上述色谱条件下进行测定, 采集黄芪汤水煎液HPLC色谱图。将15批黄芪汤水煎液HPLC色谱图导入中药指纹图谱相似度评价系统(2012年A版), 采用中位数法进行模式识别, 获得了黄芪汤水煎液的共有模式, 并计算相似度。
基于“成分-靶点-通路”的网络药理学分析
黄芪汤治疗NAFLD潜在靶标基因的获取 通过Swiss Target Prediction数据库(http://www.swisstargetprediction.ch/)、TCMSP (http://tcmspw.com/tcmsp.php) 和Pub Chem数据库(https://www.ncbi.nlm.nih.gov/pubmed/) 检索毛蕊异黄酮、芹糖甘草苷、甘草苷、芒柄花苷、甘草素等16个候选化合物作用的靶点。然后, 通过UniProt数据库(https://www.uniprot.org/) 将得到的所有蛋白校正为对应的基因名。在TTD (http://bidd.nus.edu.sg/group/cjttd/)、CTD (http://ctdbase.org/)、OMIM (https://www.omim.org/) 和DisGenet数据库(http://disgenet.org/) 上以“non-alcoholic fatty liver disease”或“NAFLD”为关键词检索相关基因, 汇总整理疾病靶点, 并与黄芪汤活性成分相关靶点整合取交集, 获得黄芪汤治疗NAFLD的潜在靶点。
成分-靶标作用网络的构建与分析 将黄芪汤16个活性成分和治疗NAFLD的相关靶标输入Cytoscape 3.6.0软件中, 构建黄芪汤治疗NAFLD的成分-靶标网络。
潜在靶标相互作用网络的构建与分析 将黄芪汤治疗NAFLD的潜在靶点带入STRING (https://string-db.org/) 数据库中, 获取靶标之间的相互作用关系。将得到的结果以文本形式输入Cytoscape 3.6.0软件, 绘制蛋白相互作用(protein-protein interaction, PPI) 网络图。
GO分类富集分析和KEGG通路分析 运用DAVID数据库(https://david.ncifcrf.gov/home.jsp) 对黄芪汤治疗NAFLD的潜在靶标进行GO和KEGG富集分析。以P < 0.01为筛选条件, 根据富集基因数的大小, 由大到小进行排序, 筛选出排名靠前的生物过程和信号通路。
“成分-靶标-通路”网络的构建 综合GO和KEGG通路富集分析的结果, 通过查阅文献, 筛选出黄芪汤治疗NAFLD密切相关的通路, 并与黄芪汤活性分子和潜在靶标一一对应, 将成分、靶标、通路输入Cytoscape 3.6.0软件, 构建黄芪汤治疗NAFLD的“成分-靶标-通路”网络。
结果 1 方法学考察 1.1 精密度黄芪汤各共有峰的相对保留时间RSD < 0.91%, 相对峰面积的RSD < 1.56%, 表明精密度良好。
1.2 重复性黄芪汤各共有峰的相对保留时间RSD < 1.03%, 相对峰面积的RSD < 1.82%, 表明该重复性良好。
1.3 稳定性黄芪汤各共有峰的相对保留时间RSD < 1.37%, 相对峰面积的RSD < 1.95%, 表明在24 h内稳定性良好。
2 黄芪汤指纹图谱的建立及相关性分析 2.1 黄芪汤指纹图谱的建立及相似度分析将15批黄芪汤水煎液HPLC色谱图导入中药指纹图谱相似度评价系统(2012年A版) 中, 获得黄芪汤水煎液的共有模式, 结果见图 1和2。15批黄芪汤水煎液的指纹图谱相似度均 > 0.869, 表明15批黄芪汤水煎液在化学成分上存在一定差异。
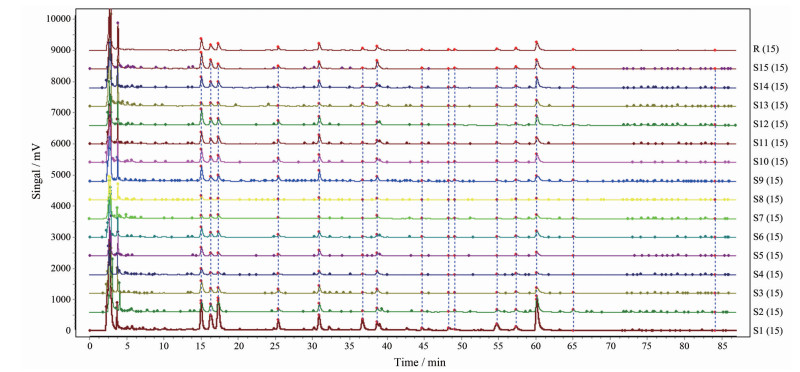
|
Figure 1 Overlay of HPLC-UV fingerprints of 15 batches of Huangqi decoction |
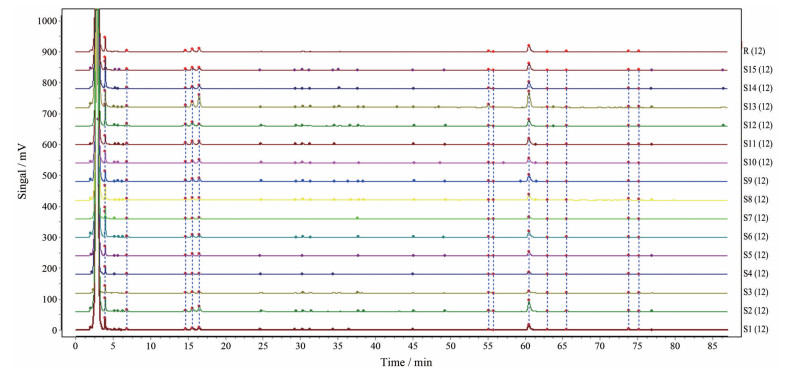
|
Figure 2 Overlay of HPLC-ELSD fingerprints of 15 batches of Huangqi decoction |
将黄芪汤水煎液和混合对照品的指纹图谱进行叠加, 结果见图 3。由图可知, 黄芪汤水煎液有27个共有峰, 经对照品指认了其中15个共有峰, UHPLC/Q-TOF MS鉴定一个共有峰, 色谱峰归属如下: 峰1为毛蕊异黄酮葡萄糖苷, 峰3为甘草苷, 峰4为芒柄花苷, 峰5为甘草素, 峰6为毛蕊异黄酮, 峰7芒柄花素, 峰8为异甘草素, 峰9为甘草酸, 峰10为甘草次酸, 峰11为黄芪甲苷, 峰12黄芪皂苷Ⅲ, 峰13为黄芪皂苷Ⅱ, 峰14为异黄芪皂苷Ⅱ, 峰15为黄芪皂苷Ⅰ, 峰16为异黄芪皂苷Ⅰ。峰2在UHPLC/Q-TOF MS质谱图上分别检测到[M+Na]+ m/z 573.163 7和[M-H]- m/z 549.168 0的准分子离子峰, 提示分子式为C26H30O13。二级谱图中也检测到m/z 419.133 9 (C21H22O9) 和[M+H-apiose-glucose]+ 257.081 3 (C15H12O4) 的特征性碎片离子, 经与文献比对[25, 26], 确定峰2为甘草素-4-芹糖苷。
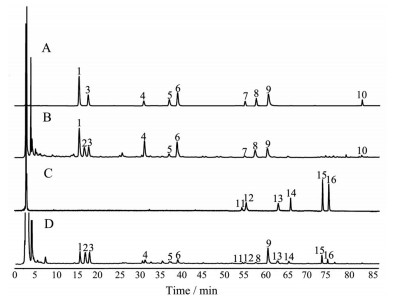
|
Figure 3 HPLC chromatograms of mixed reference substance by HPLC-DAD (A), sample by HPLC-DAD (B), mixed reference substance by HPLC-ELSD (C), and reference substance by HPLC-ELSD (D). 1: Calycosin-7-O-β-D-glycoside; 2: Liquiritin apioside; 3: Liquiritin; 4: Ononin; 5: Liquiritigenin; 6: Calycosin; 7: Formononnetin; 8: Isoliquiritigenin; 9: Glycyrrhizic acid; 10: Glycyrrhetinic acid; 11: Astragaloside Ⅳ; 12: Astragalus Ⅲ; 13: Astragalus Ⅱ; 14: Isoastragalus Ⅱ; 15: Astragalus Ⅰ; 16: Isoastragalus Ⅰ |
将黄芪汤潜在靶点与NAFLD靶基因取交集, 共筛选出潜在靶标129个。
3.2 “成分-靶标”网络的构建与分析黄芪汤16个活性成分和治疗NAFLD潜在靶标基因输入Cytoscape 3.6.0软件中, 得黄芪汤治疗NAFLD的“成分-靶标”网络(图 4)。由图 4可知, 节点145个, 边线406条, 黄芪汤治疗NAFLD的药理机制不是单一活性成分或单一靶标, 而是多成分与多靶标之间共同作用的机制。度值由大到小的顺序依次为甘草次酸(degree=43)、异甘草素(degree=36)、甘草酸(degree=30)、黄芪甲苷(degree=29)、甘草素(degree=28)、黄芪皂苷Ⅰ (degree=27)、芒柄花素(degree=27)、甘草苷(degree=26)、异黄芪皂苷Ⅰ (degree=25)、芹糖甘草苷(degree=24)、毛蕊异黄酮葡萄糖苷(degree=24)、毛蕊异黄酮(degree=23)、芒柄花苷(degree=22)、异黄芪皂苷Ⅱ (degree=22)、黄芪皂苷Ⅲ (degree=16) 和黄芪皂苷Ⅱ (degree=4)。

|
Figure 4 Component-target network of Huangqi decoction |
将潜在靶蛋白输入STRING数据库, 绘制PPI相互作用网络图(图 5)。网络图包含节点126个, 节点大小和颜色深浅反映度值的大小。通过比较度值的大小, 推测丝氨酸/苏氨酸蛋白激酶1 (AKT1)、白介素-6 (IL-6)、血管内皮生长因子A (VEGFA)、丝裂原活化蛋白激酶8 (MAPK8) 和信号转导与转录激活因子3 (STAT3) 这5个靶标可能与黄芪汤治疗NAFLD关系最密切。
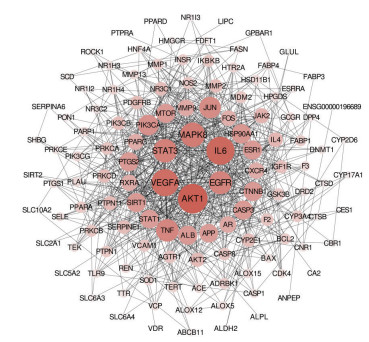
|
Figure 5 Candidate targets interaction network of Huangqi decoction |
GO分析共获取314个GO条目, 其中生物过程占224个、分子功能占55个、细胞组分占35个。生物过程主要富集在RNA聚合酶Ⅱ启动子转录的正调控、信号转导、药物的反应; 细胞组分主要富集在细胞膜和细胞液区域; 分子功能主要富集在蛋白结合、锌离子结合、酶结合等, 结果见图 6。KEGG通路富集分析共得到110条通路, 根据显著性程度P < 0.05, 筛选出前20条相关通路, 主要包括癌症通路(pathways in cancer)、癌症蛋白多糖通路(proteoglycans in cancer)、磷脂酰肌醇-3-羟激酶/蛋白激酶B (PI3K/AKT signaling pathway)、乙型肝炎(hepatitis B)、胰岛素抵抗(insulin resistance)、非酒精性脂肪肝(non-alcoholic fatty liver disease)、低氧诱导因子-1通路(HlF-1 signaling pathway) 等, 见图 7。
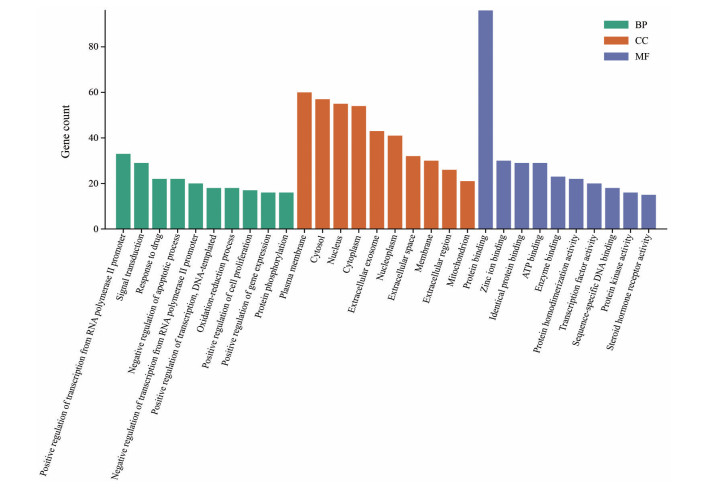
|
Figure 6 GO pathway enrichment analysis for biological processes, cellular components, and molecular function of candidate targets from active components of Huangqi decoction |
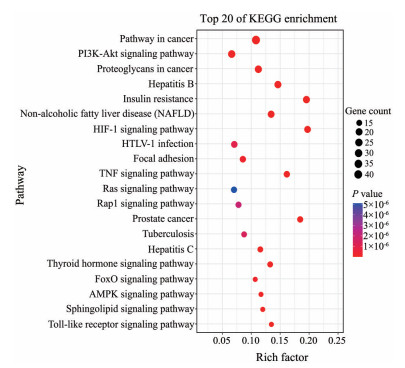
|
Figure 7 KEGG pathway enrichment analysis of candidate targets from active components of Huangqi decoction |
将成分、靶点、通路输入Cytoscape 3.6.0软件, 构建黄芪汤治疗NAFLD的“成分-靶标-通路”网络(图 8)。网络图包含66个节点, 244条边线, 黄芪汤治疗NAFLD与甘草次酸、异甘草素、甘草酸、黄芪甲苷、甘草素、黄芪皂苷Ⅰ等16个活性成分有关, 与AKT1、IL-6、VEGFA、MAPK8和STAT3等靶标密切有关, 与PI3K/AKT、胰岛素抵抗、HlF-1、肿瘤坏死因子、Ras信号通路、Rap1信号通路、甲状腺激素和丝裂原活化蛋白激酶通路密切相关。
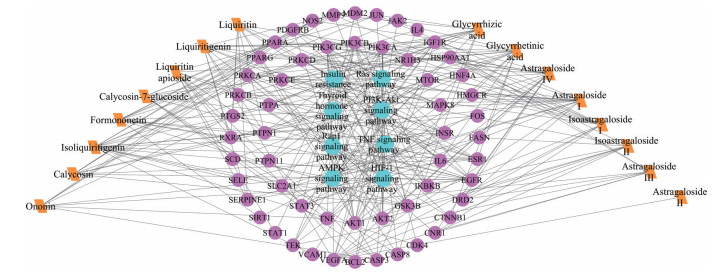
|
Figure 8 "Components-targets-pathways" network of Huangqi decoction |
NAFLD是现代医学的概念, 主要表现为脂堆积、氧化应激损伤、胰岛素抵抗和炎症等[2, 5]。中医则根据其临床表现将其归属于“肥气”、“肝满”、“肝癖”或“积聚”等疾病范畴[20]。目前, NAFLD的发病机制和原因尚不完全清楚, 且临床上缺乏有效的治疗药物。黄芪汤具有治疗诸虚不足、倦怠乏力和清热解毒等功效。近些年来以黄芪或甘草为主要药物的中药复方在治疗NAFLD方面疗效显著。然而, 黄芪汤的主要活性成分、靶蛋白及分子机制尚不清楚。
本研究采用HPLC-DAD-ELSD联用技术构建了由27个共有峰组成的黄芪汤水煎液高效液相色谱指纹图谱, 同时对16个活性成分进行了指认。预测了黄芪汤治疗NAFLD的相关靶蛋白, 构建了“成分-靶点-通路”网络。通过对黄芪汤-靶点网络分析得出黄芪汤治疗NAFLD的主要成分依次是甘草次酸、异甘草素、甘草酸、黄芪甲苷和甘草素等。Zhao等[27]通过构建干扰素γ诱导肝细胞炎症反应细胞模型, 用异甘草素干预, 结果显示异甘草素可下调IL-6炎症因子水平, 其分子机制可能是通过抑制IL-6/STAT3信号通路来发挥抗炎作用的。He等[28]发现甘草酸能下调白血病患者血液细胞中AKT、哺乳动物雷帕霉素靶蛋白(mTOR) 和STAT3磷酸化水平, 可通过阻断AKT/mTOR/STAT3信号通路抑制体内肿瘤细胞生长。黄芪甲苷通过活化PI3K/AKT信号通路介导的线粒体凋亡途径对多西环素诱导的乳鼠心肌细胞的凋亡有保护作用[29]。进一步分析16个活性成分所对应的潜在靶蛋白, 发现一个活性成分往往对应多个潜在靶蛋白, 而一个潜在靶蛋白也同时对应多个活性成分, 不同的潜在靶蛋白共同组成强大的互作网络系统, 体现了黄芪汤主要活性成分配伍的多靶点共同作用机制。通过整合分析共得到129个黄芪汤水煎液治疗NAFLD疾病的潜在靶点, 可作为治疗NAFLD的主要靶点有AKT1、IL-6、VEGFA、MAPK8和STAT3。将黄芪汤治疗NAFLD的潜在靶标进行GO分类富集分析和KEGG通路分析, 癌症通路、癌症蛋白多糖通路、PI3K/AKT、乙型肝炎、胰岛素抵抗和NAFLD等多条信号通路被显著性地富集。根据文献筛选得到与NAFLD密切相关的信号通路, 如PI3K/AKT、胰岛素抵抗、HIF-1、肿瘤坏死因子等, 这些信号通路与胰岛素抵抗、氧化应激和炎性反应密切相关。
非酒精性脂肪肝的发病过程常见脂肪肝和炎症的发生, IL-6是一种主要的促炎细胞因子, 在炎症和胰岛素抵抗等作用中具有重要作用[30]。在非酒精性脂肪肝的患者以及动物模型的血清中均发现其呈现高表达[31, 32]。Miller等[33]研究发现, IL-6/STAT3的激活介导了脂肪基因的表达降低, 改善了IL-10缺乏小鼠的酒精性和非酒精性脂肪肝小鼠的脂肪变性, 表明IL-6/STAT3在非酒精性脂肪肝的调控过程中至关重要。肝脏胰岛素抵抗被认为是发生非酒精性脂肪肝的主要生理因素。Min等[34]研究发现, IL-6的增加诱发了磷酸化STAT3的增加, 使胰岛功能受损, 并且抑制了下游的糖蛋白130/STAT3信号通路的激活, 促进了肝细胞脂肪变性, 以上研究证实了糖蛋白130/STAT3信号通路对于非酒精性脂肪肝的作用。MAPK8也被称为是c-Jun氨基末端激酶1, 是丝裂原活化蛋白激酶家族一员, 在非酒精性脂肪肝的形成中占有重要地位[35]。有研究证明, MAPK8诱导了肝细胞的脂肪变性, 导致了药物诱导的脂肪肝的发生[36]。VEGFA是一种影响血管生成和血管功能的多功能细胞因子, 其生物活性受可溶性受体血管内皮生长因子受体1的调节。临床研究发现, 相较于健康志愿者, 血管内皮生长因子受体1在非酒精性脂肪肝患者的血浆中显著降低, 说明其可能参与了非酒精性脂肪肝疾病的发生发展[37]。王倩等[38]也证实血管内皮生长因子基因多态性与NAFLD发病有关, 血管内皮生长因子基因rs833061位点多态性与吸烟在诱发NAFLD过程中具有协同效应。
综上, 结果表明黄芪汤对NAFLD的治疗涉及AKT1、IL-6、VEGFA、MAPK8和STAT3等关键靶点以及PI3K/AKT、胰岛素抵抗、HIF-1、肿瘤坏死因子等重要信号通路。本研究基于指纹图谱和网络药理学探讨黄芪汤治疗NAFLD的作用机制, 阐述了多成分、多靶点、多通路间的复杂网络相互作用关系, 为进一步开展细胞生物学实验和动物模型实验提供了理论依据。
作者贡献: 李文兰和阎新佳负责文章的实验设计; 杨波和孙向明负责查阅文献; 赵丽珠和于大海负责指纹图谱和网络药理学的实验; 张天雷整理实验数据; 赵丽珠负责论文撰写和修改。
利益冲突: 所有作者均声明没有利益冲突。
| [1] |
Wu JX, Shao HR, Zhang JH, et al. Mussel polysaccharide α-D-glucan (MP-A) protects against nonalcoholic fatty liver disease via maintaining the homeostasis of gut-microbiota and regulating related gut-liver axis signaling pathways[J]. Int J Biol Macromol, 2019, 130: 68-78. DOI:10.1016/j.ijbiomac.2019.02.097 |
| [2] |
Buzzetti E, Pinzani M, Tsochatzis EA. The multiple-hit pathogenesis of non-alcoholic fatty liver disease (NAFLD)[J]. Metabolism, 2016, 65: 1038-1048. DOI:10.1016/j.metabol.2015.12.012 |
| [3] |
Yang P, Zhou YP, Chang CT, et al. Astragaloside Ⅳ regulates Nrf2/Bach1/HO-1 signaling pathway and inhibits H9c2 cardiomyocyte injury induced by hypoxia-reoxygenation[J]. China J Chin Mater Med (中国中药杂志), 2019, 44: 2331-2337. |
| [4] |
Jia W, Xie GX, Zhao AH. Influence of Huangqi decoction on human metabolism and its auxiliary role in disease prevention and treatment[J]. J Med Res (医学研究杂志), 2017, 46: 26-30. |
| [5] |
Li YY, Zeng JK, Zhang XY, et al. Effect of Huangqi decoction on entecavir pharmacokinetics in rat plasma[J]. Acta Pharm Sin (药学学报), 2016, 51: 1429-1435. |
| [6] |
Ma YH, Qiu XQ, Shi X, et al. Effects of Astragali Radix polysaccharides on ACE2-[Ang-(1-7)]-Mas axis and insulin resistance in non-alcoholic steatohepatitis rats[J]. Chin Tradit Pat Med (中成药), 2019, 41: 1012-1017. |
| [7] |
Liu P, Wang GQ, Chen GF, et al. Huangqi decoction inhibits apoptosis and fibrosis, but promotes Kupffer cell activation in dimethylnitrosamine-induced liver fibrosis in rats[J]. BMC Complement Altern Med, 2012, 12: 51-58. DOI:10.1186/1472-6882-12-51 |
| [8] |
Yuan QF, Tang SM, Chen SY, et al. Therapeutic effect of astragalus polysaccharides on nonalcoholic fatty liver disease in rats[J]. Acad J Second Mil Med Univ (第二军医大学学报), 2018, 39: 573-578. |
| [9] |
Li Y, Yi H, Cai YL, et al. Effect of total flavonoids of astragalus on liver fibrosis induced by carbon tetrachloride in rats[J]. Chin Tradit Pat Med (中成药), 2018, 41: 1710-1713. |
| [10] |
Fu X, Song B, Tian GW, et al. The effects of the water-extraction of Astragali Radix and Lycopi herba on the pathway of TGF-smads-UPP in a rat model of diabetic nephropathy[J]. Pharmacogn Mag, 2013, 10: 491-496. |
| [11] |
Wang YL, Ba Y. Studies on the chemical constituents of Radix astragali and their inhibitory effect on HepG2 proliferation[J]. Biomed Res, 2015, 26: 393-398. |
| [12] |
Long Y, Zhang XX, Chen T, et al. Radix Astragali improves dysregulated triglyceride metabolism and attenuates macrophage infiltration in adipose tissue in high-fat diet-induced obese male rats through activating mTORC1-PPARγ signaling pathway[J]. PPAR Res, 2014, 2014: 189085. |
| [13] |
Gao J, Liu ZJ, Chen T, et al. Pharmaceutical properties of calycosin, the major bioactive isoflavonoid in the dry root extract of Radix astragali[J]. Pharm Biol, 2014, 52: 1217-1222. DOI:10.3109/13880209.2013.879188 |
| [14] |
Li L, Hou X, Xu R, et al. Research review on the pharmacological effects of astragaloside Ⅳ[J]. Fund Clin Pharmacol, 2016, 31: 17-36. |
| [15] |
Cai Z, Liu J, Bian H, et al. Astragaloside Ⅳ ameliorates necrotizing enterocolitis by attenuating oxidative stress and suppressing inflammation via the vitamin D3-upregulated protein 1/NF-κB signaling pathway[J]. Exp Ther Med, 2016, 12: 2702-2708. DOI:10.3892/etm.2016.3629 |
| [16] |
Quan GH, Wang H, Cao J, et al. Calycosin suppresses RANKL-mediated osteoclastogenesis through inhibition of MAPKs and NF-κB[J]. Int J Mol Sci, 2015, 16: 29496-29507. DOI:10.3390/ijms161226179 |
| [17] |
Wu H, Gao Y, Shi HL, et al. Astragaloside Ⅳ improves lipid metabolism in obese mice by alleviation of leptin resistance and regulation of thermogenic network[J]. Sci Rep, 2016, 22: 30-39. |
| [18] |
Tang JY, Li S, Li ZH, et al. Calycosin promotes angiogenesis involving estrogen receptor and mitogen-activated protein kinase (MAPK) signaling pathway in zebrafish and HUVEC[J]. PLoS One, 2015, 5: e11822. |
| [19] |
Li J, Lin X, Ma YF, et al. Protective effect of calycosin-7-O-β-D-glucopyranoside against oxidative stress of BRL-3A cells induced by thioacetamide[J]. Pharmacogn Mag, 2015, 11: 524-532. DOI:10.4103/0973-1296.160461 |
| [20] |
Wu L, Zhang F, Zheng SZ, et al. Research progress on treatment of non-alcoholic fatty liver with traditional Chinese medicine[J]. Chin Tradit Pat Med (中成药), 2015, 37: 1072-1075. |
| [21] |
Hoo RL, Wong JY, Qiao CF, et al. The effective fraction isolated from Radix Astragali alleviates glucose intolerance, insulin resistance and hypertriglyceridemia in db/db diabetic mice through its anti-inflammatory activity[J]. Nutr Metab, 2010, 7: 67-79. DOI:10.1186/1743-7075-7-67 |
| [22] |
Zhang MF, Shen YQ. Research advances on anti-obesity and anti-fatty liver effects of licorice and its active components[J]. Drug Eval Res (药物评价研究), 2009, 38: 439-447. |
| [23] |
Gao XY, Wang WQ, Wei SL, et al. Review of pharmacological effects of Glycyrrhiza Radix and its bioactive compounds[J]. China J Chin Mater Med (中国中药杂志), 2009, 34: 2695-2700. |
| [24] |
Yan CL, Luo YL, An FY, et al. Inhibition effects of total astragalosides combined with cisplatin on STAT3-mediated inflammatory signal pathways in H22 tumor-bearing mice[J]. Chin J Biochem Mol Biol (中国生物化学与分子生物学报), 2020, 36: 1359-1366. |
| [25] |
Zhao YM, Liu SX, Zhang CX, et al. Analysis on chemical constituents from Glycyrrhizae Radix et Rhizoma by HPLC-Q-TOF-MS[J]. Chin Tradit Pat Med (中草药), 2016, 47: 2061-2068. |
| [26] |
Yang B, Wang Y, Tian M, et al. Analysis on chemical constituents of Glycyrrhizae Radix et Rhizoma in Pinelliae Rhizoma Praeparatum by UPLC-Q-TOF-MS/MS[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2017, 22: 45-50. |
| [27] |
Zhao HX, Zhang XH, Chen XW, et al. Isoliquiritigenin, a flavonoid from licorice, blocks M2 macrophage polarization in colitis-associated tumorigenesis through downregulating PGE2 and IL-6[J]. Toxicol Appl Pharm, 2014, 179: 311-321. |
| [28] |
He SQ, Gao M, Fu YF, et al. Glycyrrhizic acid inhibits leukemia cell growth and migration via blocking AKT/mTOR/STAT3 signaling[J]. Int J Clin Exp Pathol, 2015, 8: 5175-5181. |
| [29] |
Yang P, Zhou YP, Xia Q, et al. Astragaloside Ⅳ regulates the PI3K/AKT/HO-1 signaling pathway and inhibits H9c2 cardiomyocyte injury induced by hypoxia-reoxygenation[J]. Biol Pharm Bull, 2019, 42: 721-727. DOI:10.1248/bpb.b18-00854 |
| [30] |
Lagathu C, Bastard JP, Auclair M, et al. Chronic interleukin-6 (IL-6) treatment increased IL-6 secretion and induced insulin resistance in adipocyte: prevention by rosiglitazone[J]. Res Commun, 2003, 311: 372-379. |
| [31] |
Kugelmas M, Hill DB, Vivian B, et al. Cytokines and NASH: a pilot study of the effects of lifestyle modification and vitamin E[J]. Hepatology, 2003, 38: 413-419. |
| [32] |
Leclercq IA, Lebrun VA, Starkel P, et al. Intrahepatic insulin resistance in a murine model of steatohepatitis: effect of PPARgamma agonist pioglitazone[J]. Lab Invest, 2007, 87: 56-65. |
| [33] |
Miller AM, Wang H, Bertola A, et al. Inflammation-associated interleukin-6/signal transducer and activator of transcription 3 activation ameliorates alcoholic and nonalcoholic fatty liver diseases in interleukin-10-deficient mice[J]. Hepatology, 2011, 54: 846-856. DOI:10.1002/hep.24517 |
| [34] |
Min HK, Mirshahi F, Verdianelli A, et al. Activation of the GP130-STAT3 axis and its potential implications in nonalcoholic fatty liver disease[J]. Am J Physiol Gastrointest Liver Physiol, 2015, 308: G794-G803. DOI:10.1152/ajpgi.00390.2014 |
| [35] |
Xu P, Zhang G, Hou S, et al. MAPK8 mediates resistance to temozolomide and apoptosis of glioblastoma cells through MAPK signaling pathway[J]. Biomed Pharmacother, 2018, 106: 1419-1427. DOI:10.1016/j.biopha.2018.06.084 |
| [36] |
Gong LY, Tang HM, Luo ZZ, et al. Tamoxifen induces fatty liver disease in breast cancer through the MAPK8/FoxO pathway[J]. Clin Transl Med, 2020, 10: 137-150. DOI:10.1002/ctm2.5 |
| [37] |
Yilmaz Y, Yonal O, Kurt R, et al. Circulating levels of vascular endothelial growth factor A and its soluble receptor in patients with biopsy-proven nonalcoholic fatty liver disease[J]. Arch Med Res, 2011, 42: 38-43. DOI:10.1016/j.arcmed.2010.12.001 |
| [38] |
Wang Q, Wu PB, Li M, et al. Gene polymorphism of VEGF and its interaction with smoking in patients with non-alcoholic fatty liver disease[J]. Shandong Med (山东医药), 2016, 56: 7-9. |
 2021, Vol. 56
2021, Vol. 56


