2. 军事科学院军事医学研究院辐射医学研究所, 北京 100850
2. Institute of Radiation Medicine, Academy of Military Medicine Sciences, Academy of Military Sciences, Beijing 100850, China
细菌性肺炎(bacterial pneumonia) 是临床最常见的肺炎类型和感染性疾病[1], 占成人各类病原体肺炎的80%。引起细菌性肺炎的病原菌主要包括金葡菌(Staphylococcus aureus, SA)[2]、肺炎链球菌(Streptococcus pneumoniae)[3]、肺炎克雷伯杆菌(Klebsiella pneumoniae)[4]和铜绿假单胞菌(Pseudomonas aeruginosa)[5]。抗生素是临床治疗细菌性肺炎的主要手段, 但随着抗生素滥用, 耐药菌包括多重耐药菌大量出现, 成为院内感染的主要原因[6], 使细菌性肺炎致死人数自60年代以来逐渐增加, 如欧盟每年约有25 000名患者死于细菌性肺炎[7]。
天然产物作为抗生素的替代药物之一受到了广泛的关注, 其中, 白藜芦醇[8]、马鞭草苷[9]和穿心莲内酯[10]均被用于治疗细菌性肺炎的研究。肉桂(Cinnamomum cassia Presl) 在我国南方广泛种植, 属樟科, 可入药, 有温中补肾、温经通脉、散寒止痛的功效[11]。肉桂油是从肉桂皮或叶中提取的挥发油, 主要成分包括肉桂醛、丁香酚和苯甲醛[12]。肉桂醛有抗菌[13]、抗炎、抗氧化[14]、抗血栓和抗肿瘤[15]和杀虫作用[16]。
肺部给药系统将药物直接递送至肺部病变组织, 可避免口服药物的首过效应, 提高药物的生物利用度[17, 18], 增加药物的肺组织分布, 降低给药剂量[19], 是治疗肺部疾病(肺炎、肺纤维化、哮喘和慢性阻塞性肺疾病) 较理想的方式[20]。根据吸入药物状态不同, 肺部给药剂型可分为气雾剂、雾化吸入溶液和粉雾剂。粉雾剂(dry powder inhaler) 是空气动力学粒径为1~5 μm的疏松粉末, 具有药物稳定性好、肺部沉积率高和起效快的优点, 是目前肺部给药系统的研究热点[21]。
环糊精(cyclodextrin, CD) 是具有亲水性外表面和亲脂性中心腔的环状低聚糖[22], 可在体内降解。α-CD、β-CD和γ-CD是3种常见的CD, 分别由6、7、8个葡萄糖基单元组成。β-CD生产成本低, 空穴大小适宜与各类有机分子形成包合物, 被广泛使用。
本文针对细菌性肺炎治疗的临床问题, 结合肉桂油、环糊精和粉雾剂特点, 制备了一种肉桂油β-环糊精包合物(cinnamon oil-β-cyclodextrin inclusion complex, CO-β-CD), 并制备其粉雾剂, 考察CO-β-CD粉雾剂对SA肺炎的治疗效果和机制。
材料与方法药物与试剂 肉桂油(批号: 20200610, 江西环球天然香料有限公司); β-环糊精(批号: 20200931, 山东精细化工有限公司); 肉桂醛标准品(批号: E1909065, 上海阿拉丁生化科技股份有限公司); 青霉素钠(批号: 200703, 华北制药集团动物保健品有限责任公司); LB肉汤培养基(批号: 525E031, 北京索莱宝科技有限公司); 琼脂粉(批号: 20180328, 国药集团化学试剂有限公司); 地塞米松磷酸钠注射液(批号: 20200302, 山西省芮城科龙兽药有限公司); 小鼠白细胞介素-6 (interleukin-6, IL-6) ELISA试剂盒(批号: M201110-004a, 欣博盛生物科技有限公司); 小鼠肿瘤坏死因子-α (tumor necrosis factor-α, TNF-α) ELISA试剂盒(批号: 02/2021, 上海酶联生物科技有限公司); 乙腈为色谱级, 其余试剂均为分析纯。本文用水均为去离子水, 用纯水仪制备。
仪器 冷冻干燥机(型号: LGJ-30F, 北京松源华兴科技发展有限公司); 干法激光粒度仪(型号: BT-2001, 丹东百特仪器有限公司); 傅里叶变换红外光谱仪(型号: Spectrum Two, 美国Perkin Elmer公司); 高效液相色谱仪(型号: Agilent 1260, 美国安捷伦公司); 扫描电镜(型号: EmCrafts CUBE Ⅱ, 韩国EMCRAFTS公司); 新一代药用撞击器(型号: TPK 2000R, 英国Copley公司); 小鼠操作台(型号: HRH-HAG6); 小动物喉镜(型号: HRH-HAG-6, 北京慧荣和科技有限公司); 小鼠肺部给药针(实验室自制); 倒置荧光显微镜(型号: BDS200-FL, 重庆奥特光学仪器有限责任公司); 高速组织研磨仪(型号: KI-Ⅱ, 武汉谷歌生物科技有限公司); 酶标仪(型号: ELX800, 美国伯滕仪器有限公司); 血液细胞分析仪(型号: DF52 Vet, 深圳市帝迈生物技术有限公司); 纯水仪(型号: Heal Force Super NW, 上海康雷仪器有限公司)。
实验动物 ICR小鼠, SPF级, 雄性, 体重20 ± 2 g, 许可证号: SCXK (京) 2019-0010, 斯贝福(北京) 生物技术有限公司。实验期间动物自由取食、饮水。所有动物实验经军事科学院军事医学研究院伦理委员会批准且实验均按照相关指导原则和规定进行。
肉桂油β-环糊精包合物粉雾剂的工艺处方筛选 取β-CD加入相应量的水, 搅拌下缓慢滴入肉桂油乙醇溶液(1∶1, w/w), 滴加完毕后继续搅拌4 h, 混悬液于1 000 r·min-1离心5 min后弃去上清液, 底部沉淀用无水乙醇洗涤3次后置-35 ℃冷冻干燥机中, 预冻3 h, 然后梯度升温, 共冷冻干燥18 h, 即得白色粉末, 过100目筛网, 得到CO-β-CD。选取影响包合物性质的3种因素优化处方工艺(表 1), 包括①干燥方法: 自然晾干, 冷冻干燥; ② β-CD与水质量比: 1∶4、1∶5、1∶6; ③肉桂油与β-CD的质量比: 1∶5、1∶8、1∶10。
| 表 1 Factors and levels for the single factor study of cinnamon oil-β-cyclodextrin inclusion complex (CO-β-CD) formulations |
激光粒度仪测定CO-β-CD中位粒径(median diameter, D50)。CO-β-CD粉末称重, 于10 mL量筒中振实100次, 记录振实前后体积, 计算CO-β-CD的松密度和振实密度(n = 3)。按公式(1) [23]计算CO-β-CD粉末的空气动力学粒径(aerodynamic diameter, Da)。Da是影响粉末肺部沉积的最主要因素。筛选得到制备CO-β-CD粉雾剂的最优工艺处方。
| $ D_{\mathrm{a}}=D_{\mathrm{e}}\left(\rho / \rho_{0} \chi\right)^{1 / 2} $ | (1) |
其中, De为几何粒径(median geometric diameter), 本文采用D50; ρ为振实密度; ρ0为参照密度(1 g·cm-3); χ为动态形态因子(球形时χ = 1, 本文采用1)。
肉桂油β-环糊精包合物粉雾剂的制备 根据筛选出的最优处方工艺制备CO-β-CD。用傅里叶变换红外光谱仪对β-CD、CO-β-CD、肉桂油、肉桂油和β-CD的物理混合物进行红外光谱扫描鉴定。
包封率与载药量测定 肉桂油中主要成分为肉桂醛。采用高效液相色谱法(HPLC) 测定肉桂油中肉桂醛的含量, 从而确定肉桂油含量[24]。色谱条件为色谱柱: Agilent C18 (250 mm × 4.5 mm, 5 μm); 柱温: 25 ℃; 流动相: 乙腈-0.1%磷酸溶液(33∶67, v/v); 流速: 1.0 mL·min-1; 检测器: 二极管阵列检测器; 检测波长: 290 nm; 进样量: 10 μL。取CO-β-CD 20 mg至10 mL量瓶中, 加入无水甲醇约8 mL, 水浴超声提取30 min, 无水甲醇定容, 过0.22 μm滤膜, 取续滤液测定肉桂醛含量。通过公式(2) 和(3) 计算CO-β-CD的包封率(entrapment efficiency, EE) 和载药量(loading efficiency, LE)。
| $ \mathrm{EE}=W_{\mathrm{e}} / W \times 100 \% $ | (2) |
| $ \mathrm{LE}=W_{\mathrm{e}} / W_{\mathrm{m}} \times 100 \% $ | (3) |
其中, We表示测得包合物内的药量; W表示投药量; Wm表示包合物的总重量。
形貌观察 取适量β-CD原料和CO-β-CD涂布在双面导电胶上, 固定于金属板上后喷金, 在扫描电镜(scanning electron microscope, SEM) 下观察粒子形态。
微细粒子比例测定 称取CO-β-CD至3号羟丙甲纤维素胶囊内, 每粒含CO-β-CD 20 mg。设置新一代药用撞击器(next generation impact, NGI) 流速为60 L·min-1, 吸入时间为4 s, 依次取10粒胶囊至吸入器内进行吸入测试。完毕后, 用无水甲醇分别冲洗预分离器、喉部, 合并洗液至50 mL量瓶中; 冲洗装置(吸入器、适配器)、1级、2级、3级和4级收集盘, 合并洗液至25 mL量瓶中; 冲洗5级、6级、7级和micro-orifice collector (MOC) 收集盘, 合并洗液至10 mL量瓶中, 参照“载药量测定”项下方法测定各部位肉桂油含量, 按公式(4) 计算CO-β-CD的微细粒子比例(fine particle fraction, FPF)。
| $ \mathrm{FPF}=W_{2 \sim 7} / W_{\mathrm{total}} \times 100 \% $ | (4) |
体外抑菌实验 取适量CO-β-CD至5 mL的Luria-Bertani (LB) 肉汤中, 配成质量浓度为1、2、4、6和10 mg·mL-1的CO-β-CD混悬液。取适量青霉素钠至10 mL LB肉汤中, 逐级稀释制成系列浓度的青霉素溶液。将药物加入100 μL SA液(5×105 CFU·mL-1), 37 ℃振荡(150 r·min-1) 孵育24 h, 取50 μL铺板计数, 观察菌落生长情况。形成菌落数 < 5的最小试样浓度为该试样对SA的最小杀菌浓度[25]。
给药剂量筛选 将小鼠随机分为5组: 正常组、假手术组、低剂量组、中剂量组和高剂量组, 每组5只; 其中低、中、高剂量组分别经气管给予CO-β-CD混悬液(40、80、120 mg·mL-1) 25 μL; 假手术组模拟给药过程, 不给予任何药物; 正常组不做处理。给药1 h后解剖观察各组小鼠肺部情况。
细菌性肺炎小鼠模型的建立及给药 将小鼠随机分为4组: 正常组、模型组、CO-β-CD组和青霉素组, 每组6只。除正常组外, 其余各组小鼠每日腹腔注射地塞米松磷酸钠注射液(5 mg·mL-1) 0.1 mL, 连续5日, 造成小鼠免疫功能低下, 末次注射地塞米松2 h后, 经小鼠气管喷入SA液(1×106 CFU·mL-1) 25 μL, 建立细菌性肺炎模型。造模6 h后CO-β-CD组和青霉素组分别经气管给予25 μL的CO-β-CD混悬液(80 mg·mL-1) 和青霉素溶液(1 mg·mL-1) 进行治疗, 连续3日。正常组和模型组不做处理。
血液细胞分析 小鼠处死前, 尾静脉取血20 μL至1.5 mL的细胞稀释液中, 混匀后用血液细胞分析仪测定血液中白细胞及中性粒细胞数量。
肺部外观及病理检查 肺部外观与肺组织病理变化可最直接反映肺部情况。末次给药12 h后, 麻醉处死小鼠, 取右上叶肺组织用生理盐水清洗, 放入10%甲醛溶液中固定24 h, 苏木精-伊红(hematoxylin and eosin, H & E) 染色后在显微镜下观察组织病理形态。
TNF-α、IL-6含量测定 取肺右中下叶称重, 加入9倍量(w/w) 4 ℃生理盐水, 于高速组织研磨仪中进行研磨, 研磨液低温高速离心(5 000 ×g) 15 min, 取上清液用ELISA试剂盒测定肺组织中TNF-α和IL-6。
统计学分析 采用SPSS 16.0软件通过单因素方差分析对数据进行统计学分析。实验数据以均数±标准差(
经搅拌法得到的含水CO-β-CD沉淀的干燥方式对包合物粉末形态有较大影响。与自然晾干比较, 冷冻干燥制备的CO-β-CD粉末更加疏松, 更容易过筛, 粉末的振实密度、D50及Da均远小于自然晾干得到的CO-β-CD, 更适合肺吸入给药(表 2)。进一步处方筛选发现, β-CD与水的质量比为1∶4时制备的包合物最疏松, Da最小, CO-β-CD粉末作为粉雾剂的粉体学性质更好。肉桂油与β-CD的质量比为1∶5时制备的CO-β-CD有明显肉桂油气味, 说明肉桂油用量过大, 部分肉桂油成分未进入β-CD疏水腔内; 肉桂油与β-CD的质量比为1∶8时Da最小, 可提高粉末肺部沉积(表 2)。因此, 制备CO-β-CD粉雾剂的最优工艺处方为: 冷冻干燥工艺, β-CD与水的质量比为1∶4, 肉桂油与β-CD的质量比为1∶8。
|
表 2 Effects of formulations and processes on the powder properties of CO-β-CD. D50: Median diameter; Da: Aerodynamic diameter. n = 3, |
红外光谱显示, β-CD与CO-β-CD在2 817 cm-1和2 744 cm-1处无肉桂醛中醛基吸收峰; CO-β-CD中1 672 cm-1和1 625 cm-1处的肉桂醛中碳氧双键的吸收峰相较于肉桂油与β-CD物理混合物明显变弱(图 1), 说明在CO-β-CD中肉桂油已被包入β-CD疏水腔内, 形成了包合物。

|
Figure 1 FTIR spectra of β-CD, CO-β-CD, CO and physical mixture |
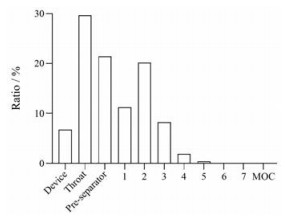
HPLC测得CO-β-CD包封率达(98.60 ± 6.00) %, 载药量为(10.96 ± 0.67) %。CO-β-CD外观为疏松的白色粉末。扫描电镜显示, β-CD原料为块状, 单个颗粒粒径达几十微米(图 2A), 而CO-β-CD粉末为约1~3 μm宽度的条状或不规则颗粒(图 2B)。CO-β-CD粉末的松密度为0.09 ± 0.00 g·cm-3, 振实密度为0.15 ± 0.01 g·cm-3, D50为3.50 ± 0.01 μm, Da为1.34 ± 0.02 μm。Da在1~5 μm内的粒子可以通过肺吸入到达肺组织深部[26]。CO-β-CD的FPF为30.90%, 符合中国药典有关吸入粉雾剂的要求(图 3)。因此, 本文制备的CO-β-CD粉雾剂可到达肺深部组织, 适合肺吸入给药和治疗细菌性肺炎。

|
Figure 2 SEM images of β-CD powders (A) and CO-β-CD powders (B) |
|
Figure 3 Ratio of CO-β-CD in the different compartments of next generation impact (NGI). MOC: Micro-orifice collector |
肉桂油和CO-β-CD不溶于水, 无法用肉汤稀释法通过液体培养基的澄清度判断其最小抑菌浓度, 但可以通过细菌在液体培养基孵育后铺板计数的结果判断最小杀菌浓度(图 4)。CO-β-CD在质量浓度为1 mg·mL-1时有大量菌落生长, 2 mg·mL-1时则未见菌落生长, 因此判断CO-β-CD对SA的最小杀菌浓度为2 mg·mL-1; 青霉素在质量浓度为12.5 mg·mL-1时有大量菌落生长, 当质量浓度增至25 μg·mL-1则无菌落生长, 因此判断青霉素对SA的最小杀菌浓度为25 μg·mL-1。青霉素对SA的抑菌作用远强于CO-β-CD, 但肉桂油的多重药理作用是其治疗细菌性肺炎的优势。

|
图 4 In vitro anti-Staphylococcus aureus (SA) effects of penicillin and CO-β-CD |
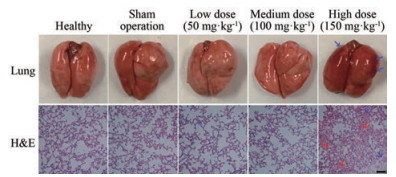
肉桂油的黏性较大, 难以经气管给药。本文仅对CO-β-CD的给药剂量进行筛选。正常组小鼠肺部为粉红色, 无出血现象; 假手术组、低剂量组及中剂量组小鼠的肺组织也未见明显损伤, 但高剂量组小鼠肺部有出血现象。H & E病理切片显示正常组、假手术组、低剂量组及中剂量组的肺组织结构清晰, 肺泡腔完整、肺泡腔内未见出血; 高剂量组小鼠肺泡腔内有出血现象、大量炎性细胞浸润, 肺部损伤严重(图 5)。因此, 本文选择中剂量(25 μL, 80 mg·mL-1, 相当于100 mg·kg-1)进行CO-β-CD气管给药。
|
Figure 5 Appearance of lung tissues and H & E (100×) stained lung tissue sections after intratracheal (i.t.) administration of CO-β-CD to the mice. The blue arrows indicate bleeding and the red arrows indicate inflammatory exudates. The scale bar indicates 50 µm |
在SA肺炎造模4天后, 模型组小鼠全部死亡; 而给药组包括CO-β-CD组和青霉素组仅死亡1只, 生存率为83.33%; 正常组小鼠未死亡(图 6)。结果表明, CO-β-CD和青霉素经气管给药后, 均可减轻细菌性肺炎造成的肺损伤, 显著提高了小鼠的生存率。

|
Figure 6 Survival profiles of the mice after treatment |
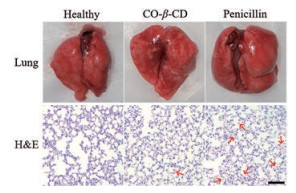
正常组小鼠肺部颜色粉红, 质地柔软, 无出血; CO-β-CD组小鼠肺部有轻微出血, 青霉素组小鼠肺部未见明显出血(图 7)。H & E病理切片显示正常组小鼠肺组织结构清晰、排列整齐, 肺泡腔内未见出血、无炎性细胞浸润; CO-β-CD和青霉素组的肺组织结构正常, 无明显出血现象; CO-β-CD组的肺组织有少量炎性细胞浸润, 而青霉素组的炎性细胞浸润较多(图 7)。结果表明, CO-β-CD和青霉素经气管给药后, 可明显减轻因细菌感染带来的肺损伤, 但CO-β-CD比青霉素的抗炎效果可能更好。
|
Figure 7 Appearance of lung tissues and H & E (100×) stained lung tissue sections after i.t. administration of CO-β-CD and penicillin to the mice. The red arrows indicate inflammatory exudates. The scale bar indicates 50 µm |
血液中白细胞、中性粒细胞数量增加是临床细菌感染诊断指标之一。本文中各组之间白细胞数量差别不大, 均无统计学差异(图 8A)。CO-β-CD组中性粒细胞的平均数量高于正常组及青霉素组, 但无统计学差异(图 8B)。TNF-α是在炎症发展中早期出现的一种重要炎症因子, IL-6也是典型的炎症指标。本研究中青霉素组的IL-6水平高于CO-β-CD组(图 8C, P < 0.05); 青霉素组的TNF-α水平明显高于正常组与CO-β-CD组(图 8D, P < 0.001)。结果表明, CO-β-CD在一定程度上通过抑制炎症因子TNF-α和IL-6, 减轻细菌性肺炎小鼠肺组织的损伤。

|
Figure 8 Effects of different treatments on the white blood cells (WBC, A), neutrophils (B) of tail vein blood and interleukin-6 (IL-6, C), and tumor necrosis factor-α (TNF-α, D) of lung tissue. WBC: White blood cell. n = 3, |
细菌性肺炎可导致严重的肺损伤, 呼吸功能受限, 甚至死亡。抗菌治疗是决定细菌性肺炎预后的关键。目前治疗细菌性肺炎主要选择抗感染药物或抗生素, 但长期应用导致细菌耐药性产生, 对临床治疗和药物开发带来极大挑战[27]。
肉桂油含有多种活性成分, 不仅可以产生协同作用, 积极发挥抗菌和多种药理活性, 而且由于成分复杂, 不易产生耐药性[28]。本文体外研究证明了肉桂油有一定抗菌作用, 但由于肉桂油是一种黏性的挥发油, 将肉桂油制备成肺吸入制剂存在较大挑战。
将油类物质制备成固体颗粒的方法包括吸附于固体颗粒[29]、成乳后再干燥[21]、制备成脂质体后干燥[30]以及形成包合物[31]。β-环糊精作为肺吸入制剂辅料安全性较好[32], 已经有多个研究报道了作为肺吸入制剂辅料[33, 34]。β-环糊精包合是将肉桂油固体化的较好方式, 既将液体药物固体化, 又在一定程度上减小了肉桂油的挥发。
肺吸入制剂特别是易携带和使用的粉雾剂对颗粒粒径有较严格要求。本文用搅拌法制备了CO-β-CD, 但发现其干燥工艺对颗粒粒径形态有较大影响。冷冻干燥是在真空下冰升华的过程, 得到的CO-β-CD包合物粉末疏松, 粒度可达到粉雾剂要求。
植物挥发油成分一般为萜烯类、醛类、酯类和醇类等。多数挥发油对皮肤和黏膜有一定刺激性。本研究发现CO-β-CD经气管给药剂量安全范围大, 可达到100 mg·kg-1。这是因为挥发油从环糊精分子释放较慢, 不易对周围组织产生刺激。
CO-β-CD对SA的最小杀菌浓度远大于青霉素, 这与青霉素的抗菌能力强有关, 同时也与CO-β-CD缓慢释放肉桂油有关。在动物体内实验中, 细菌性肺炎疾病模型较严重, 模型组动物在考察末期均死亡。而治疗组小鼠的肺部感染经相应治疗后, 肺部损伤大大减轻, 全身免疫反应大大减弱, 呈现较好治疗效果, 表明青霉素与CO-β-CD在体内均有较好的抗菌能力。在治疗末期, 青霉素组小鼠肺组织中的炎症依然存在, 而CO-β-CD组的炎症几乎消失, 表明CO-β-CD具有较好的抗炎效果, 这与其含有多种活性成分有关。CO-β-CD抗菌和抗炎的双重作用有利于细菌性肺炎的治疗和受损肺组织的修复。另外, 肉桂油具有广谱抗菌作用, 对革兰阳性菌、革兰阴性菌和真菌都有较强的抗菌效果[35], 而青霉素的抗菌谱有限, 且部分患者对青霉素过敏。
本文针对细菌性肺炎传统治疗药物如青霉素长期应用后易产生细菌耐药性的问题, 提供了一种天然挥发油的肺吸入制剂, 即CO-β-CD粉雾剂, 发现其适合肺吸入, 对常见的SA有一定抗菌作用, 对细菌性肺炎有较好的治疗作用。CO-β-CD粉雾剂是一种有潜力的细菌性肺炎治疗肺吸入制剂。
作者贡献: 李瑞滕负责实验设计、实验操作、数据分析和论文初稿撰写; 刘岩负责实验设计和结果分析; 章辉负责实验操作; 袁伯川负责论文写作与修改; 杜丽娜负责实验指导和数据分析; 金义光负责课题设计、实验指导、数据分析、论文写作与修改。
利益冲突: 本文不与任何个人或集体存在利益冲突。
| [1] |
Wang ZW, Li JS, Yu XQ, et al. Analysis of curative effect index and criterion in the treatment of bacterial pneumonia with anti-infective drug[J]. Chin J Antibiotic (中国抗生素杂志), 2008, 12: 714-716. |
| [2] |
Calle CD, Morata L, Cobos-Trigueros N, et al. Staphylococcus aureus bacteremic pneumonia[J]. Eur J Clin Microbiol Infect Dis, 2016, 35: 497-502. DOI:10.1007/s10096-015-2566-8 |
| [3] |
Jacobs MR. Streptococcus pneumoniae: epidemiology and patterns of resistance[J]. Am J Med, 2004, 117: 3-15. DOI:10.1016/S0002-9343(04)00442-5 |
| [4] |
Wang GY, Zhao G, Chao XY, et al. The characteristic of virulence, biofifilm and antibiotic resistance of klebsiella pneumoniae[J]. Int J Environ Res Public Health, 2020, 17: 6278. DOI:10.3390/ijerph17176278 |
| [5] |
Colleen SC, Thomas B, Parizad TP. Mechanisms and targeted therapies for Pseudomonas aeruginosa lung infection[J]. Am J Respir Crit Care Med, 2018, 197: 708-727. DOI:10.1164/rccm.201705-1043SO |
| [6] |
Loebinger MR, Wilson R. Bacterial pneumonia[J]. Medicine, 2008, 36: 285-290. DOI:10.1016/j.mpmed.2008.03.011 |
| [7] |
Elcocks ER, Spencer-Phillips PT, Adukwu EC. Rapid bactericidal effect of cinnamon bark essential oil against Pseudomonas aeruginosa[J]. J Appl Microbiol, 2020, 128: 1025-1037. DOI:10.1111/jam.14538 |
| [8] |
Zhu LF, Liu X, Chen HJ, et al. Preparation of resveratrol-DPPC liposomal dry powder inhalations and its antibacterial activities[J]. Chin Tradit Herbal Drugs (中草药), 2018, 49: 5803-5811. |
| [9] |
Zhao X, Li H, Wang J, et al. Verbascoside alleviates pneumococcal pneumonia by reducing pneumolysin oligomers[J]. Mol Pharmacol, 2016, 89: 376-387. DOI:10.1124/mol.115.100610 |
| [10] |
Zhang TT, Zhu LF, Li M, et al. Inhalable andrographolide-β-cyclodextrin inclusion complexes for treatment of Staphylococcus aureus pneumonia by regulating immune responses[J]. Mol Pharm, 2017, 14: 1718-1725. DOI:10.1021/acs.molpharmaceut.6b01162 |
| [11] |
Mu HD, Tu PF, Jiang Y. Network pharmacology-based study on mechanisms of warming channel and relieving stagnation effects of cinnamomum cassia presl[J]. Acta Pharm Sin (药学学报), 2016, 51: 1724-1733. |
| [12] |
Iqbal S, Bhanger MI, Anwar F. Antioxidant properties and components of some commercially available varieties of rice bran in Pakistan[J]. Food Chem, 2005, 93: 265-272. DOI:10.1016/j.foodchem.2004.09.024 |
| [13] |
Sim JX, Khazandi M, Pi H, et al. Antimicrobial effects of cinnamon essential oil and cinnamaldehyde combined with EDTA against canine otitis externa pathogens[J]. J Appl Microbiol, 2019, 127: 99-108. DOI:10.1111/jam.14298 |
| [14] |
Bessonov VV, Zaĭtseva LV, Stepanova LI, et al. Oxidative and hydrolytic deterioration of palm oil and fat products based on it under various conditions of storage and transportation[J]. Vopr Pitan, 2012, 81: 18-23. |
| [15] |
Song ZH, Zhang YW, Wang LJ, et al. The pharmacological activity of cinnamaldehyde and its research progress[J]. Pharm J Chin PLA (解放军药学学报), 2018, 34: 550-554. |
| [16] |
Butt MS, Sultan MT, Butt MS, et al. Garlic: nature's protection against physiological threats[J]. Crit Rev Food Sci Nutr, 2009, 49: 538-551. DOI:10.1080/10408390802145344 |
| [17] |
Jin Y, Li M. Pulmonary drug delivery systems and progress in their applications to lung disease treatment[J]. J Int Pharma Res (国际药学研究杂志), 2015, 42: 289-295, 322. |
| [18] |
Zhang MM, Li M, Ge YY, et al. Liposomal melatonin dry powder inhalers for the treatment of primary lung cancer[J]. Acta Pharm Sin (药学学报), 2019, 54: 555-564. |
| [19] |
Hu YZ, Li M, Zhang TT, et al. Preparation of liposomal artesunate dry powder inhalers and the effect on the acute lung injury of rats[J]. Acta Pharm Sin (药学学报), 2016, 51: 1906-1912. |
| [20] |
Zhang GL, Xiao ZM, Yu X, et al. Comparative study of zedoary turmeric oil and curcumol dry powder inhalers for treatment of acute lung injury[J]. Acta Pharm Sin (药学学报), 2020, 55: 1312-1319. |
| [21] |
Li M, Zhu L, Zhang T, et al. Pulmonary delivery of tea tree oil-β-cyclodextrin inclusion complexes for the treatment of fungal and bacterial pneumonia[J]. J Pharm Pharmacol, 2017, 69: 1458-1467. DOI:10.1111/jphp.12788 |
| [22] |
Zhang HY, Ping QN, Guo JX, et al. Pharmacokinetics of breviscapine and its β-cyclodextrin complex in rats[J]. Acta Pharm Sin (药学学报), 2005, 40: 563-567. |
| [23] |
Francesca U, Roberta EV, Concetta G, et al. Insulin-loaded PLGA/cyclodextrin large porous particles with improved aerosolization properties: in vivo deposition and hypoglycaemic activity after delivery to rat lungs[J]. J Control Release, 2009, 135: 25-34. DOI:10.1016/j.jconrel.2008.12.011 |
| [24] |
Yi X, Li L, Xiao XN. The determination of cinnamicaldehyde in cinnamon oil microemulsion by HPLC[J]. Lishizhen Med Mater Med Res (时珍国医国药), 2011, 6: 1325-1326. |
| [25] |
Zhong X. The Study of Antimicrobial Activity for Essential Oil in the Chinese Fir Sawdust Extraction (杉木屑精油提取及抑菌活性的研究)[D]. Changsha: Central South University of Forestry and Technology, 2013.
|
| [26] |
Elversson J, Millqvist-Fureby A, Alderborn G. Droplet and particle size relationship and shell thickness of inhalable lactose particles during spray drying[J]. J Pharm Sci, 2003, 92: 900-910. DOI:10.1002/jps.10352 |
| [27] |
Alós JI. Antibiotic resistance: a global crisis[J]. Enferm Infecc Microbiol Clin, 2015, 33: 692-699. DOI:10.1016/j.eimc.2014.10.004 |
| [28] |
Chaib F, Allali H, Bennaceur M, et al. Chemical composition and antimicrobial activity of essential oils from the aerial parts of asteriscus graveolens (forssk.) less. and pulicaria incisa (lam.) DC.: two asteraceae herbs growing wild in the hoggar[J]. Chem Biodivers, 2017, 14: e1700092. DOI:10.1002/cbdv.201700092 |
| [29] |
Hua YZ, Li M, Zhang MM, et al. Inhalation treatment of idiopathic pulmonary fibrosis with curcumin large porous microparticles[J]. Int J Pharm, 2018, 551: 212-222. DOI:10.1016/j.ijpharm.2018.09.031 |
| [30] |
Sherry M, Charcosset C, Fessi H, et al. Essential oils encapsulated in liposomes: a review[J]. J Liposome Res, 2013, 23: 268-275. DOI:10.3109/08982104.2013.819888 |
| [31] |
Su ZP, Qin YR, Zhang K, et al. Inclusion complex of exocarpium citri grandis essential oil with β-cyclodextrin: characterization, stability, and antioxidant activity[J]. J Food Sci, 2019, 84: 1592-1599. DOI:10.1111/1750-3841.14623 |
| [32] |
Evrard B, Bertholet P, Gueders M, et al. Cyclodextrins as a potential carrier in drug nebulization[J]. J Control Release, 2004, 93: 403-410. |
| [33] |
Ozeki T, Kano Y, Takahashi N, et al. Improved bioavailability of a water-insoluble drug by inhalation of drug-containing maltosyl-β-cyclodextrin microspheres using a four-fluid nozzle spray drier[J]. AAPS Pharm Sci Tech, 2012, 13: 1130-1137. DOI:10.1208/s12249-012-9826-z |
| [34] |
Ge YY, Zhang TT, Zhang MM, et al. Pulmonary delivery of chlorogenic acid β-cyclodextrin inclusion complexes for therapy of acute lung injury[J]. J Int Pharm Res (国际药学研究杂志), 2018, 45: 772-777. |
| [35] |
Brochot A, Angèle G, Haddioui L, et al. Antibacterial, antifungal, and antiviral effects of three essential oil blends[J]. Microbiol Open, 2017, 6: e459. |
 2021, Vol. 56
2021, Vol. 56


