“本草名言十八反, 半蒌贝蔹及攻乌; 藻戟遂芫俱战草, 诸参辛芍叛藜芦”[1]。“十八反”是中药配伍禁忌的重要组成部分, 而芫花-甘草是“十八反”的代表性组合之一, 对其的研究也较为深入。芫花-甘草配伍后的毒性较芫花单独使用时大, 并且随着甘草配比增加, 毒性也逐渐增加[2]。虽然已有学者证实两者合煎时, 随着甘草配比的增加会使芫花中的有毒二萜类成分溶出增加[3, 4], 也有甘草酸(glycyrrhizic acid, GA) 具有表面活性剂性质起到助溶作用的报道, 但尚未直接观察到GA以何种形式增加芫花二萜类成分溶出度, 进而导致配伍后毒性增强。芫花的乙酸乙酯部位是其毒性部位[5], 毒性成分以芫花酯甲、芫花酯乙、芫花酯丙等二萜类成分为主。课题组前期对中药芫花成分系统分离及抗肿瘤活性的研究发现, 毒性成分芫花酯甲的量最大, 并且对MCF-7、HT1080细胞有很好的体外抗肿瘤活性[6]。因此, 本实验以芫花中强毒性且含量最高的有毒二萜类成分芫花酯甲、以甘草中含量最高且《中华人民共和国药典》 2020年版规定的指标性成分GA为研究对象, 从分析化学、材料化学和毒理学层面尝试阐释芫花-甘草配伍增毒机制, 为芫花-甘草在临床的应用提供理论基础。
材料与方法试剂 芫花饮片购自北京同仁堂(经北京中医药大学刘春生教授鉴定为瑞香科植物芫花Daphne genkwa Sieb. et Zucc.的干燥花蕾), 储存于本实验室; GA (上海源叶生物科技生物有限公司, 批号: S30717, 纯度: 98%)。4%多聚甲醛(武汉赛维尔生物科技有限公司, 批号: G1101); 4', 6-二脒基-2-苯基吲哚(4', 6-diamidino-2-phenylindole, DAPI) (北京索莱宝科技有限公司, 批号: C0065); 硅片(上海国丽电子科技有限公司); 芫花酯甲为自制[6], 前处理在材料与方法“供试品制备”和“试管倒置实验”中, 对液相样品进行1H-NMR和13C-NMR鉴定为芫花酯甲, 纯度约90%。
仪器 荧光倒置显微镜(Dmi8, Leica公司); 场发射扫描电子显微镜(JSM-7001F, JEOL公司); Beta 2-8 LDplus真空冷冻干燥机(德国Christ公司); 电子分析天平BS124S (德国赛多利斯股份有限公司); KQ-100KDB型超声清洗仪(昆山市超声仪器有限公司); 高效液相色谱仪(型号1260, 安捷伦公司)。
供试品制备 芫花乙酸乙酯部位制备: 称取芫花饮片30 g放入圆底烧瓶中, 加入15倍量95%乙醇, 回流煎煮1 h, 趁热过滤, 得滤液Ⅰ; 过滤所得药渣加入10倍量95%乙醇, 提取1 h, 趁热过滤, 得滤液Ⅱ; 合并滤液Ⅰ、Ⅱ, 减压浓缩至35 mL, 1倍量乙酸乙酯萃取3次, 合并3次乙酸乙酯部位, 冷冻干燥后, 得芫花乙酸乙酯部位1.30 g, 备用。芫花乙酸乙酯部位与GA煎煮液(芫花-甘草): 称取芫花乙酸乙酯部位25 mg、GA 20 mg放入圆底烧瓶中, 加入10 mL水回流煎煮1 h, 趁热过滤, 得芫花-甘草共煎煮液。芫花乙酸乙酯部位煎煮液(芫花): 称取芫花乙酸乙酯部位25 mg放入圆底烧瓶中, 加入10 mL水回流煎煮1 h, 趁热过滤, 得芫花煎煮液。芫花乙酸乙酯部位DMSO完全溶解液: 称取芫花乙酸乙酯部位25 mg, 加入10 mL DMSO使其完全溶解, 得芫花DMSO完全溶解液。GA溶液: 称取GA 20 mg, 加入10 mL去离子水使其完全溶解, 得GA溶液。
试管倒置实验 将上述质量浓度相同的芫花-甘草、芫花、DMSO、GA供试品于70 ℃水浴锅加热0.5 h使其完全溶解, 每个样品吸取4 mL置于10 mL透明玻璃小瓶中静置, 用于试管倒置实验。
芫花酯甲高效液相色谱条件 Agilent XDB-C18色谱柱(50 mm×2.1 mm, 3.5 μm); 流速: 0.3 mL·min-1; 柱温: 25 ℃; 进样量: 5 μL; 检测波长[7]: 238 nm。等度洗脱: 甲醇: 水= 80∶20。
形貌表征 场发射扫描电子显微镜(scanning electron microscope, SEM): 芫花-甘草、芫花煎煮液分散后, 水浴锅60 ℃加热0.5 h, 移液枪吸取悬浮液滴2 μL滴于用擦拭纸擦拭干净的硅片上, 滴加时形成水滴样, 滴加后室温自然干燥4 h, 将样品进行喷镀黄金处理后置于场发射扫描电子显微镜下, 工作电压15.0 kV, 观察两组样品表面形貌和形貌大小。
实验用细胞 人胚胎肝细胞(L-02细胞) 购自中国医学科学院基础医学研究所基础医学细胞中心。
细胞铺板 取对数生长期的L-02细胞, 胰酶消化后收集细胞并计数至细胞浓度为每毫升3×104个, 然后将其接种至96孔板, 每孔接种密度3×103个, 每孔100 μL细胞悬液, 平行3个复孔, 随后将细胞置于5% CO2无菌培养箱[8]中37 ℃培养24 h, 使细胞完全贴壁。
细胞加药 设置芫花-甘草组、芫花组, 每组每孔分别加入含100 μL相应化合物的培养基, 将细胞培养板置于CO2培养箱中继续培养24、48和72 h后, 每孔加入20 μL MTT溶液(5 mg·mL-1)[9], 继续孵育4 h后弃去上层细胞培养基, 每孔用排枪加入150 μL DMSO, 然后置于酶标仪上振荡10 s使蓝紫色结晶物充分溶解, 随后在490 nm波长测定各孔的吸光度值, 计算细胞增殖率[细胞增殖率% = (A490给药组-A490空白对照组)/(A490细胞对照组-A490空白对照组) × 100%]。
显微镜下观察及DAPI染色 取对数生长期的L-02细胞, 以800 μL (2.4×104个细胞)/孔的数量接种于12孔培养板中, 置于5% CO2生化培养箱中37 ℃培养24 h使细胞贴壁。待细胞贴壁后每孔分别加入800 μL浓度为0.078 mg·mL-1的芫花-甘草、芫花培养液, 平行3个复孔。培养箱中继续培养48 h后, 弃去细胞培养液, PBS洗3次, 均匀滴加800 μL 4%多聚甲醛[10]固定10 min, PBS洗3次后, 均匀滴加DAPI (10 μg·mL-1) 染料800 μL染色3 min, 随后用PBS洗去多余的染料, 置于荧光显微镜(100×) 下观察细胞形态的变化, 并进行拍照。
统计学分析 用IBM SPSS 25.0进行数据统计分析, 方差分析采用ANOVA分析, 运用t检验比较两组数据差异的显著性, P < 0.05表示具有显著性差异。
结果 1 试管倒置实验观察DMSO、芫花、GA、芫花-甘草流动性根据试管倒置实验观察DMSO、芫花、GA、芫花-甘草共4个供试品的流动性。图 1中, DMSO溶液呈淡黄色澄清透明状, 芫花提取液呈淡黄色混悬液, GA呈无色澄清透明水凝胶状, 芫花-甘草提取液呈棕色凝胶状。由第1天试管倒置实验图片可知, 芫花乙酸乙酯部位与GA共煎煮后促进GA水凝胶的形成。室温放置15天后, 水凝胶仍稳定存在。猜测芫花-甘草组颜色较芫花单煎时颜色加深是由于芫花中化学成分溶出增多的原因。目前, 天然产物凝胶普遍存在于中药分子中, 比如萜类、甾体类、糖苷类等。凝胶作为一种可再生资源, 遵循了绿色发展的理念, 也多用于药物传输系统、对活性物质的包封、自身生物活性研究等[11]。

|
Figure 1 The test tubes inversion experiments of DMSO, Flos Genkwa, glycyrrhizic acid, and Radix et Rhizoma Glycyrrhizae |
以芫花酯甲为对照品溶液作标准曲线, 线性方程: y = 8 129.4 x + 69.522, R = 0.999 5。且芫花酯甲在0.039~5.00 μg范围内线性关系良好。芫花酯甲高效液相色谱图及其结构如图 2所示。
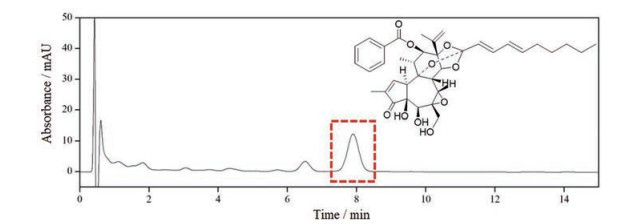
|
Figure 2 The high performance liquid chromatography (HPLC) and structure of yuanhuacine |
DMSO、芫花和芫花-甘草3个供试品液相色谱图如图 3所示。采用标准曲线法通过峰面积进行芫花酯甲(虚线框) 定量计算。由图 3可知, DMSO供试品中芫花酯甲峰面积最大, 经过自动积分峰面积为321, 其绝对含量为12.4 mg·g-1; 芫花供试品中没有检测到芫花酯甲单体; 芫花-甘草供试品中芫花酯甲峰面积为203.7, 其绝对含量为6.6 mg·g-1。芫花乙酸乙酯部位与GA共煎后, 芫花酯甲溶出量达54.8% (以DMSO供试品中芫花酯甲计)。以上结果说明, 芫花乙酸乙酯部位与GA共煎后, GA促进毒性成分芫花酯甲的溶出。同时, 也证实试管倒置实验猜测: 芫花-甘草颜色的加深是由于芫花中包含芫花酯甲在内的化学成分溶出增多的原因。
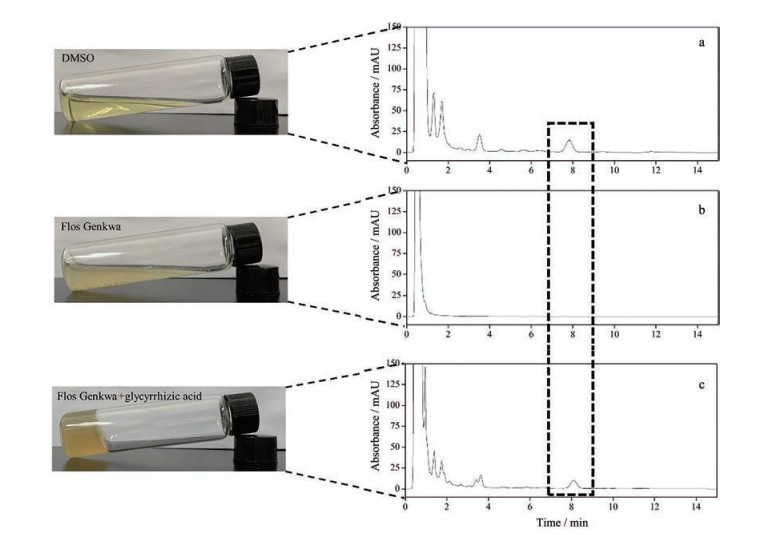
|
Figure 3 Liquid chromatograms of DMSO (a), Flos Genkwa (b), and Flos Genkwa-Radix et Rhizoma Glycyrrhizae (c) |
图 4a、b分别是芫花-甘草、芫花乙酸乙酯部位场发射扫描电子显微镜结果图。由SEM结果可看出, 芫花-甘草组形貌是分布均匀、形状规则的球形纳米颗粒, 颗粒平均直径大约在200 nm (图 4a); 而芫花组形貌不均一, 且不规则颗粒感强(图 4b)。由实验结果可知, GA的加入使芫花乙酸乙酯部位形成形貌分布均一纳米颗粒, 从而发挥其毒性。

|
Figure 4 Scanning electron microscope (SEM) images of Flos Genkwa-Radix et Rhizoma Glycyrrhizae (a) and Flos Genkwa (b) |
由图 5可知, 芫花-甘草组和芫花组在24、48和72 h均抑制细胞增殖, 显示出一定的细胞毒性, 且细胞毒性与给药剂量、给药时间呈正相关。此外, 芫花-甘草组在3个不同时间点细胞存活率均低于芫花组, 说明GA的加入增强了芫花的细胞毒性, 进一步证明GA促进芫花乙酸乙酯部位毒性成分的溶出。
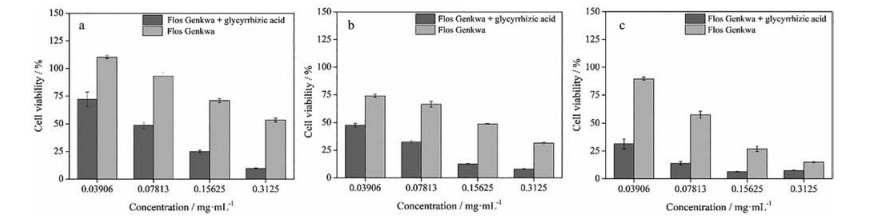
|
Figure 5 Evaluation of Flos Genkwa-Radix et Rhizoma Glycyrrhizae and Flos Genkwa to L-02 cytotoxicity at different time points. a, b, and c: 24, 48, and 72 h |
显微镜下观察结果如图 6A所示, 空白组细胞生长状态良好, 细胞形态明显; 芫花-甘草给药组, 细胞数量急剧减少, 且细胞发生皱缩, 细胞间距明显变大; 芫花给药组, 可以看到有多数细胞凋亡, 但细胞形态完整, 细胞状态良好。DAPI染色结果如图 6B所示, 空白组细胞核呈球形且完整; 芫花-甘草给药组, 细胞数量急剧减少, 细胞核有破损, 但不明显; 芫花给药组, 细胞数量同样减少, 但细胞核无破损; 芫花-甘草组和芫花组虽然细胞数量显著减少, 但是细胞核呈球形且完整。故得出结论, 与芫花组相比, 芫花-甘草组有十分明显的抑制L-02细胞增殖的活性, 同时具有明显的诱导细胞凋亡的活性, 但可能不是通过诱导细胞核破碎从而使细胞凋亡。该结果与高效液相色谱、扫描电子显微镜结果相吻合, 三者结果共同验证了芫花乙酸乙酯部位与GA共煎煮后促进毒性成分芫花酯甲的溶出, 并使该部位形成分布均一的纳米粒, 有利于成分吸收, 从而使毒性增强。
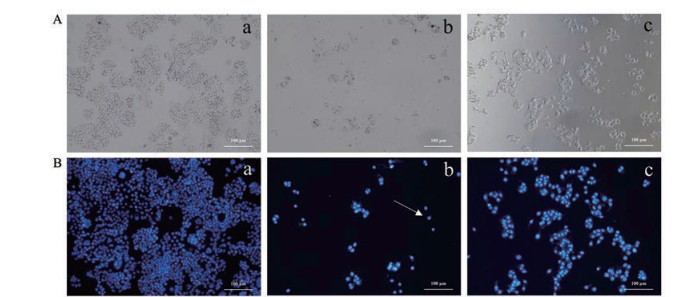
|
Figure 6 Comparison of the cell morphology of on microscope (A, ×100) and DAPI staining (B) on L-02 cells induced by Flos Genkwa-Radix et Rhizoma Glycyrrhizae and Flos Genkwa (0.078 mg·mL-1). Nuclear damage was indicated by the arrow. Scale bar: 100 μm. a: Control group; b: Flos Genkwa-Radix et Rhizoma Glycyrrhizae; c: Flos Genkwa. DAPI: 4', 6-Diamidino-2-phenylindole |
基于GA增溶原理探讨中药芫花与甘草配伍增毒机制, 该理念首次较为清楚且直观解释了芫花-甘草配伍增毒原因。此外, 采用材料学形貌表征方法以及交叉学科有助于多角度理解芫花-甘草配伍增毒机制, 为反药配伍的深入研究提供参考依据。同时, 为配伍禁忌的研究提供一个新的模式, 也为临床提供指导和科学依据。
GA与芫花乙酸乙酯部位共同煎煮后能形成分布均匀纳米粒, 从微观角度, 观察到GA助溶芫花的直观证据, 为理解甘草-芫花配伍禁忌提供新的实证[12]。本课题组通过对中药复方水煎液自沉淀的研究发现纳米形态是影响生物活性的原因之一[13-15], 芫花-甘草组的细胞毒性大于芫花组同样证明了此观点。
作者贡献: 杨玉琴负责实验研究、分析数据和文章撰写; 陈珊、王志家负责实验研究和文章撰写; 王鹏龙负责实验设计和指导, 对文章的知识性内容进行审阅; 李菲菲、雷海民负责思路指导和对文章的知识性内容进行审阅并提供研究经费。
利益冲突: 所有作者均声明没有利益冲突。
| [1] |
Ou LN, Zhong GS, Liu HY, et al. Historical evolution, incompatibility arguments and suggestions on "eighteen incompatible medicaments"[J]. Sci Technol Rev (科技导报), 2015, 33: 88-94. |
| [2] |
Xiu LL, Zhong GS, Zhang JM, et al. Review on the experimental studies of suitable and contraindicant conditions of Chinese medicine antagonism compatibility genkwa flos and glycyrrhiza[J]. Glob Tradit Chin Med (环球中医药), 2015, 8: 1050-1053. |
| [3] |
Shen J, Mo X, Tang Y, et al. Analysis of herb-herb interaction when decocting together by using ultra-high-performance liquid chromatography-tandem mass spectrometry and fuzzy chemical identification strategy with poly-proportion design[J]. J Chromatogr A, 2013, 1297: 168-178. DOI:10.1016/j.chroma.2013.05.001 |
| [4] |
Chen YY, Qian DW, Shang EX, et al. The incompatibility mechanism based on the interaction of multiple components for Flos Genkwa and Radix et Rhizoma Glycyrrhizae[J]. Acta Pharm Sin (药学学报), 2012, 47: 1043-1048. |
| [5] |
Dai GX. Experimental study on toxicity and efficacy of genkwa flos stir-baked with vinegar[J]. Chin Arch Tradit Chin Med (中华中医药学刊), 2012, 30: 2766-2767. |
| [6] |
Li FF. Studies on Bioactive Constituents of Two Plants from the Genus Daphne (两种瑞香属植物芫花和黄瑞香的活性成分研究)[D]. Shenyang: Shenyang Pharmaceutical University, 2013.
|
| [7] |
Xu ZF, Li RR, Gong QF, et al. Content comparison of genkwanin and yuanhuacine in different medicinal parts of Daphne genkwa Sieb et Zucc[J]. Chin J Inf Tradit Chin Med (中国中医药信息杂志), 2011, 18: 59-61. |
| [8] |
Hu JP, Li YH, Shi XC, et al. An U-2 OS cells/CCK-8 method for oncolytic activity determination of herpes simplex virus type 1[J]. Chin J Pharm Anal (药物分析杂志), 2020, 40: 31-36. |
| [9] |
Lin Y, Xiao R, Yin LZ, et al. Developing spectrum-toxicity relationship with rough set theory for hepatotoxicity material basis of Polygonum multiflorum[J]. China J Chin Mater Med (中国中药杂志), 2019, 44: 509-517. |
| [10] |
BalaKumaran MD, Ramachandran R, Balashanmugam P, et al. Comparative analysis of antifungal, antioxidant and cytotoxic activities of mycosynthesized silver nanoparticles and gold nanoparticles[J]. Mater Technol, 2020. DOI:10.1080/10667857.2020.1854518 |
| [11] |
Zhi KK. Discovery and Formation of Novel Small Molecule Natural Product Gels and Their Application in Drug Delivery (新型小分子天然产物凝胶的发现与形成及其药物传输应用)[D]. Harbin: Harbin Institute of Technology, 2019.
|
| [12] |
Wei XH. Salicylic acid-grafted chitosan oligosaccharide nanoparticle for paclitaxel delivery[J]. J Bioact Compat Polym, 2010, 25: 319-335. DOI:10.1177/0883911510363548 |
| [13] |
Li T, Wang PL, Guo WB, et al. Natural berberine-based Chinese herb medicine assembled nanostructures with modified antibacterial application[J]. ACS Nano, 2019, 13: 6770-6781. DOI:10.1021/acsnano.9b01346 |
| [14] |
Huang XM, Wang PL, Li T, et al. Self-assemblies based on traditional medicine berberine and cinnamic acid for adhesion-induced inhibition multidrug-resistant staphylococcus aureus[J]. ACS Appl Mater Interfaces, 2020, 12: 227-237. DOI:10.1021/acsami.9b17722 |
| [15] |
Tian X, Wang P, Li T, et al. Self-assembled natural phytochemicals for synergistically antibacterial application from the enlightenment of traditional Chinese medicine combination[J]. Acta Pharm Sin B, 2020, 10: 1784-1795. DOI:10.1016/j.apsb.2019.12.014 |
 2021, Vol. 56
2021, Vol. 56


