恶性肿瘤是影响人类健康的重大疾病, 发病率和死亡率逐年攀升[1]。为提高临床治疗效果, 设计与开发具备良好生物相容性、高效载药、特异性靶向和时空控制释药的药物递送系统已成为研究热点[2, 3]。巨噬细胞(macrophage, MΦ)具有自身形态灵活、表面受体丰富、免疫原性低和循环时间长的特点, 不仅具备吞噬肿瘤细胞、递呈抗原和分泌细胞因子等细胞治疗潜力[4], 还具有吞噬载药、固有靶向和深层渗透的药物递送能力, 有望成为细胞疗法及药物递送的双重工具, 在新型纳米仿生递药系统研究中备受期待。目前, 基于MΦ的纳米仿生递药系统主要处于临床前研究阶段, 常用骨髓来源巨噬细胞(bone marrow-derived macrophage, BMDM)[5]、腹腔来源巨噬细胞(peritoneal macrophage, PM)[6]、外周血来源巨噬细胞[7]、诱导多能干细胞来源巨噬细胞[8]及永生化单核/巨噬细胞株(BALB/c小鼠来源的巨噬细胞株RAW264.7[9]和J774.A1[10])。本综述基于MΦ的纳米仿生递药系统设计策略及最新研究进展, 以期为纳米仿生递药系统的研究与开发提供参考。
1 纳米-MΦ递药系统纳米-MΦ递药系统是将纳米药物装载于活MΦ内部或表面而形成的递送体系。
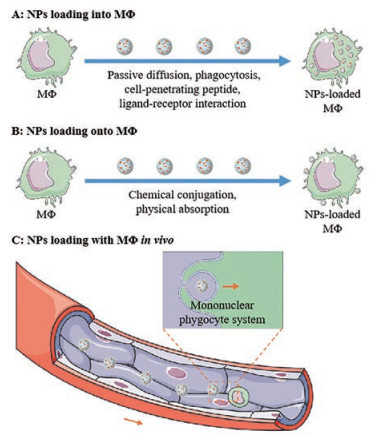
1.1 纳米-MΦ递药系统的载药策略 1.1.1 MΦ胞内载药MΦ作为专职吞噬细胞具有强大摄取能力, 其胞内空间为药物提供在细胞质储存的机会。利用MΦ固有摄取能力和药物被动扩散性质将药物装载到细胞中是最简便易行的载药策略(图 1A)。Evans等[5]将缺氧激活前药替拉扎明(tirapazamine, TPZ)疏水衍生物的乳酸-乙醇酸共聚物纳米颗粒(TPZ-C12)与MΦ直接孵育制备MΦ-TPZ-C12, 其中TPZ-C12的疏水性足以保证药物在细胞内水性介质中稳定存在, 防止药物过早释放而对MΦ产生毒性, 亲水性又足以提供药物扩散所需浓度梯度, 药物可向肿瘤深层渗透, 最终利用MΦ肿瘤趋向作用及其在缺氧部位扩散和浸润能力, 促使药物到达肿瘤深层, 较TPZ-C12产生更优抗肿瘤效果。纳米粒的粒径、表面电荷和形状质地能够影响MΦ摄取, 带正电的纳米粒可通过吸附性胞饮作用入胞, 比中性或表面负电纳米粒内化效率更高[11, 12]; 硬质球形纳米粒能与细胞表面形成更多附着位点, 较少依赖肌动蛋白重塑细胞形态, 比软质圆柱形纳米粒更易吞噬[13, 14]; 当粒径大于100 nm时, 主要通过网格蛋白介导或巨胞饮途径入吞; 粒径小于100 nm时, 主要通过小窝蛋白介导途径入吞[15, 16]。此外, 使用细胞穿透肽或配体修饰纳米药物可进一步增强纳米药物被MΦ吞噬装载的能力。Qiu等[17]发现与R8dGR修饰的脂质体和聚乙二醇化脂质体相比, MΦ对八精氨酸修饰的聚乙二醇化两药共载脂质体(R8-Lip)具有更高摄取率, 脂质体粒径约110 nm时摄取效果最优, 总载药量达63 μg/106细胞。
|
Figure 1 NPs loading strategies of nano-MΦ drug delivery system. A: NPs loading into MΦ; B: NPs loading onto MΦ; C: NPs loading with MΦ in vivo. NPs: Nanoparticles; MΦ: Macrophage |
MΦ膜表面富含脂质、多糖和蛋白质等, 具有一系列功能基团(伯胺残基、硫醇残基等)和表面特性(负电荷、疏水性、配体结合位点等), 可采用化学偶联或物理吸附的方式将纳米药物负载到MΦ表面(图 1B)。Zhou等[18]利用三(2-羧乙基)膦选择性还原MΦ表面巯基, 并进一步与载免疫佐剂多聚肌苷酸多聚胞苷酸的纳米粒(PLP)的马来酰亚胺基团偶联, 将PLP负载到MΦ表面, 且保证了MΦ的活性和功能。Cao等[19]利用脂质疏水长链锚定插入细胞膜的性质, 将通过二硫键连接到聚乙二醇化二肉豆蔻酰磷脂酰乙醇胺的氧化还原敏感细胞毒性药物DM4前药(DMPE-PEG-S-S-DM4)和与DMPE-PEG偶联的豆类特异性蜂毒素前肽(DMPE-PEG-legM)锚定在活MΦ表面制备胞外载DM4和legM的MΦ递药系统(LD-MDS), 将治疗药物优先递送至肺转移瘤中。但是由于细胞表面空间有限, LD-MDS载药量仅为2.0 μg/106细胞。
1.1.3 MΦ体内载药将纳米制剂直接静脉注射, 进而被单核-吞噬细胞系统摄取, 在体内形成装载纳米粒的MΦ载药策略因简单易行, 无需考虑细胞分离和回输过程潜在风险而受到关注(图 1C)。Franco等[20]证实静脉注射介孔二氧化硅纳米粒或载介孔二氧化硅纳米粒的脾细胞(MΦ同源细胞)后, 24 h内均使硅纳米粒被体内MΦ大量摄取。Zheng等[21]制备装载了含有CpG基序的寡聚脱氧核苷酸(CpG oligodeoxynucleotide, CpG ODN)修饰金银纳米棒(AuNR-CpG)的肿瘤细胞凋亡小体, 经静脉注射后约83.0%被血液循环中炎性Ly-6C+单核细胞特异性吞噬, 在体内形成载药细胞(相当于全身Ly-6C+单核细胞共装载AuNR 156.4 μg), 然后通过载药细胞固有肿瘤归巢倾向主动迁移到肿瘤部位, 实现AuNR-CpG在肿瘤中深层渗透, 增强光热治疗效果; 同时还可诱导肿瘤特异性免疫反应, 缓解免疫抑制, 防止肿瘤转移和复发。但是, 血液循环中的单核细胞(MΦ前体细胞), 需进一步迁移至组织, 经细胞体积增大、细胞器数量增加等变化后才能分化成寿命更长、更具吞噬功能和分泌细胞因子能力的MΦ, 因此, 构建此类递药系统时应关注单核细胞血液循环和分化过程对载体的影响。
1.2 纳米-MΦ递药系统在肿瘤治疗中的应用纳米-MΦ递药系统可维持或增强吞噬肿瘤细胞及抗原递呈能力, 并有效延长药物循环时间, 主动穿透间质液压增高的实体肿瘤组织, 特异性靶向肿瘤深部区域[22]。An等[23]以金纳米粒为模型诊断试剂, 制备载阴离子金纳米粒的MΦ (AuNR@RAW), 利用多光谱成像技术和肿瘤切片实验证实该递送系统的缺氧区趋向, 并发现给药1 h后AuNR@RAW开始蓄积于肿瘤部位, 并于8 h达到峰值, 24 h时蓄积量略有下降。另有研究表明载金纳米壳的MΦ (ANS-MA)生物半衰期约为12 h[24]。Xu等[25]利用流式细胞术和荧光显微技术证实: 未处理组MΦ与载聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid), PLGA] 纳米粒组MΦ对肿瘤细胞的吞噬百分率无显著性差异(32.1% vs 33.9%), 载硫化铜纳米粒的MΦ (CuS-MΦ)因下调程序性死亡受体-1 (programmed death-1, PD-1)表达并上调溶酶体中消化酶活性, 使吞噬肿瘤细胞百分率增长1倍以上, 达到77.15%; 同时, 以卵清蛋白为模型抗原进行研究, 发现CuS-MΦ比未处理组MΦ的抗原递呈能力更强, 经瘤内注射后, 可靶向肿瘤引流淋巴结, 提高效应性T细胞和树突状细胞比例, 产生抗肿瘤免疫效应。此外, 活MΦ在实现药物递送的同时, 还可实现过继免疫细胞疗法, 提升治疗效果。本课题组[26]提出“细胞-药物一体化”理念, 以具有免疫治疗功能的M1型MΦ作为化疗药物递送载体, 构建载索拉非尼脂质纳米粒的M1型MΦ递送体系。该体系利用MΦ靶向肿瘤微环境后, 可持续释放化疗药物及治疗性细胞因子, 显著提高肿瘤组织M1型MΦ、CD3+CD4+T细胞和CD3+CD8+T细胞比例, 降低肿瘤组织调节性T细胞数量, 实现化学-细胞联合治疗。
纳米-MΦ递药系统主要通过细胞死亡或跨细胞膜的缓慢释放、基于外泌体的被动释放及借助隧道纳米管作为MΦ载体与肿瘤细胞间药物转运通道的方式实现装载药物释放[20, 27, 28]。静脉注射后, MΦ需6~12 h的体内递送过程才会迁移到肿瘤组织[29]。Zhang等[9]设计了一种具有两相药物释放曲线的纳米胶囊, 由药物-二氧化硅纳米复合物核心和固体二氧化硅外壳组成。该体系药物-二氧化硅纳米复合物比壳层更易降解, 因为药物分子在二氧化硅基质中打破稳定晶态结构, 导致两相释放。通过微调外壳厚度, 实现药物在体内递送的6~12 h内较少释放或几乎不释放。通过内源性或外源性刺激, 可实现纳米-MΦ递药系统在肿瘤部位可控释药。例如, Cao等[19]利用肿瘤微环境中高表达豆荚蛋白酶的特性, 制备LD-MDS, 在肿瘤部位LD-MDS可被豆荚蛋白酶激活并转化为装载DM4的外泌体样纳米囊泡, 促进转移性4T1乳腺癌细胞有效内化和大量细胞死亡。与内源性触发机制相比, 外源性触发具有时间、位置和强度可控的优势[30]。Xu等[31]将多柔比星(doxorubicin, DOX)和相变温度29 ℃的全氟戊烷(perfluoropentane, PFP)装载到中空介孔有机二氧化硅纳米颗粒(hollow mesoporous organosilica nanoparticle, HMON)中得载DOX和PFP的HMON (DPH), 再与MΦ共孵育得载DPH的MΦ (DPH-MΦ), 在体内递送过程中, DPH中的PFP部分蒸发成气泡可实时超声成像, 待蓄积后, 剩余液体PFP, 通过短脉冲高强度聚焦超声进一步汽化成许多更大气泡, 诱导轻度高温(< 45 ℃), 破裂MΦ, 促使DOX从细胞中释放。
2 纳米-MΦ膜递药系统纳米-MΦ膜递药系统主要由MΦ膜包裹纳米粒组成, 具备明显的“核-壳”结构。
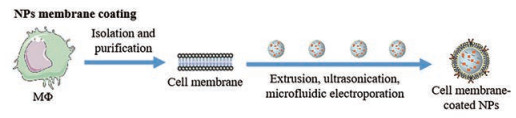
2.1 纳米-MΦ膜递药系统的载药策略MΦ膜载药主要分为3个步骤: 外壳MΦ膜的分离纯化、内核纳米载体的制备及“核-壳”结构融合过程[32] (图 2)。为最大限度减少对膜相关成分(蛋白质等)的破坏, 制备步骤应尽可能在温和条件下进行, 确保得到的MΦ膜包衣纳米粒既有纳米载体本身物化特性, 又具有细胞生物学性质。首先, MΦ增殖到足够数量后, 经低渗裂解、机械破膜和差速离心相结合的方法去除细胞核和细胞质, 分离纯化细胞膜; 然后根据装载药物特性及载体设计需求制备内核纳米载体; 最后, 采用薄膜挤压法、超声处理法或微流控电穿孔法将两者融合[33, 34]。其中, 微流控电穿孔法是近年来应用广泛的制备技术, Rao等[35]报道了一种用于膜包衣纳米颗粒制备的系统, 该系统将纳米粒与细胞膜囊泡注入后, 经Y形和S形通道充分混合, 在电穿孔区域使纳米粒进入细胞膜囊泡, 进而通过出口获得膜包衣的纳米粒。该过程通过调节流速、持续时间和脉冲电压, 可确保纳米粒与细胞膜完全覆盖, 具有高通量、低成本和可控性好等优点, 极具产业化前景。
|
Figure 2 NPs loading strategies of nano-MΦ membrane drug delivery system |
MΦ膜富含多种膜蛋白, 可模拟MΦ体内药动学特征, 逃避单核吞噬细胞系统的清除, 从而延长血液循环时间(生物半衰期超过12 h)、提高肿瘤积聚、靶向转移肿瘤及跨越血脑屏障等[36]。Xuan等[37]研究发现静脉注射巨噬细胞膜包裹的金纳米壳(MPCM-AuNS)48 h后仍在血液滞留30%以上, 而静脉注射AuNS可在24 h内几乎全部从血液循环中清除。Zhao等[38]制备包裹MΦ膜的载槲皮素空心硒化铋纳米粒(M@BS-QE NP)用于乳腺癌治疗, M@BS-QE NP因包裹MΦ膜具有免疫逃避功能、CCL2介导的募集特性及主动靶向性, 与BS-QE NP组相比, 可更快实现肿瘤部位蓄积(4 h vs 6 h), 且给药36 h后仍显著蓄积于瘤内。Lai等[39]制备包裹MΦ膜的载IR-792聚乙二醇化脂质纳米粒(MDINP), 载药量高达27.85%, 该系统显著提升了IR-792的光稳定性, 具有穿透血脑屏障和特异性靶向恶性胶质瘤的能力。
为提高治疗效果, 基于多模态联合治疗理念的仿生载体逐渐成为未来发展新趋势。Liu等[40]报道了一种MΦ膜包裹的激光响应可变形纳米药物I-P@NP@M, 其中二氢卟吩e6可将650 nm激光转化为活性氧, 触发球形胶束转变为纳米纤维, 使其在肿瘤区域有很强滞留作用, 从而使线性纳米纤维能够长时间定位并持续释放药物。同时, 活性氧不仅通过光动力疗法直接杀死肿瘤细胞, 还刺激紫杉醇前药裂解产生游离药物, 联合化疗-光动力疗法显著抑制肿瘤生长并诱导免疫原性细胞死亡, 再与吲哚胺-(2, 3)-双加氧酶抑制剂indoximod协同作用, 激活免疫应答, 集化疗、光动力治疗和免疫治疗三者于一体, 在小鼠4T1原位乳腺癌模型中, 抑瘤率达85.27%, 远高于I-P@NP组72.30%的抑瘤率。随着制备技术快速发展, 杂交不同来源细胞膜获得融合膜, 可整合并保持与单来源细胞非常相似的生物学性能已成为一种简单有效的纳米粒修饰策略。Gong等[41]开发了一种RAW264.7与4T1乳腺癌细胞融合膜包裹载DOX的聚乳酸-羟基乙酸共聚物纳米粒(DPLGA@[RAW-4T1]NP)用于治疗乳腺癌肺转移。该递送系统拥有MΦ免疫逃逸功能及肿瘤细胞同源靶向性, 能特异性蓄积肿瘤部位, 与DPLGA组相比, 肺转移结节数减少66.7%。
3 纳米-MΦ囊泡递药系统细胞间通讯能够通过化学信使, 以胞外囊泡(extracellular vesicle, EV)的形式进行传递。根据来源和大小不同, EV可分为3类: 外泌体(直径约30~150 nm)、微囊(直径约200~500 nm)和凋亡小体(直径约1~10 µm)[42, 43]。纳米-MΦ囊泡递药系统主要由MΦ外泌体、微囊、凋亡小体或胞外囊泡样结构装载纳米药物构成。
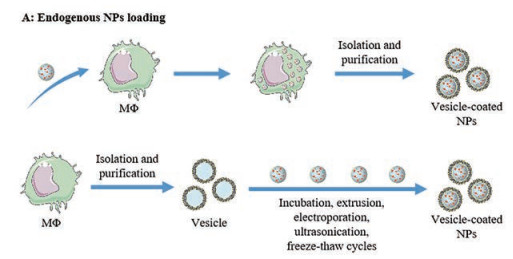
3.1 纳米-MΦ囊泡递药系统的载药策略 3.1.1 内源性载药内源性载药即先将药物载入到细胞中, 当药物分选进入EV并从供体细胞中释放后, 通过分离纯化而获得载药EV (图 3A)[44]。MΦ能主动吞噬内化多种外源物质, 是获得内源性载药EV的理想细胞。Silva等[45]将磁性氧化铁纳米粒和治疗性光敏剂m-THPC与人THP-1细胞来源的MΦ共同孵育, 并在无血清培养基中培养2天, 诱导饥饿环境, 促使EV释放, 经离心和磁分选制得具有磁性和光热转换效应的载药EV, 每108个EV装载93.3 ng氧化铁纳米粒和5.6 ng光敏剂。由于药物分选至EV机制复杂, 很难通过外界手段进行调控, 致使内源性载药策略普适性不高。
|
Figure 3 NPs loading strategies of nano-MΦ vesicle drug delivery system. A: Endogenous NPs loading; B: Exogenous NPs loading |
外源性载药是指将EV从细胞中分离纯化, 然后将药物通过孵育、挤出、超声、电穿孔、冻融循环和脂质体介导的膜融合等方式导入EV内实现载药(图 3B)[46]。Xiong等[47]采用循环超声和快速超速离心方式制备包裹月桂酸功能化铂(Ⅳ)前药和人血清白蛋白纳米复合物的MΦ外泌体递送体系(NPs/Rex), 结果表明超声处理后外泌体的结构和功能依旧完整。
3.2 纳米-MΦ囊泡递药系统在肿瘤治疗中的应用在纳米-MΦ囊泡递药系统中, 外泌体载药应用最多, 其起源于多囊泡体, 经细胞膜融合后由细胞自然分泌, 膜结构富含胆固醇、神经酰胺和磷脂酰丝氨酸等, 可包裹RNA、蛋白质和脂质等[48, 49]。MΦ来源外泌体表现出与MΦ相似的表面膜特性, 易与膜融合被细胞吸收, 在药物递送中具有良好潜力。Xiong等[47]评估NPs/Rex的药代动力学性质, 使用非房室模型分析平均驻留时间为47.3 h, 远超过顺铂游离药组的平均驻留时间10.5 h。对M1型MΦ外泌体的进一步修饰可增强其靶向递送和抗肿瘤作用。Kim等[50]利用外源性载药方式开发一种以肺癌细胞过度表达的σ受体为靶点的氨乙基苯甲酰胺-聚乙二醇修饰的紫杉醇载药外泌体制剂, 载药量高达33.0%, 在小鼠肺转移瘤治疗中, 与未修饰组相比, 小鼠生存期可延长近1倍(55天vs 28天)。此外, M1型MΦ外泌体本身具有促炎作用, 释放辅助性T淋巴细胞1分泌的细胞因子, 增强抗肿瘤作用。Cheng等[51]发现M1型MΦ外泌体能增强脂质磷酸钙纳米粒包裹酪氨酸激酶相关蛋白-2 (tyrosinase related protein-2, Trp2)疫苗的活性, 且免疫增强效果超过对照CpG ODN组, 可作为癌症疫苗佐剂。
但是, 目前外泌体存在产量较低、分离纯化困难的生产局限性, 一些研究表明可将其他衍生的纳米囊泡作为外泌体替代品[52]。Xu等[53]制备包裹DOX和硫化银量子点的MΦ微囊纳米平台MVs@QDs & DOX, 其中微囊本身具有肿瘤靶向性且无免疫原性, 使MVS@QDs & DOX的生物半衰期延长至14.2 h, 约为QDs & DOX (生物半衰期3.6 h)的4倍; 硫化银量子点的近红外荧光成像特性和光热效应, 可监测纳米平台在体内生物分布及蓄积肿瘤后药物的控制释放。Rayamajhi等[10]选用粒径较小的M1型MΦ来源胞外囊泡作为外泌体类似物与合成脂质体融合制备外泌体样杂化囊泡, 在保留M1型MΦ外泌体功能特性的同时, 具有更高产量、载药量、胶体稳定性和pH敏感特性。表 1汇总了近年来基于MΦ的纳米仿生递药系统在肿瘤治疗中的研究[6, 9, 10, 17, 19, 26, 38-41, 50-52, 54, 55]。
| Table 1 Nano-bionic drug delivery system based on MΦ in tumor therapy. BMDM: Murine bone marrow-derived macrophage; HION: Hyaluronic acid-decorated superparamagnetic iron oxide nanoparticle; HBSN: Hollow bismuth selenide nanoparticle; PM: Peritoneal macrophage; Trp2: Tyrosinase related protein-2 |
MΦ凭借肿瘤吞噬、抗原递呈和上调炎性细胞因子表达等细胞治疗潜力, 结合吞噬载药、固有靶向和深层渗透的药物载体功能, 已逐渐成为细胞疗法及药物递送的双重工具, 极具发展前景。本文阐述的3类基于MΦ的药物递送系统各具特点[56]: 在制备工艺上, 纳米-MΦ膜药物递送系统工艺最简单, 技术最成熟, 而纳米-MΦ囊泡药物递送系统因外泌体产量较低、分离纯化困难而难度较大, 纳米-MΦ药物递送系统因需考虑载药、体内递送和释药过程中药物对细胞活性的影响而尤为困难; 对于膜蛋白组成, MΦ及其胞外囊泡相似, 而纳米-MΦ膜药物递送系统因体外细胞膜提取操作或许会破坏部分蛋白; 关于载药量, 纳米-MΦ药物递送系统的载药量相对有限且药物应对MΦ活性无明显影响, 而另外两种递药系统载药量较高, 可适用于绝大多数药物。就靶向递送效果而言, 受MΦ优先募集至转移瘤部位[57, 58]及肿瘤切除创面产生大量炎性因子而诱导MΦ炎症趋向性[17]等影响, 纳米-MΦ药物递送系统对肿瘤转移和术后复发的抑制效果较优。在原发瘤中, 纳米-MΦ药物递送系统在肿瘤部位仍被观察到具有深层渗透能力, 这是由于肿瘤微环境对MΦ具有良好招募能力[26]。然而, 值得注意的是, MΦ在原发瘤复杂免疫抑制微环境中可能被重极化为M2表型, 影响MΦ本身的抗肿瘤效果[54]; 而在转移瘤中, 对MΦ表型影响较小, 因此, 有研究表明纳米-MΦ药物递送系统对转移的抑制较好[19]。
作者贡献: 刘金虎负责文献查阅、文章撰写; 刘永军和张娜负责确定文章方向及内容组成, 并对文章撰写质量进行把关和审校。
利益冲突: 本文不存在任何与本稿件相关的利益冲突。
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68: 394-424. DOI:10.3322/caac.21492 |
| [2] |
Li WS, Su ZG, Hao MX, et al. Cytopharmaceuticals: an emerging paradigm for drug delivery[J]. J Control Release, 2020, 328: 313-324. DOI:10.1016/j.jconrel.2020.08.063 |
| [3] |
Lai XX, Wang S, Yan XY, et al. Strategies and reflections on platelet-based targeted therapy for tumor[J]. Acta Pharm Sin (药学学报), 2021, 56: 1025-1034. |
| [4] |
Franken L, Schiwon M, Kurts C. Macrophages: sentinels and regulators of the immune system[J]. Cell Microbiol, 2016, 18: 475-487. DOI:10.1111/cmi.12580 |
| [5] |
Evans MA, Shields ICW, Krishnan V, et al. Macrophage-mediated delivery of hypoxia-activated prodrug nanoparticles[J]. Adv Therap, 2019, 3: 1900162. |
| [6] |
Liu LQ, Wang Y, Guo X, et al. A biomimetic polymer magnetic nanocarrier polarizing tumor-associated macrophages for potentiating immunotherapy[J]. Small, 2020, 16: 2003543. DOI:10.1002/smll.202003543 |
| [7] |
Klichinsky M, Ruella M, Shestova O, et al. Human chimeric antigen receptor macrophages for cancer immunotherapy[J]. Nat Biotechnol, 2020, 38: 947-953. DOI:10.1038/s41587-020-0462-y |
| [8] |
Zhang L, Tian L, Dai XY, et al. Pluripotent stem cell-derived CAR-macrophage cells with antigen-dependent anti-cancer cell functions[J]. J Hematol Oncol, 2020, 13: 153. DOI:10.1186/s13045-020-00983-2 |
| [9] |
Zhang WZ, Wang MZ, Tang W, et al. Nanoparticle-laden macrophages for tumor-tropic drug delivery[J]. Adv Mater, 2018, 30: 1805557. DOI:10.1002/adma.201805557 |
| [10] |
Rayamajhi S, Nguyen TDT, Marasini R, et al. Macrophage-derived exosome-mimetic hybrid vesicles for tumor targeted drug delivery[J]. Acta Biomater, 2019, 94: 482-494. DOI:10.1016/j.actbio.2019.05.054 |
| [11] |
Kelly C, Jefferies C, Cryan SA. Targeted liposomal drug delivery to monocytes and macrophages[J]. J Drug Deliv, 2011, 2011: 727241. |
| [12] |
Nair M, Jayant RD, Kaushik A, et al. Getting into the brain: potential of nanotechnology in the management of neuro AIDS[J]. Adv Drug Deliv Rev, 2016, 103: 202-217. DOI:10.1016/j.addr.2016.02.008 |
| [13] |
Gustafson HH, Holt Casper D, Grainger DW, et al. Nanoparticle uptake: the phagocyte problem[J]. Nano Today, 2015, 10: 487-510. DOI:10.1016/j.nantod.2015.06.006 |
| [14] |
Garapaty A, Champion JA. Tunable particles alter macrophage uptake based on combinatorial effects of physical properties[J]. Bioeng Transl Med, 2017, 2: 92-101. DOI:10.1002/btm2.10047 |
| [15] |
Ngambenjawong C, Gustafson HH, Pun SH. Progress in tumor-associated macrophage (TAM)-targeted therapeutics[J]. Adv Drug Deliv Rev, 2017, 114: 206-221. DOI:10.1016/j.addr.2017.04.010 |
| [16] |
Patel S, Kim J, Herrera M, et al. Brief update on endocytosis of nanomedicines[J]. Adv Drug Deliv Rev, 2019, 144: 90-111. DOI:10.1016/j.addr.2019.08.004 |
| [17] |
Qiu Y, Ren KB, Zhao W, et al. A "dual-guide" bioinspired drug delivery strategy of a macrophage-based carrier against postoperative triple-negative breast cancer recurrence[J]. J Control Release, 2021, 329: 191-204. DOI:10.1016/j.jconrel.2020.11.039 |
| [18] |
Zhou H, He H, Liang R, et al. In situ poly I: C released from living cell drug nanocarriers for macrophage-mediated antitumor immunotherapy[J]. Biomaterials, 2021, 269: 120670. DOI:10.1016/j.biomaterials.2021.120670 |
| [19] |
Cao HQ, Wang H, He XY, et al. Bioengineered macrophages can responsively transform into nanovesicles to target lung metastasis[J]. Nano Lett, 2018, 18: 4762-4770. DOI:10.1021/acs.nanolett.8b01236 |
| [20] |
Franco S, Noureddine A, Guo JM, et al. Direct transfer of mesoporous silica nanoparticles between macrophages and cancer cells[J]. Cancers, 2020, 12: 2892. DOI:10.3390/cancers12102892 |
| [21] |
Zheng LY, Hu XX, Wu H, et al. In vivo monocyte/macrophage-hitchhiked intratumoral accumulation of nanomedicines for enhanced tumor therapy[J]. J Am Chem Soc, 2020, 142: 382-391. DOI:10.1021/jacs.9b11046 |
| [22] |
Facklam AL, Volpatti LR, Anderson DG. Biomaterials for personalized cell therapy[J]. Adv Mater, 2019, 32: 1902005. |
| [23] |
An L, Wan YY, Lin JM, et al. Macrophages-mediated delivery of small gold nanorods for tumor hypoxia photoacoustic imaging and enhanced photothermal therapy[J]. ACS Appl Mater Interfaces, 2019, 11: 15251-15261. DOI:10.1021/acsami.9b00495 |
| [24] |
Kang SH, Lee YK, Park IS, et al. Biomimetic gold nanoshell-loaded macrophage for photothermal biomedicine[J]. Biomed Res Int, 2020, 2020: 5869235. |
| [25] |
Xu JJ, Zheng BB, Zhang SH, et al. Copper sulfide nanoparticle-redirected macrophages for adoptive transfer therapy of melanoma[J]. Adv Funct Mater, 2021. DOI:10.1002/adfm.202008022 |
| [26] |
Hou T, Wang TQ, Mu WW, et al. Nanoparticle-loaded polarized-macrophages for enhanced tumor targeting and cell-chemotherapy[J]. Nano Micro Lett, 2021, 13: 6. DOI:10.1007/s40820-020-00531-0 |
| [27] |
Lee S, Kivimäe S, Dolor A, et al. Macrophage-based cell therapies: the long and winding road[J]. J Control Release, 2016, 240: 527-540. DOI:10.1016/j.jconrel.2016.07.018 |
| [28] |
Guo L, Zhang Y, Yang ZP, et al. Tunneling nanotubular expressways for ultrafast and accurate M1 macrophage delivery of anticancer drugs to metastatic ovarian carcinoma[J]. ACS Nano, 2019, 13: 1078-1096. |
| [29] |
Li SW, Feng S, Ding L, et al. Nanomedicine engulfed by macrophages for targeted tumor therapy[J]. Int J Nanomedicine, 2016, 11: 4107-4124. DOI:10.2147/IJN.S110146 |
| [30] |
Yang Y, Zeng WW, Huang P, et al. Smart materials for drug delivery and cancer therapy[J]. VIEW, 2020. DOI:10.1002/VIW.20200042 |
| [31] |
Xu ZL, Liu HM, Tian H, et al. Real-time imaging tracking of engineered macrophages as ultrasound-triggered cell bombs for cancer treatment[J]. Adv Funct Mater, 2020, 30: 1910304. DOI:10.1002/adfm.201910304 |
| [32] |
Liu Y, Luo JS, Chen XJ, et al. Cell membrane coating technology: a promising strategy for biomedical applications[J]. Nano Micro Lett, 2019, 11: 100. DOI:10.1007/s40820-019-0330-9 |
| [33] |
Zhai YH, Su JH, Ran W, et al. Preparation and application of cell membrane-camouflaged nanoparticles for cancer therapy[J]. Theranostics, 2017, 7: 2575-2592. DOI:10.7150/thno.20118 |
| [34] |
Seaberg J, Montazerian H, Hossen MN, et al. Hybrid nanosystems for biomedical applications[J]. ACS Nano, 2021, 15: 2099-2142. DOI:10.1021/acsnano.0c09382 |
| [35] |
Rao L, Cai B, Bu LL, et al. Microfluidic electroporation-facilitated synthesis of erythrocyte membrane-coated magnetic nanoparticles for enhanced imaging-guided cancer therapy[J]. ACS Nano, 2017, 11: 3496-3505. DOI:10.1021/acsnano.7b00133 |
| [36] |
Zhang X, Li W, Sun J, et al. How to use macrophages to realize the treatment of tumor[J]. J Drug Target, 2020, 28: 1034-1045. DOI:10.1080/1061186X.2020.1775236 |
| [37] |
Xuan MJ, Shao JX, Dai LR, et al. Macrophage cell membrane camouflaged Au nanoshells for in vivo prolonged circulation life and enhanced cancer photothermal therapy[J]. ACS Appl Mater Interfaces, 2016, 8: 9610-9618. DOI:10.1021/acsami.6b00853 |
| [38] |
Zhao HJ, Li L, Zhang JL, et al. CCL2 recruits macrophage membrane camouflaged hollow bismuth selenide nanoparticles to facilitate photothermal-sensitivity and inhibit lung metastasis of breast cancer[J]. ACS Appl Mater Interfaces, 2018, 10: 31124-31135. DOI:10.1021/acsami.8b11645 |
| [39] |
Lai JZ, Deng GJ, Sun ZH, et al. Scaffolds biomimicking macrophages for a glioblastoma NIR-Ib imaging guided photothermal therapeutic strategy by crossing Blood-Brain Barrier[J]. Biomaterials, 2019, 211: 48-56. DOI:10.1016/j.biomaterials.2019.04.026 |
| [40] |
Liu R, An Y, Jia WF, et al. Macrophage-mimic shape changeable nanomedicine retained in tumor for multimodal therapy of breast cancer[J]. J Control Release, 2020, 321: 589-601. DOI:10.1016/j.jconrel.2020.02.043 |
| [41] |
Gong CA, Yu XY, You BM, et al. Macrophage-cancer hybrid membrane-coated nanoparticles for targeting lung metastasis in breast cancer therapy[J]. J Nanobiotechnol, 2020, 18: 92. DOI:10.1186/s12951-020-00649-8 |
| [42] |
Rayamajhi S, Marasini R, Nguyen TDT, et al. Strategic reconstruction of macrophage-derived extracellular vesicles as a magnetic resonance imaging contrast agent[J]. Biomater Sci, 2020, 8: 2887-2904. DOI:10.1039/D0BM00128G |
| [43] |
Ye SJ, Hu KL. Research progress of exosomes as drug delivery systems in the treatment of brain diseases[J]. Acta Pharm Sin (药学学报), 2020, 55: 1540-1548. |
| [44] |
Liang YJ, Duan L, Lu JP, et al. Engineering exosomes for targeted drug delivery[J]. Theranostics, 2021, 11: 3183-3195. DOI:10.7150/thno.52570 |
| [45] |
Silva AKA, Kolosnjaj Tabi J, Bonneau S, et al. Magnetic and photoresponsive theranosomes: translating cell-released vesicles into smart nanovectors for cancer therapy[J]. ACS Nano, 2013, 7: 4954-4966. DOI:10.1021/nn400269x |
| [46] |
Wu PP, Zhang B, Ocansey DKW, et al. Extracellular vesicles: a bright star of nanomedicine[J]. Biomaterials, 2021, 269: 120467. DOI:10.1016/j.biomaterials.2020.120467 |
| [47] |
Xiong F, Ling X, Chen X, et al. Pursuing specific chemotherapy of orthotopic breast cancer with lung metastasis from docking nanoparticles driven by bioinspired exosomes[J]. Nano Lett, 2019, 19: 3256-3266. DOI:10.1021/acs.nanolett.9b00824 |
| [48] |
Colombo M, Raposo G, Théry C. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles[J]. Annu Rev Cell Dev Biol, 2014, 30: 255-289. DOI:10.1146/annurev-cellbio-101512-122326 |
| [49] |
Ibrahim A, Marbán E. Exosomes: fundamental biology and roles in cardiovascular physiology[J]. Annu Rev Physiol, 2016, 78: 67-83. DOI:10.1146/annurev-physiol-021115-104929 |
| [50] |
Kim MS, Haney MJ, Zhao YL, et al. Engineering macrophage-derived exosomes for targeted paclitaxel delivery to pulmonary metastases: in vitro and in vivo evaluations[J]. Nanomed Nanotechnol Biol Med, 2018, 14: 195-204. DOI:10.1016/j.nano.2017.09.011 |
| [51] |
Cheng LF, Wang YH, Huang L. Exosomes from M1-polarized macrophages potentiate the cancer vaccine by creating a pro-inflammatory microenvironment in the lymph node[J]. Mol Ther, 2017, 25: 1665-1675. DOI:10.1016/j.ymthe.2017.02.007 |
| [52] |
Guo L, Zhang Y, Wei RX, et al. Proinflammatory macrophage-derived microvesicles exhibit tumor tropism dependent on CCL2/CCR2 signaling axis and promote drug delivery via SNARE-mediated membrane fusion[J]. Theranostics, 2020, 10: 6581-6598. DOI:10.7150/thno.45528 |
| [53] |
Xu Z, Huang HB, Xiong X, et al. A near-infrared light-responsive extracellular vesicle as a "Trojan horse" for tumor deep penetration and imaging-guided therapy[J]. Biomaterials, 2021, 269: 120647. DOI:10.1016/j.biomaterials.2020.120647 |
| [54] |
Shields Iv CW, Evans MA, Wang LW, et al. Cellular backpacks for macrophage immunotherapy[J]. Sci Adv, 2020, 6: z6579. |
| [55] |
Li CX, Zhang Y, Dong X, et al. Artificially reprogrammed macrophages as tumor-tropic immunosuppression-resistant biologics to realize therapeutics production and immune activation[J]. Adv Mater, 2019, 31: 1807211. DOI:10.1002/adma.201807211 |
| [56] |
Xia Y, Rao L, Yao HM, et al. Engineering macrophages for cancer immunotherapy and drug delivery[J]. Adv Mater, 2020, 32: 2002054. DOI:10.1002/adma.202002054 |
| [57] |
Qian BZ, Li JF, Zhang H, et al. CCL2 recruits inflammatory monocytes to facilitate breast-tumour metastasis[J]. Nature, 2011, 475: 222-225. DOI:10.1038/nature10138 |
| [58] |
Bonapace L, Coissieux MM, Wyckoff J, et al. Cessation of CCL2 inhibition accelerates breast cancer metastasis by promoting angiogenesis[J]. Nature, 2014, 515: 130-133. DOI:10.1038/nature13862 |
 2021, Vol. 56
2021, Vol. 56


