血液肿瘤是指发生在血液系统的恶性肿瘤, 包括各种白血病、多发性骨髓瘤和恶性淋巴瘤等。与实体肿瘤不同, 血液肿瘤无法进行常规手术切除, 因而治疗效果和预后较差。世界癌症报告指出, 2018年全球白血病新增病例437 033例, 新增死亡病例309 006例; 恶性淋巴瘤新增病例509 590例, 新增死亡病例248 724例; 多发性骨髓瘤新增病例159 985例, 新增死亡病例106 105例[1]。2019年全国癌症报告显示, 白血病和淋巴瘤分列全国恶性肿瘤死亡率的第九和第十位[2]。由此可见, 血液肿瘤因其特殊性严重威胁着人类的健康。目前, 针对血液肿瘤的治疗主要是以放化疗为主、结合靶向药物的治疗手段。虽然, 在治疗前期能一定程度改善患者病情, 但是随着治疗的进行, 耐药作用的产生和严重的不良反应仍影响着患者的生存状态。如对于白血病的非移植治疗, 主要手段是放化疗为主结合其他疗法, 自上世纪80年代以来, 阿糖胞苷联合柔红霉素"7+3"诱导化疗方案就成为治疗急性髓系白血病(acute myelogenous leukemia, AML) 的标准方案[3], 环磷酰胺等烷化剂化疗药也是治疗慢性淋巴细胞白血病(chronic lymphoblastic leukemia, CLL) 的主要手段[4]。但是, 这些药物往往伴随着严重的不良反应, 如骨髓抑制、胃肠道刺激和脱发等, 严重影响着患者的治疗效果。随着目前靶向抗肿瘤药物及免疫抗肿瘤研究的进展, 恶性血液肿瘤的治疗也取得一些进步, 如布鲁顿酪氨酸激酶(Bruton's tyrosine kinase, BTKs) 抑制剂、免疫治疗药物博纳吐单抗(Blincyto, blinatumomab)、抗体药物偶联物(ADC) 奥英妥珠单抗(inotuzumab ozogamicin)、吉妥单抗(gemtuzumab ozogamicin), 以及嵌合抗原受体(CAR) T细胞疗法治疗血液肿瘤等[5, 6]。但是由于靶向药物和免疫治疗药物在效果、价格和患者响应率上还存在一定的问题, 所以仍然不能替代放化疗在临床治疗中的地位, 因此, 发现新的血液肿瘤发病机制, 发展新的更有效的血液肿瘤治疗方法, 是目前亟待解决的关键问题。
肿瘤细胞通过代谢重编程调节自身及微环境能量代谢来促进其生长和增殖, 已经是目前被广泛认可的现象[7]。众所周知, 正常细胞在胞浆中将大部分葡萄糖通过糖酵解的方式转化为丙酮酸, 并转运到线粒体中。在有氧条件下, 丙酮酸为三羧酸循环和电子传输链提供燃料, 发生氧化磷酸化, 以ATP的形式产生能量。其中大部分细胞只有在氧气匮乏时, 才会依靠糖酵解途径为自身提供能量。而对于大部分肿瘤细胞来说, 即使是氧气充足的情况下, 也更倾向于通过糖酵解的方式提供能量, 这便是著名的"Warburg effect"[8], 因此越来越多的研究人员开始认为肿瘤是一种代谢疾病。除了糖代谢的异常以外, 脂代谢异常同样是肿瘤细胞代谢特性之一, 脂质的生成、摄取及氧化分解异常发生在多种肿瘤中, 并且促进肿瘤的快速增殖。脂质尤其是甾醇、甘油、磷脂等, 不但是生物膜的重要组成部分, 也被用于储存能量或传递细胞信号。脂肪酸根据含有双键的数量被分为饱和脂肪酸和不饱和脂肪酸, 它的分解是生命体重要的能量来源。脂质合成的物质来源众多, 包括葡萄糖及谷氨酰胺等, 它们的代谢产物丙酮酸和谷氨酸盐在进入线粒体后形成柠檬酸, 然后释放到细胞质中, 作为合成脂肪酸和胆固醇的前体[9]。
在多种实体肿瘤中, 脂质合成或脂肪酸分解途径异常活化, 从而促进肿瘤进展。如肺癌中脂质合成途径异常活跃, 通过抑制脂质合成相关代谢酶, 可以显著抑制肺癌细胞的增殖; 脂肪酸氧化途径异常激活能够促进乳腺癌细胞的侵袭转移等[10, 11]。越来越多的证据表明, 脂质代谢重编程影响肿瘤的发生发展, 肿瘤细胞能通过显著上调脂质合成途径, 促进自身增殖[12], 并且在营养有限的情况下通过脂肪酸氧化分解提供能源[13]。虽然实体瘤的脂代谢重编程已经得到了一定重视, 但是脂代谢异常在血液肿瘤中的作用研究还并不全面。众所周知, 在人体血液和骨髓中, 存在着大量的脂质成分, 脂质代谢异常也是多种心血管疾病发生的重要原因, 已有研究表明脂蛋白脂酶(lipoprotein lipase, LPL) 的异常表达与CLL的进展和不良预后相关[14]。在AML和CLL中还发现了一种特定的白血病干细胞(leukemia stem cells, LSCs) 亚群, 它们能够通过表达脂肪酸转运蛋白CD36来利用脂解代谢, 并逃避化疗导致的凋亡[15], 同样CD36也被认为与AML的预后相关[16]。由此可知, 脂质代谢与血液肿瘤也存在密切联系, 本文将针对脂质代谢相关的关键代谢酶在血液肿瘤中的研究作一综述, 探讨脂质代谢异常与恶性血液肿瘤发生发展的关系。
1 脂质合成代谢关键酶与血液肿瘤人体通过自身合成和外界摄取两种方式获取脂质。多个研究表明, 脂质代谢在多种恶性肿瘤中重编程, 脂质合成在多种实体肿瘤中被显著上调, 在血液肿瘤中, 同样观察到脂质合成通路的异常活跃[17]。脂质从头合成途径中, 存在多种关键调节因子, 如ATP柠檬酸裂解酶(ATP citrate lyase, ACLY)、乙酰辅酶A羧化酶(acetyl-CoA carboxylase, ACC)、脂肪酸合成酶(fatty acid synthase, FASN) 和硬脂酰辅酶A去饱和酶1 (stearyl coenzyme A dehydrogenase-1, SCD1) 等[18-20]。乙酰辅酶A是脂质合成的前体, 由进入胞质的柠檬酸在ACLY的催化下生成[21]。在ACC的作用下, 乙酰辅酶A羧基化生成丙二酰辅酶A[22], 最终将二碳单位连接为脂肪酸, 作为能量储存与代谢的场所。
1.1 ACLY作为调控脂质合成最上游关键酶, 前期研究显示ACLY在直结肠癌、乳腺癌和非小细胞肺癌等多种恶性肿瘤中表达上调[23, 24]。最近, Basappa等[25]的研究发现, AML中ACLY存在Y227、Y252等多个磷酸化活化位点, 并存在异常活化, 且ACLY的CoA结合区可与磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K) 信号通路中磷脂酰肌醇-4, 5-二磷酸[phosphatidylinositol(4, 5)bisphosphate, PIP2] 或磷脂酰肌醇-3, 4, 5-二磷酸[phosphatidylinositol(3, 4, 5)bisphosphate, PIP3] 直接作用。实验结果表明, ACLY的活性受到PI3K信号通路和Src家族酪氨酸激酶Lyn的调节。这些结果说明, 在AML中, 活化的PI3K信号通路和酪氨酸激酶可以通过促进ACLY的活性, 调节乙酰辅酶A和脂肪酸的合成, 从而促进AML进展。此外, 研究人员通过检测274例AML患者体内ACLY的转录水平, 发现, 低表达ACLY的患者拥有更好的总体生存期, 同时在体外实验中, 通过沉默细胞中的ACLY或使用ACLY抑制剂SB-204990处理可以抑制人急性髓系白血病细胞MOLM-13和单核巨噬细胞THP-1的生长[26]。作为连接糖酵解和脂代谢的关键酶, ACLY被认为是具有巨大潜力的抗肿瘤药物靶点。原有的ACLY抑制剂主要应用于肥胖和高脂血症的治疗, 探索它们在抗肿瘤方面的作用已逐渐成为热点[27], 2017年Koerner等[28]研究人员开发了一系列以天然蒽酮衍生物为来源的ACLY抑制剂, 其中化合物23能够显著抑制肺癌A549细胞增殖, 并且诱导细胞凋亡。总体而言, 随着肿瘤代谢研究的发展, ACLY抑制剂无疑会在抗肿瘤领域发挥出重要的作用。
1.2 FASNFASN作为催化脂肪酸生物合成最后一步的关键酶, 其已在多种实体瘤, 如乳腺癌、膀胱癌和前列腺癌等中得到了广泛的研究[13, 29, 30], 其特异性抑制剂C75、浅蓝菌素和奥利司他已有相关抗肿瘤活性的报道[10]。急性淋巴细胞白血病(acute lymphocytic leukemia, ALL) 是儿童最常见的血液系统恶性肿瘤, 其治疗后的复发和相关并发症是儿童癌症相关死亡的重要原因[31], 研究人员通过对复发ALL的患儿和初次ALL患儿的mRNA进行对比, 发现复发患儿FASN的表达显著高于新患儿, 首次提出以FASN作为ALL预后指标的观点, 并且验证了生姜提取物对FASN的抑制作用[32]。此外, 在恶性淋巴瘤代谢重编程中, FASN的高表达同样吸引了研究人员的关注。原发性渗出淋巴瘤(primary exudative lymphoma, PEL) 是一种侵袭性B细胞淋巴瘤, 其细胞代谢改变不仅使糖酵解途径过度激活, 还增加了脂肪酸的合成。正常的B细胞几乎没有FASN的生物合成和表达, 而PEL表现出FASN的过度表达。FASN特异抑制剂C75可以明显抑制脂肪酸合成, 降低B细胞非霍奇金淋巴瘤(B-cell non-Hodgkin's lymphoma, B-NHL) 的活性, 而对原代B细胞基本无影响[33]。相似地是, 在套细胞淋巴瘤(mantle cell lymphoma, MCL) 中, Gelebart等[34]发现, FASN同样高度表达。一般认为, 细胞周期蛋白cyclin D1诱导的细胞周期调节是MCL发生发展的重要原因, 通过采用C75和奥利司他处理MCL细胞, 可以观察到MCL活细胞数剂量依赖性降低。同样, 敲低细胞中的FASN, 能够诱导MCL细胞凋亡并且抑制cyclin D1的表达。在针对弥漫性大B细胞淋巴瘤(diffuse large B-cell lymphoma, DLBCL) 的研究中, 研究人员还发现FASN能诱导PI3K-S6Kinase信号导致去泛素化酶USP11 (ubiquitin-specific protease 11, USP11) 磷酸化, 增强了它与真核细胞翻译起始因子4B (eukaryotic initiation factor 4B, elF4B) 的相互作用, 从而促进DLBCL中多种促癌基因的翻译[35]。Danilova等[36]通过对美国DLBCL患者的临床检查, 得出结论, FASN的表达是化疗后DLBCL的独立预后指标, FASN高表达的患者预后较差。同样在T细胞淋巴瘤中, 奥利司他可以通过促进肿瘤细胞产生干扰素γ而抑制FASN的表达, 并诱导肿瘤细胞凋亡[37]。多发性骨髓瘤(multiple myeloma, MM) 是一种不可治愈的浆细胞癌症, 主要发生在骨髓中, 会对患者造成严重的骨骼损伤, 它的发病率占全部血液肿瘤的13%~15%, 是第二常见的恶性血液病[38]。研究人员在针对MM代谢特性的研究中发现, 其糖代谢和谷氨酰胺代谢发生重编程[39, 40], 而与糖代谢和谷氨酰胺代谢密切相关的脂代谢则研究较少。奥利司他可以通过抑制FASN在MM细胞中的表达, 增加MM细胞凋亡, 从而抑制细胞增殖[41]。我国研究人员通过对MM患者的临床检测发现, 27例骨髓瘤患者中, 有22位检测到FASN高表达, 而在12例健康供体的外周血单个核细胞(peripheral blood mononuclear cell, PBMC) 中则未检出FASN[42]。以上结果可知, FASN作为脂质合成关键代谢酶, 在多种血液肿瘤中存在异常高表达, 尤其是B细胞淋巴瘤和MM, 由此可见在血液肿瘤中存在着活跃的脂质合成过程, 因此, 以FASN作为血液肿瘤的治疗靶点具有极大潜力。越来越多的证据表明, FASN参与了肿瘤代谢重编程, 但将阻断FASN的基础科学手段应用于血液肿瘤的临床治疗仍面临不小的挑战, 新的FASN抑制剂将具有极大的临床前景。
1.3 SCD1SCD1是附着在内质网的催化饱和脂肪酸向不饱和脂肪酸转化的关键代谢酶, 其介导的脂肪酸平衡对生物膜形成和支持肿瘤快速增殖具有重要意义[43, 44]。降脂药物苯扎贝特和醋酸甲羟孕酮的组合在临床上对AML有显著的抗癌活性, 能够诱导AML细胞分化和凋亡, 并且对CD34+的正常血管内皮细胞不存在影响[45], 而贝特类药物则可以显著影响SCD1或SCD2的表达[46], Southam等[47]通过基于质谱的脂质组学和蛋白组学研究发现, 经苯扎贝特处理后, AML细胞增殖受到明显抑制, 且细胞脂肪酸和磷脂合成显著降低, 并且SCD1蛋白水平也明显下降。通过细胞补充SCD1的酶解产物油酸盐, 可以逆转由苯扎贝特导致的细胞死亡, 这说明贝特类药物的抗白血病作用是通过降低SCD1的水平而起作用的。然而有趣的是, 在针对慢性髓系白血病(chronic myeloid leukemia, CML) 的研究中, 研究人员发现SCD1在LSCs中表达下调, SCD1的缺失会加速CML的发展, 过表达SCD1则可以促进CML细胞凋亡, 抑制癌症进程。LSCs中SCD1的表达缺失, 导致凋亡相关基因表达异常, 其中人第10号染色体缺失的磷酸酶及张力蛋白同源的基因(phosphatase and tensin homologue deleted on chromosome 10, PTEN) 和P53表达降低, B细胞淋巴瘤-2基因(B-cell lymphoma-2, Bcl-2) 表达增加是SCD1对LSCs功能调节的分子基础, 作者认为在不同的肿瘤中SCD1作用的差异有助于今后针对肿瘤干细胞的抗肿瘤治疗[48]。在不同的血液肿瘤中, SCD1起到了不同的作用, 目前针对SCD1为靶点的药物均处于临床前研究阶段, 其特异性抑制剂BZ36和A939572等在肾癌和肺癌的相关研究中取得了一定的进展[49, 50], 可以抑制肿瘤细胞增殖, 诱导细胞凋亡并且逆转肿瘤细胞化疗耐药, 然而由于治疗过程中出现的毒副作用, 目前仍需要进一步研究, 但足以证明靶向SCD1的干预治疗仍有望成为肿瘤治疗的一个新选择。
通过以上结果可知, 虽然脂质代谢与血液肿瘤之间的关系还有待研究, 但是脂质合成在其发展中应该发挥重要的作用, 靶向抑制脂质合成相关代谢酶, 可能是治疗血液肿瘤的新方向。代谢重编程已经被证实同样发生在血液肿瘤中, 值得注意的是, 旺盛的糖酵解过程产生的多种中间体被显著分流到脂质合成途径中, 其中ACLY、SCD1和FASN等关键代谢酶已经被证实在多种血液肿瘤中异常活化, 并可能作为疾病预后的重要靶点, 通过采用针对性抑制剂如奥利司他、C75等抑制脂质合成途径, 显示出良好的抗肿瘤作用。综上所述, 靶向脂质合成开发抗血液肿瘤药物有较好的研究前景, 针对其代谢重编程机制的研究可能发现新的耐药机制, 为血液肿瘤的治疗和预后做出贡献。
2 脂质分解代谢酶与血液肿瘤研究表明, 脂肪酸氧化途径是还原型辅酶Ⅰ (nicotinamide adenine dinucleotide, NADH)、黄素腺嘌呤二核苷酸递氢体(flavin adenine dinucleotide, FADH2)、烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate, NADPH) 和ATP产生的重要来源, 为肿瘤细胞提供了生存优势[51, 52]。在脂肪酸氧化过程中, 游离脂肪酸通过长链酰基辅酶A合成酶(long chain acyl coenzyme A synthase, LACS) 催化转化为酰基辅酶A, 然后酰基辅酶A通过肉碱棕榈酰基转移酶1 (carnitine palmitoyltransferase 1, CPT1) 转化为酰基肉碱, 从而进入线粒体内。一旦进入线粒体基质, 酰基辅酶A就会经历一系列氧化反应, 每一步都会释放NADH和FADH2, 这个过程为肿瘤细胞产生大量的能量, 是生命体产生能量效率最高的途径。在肿瘤高速增殖转移的过程中, 需要大量的能量, 一般认为这部分能量来自糖酵解过程, 随着研究的不断发展, 越来越多的证据表明, 由于糖酵解的低效性, 脂肪酸氧化同样为多种恶性肿瘤提供能量来源。
2.1 CPT1CPT1是脂肪酸氧化过程的关键限速酶[53], 定位于线粒体外膜, 催化游离脂肪酸合成脂酰肉碱(acyl carnitine, AC) 并进入线粒体, AC在线粒体中进行氧化并产生大量能量供给细胞生长[54], 该家族目前发现有3种亚型, CPT1A、CPT1B和CPT1C, 其中A亚型和B亚型广泛分布在脂代谢旺盛的各种组织器官中, 而C亚型目前仅在神经元中被发现[55-57]。CPT1直接调控脂肪酸代谢过程, 从而促进肿瘤代谢适应。同时, CPT1还与多种信号通路密切相关, 是促进癌症进展的重要因素。CPT1家族中的CPT1A已经被证实与乳腺癌和前列腺癌等恶性实体瘤密切相关[58, 59]。在白血病细胞系中, CPT1A广泛表达, CPT1A特异性抑制剂ST1326可以显著抑制其酶活性, 减少白血病细胞中的脂肪酸β氧化, 从而导致肿瘤细胞生长抑制, 促进凋亡[60]。同样Gugiatti等[61]也发现, ST1326可以诱导CLL细胞中髓细胞白血病基因(myeloid cell leukemia-1, Mcl-1) 和B细胞淋巴瘤-xL基因(B-cell lymphoma-xL, Bcl-xL) 表达上调, 从而使活化的CLL细胞对抗凋亡药物敏感。白血病患者中CPT1A高表达的患者相比于低表达患者有更短的总生存期(overall survival, OS) 和无事件生存率(event free survival, EFS), 且高表达的患者中很多促癌基因的表达也更高, 因此CPT1A可以作为判断白血病患者预后和进展的生物标志物[62]。Liu等[63]认为, 抑制CPT1来治疗CLL的机制是通过抑制脂肪酸向线粒体转运, 而导致线粒体中磷脂的严重枯竭, 线粒体完整性丧失, 凋亡因子释放最终导致CLL细胞死亡。他们通过CPT1抑制剂perhexiline验证了这个结论。本课题组从TCGA数据库提取151例AML基因表达数据, 从GTEx数据库提取正常血液基因表达数据444例进行对比, 通过wilcoxtext算法对两组数据进行差异对比, 纳入表达差异logFC > 2且P < 0.05的因子, 共获取2 509个差异基因, 对以上的基因进行KEGG富集分析发现, 脂肪酸降解途径被显著富集(图 1a), 其中CPT1A和CPT1B在正常组织和AML中差异倍数超过8倍, 并且与生存期显著相关(图 1b、c)。以上结果表明, 通过抑制脂肪酸β氧化限速酶CPT1, 抑制脂肪酸向线粒体内的转移, 可以显著降低肿瘤细胞能量代谢, 从而抑制白血病细胞增殖, 相应的抑制剂也显示出较好的体外效果。然而, 在针对恶性淋巴瘤和MM的研究中, 有关脂肪酸氧化与其发生发展的研究相对较少, 有研究显示etomoxir作为一种已知的CPT1A抑制剂, 可以抑制MM细胞增殖但不会促进细胞凋亡。而将etomoxir与FASN抑制剂奥利司他联用可以促进MM细胞发生凋亡, 显著增加etomoxir对细胞增殖的抑制[41]。虽然CPT1表达与血液肿瘤的相关性已经得到了广泛的证实, 但是脂肪酸氧化过程在血液肿瘤发生发展中的作用机制还尚未明确, 与糖酵解等其他能量代谢途径之间的关系未被详细阐述, 目前也没有任何CPT1抑制剂应用于血液肿瘤的临床治疗。
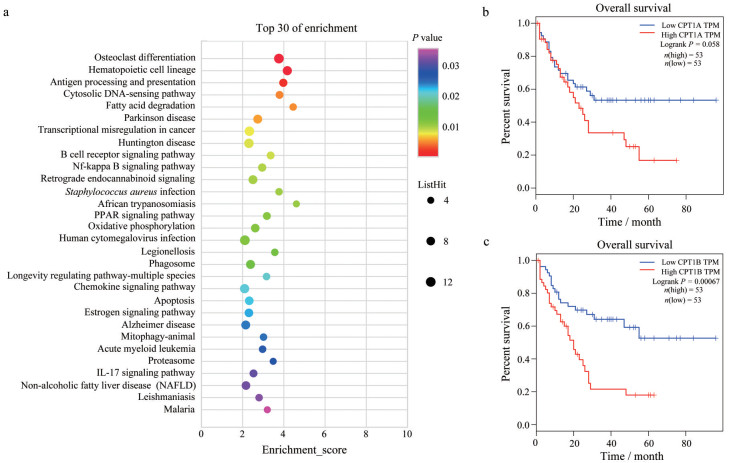
|
图 1 Function enrichment analyses for differently expressed genes and survival analysis of CPT1. a: KEGG pathways enrichment for differently expressed gene. logFC > 2, P value < 0.05; b: Survival analysis of CPT1A; c: Survival analysis of CPT1B. CPT1: Carnitine palmitoyltransferase 1; FC: Fold change |
除了CPT1之外, 研究人员还发现与脂肪酸氧化密切相关的HADHA在高度恶性淋巴瘤中存在过度表达。线粒体三功能蛋白MTP是脂肪酸β氧化重要的调节酶, 它可以催化氧化过程中的水合、脱氢和硫解三步, 它的α亚基HADHA不但可以调控脂肪酸氧化过程, 还与miRNA合成密切相关, 通过敲除HADHA可以明显抑制MM和DLBCL细胞的增殖, 其机制可能与脂肪酸β氧化过程被抑制有关[64]。
由此可见, 脂肪酸分解代谢与血液肿瘤存在密切关系, 无论是抑制脂肪酸进入线粒体还是阻断线粒体中的β氧化都可以比较显著地影响血液肿瘤进程, 相关代谢酶如CPT1还可以作为预后标志物, 因此脂肪酸分解代谢过程同样具有成为治疗靶点的潜力, 针对相关代谢酶的特异性抑制剂研究可能会具有良好的前景。
3 其他脂代谢酶与血液肿瘤 3.1 CD36除了从头合成外, 外源性摄取脂质是细胞获得脂肪酸的另一个重要途径。CD36是一种跨膜蛋白, 又被称为脂肪移位酶(FA translocase, FAT), 其可以通过胞内和胞外囊泡转运到细胞器或细胞膜, 从而调控脂肪酸的摄取和能量代谢的平衡[65]。CD36与CPT1共同调控线粒体脂肪酸氧化(FA oxidation, FAO), 并且在骨骼肌线粒体FAO中起关键作用[66]。在AML中, CD36可以和载脂蛋白C2 (apolipoprotein C2, APOC2) 协同激活胞外信号调节激酶(extracellular signal-regulated kinase, ERK) 信号通路, 促进疾病进展。研究人员使用CD36阻断抗体治疗AML细胞移植小鼠, 可以显著延长小鼠生存期, 并且降低肿瘤细胞转移[67]。在CML中, LSCs相比与其他细胞具有更高的FAO利用率, CD36的异常高表达是LSCs中FAO升高的原因, CD36+的LSCs具备更强的耐药性, 可以克服阿糖胞苷在内的多种化疗药物的治疗[15]。同样的, Farge等[68]的研究也证实CD36的高表达是AML耐药的重要原因。此外, 在CLL中, 信号传导与转录活化因子3 (signal transducer and activator of transcription 3, STAT3) 被证明通过与CD36启动子结合来激活CD36促进脂肪酸摄取[69]。CD36还在大部分DLBCL患者中存在高表达, 可以作为利妥昔单抗治疗后DLBCL的独立预后因子[36]。由此可见, CD36介导的脂质摄取与多种血液肿瘤的耐药、进展及预后相关, 目前, CD36靶向药物均处于临床前研究中[70, 71], 并且针对血液肿瘤的研究仍处于空白, 脂质摄取对血液肿瘤影响的作用机制仍有待探索。
3.2 PHD3和ACC2脯氨酰羟化酶家族(prolyl hydroxylases, PHDs) 是一类保守依赖氧气和α-酮戊二酸的酶家族, 它们通过调节缺氧诱导因子(HIF) 的羟基化来调节糖酵解代谢, 对细胞所处环境产生应激[72]。ACC2与线粒体外膜结合后, 催化生成丙二酰辅酶A, 能够抑制CPT1的活性, 从而影响FAO。研究发现, PHD3通过脯氨酰羟化作用与ACC2结合, 并使ACC2发生羟基化激活, 从而抑制细胞FAO过程。在AML中, PHD3的表达显著下调, 导致脂肪酸消耗增加, FAO异常活跃, 从而驱动AML细胞增殖和疾病进展[73]。此外, 在B细胞淋巴瘤和MM等多种肿瘤中, PHD3表达下调, 提示在这些肿瘤中, 活跃的FAO过程可能对疾病的进展起到促进作用[74]。以上结果说明, PHD3低表达可能作为一种标志物, 用以识别可能对FAO抑制剂治疗敏感的患者, 并在未来的临床治疗上起到重要作用。
4 总结和展望肿瘤细胞代谢重编程已经被认为是肿瘤发生发展中的重要标志。脂质代谢作为细胞重要的能量储存和产生的途径, 在肿瘤发生发展中发挥重要作用。脂质代谢重编程在多种实体瘤研究中已经得到证实, 而血液肿瘤中特殊的微环境可能导致脂质代谢在其进展中起到更加关键的作用。无论是血液还是骨髓中, 都存在大量的脂质, 肿瘤细胞和周围环境间存在广泛的脂质传递。越来越多的研究也表明, 血液肿瘤中存在着脂质合成和代谢过程的异常, 相关代谢酶发生不同程度的上调, 而沉默或加入靶向ACLY、FASN、CPT1和HADHA等脂质代谢关键代谢酶的抑制剂后, 可以起到抑制肿瘤生长、迁徙、转移, 促进肿瘤细胞凋亡、自噬过程和逆转部分现有药物耐药的作用。因此, 针对血液肿瘤中脂质代谢异常的研究迫在眉睫。但脂质代谢异常在血液肿瘤中是否具有普适性, 从而能够将靶向脂质代谢关键代谢酶的抑制剂推向血液肿瘤治疗的市场, 有待进一步研究确认。此外, 血液肿瘤中是如何引起脂质代谢异常, 即异常脂质代谢是怎样被激活以及怎样影响血液肿瘤生长的机制有待进一步阐明。找到关键的脂质异常代谢酶与血液肿瘤的恶性程度、预后、治疗之间的关系, 亦必将对血液肿瘤的治疗提供新的治疗思路。综上所述, 脂代谢相关研究对血液肿瘤发生发展机制的阐明具有重要意义, 其相关代谢酶可能成为潜力巨大的抗血液肿瘤新靶点。
作者贡献: 刘羿晨是综述的主要撰写人, 完成相关文献资料的收集和分析及论文初稿的写作; 杜婷婷、王庆华、张智慧参与文献资料的分析、整理; 陈晓光是项目的构思者及负责人, 指导论文写作。全体作者都阅读并同意最终的文本。
利益冲突: 无利益冲突。
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68: 394-424. DOI:10.3322/caac.21492 |
| [2] |
Zheng RS, Sun KX, Zhang SW, et al. Report of cancer epidemiology in China[J]. Chin J Oncol (中华肿瘤杂志), 2019, 41: 19-28. |
| [3] |
Chen KTJ, Gilabert-Oriol R, Bally MB, et al. Recent treatment advances and the role of nanotechnology, combination products, and immunotherapy in changing the therapeutic landscape of acute myeloid leukemia[J]. Pharm Res, 2019, 36: 125. DOI:10.1007/s11095-019-2654-z |
| [4] |
Sharma S, Rai KR. Chronic lymphocytic leukemia (CLL) treatment: so many choices, such great options[J]. Cancer, 2019, 125: 1432-1440. DOI:10.1002/cncr.31931 |
| [5] |
Topp MS, Zimmerman Z, Cannell P, et al. Health-related quality of life in adults with relapsed/refractory acute lymphoblastic leukemia treated with blinatumomab[J]. Blood, 2018, 131: 2906-2914. DOI:10.1182/blood-2017-09-804658 |
| [6] |
Turtle CJ, Hay KA, Hanafi LA, et al. Durable molecular remissions in chronic lymphocytic leukemia treated with CD19-specific chimeric antigen receptor-modified T cells after failure of ibrutinib[J]. J Clin Oncol, 2017, 35: 3010-3020. DOI:10.1200/JCO.2017.72.8519 |
| [7] |
Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation[J]. Cell, 2011, 144: 646-674. DOI:10.1016/j.cell.2011.02.013 |
| [8] |
Warburg O. On respiratory impairment in cancer cells[J]. Science, 1956, 124: 269-270. |
| [9] |
Luengo A, Gui DY, Vander Heiden MG. Targeting metabolism for cancer therapy[J]. Cell Chem Biol, 2017, 24: 1161-1180. DOI:10.1016/j.chembiol.2017.08.028 |
| [10] |
Merino Salvador M, Gómez de Cedrón M, Moreno Rubio J, et al. Lipid metabolism and lung cancer[J]. Crit Rev Oncol Hematol, 2017, 112: 31-40. DOI:10.1016/j.critrevonc.2017.02.001 |
| [11] |
Wright HJ, Hou J, Xu B, et al. CDCP1 drives triple-negative breast cancer metastasis through reduction of lipid-droplet abundance and stimulation of fatty acid oxidation[J]. Proc Natl Acad Sci U S A, 2017, 114: E6556-E6565. DOI:10.1073/pnas.1703791114 |
| [12] |
Holthuis JC, Menon AK. Lipid landscapes and pipelines in membrane homeostasis[J]. Nature, 2014, 510: 48-57. DOI:10.1038/nature13474 |
| [13] |
Menendez JA, Lupu R. Fatty acid synthase and the lipogenic phenotype in cancer pathogenesis[J]. Nat Rev Cancer, 2007, 7: 763-777. DOI:10.1038/nrc2222 |
| [14] |
Heintel D, Kienle D, Shehata M, et al. High expression of lipoprotein lipase in poor risk B-cell chronic lymphocytic leukemia[J]. Leukemia, 2005, 19: 1216-1223. DOI:10.1038/sj.leu.2403748 |
| [15] |
Ye H, Adane B, Khan N, et al. Leukemic stem cells evade chemotherapy by metabolic adaptation to an adipose tissue niche[J]. Cell Stem Cell, 2016, 19: 23-37. DOI:10.1016/j.stem.2016.06.001 |
| [16] |
Perea G, Domingo A, Villamor N, et al. Adverse prognostic impact of CD36 and CD2 expression in adult de novo acute myeloid leukemia patients[J]. Leuk Res, 2005, 29: 1109-1116. DOI:10.1016/j.leukres.2005.02.015 |
| [17] |
Stuani L, Riols F, Millard P, et al. Stable isotope labeling highlights enhanced fatty acid and lipid metabolism in human acute myeloid leukemia[J]. Int J Mol Sci, 2018, 19: 3325. DOI:10.3390/ijms19113325 |
| [18] |
Rohrig F, Schulze A. The multifaceted roles of fatty acid synthesis in cancer[J]. Nat Rev Cancer, 2016, 16: 732-749. DOI:10.1038/nrc.2016.89 |
| [19] |
Geng F, Cheng X, Wu X, et al. Inhibition of SOAT1 suppresses glioblastoma growth via blocking SREBP-1-mediated lipogenesis[J]. Clin Cancer Res, 2016, 22: 5337-5348. DOI:10.1158/1078-0432.CCR-15-2973 |
| [20] |
Currie E, Schulze A, Zechner R, et al. Cellular fatty acid metabolism and cancer[J]. Cell Metab, 2013, 18: 153-161. DOI:10.1016/j.cmet.2013.05.017 |
| [21] |
Zhao S, Torres A, Henry RA, et al. ATP-citrate lyase controls a glucose-to-acetate metabolic switch[J]. Cell Rep, 2016, 17: 1037-1052. DOI:10.1016/j.celrep.2016.09.069 |
| [22] |
Wang C, Rajput S, Watabe K, et al. Acetyl-CoA carboxylase-a as a novel target for cancer therapy[J]. Front Biosci (Schol Ed), 2010, 2: 515-526. |
| [23] |
Khwairakpam AD, Shyamananda MS, Sailo BL, et al. ATP citrate lyase (ACLY): a promising target for cancer prevention and treatment[J]. Curr Drug Targets, 2015, 16: 156-163. DOI:10.2174/1389450115666141224125117 |
| [24] |
Osugi J, Yamaura T, Muto S, et al. Prognostic impact of the combination of glucose transporter 1 and ATP citrate lyase in node-negative patients with non-small lung cancer[J]. Lung Cancer, 2015, 88: 310-318. DOI:10.1016/j.lungcan.2015.03.004 |
| [25] |
Basappa J, Citir M, Zhang Q, et al. ACLY is the novel signaling target of PIP2/PIP3 and Lyn in acute myeloid leukemia[J]. Heliyon, 2020, 6: e03910. DOI:10.1016/j.heliyon.2020.e03910 |
| [26] |
Wang J, Ye W, Yan X, et al. Low expression of ACLY associates with favorable prognosis in acute myeloid leukemia[J]. J Transl Med, 2019, 17: 149. DOI:10.1186/s12967-019-1884-5 |
| [27] |
Granchi C. ATP citrate lyase (ACLY) inhibitors: an anti-cancer strategy at the crossroads of glucose and lipid metabolism[J]. Eur J Med Chem, 2018, 157: 1276-1291. DOI:10.1016/j.ejmech.2018.09.001 |
| [28] |
Koerner SK, Hanai JI, Bai S, et al. Design and synthesis of emodin derivatives as novel inhibitors of ATP-citrate lyase[J]. Eur J Med Chem, 2017, 126: 920-928. DOI:10.1016/j.ejmech.2016.12.018 |
| [29] |
Menendez JA, Lupu R. Fatty acid synthase (FASN) as a therapeutic target in breast cancer[J]. Expert Opin Ther Targets, 2017, 21: 1001-1016. DOI:10.1080/14728222.2017.1381087 |
| [30] |
Pandey PR, Liu W, Xing F, et al. Anti-cancer drugs targeting fatty acid synthase (FAS)[J]. Recent Pat Anticancer Drug Discov, 2012, 7: 185-197. DOI:10.2174/157489212799972891 |
| [31] |
Iacobucci I, Mullighan CG. Genetic basis of acute lymphoblastic leukemia[J]. J Clin Oncol, 2017, 35: 975-983. DOI:10.1200/JCO.2016.70.7836 |
| [32] |
Ghaeidamini Harouni M, Rahgozar S, Rahimi Babasheikhali S, et al. Fatty acid synthase, a novel poor prognostic factor for acute lymphoblastic leukemia which can be targeted by ginger extract[J]. Sci Rep, 2020, 10: 14072. DOI:10.1038/s41598-020-70839-9 |
| [33] |
Bhatt AP, Jacobs SR, Freemerman AJ, et al. Dysregulation of fatty acid synthesis and glycolysis in non-Hodgkin lymphoma[J]. Proc Natl Acad Sci U S A, 2012, 109: 11818-11823. DOI:10.1073/pnas.1205995109 |
| [34] |
Gelebart P, Zak Z, Anand M, et al. Blockade of fatty acid synthase triggers significant apoptosis in mantle cell lymphoma[J]. PLoS One, 2012, 7: e33738. DOI:10.1371/journal.pone.0033738 |
| [35] |
Kapadia B, Nanaji NM, Bhalla K, et al. Fatty acid synthase induced S6Kinase facilitates USP11-eIF4B complex formation for sustained oncogenic translation in DLBCL[J]. Nat Commun, 2018, 9: 829. DOI:10.1038/s41467-018-03028-y |
| [36] |
Danilova OV, Dumont LJ, Levy NB, et al. FASN and CD36 predict survival in rituximab-treated diffuse large B-cell lymphoma[J]. J Hematop, 2013, 6: 11-18. DOI:10.1007/s12308-012-0166-4 |
| [37] |
Kant S, Kumar A, Singh SM. Fatty acid synthase inhibitor orlistat induces apoptosis in T cell lymphoma: role of cell survival regulatory molecules[J]. Biochim Biophys Acta, 2012, 1820: 1764-1773. DOI:10.1016/j.bbagen.2012.07.010 |
| [38] |
Kyle RA, Rajkumar SV. Criteria for diagnosis, staging, risk stratification and response assessment of multiple myeloma[J]. Leukemia, 2009, 23: 3-9. DOI:10.1038/leu.2008.291 |
| [39] |
Bolzoni M, Chiu M, Accardi F, et al. Dependence on glutamine uptake and glutamine addiction characterize myeloma cells: a new attractive target[J]. Blood, 2016, 128: 667-679. |
| [40] |
Nakano A, Miki H, Nakamura S, et al. Up-regulation of hexokinaseII in myeloma cells: targeting myeloma cells with 3-bromopyruvate[J]. J Bioenerg Biomembr, 2012, 44: 31-38. DOI:10.1007/s10863-012-9412-9 |
| [41] |
Tirado-Velez JM, Joumady I, Saez-Benito A, et al. Inhibition of fatty acid metabolism reduces human myeloma cells proliferation[J]. PLoS One, 2012, 7: e46484. DOI:10.1371/journal.pone.0046484 |
| [42] |
Wang WQ, Zhao XY, Wang HY, et al. Increased fatty acid synthase as a potential therapeutic target in multiple myeloma[J]. J Zhejiang Univ Sci B, 2008, 9: 441-447. DOI:10.1631/jzus.B0740640 |
| [43] |
Bai Y, McCoy JG, Levin EJ, et al. X-ray structure of a mammalian stearoyl-CoA desaturase[J]. Nature, 2015, 524: 252-256. DOI:10.1038/nature14549 |
| [44] |
Wu X, Zou X, Chang Q, et al. The evolutionary pattern and the regulation of stearoyl-CoA desaturase genes[J]. Biomed Res Int, 2013, 2013: 856521. |
| [45] |
Khanim FL, Hayden RE, Birtwistle J, et al. Combined bezafibrate and medroxyprogesterone acetate: potential novel therapy for acute myeloid leukaemia[J]. PLoS One, 2009, 4: e8147. DOI:10.1371/journal.pone.0008147 |
| [46] |
Yamazaki T, Okada H, Sakamoto T, et al. Differential induction of stearoyl-CoA desaturase 1 and 2 genes by fibrates in the liver of rats[J]. Biol Pharm Bull, 2012, 35: 116-120. DOI:10.1248/bpb.35.116 |
| [47] |
Southam AD, Khanim FL, Hayden RE, et al. Drug redeployment to kill leukemia and lymphoma cells by disrupting SCD1-mediated synthesis of monounsaturated fatty acids[J]. Cancer Res, 2015, 75: 2530-2540. DOI:10.1158/0008-5472.CAN-15-0202 |
| [48] |
Zhang H, Li H, Ho N, et al. SCD1 plays a tumor-suppressive role in survival of leukemia stem cells and the development of chronic myeloid leukemia[J]. Mol Cell Biol, 2012, 32: 1776-1787. DOI:10.1128/MCB.05672-11 |
| [49] |
von Roemeling CA, Marlow LA, Wei JJ, et al. Stearoyl-CoA desaturase 1 is a novel molecular therapeutic target for clear cell renal cell carcinoma[J]. Clin Cancer Res, 2013, 19: 2368-2380. DOI:10.1158/1078-0432.CCR-12-3249 |
| [50] |
Pisanu ME, Noto A, De Vitis C, et al. Blockade of stearoyl-CoA-desaturase 1 activity reverts resistance to cisplatin in lung cancer stem cells[J]. Cancer Lett, 2017, 406: 93-104. DOI:10.1016/j.canlet.2017.07.027 |
| [51] |
Carracedo A, Cantley LC, Pandolfi PP. Cancer metabolism: fatty acid oxidation in the limelight[J]. Nat Rev Cancer, 2013, 13: 227-232. DOI:10.1038/nrc3483 |
| [52] |
Hossain F, Al-Khami AA, Wyczechowska D, et al. Inhibition of fatty acid oxidation modulates immunosuppressive functions of myeloid-derived suppressor cells and enhances cancer therapies[J]. Cancer Immunol Res, 2015, 3: 1236-1247. DOI:10.1158/2326-6066.CIR-15-0036 |
| [53] |
Schlaepfer IR, Joshi M. CPT1A-mediated fat oxidation, mechanisms, and therapeutic potential[J]. Endocrinology, 2020, 161: bqz046. DOI:10.1210/endocr/bqz046 |
| [54] |
Corbet C, Feron O. Emerging roles of lipid metabolism in cancer progression[J]. Curr Opin Clin Nutr Metab Care, 2017, 20: 254-260. DOI:10.1097/MCO.0000000000000381 |
| [55] |
Ceccarelli SM, Chomienne O, Gubler M, et al. Carnitine palmitoyltransferase (CPT) modulators: a medicinal chemistry perspective on 35 years of research[J]. J Med Chem, 2011, 54: 3109-3152. DOI:10.1021/jm100809g |
| [56] |
Price N, van der Leij F, Jackson V, et al. A novel brain-expressed protein related to carnitine palmitoyltransferase I[J]. Genomics, 2002, 80: 433-442. DOI:10.1006/geno.2002.6845 |
| [57] |
Zhang MY, Du TT, Ji M, et al. Research progress of carnitine palmitoyltransferase 1 in tumor immunotherapy[J]. Acta Pharm Sin (药学学报), 2019, 54: 1824-1830. |
| [58] |
Gatza ML, Silva GO, Parker JS, et al. An integrated genomics approach identifies drivers of proliferation in luminal-subtype human breast cancer[J]. Nat Genet, 2014, 46: 1051-1059. DOI:10.1038/ng.3073 |
| [59] |
Valentino A, Calarco A, Di Salle A, et al. Deregulation of microRNAs mediated control of carnitine cycle in prostate cancer: molecular basis and pathophysiological consequences[J]. Oncogene, 2017, 36: 6030-6040. DOI:10.1038/onc.2017.216 |
| [60] |
Ricciardi MR, Mirabilii S, Allegretti M, et al. Targeting the leukemia cell metabolism by the CPT1a inhibition: functional preclinical effects in leukemias[J]. Blood, 2015, 126: 1925-1929. |
| [61] |
Gugiatti E, Tenca C, Ravera S, et al. A reversible carnitine palmitoyltransferase (CPT1) inhibitor offsets the proliferation of chronic lymphocytic leukemia cells[J]. Haematologica, 2018, 103: e531-e536. DOI:10.3324/haematol.2017.175414 |
| [62] |
Shi J, Fu H, Jia Z, et al. High expression of CPT1A predicts adverse outcomes: a potential therapeutic target for acute myeloid leukemia[J]. EBioMedicine, 2016, 14: 55-64. DOI:10.1016/j.ebiom.2016.11.025 |
| [63] |
Liu PP, Liu J, Jiang WQ, et al. Elimination of chronic lymphocytic leukemia cells in stromal microenvironment by targeting CPT with an antiangina drug perhexiline[J]. Oncogene, 2016, 35: 5663-5673. DOI:10.1038/onc.2016.103 |
| [64] |
Yamamoto K, Abe S, Honda A, et al. Fatty acid beta oxidation enzyme HADHA is a novel potential therapeutic target in malignant lymphoma[J]. Lab Invest, 2020, 100: 353-362. DOI:10.1038/s41374-019-0318-6 |
| [65] |
Glatz JF, Luiken JJ, Bonen A. Membrane fatty acid transporters as regulators of lipid metabolism: implications for metabolic disease[J]. Physiol Rev, 2010, 90: 367-417. DOI:10.1152/physrev.00003.2009 |
| [66] |
Yoshida Y, Jain SS, McFarlan JT, et al. Exercise- and training-induced upregulation of skeletal muscle fatty acid oxidation are not solely dependent on mitochondrial machinery and biogenesis[J]. J Physiol, 2013, 591: 4415-4426. DOI:10.1113/jphysiol.2012.238451 |
| [67] |
Zhang T, Yang J, Vaikari VP, et al. Apolipoprotein C2-CD36 promotes leukemia growth and presents a targetable axis in acute myeloid leukemia[J]. Blood Cancer Discov, 2020, 1: 198-213. DOI:10.1158/2643-3230.BCD-19-0077 |
| [68] |
Farge T, Saland E, de Toni F, et al. Chemotherapy-resistant human acute myeloid leukemia cells are not enriched for leukemic stem cells but require oxidative metabolism[J]. Cancer Discov, 2017, 7: 716-735. DOI:10.1158/2159-8290.CD-16-0441 |
| [69] |
Rozovski U, Harris DM, Li P, et al. STAT3-activated CD36 facilitates fatty acid uptake in chronic lymphocytic leukemia cells[J]. Oncotarget, 2018, 9: 21268-21280. DOI:10.18632/oncotarget.25066 |
| [70] |
Ladanyi A, Mukherjee A, Kenny HA, et al. Adipocyte-induced CD36 expression drives ovarian cancer progression and metastasis[J]. Oncogene, 2018, 37: 2285-2301. DOI:10.1038/s41388-017-0093-z |
| [71] |
Pascual G, Avgustinova A, Mejetta S, et al. Targeting metastasis-initiating cells through the fatty acid receptor CD36[J]. Nature, 2017, 541: 41-45. DOI:10.1038/nature20791 |
| [72] |
Gorres KL, Raines RT. Prolyl 4-hydroxylase[J]. Crit Rev Biochem Mol Biol, 2010, 45: 106-124. DOI:10.3109/10409231003627991 |
| [73] |
German NJ, Yoon H, Yusuf RZ, et al. PHD3 loss in cancer enables metabolic reliance on fatty acid oxidation via deactivation of ACC2[J]. Mol Cell, 2016, 63: 1006-1020. DOI:10.1016/j.molcel.2016.08.014 |
| [74] |
Rawluszko A A, Bujnicka KE, Horbacka K, et al. Expression and DNA methylation levels of prolyl hydroxylases PHD1, PHD2, PHD3 and asparaginyl hydroxylase FIH in colorectal cancer[J]. BMC Cancer, 2013, 13: 526. DOI:10.1186/1471-2407-13-526 |
 2021, Vol. 56
2021, Vol. 56


