2. 中国中医科学院中药资源中心, 北京 100700
2. National Resource Center for Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China
中药续断来源于川续断科川续断植物Dipsacus asper Wall.ex Henry的干燥根, 具有补肝肾、强筋骨的功效[1], 为历版《中国药典》收载。续断药材主要含有皂苷类、生物碱、环烯醚萜类等化学成分[2], 其中川续断皂苷VI是评价续断药材质量的指标性成分(图 1)。现代研究表明, 其在临床上续断不仅常用于骨科疾病的治疗, 在保护神经、促进血管生成等方面也有药理作用[3, 4]。近年来, 随着市场需求量增大, 川续断野生资源逐年减少, 目前在湖北、四川、河南及贵州等地已有人工种植[5], 但由于环境和人为等多因素的影响, 不同产地甚至同一产地不同区域下川续断皂苷VI的含量差异均较大[6]。因此, 提高栽培川续断皂苷的含量, 稳定药材质量, 对提高临床疗效十分有必要。
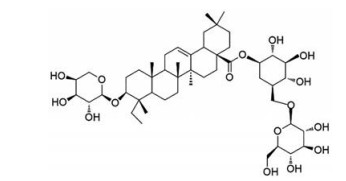
|
Figure 1 Chemical structure of asperosaponin VI |
MeJA是由脂肪酸衍生而来的一种环戊酮类化合物, 常作为植物诱导剂使用。有研究表明, 施加MeJA后, 植物体内会迅速积累大量MDA与活性氧(如超氧化物阴离子), 从而对植物的生长发育造成影响。为了维持机体正常的生理代谢活动, 植物体内抗氧化酶(如SOD) 的活性会发生相应变化, 同时会增加植物次生代谢产物的合成共同对抗外界的逆境胁迫[7]。如Shadi等[8]用外源MeJA处理人参的不定根后, 结果表明人参皂苷合成相关基因与对照组相比表达量上调, 促进含量显著上升。Wang等[9]发现在MeJA调控下人参发状根皂苷合成相关基因表达上调, 从而促进人参皂苷含量的积累。但MeJA是否能调控川续断根中川续断皂苷Ⅵ的合成与积累, 目前还未见相关报道, 因此, 本研究以川续断为实验材料, 研究MeJA对川续断根中川续断皂苷Ⅵ含量积累的影响, 旨在为深入探讨川续断皂苷Ⅵ的合成奠定基础。
材料与方法植物材料 川续断种子于2018年12月采自贵州省龙里县, 经贵州中医药大学江维克教授鉴定为川续断Dipsacus asper Wall.ex Henry的成熟种子。晾干后挑选颗粒饱满、无虫蛀的种子播种, 将生长健壮、长势一致的川续断幼苗移栽到育苗盘中, 加入MS液体培养液培养3周, 将外观形态, 长势优良的幼苗作为实验植物材料。
仪器和试剂 高效液相色谱仪(Waters e2695, 美国Waters公司); 实时荧光定量分析仪(CFX96 Real-Time System); 川续断皂苷VI对照品(批号: 111685-201305, 中国药品生物制品检定所); 茉莉酸甲酯(MeJA, 索莱宝生物技术有限公司); MDA、SOD试剂盒(苏州科铭生物技术有限公司); 超氧化物阴离子荧光探针(上海碧云天生物技术有限公司); Eastep® Super总RNA提取试剂盒(上海普洛麦格生物产品有限公司); M-MLV反转录试剂盒、TB Green® premix Ex TaqTMⅡ试剂盒(Takara生物技术有限公司)。
材料处理 在MS液体培养基中分别添加50、100、150、200、300 μmol·L-1的MeJA对川续断幼苗进行处理, 添加等量无水乙醇为对照, 24 ℃条件下光照培养。除MeJA施加浓度不同外, 其他条件均保持一致。于MeJA处理1、3、5天后, 分别取叶和根, 叶片用于SOD活性及MDA含量的测定。根一部分用于总RNA的提取及超氧化物阴离子荧光检测, 另一部分干燥, 磨粉, 用于川续断皂苷Ⅵ含量测定。每个实验3个生物学重复。
样品处理 取川续断根干燥粉末0.01 g, 精密称定, 置于2 mL离心管中, 精密加入甲醇2 mL, 超声(功率100 W, 频率40 kHz) 30 min, 放冷, 离心, 取上清1.5 mL, 挥干, 溶于0.3 mL甲醇后用微孔滤膜过滤, 即得。
对照品溶液的制备 取川续断皂苷VI对照品适量, 精密称定, 置于10 mL容量瓶中, 用甲醇溶解定容至刻度, 并稀释至浓度为0.149 8 mg·mL-1的对照品溶液。
川续断皂苷Ⅵ含量检测方法 色谱柱为C18 (Wondasil C18, 5 μm, 4.6 mm×250 mm); 流动相为乙腈-0.1%磷酸水(30∶70); 检测波长212 nm; 柱温30 ℃; 流速1 mL·min-1; 检测时间20 min; 进样量20 μL。外标一点法进行含量计算。
MDA含量测定 称取新鲜叶片约0.1 g于2 mL离心管中, 加入1 mL提取液, 冰浴匀浆, 离心, 取上清, 置冰上待测。实验过程参照MDA含量试剂盒说明书, 吸取200 μL上清液于96孔板中, 测定532 nm和600 nm处的吸光度, 记为A532和A600, ΔA = A532 - A600。MDA含量(nmol·g-1鲜重) = 5 136 × ΔA/W (W为叶片鲜重)。
SOD活性测定 参考超氧化物歧化酶试剂盒说明书(NBT法), 提取方法同上, 按照试剂盒说明书依次在96孔板中添加反应试剂, 充分混匀, 静置30 min, 在560 nm处测定各管吸光值A。抑制百分率= (A对照管 - A测定管) / A对照管× 100%, SOD活性(U·g-1鲜重) = 11.11 ×抑制百分率/ (1 - 抑制百分率) / W (W为叶片鲜重)。
超氧化物阴离子荧光检测 分别于MeJA处理后1、3、5天取根, 用浓度为5 μmol·L-1的超氧化物阴离子荧光探针(DHE) 与根染色30 min进行荧光探针装载, 用PBS缓冲液洗涤, 荧光显微镜下观察, 拍照。
总RNA的提取及cDNA合成 参照Eastep® Super总RNA提取试剂盒说明书提取川续断根的总RNA并检测完整性, 微量核酸定量分析仪检测浓度和纯度。以川续断总RNA为模板, 合成cDNA。
川续断皂苷Ⅵ合成关键酶基因的获取 从实验室已有的川续断转录组数据库中检索获得三萜皂苷合成关键酶基因, 并结合美国国立生物技术信息中心(NCBI) 数据库进行同源比对, 对基因进行鉴定。
引物设计及实时荧光定量PCR分析 用Premier Premier 5.0设计实时荧光定量PCR特异引物, 见表 1。以川续断DaACT103为内参基因[10], 参照TB Green® premix Ex TaqTMⅡ试剂盒说明书进行RT-qPCR, 用2-ΔCt计算基因表达量。
| Table 1 Primer information of RT-qPCR |
数据整理及软件分析 利用SPSS 26.0分析数据, GraphPad Prism5.0统计作图。
结果与分析 1 MeJA对根中川续断皂苷Ⅵ含量的影响不同浓度MeJA处理后川续断根中川续断皂苷VI含量的积累如图 2所示。在处理第1天时, 50、150、200、300 μmol·L-1的根中川续断皂苷VI的含量分别为0.038%、0.025%、0.023%、0.027%, 均高于对照组(0.020%)。随着处理时间的增加, 采用浓度为100、150、200 μmol·L-1的MeJA处理3天后, 根中川续断皂苷VI的含量均升高, 其中用150 μmol·L-1的MeJA处理后川续断皂苷VI的含量达到0.147%, 为对照的2.16倍。在处理时间达到第5天时, 50、150 μmol·L-1的MeJA处理后川续断皂苷VI的含量与对照相比升高, 但低于处理第3天的含量。综上所述, 150 μmol·L-1的MeJA处理川续断3天后, 能极显著促进根中川续断皂苷VI含量的增加。
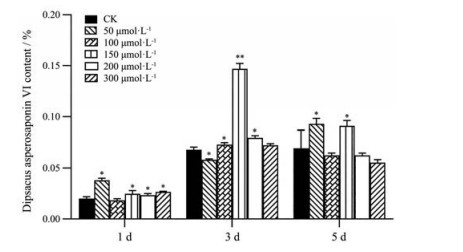
|
Figure 2 The content of Dipsacus asperosaponin VI in D. asper roots treated by different MeJA concentrations. *P < 0.05, **P < 0.01 vs control (CK). d: Day(s) |
检测川续断幼苗叶片中MDA含量及SOD活性的变化, 如图 3所示。在150 μmol·L-1的MeJA处理下, 处理组的MDA含量显著高于对照组; 而SOD活性在处理第1和3天时显著低于对照组, 在第5天时二者相差不大, 说明MeJA处理使川续断细胞膜系统受到了不同程度的氧化伤害, 外源施加MeJA对川续断造成了一定的逆境胁迫。
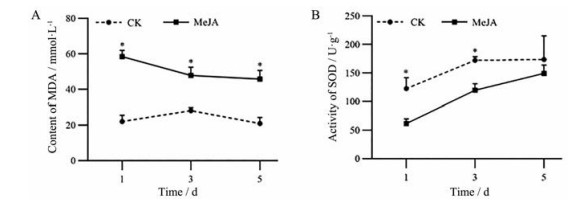
|
Figure 3 The effect of MeJA on MDA (A) content and SOD (B) activity of D. asper leaves. *P < 0.05 vs control |
结果如图 4所示, 用浓度为150 μmol·L-1的MeJA处理1、3、5天后, 处理组(分别为14.32%、9.95%、10.67%) 的红色荧光强于对照组(6.07%、4.46%、6.04%), 即与对照相比, MeJA处理使根中超氧化物阴离子升高。其中在处理第1天时红色荧光最明显, 到第3天和第5天时红色荧光强度减弱, 说明川续断的根在MeJA处理第1天时川续断根细胞内超氧化物阴离子水平较高, 到第3天和第5天时超氧化物阴离子水平减弱, 最终达到平稳状态。
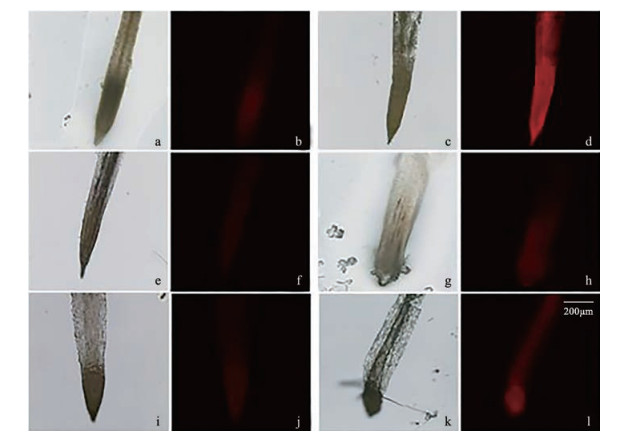
|
Figure 4 After MeJA treatment, the superoxide anion in the roots of D. asper was detected by fluorescence using dihydroethidium. (c, d), (g, h), (k, l) are the first, third and fifth days of treatment; (a, b), (e, f), (i, j) were the first, third and fifth days of the control |
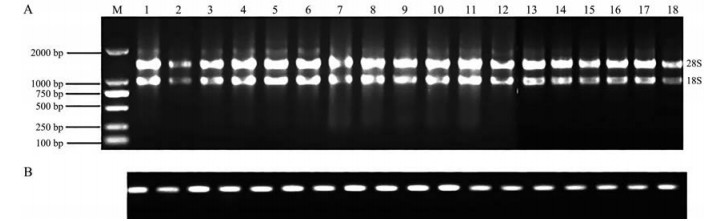
提取川续断根的总RNA (图 5A), 用内参DaACT103检测cDNA模板质量, 结果显示内参基因在各cDNA模板中表达一致, 表明反转录的cDNA可用于后续基因表达定量分析(图 5B)。
|
Figure 5 Electrophoresis of total RNA of D. asper (A) and cDNA quality detection (B). 1-3, 7-9, 13-15 were the first, third and fifth days of the control. 4-6, 10-12, 16-18 are the first, third and fifth days of treatment |
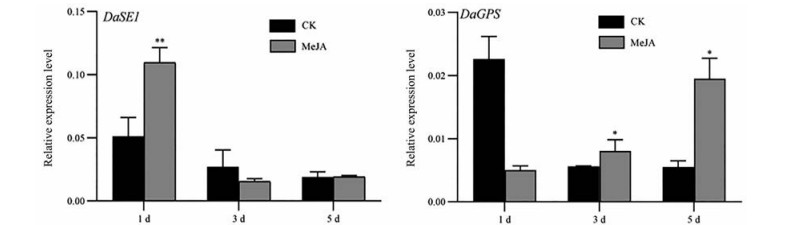
MeJA对川续断皂苷Ⅵ合成关键酶基因DaSE1、DaGPS表达量的影响, 如图 6所示。在MeJA处理第1天时, DaSE1基因的表达量显著升高, 为对照组的2.05倍; DaGPS基因的表达量在第5天时达到最大值, 为对照的3.54倍。
|
Figure 6 Expression of key enzyme genes of Dipsacus asperosaponin VI after MeJA treatment at different time. *P < 0.05, **P < 0.01 vs control |
川续断皂苷Ⅵ为三萜皂苷类化合物。目前, 有大量研究表明, 外源添加MeJA可上调三萜类化合物合成相关基因的表达, 从而促进三萜类化合物的合成[11]。本研究通过不同浓度梯度的MeJA处理川续断后, 发现不同浓度的MeJA对川续断皂苷Ⅵ含量积累的影响不同, 其中采用浓度为150 μmol·L-1的MeJA处理3天后, 能极显著的增加川续断根中川续断皂苷Ⅵ的含量。
杨英等[11]等研究发现采用外源MeJA诱导悬浮培养的胀果甘草细胞后, 细胞中MDA的含量升高。MDA是植物细胞膜系统受到伤害的重要标志之一, 其含量与超氧化物阴离子产生的速率密切相关[12]。本研究表明, MeJA处理后, 川续断叶片中MDA的含量与根中超氧化物阴离子产生速率的变化一致, 随着超氧化物阴离子产生速率增加, MDA的含量升高, SOD活性降低, 说明在MeJA处理下, 川续断细胞膜受损, 植株生长状态变差。
已有研究表明, 三萜皂苷生物合成途径主要由上游的前体形成、中游的骨架构建及下游后修饰三部分组成。其中香叶二磷酸合成酶(GPS) 是上游的一个关键酶, 能催化上游前体物质异戊二烯焦磷酸(IPP) 和二甲基烯丙基焦磷酸(DMAPP) 合成牻牛儿基二磷酸GPP[13]。鲨烯环氧酶(SE) 是碳环骨架合成及构建的一个关键酶, 前体物质鲨烯在SE的作用下形成2, 3-氧化鲨烯(2, 3-oxidosqualene), 再由不同的OSCs催化形成各种类型的三萜或甾醇类产物[14]。在本研究中, 外源施加MeJA后, 根中川续断皂苷Ⅵ的含量升高, 同时川续断皂苷Ⅵ合成关键酶基因DaGPS、DaSE1的表达量与对照相比升高。由此推测, 川续断皂苷Ⅵ含量的增加与其合成代谢途径中关键酶基因的表达量升高有关。
本研究认为通过外源对川续断幼苗施加MeJA, 造成一定的逆境胁迫, 促使植物上调川续断根中川续断皂苷Ⅵ合成关键酶基因表达, 使根系中代谢生成更多川续断皂苷Ⅵ来适应胁迫。本研究为进一步探讨川续断皂苷Ⅵ的合成机制奠定了基础。
作者贡献: 徐娇、肖承鸿设计了本实验; 胡正平和周冰清完成了川续断的种植、处理及相关指标的检测; 张进强指导相关图片的制作; 胡正平完成了数据分析、论文初稿的写作; 徐娇、周涛、江维克及郭娟共同指导论文的写作与修改。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. Vol 1. Beijing: China Medical Science Press, 2020: 343.
|
| [2] |
Wang Q, Liu EW, Han LF, et al. Chemical constituents of Dipsacus asper[J]. Acta Pharm Sin (药学学报), 2013, 48: 1124-1127. |
| [3] |
Wang C, Lou Y, Tong M, et al. Asperosaponin VI promotes angiogenesis and accelerates wound healing in rats via up-regulating HIF-1α/VEGF signaling[J]. Acta Pharmacol Sin, 2018, 39: 393-404. DOI:10.1038/aps.2017.161 |
| [4] |
Ke K, Li Q, Yang X, et al. Asperosaponin VI promotes bone marrow stromal cell osteogenic differentiation through the PI3K/AKT signaling pathway in an osteoporosis model[J]. Sci Rep, 2016, 6: 35233. DOI:10.1038/srep35233 |
| [5] |
Chen DX, Zhang X, Li LY, et al. Research progress on germplasm resources of Dipsacus asperoides[J]. China Pharm Med Sin (中华中医药杂志), 2019, 34: 5300-5304. |
| [6] |
Jiang WK, Zhou T, Xiao CH, et al. A novel method for germplasm diversity evaluation of medicinal plant based on chemical fingerprint: a case study on Dipsacus asper[J]. Mod Chin Med (中国现代中药), 2014, 16: 813-818. |
| [7] |
Tan ZW, Li L, Yang HQ, et al. The mechanism of methyl jasmonate-induced accumulation of hydroxysafflor yellow A in safflower of different colors[J]. Acta Pharm Sin (药学学报), 2020, 55: 2982-2988. |
| [8] |
Shadi R, Yu-Jin K, Johan S, et al. PgLOX6 encoding a lipoxygenase contributes to jasmonic acid biosynthesis and ginsenoside production in Panax ginseng[J]. J Exp Bot, 2016, 67: 6007-6019. DOI:10.1093/jxb/erw358 |
| [9] |
Wang KY, Yu LL, Zhang MP, et al. Research of genes expression related to ginsenosides biosynthesis by methyl jasmonic acid in ginseng hair roots[J]. China J Chin Mater Med (中国中药杂志), 2017, 42: 2269-2275. |
| [10] |
Liang Q, Xu J, Xiao CH, et al. Cloning and expression stability analysis of actin, tublin and GAPDH genes in Dipsacus asper[J]. Chin Tradit Herb Drugs (中草药), 2020, 51: 5571-5578. |
| [11] |
Yang Y, Zheng H, He F, et al. The effects of methyl jasmonate on the flavonoids synthesis in cell suspension culture of Glycyrrhiza inflata (Leguminosae)[J]. Acta Bot Yunnan (云南植物研究), 2008, 30: 586-592. |
| [12] |
Liu BR, Zhen CD, Xiao HD, et al. Effects of boron on superoxide dismutase activity, superoxide anion production rate and malondialdehyde content in turfgrass[J]. J Huazhong Agric Univ (华中农业大学学报), 2008, 27: 378-381. |
| [13] |
Zhao HW, Ge F, Sun Y, et al. Transcription factors involved in plant terpenoid biosynthesis and their application prospect[J]. Chin Tradit Herb Drugs (中草药), 2012, 43: 2512-2519. |
| [14] |
Xiong MJ, Tang Q, Ma XJ. Biosynthesis of triterpene glycoside in Lo Han Kuo[J]. J Guangdong Pharm Univ (广东药学院学报), 2011, 27: 543-548. |
 2021, Vol. 56
2021, Vol. 56


