2. 中药资源教育部工程研究中心, 北京 100193
2. Engineering Research Center of Chinese Medicine Resources, Ministry of Education, Beijing 100193, China
苦杏仁(Armeniacae Semen Amarum, ASA) 始载于《神农本草经》, 是药食两用品种。其来源于蔷薇科植物山杏Prunus armeniaca L. var. ansu Maxim.、西伯利亚杏P. sibirica L.、东北杏P. mandshurica (Maxim.) Koehne或杏P. armeniaca L.的干燥成熟种子, 具有降气止咳平喘、润肠通便的功效, 用于治疗咳嗽气喘、胸满痰多、肠燥便秘[1]。现代研究表明苦杏仁中的化学成分为苦杏仁苷、脂肪、纤维素、蛋白质和糖类等[2], 具有免疫调节、抗炎镇痛、抗肿瘤和抗纤维化等药理作用[3]。在新型冠状病毒肺炎(coronavirus disease 2019, COVID-19) 的临床治疗中, 苦杏仁是最常用的中药之一[4]。
黄曲霉毒素(Aflatoxins, AF) 是中药材中常见的污染真菌毒素之一, 主要包括B1、B2、G1、G2四种, 其中B1的毒性最强, 对人类健康造成严重威胁[5]。苦杏仁富含油脂等丰富的营养物质, 其在采收、加工和贮藏等多个环节中容易污染真菌而发生霉变, 在适宜条件下所污染的产毒真菌还会产生真菌毒素。有研究报道苦杏仁中污染真菌和黄曲霉毒素严重, 且有样品检测出AFB1超过限量标准[6, 7], 威胁到临床用药安全。此外, 不同炮制规格的苦杏仁样品污染黄曲霉毒素情况存在差异, 研究表明去种皮的苦杏仁比未去种皮的苦杏仁更容易污染黄曲霉毒素[8]。因此, 有必要对中药材苦杏仁中污染真菌进行快速准确鉴定, 为药材安全使用提供风险预警。
Taberlet等[9]于2012年提出了DNA宏条形码(DNA metabarcoding) 的概念, 即对环境样本(土壤、水、粪便等) 中提取的总DNA和典型的降解DNA进行高通量测序, 实现多物种(或更高水平分类单元) 的鉴定。在高通量测序技术和生物信息学分析手段的有力支持下, DNA宏条形码技术使混合样品中多物种的分类鉴定成为可能[9]。近年来, 该技术已广泛应用于微生物群落多样性分析中[10-12], 为中药材污染真菌多样性分析提供了新的思路。本研究应用DNA宏条形码技术对不同收集地和不同炮制规格的苦杏仁中污染真菌多样性进行分析, 为其安全使用提供参考依据。
材料与方法材料 从河北安国、安徽亳州和成都荷花池3个药材市场收集燀苦杏仁药材各2批, 从山东舜王城药材市场收集生苦杏仁、燀苦杏仁和炒苦杏仁3种规格的药材各2批。将燀苦杏仁样品按照不同收集地分为AG (安国)、BZ (亳州)、HH (荷花池)、SW (舜王城) 4组, 并将收集于舜王城药材市场的样品按照不同炮制规格分为P (燀苦杏仁)、C (炒苦杏仁)、S (生苦杏仁) 3组(表 1)。
| Table 1 Voucher information for the Armeniacae Semen Amarum (ASA) samples in this study |
DNA提取 称取约5 g苦杏仁样品于15 mL离心管中, 加入10 mL磷酸缓冲盐溶液(phosphate buffer saline, PBS), 涡旋振摇5 min, 用单层无菌纱布进行过滤, 滤液用高速冷冻离心机(湖南赫西仪器装备有限公司, 中国, 型号: 3H20RI) 以最大转速离心20 min获得微生物。根据EZNA®土壤DNA提取试剂盒(Omega公司, 美国, 型号: D5625-01) 说明书提取微生物总DNA。
PCR扩增和高通量测序 提取所获DNA经检验合格后, 扩增真菌ITS2序列, 扩增引物为ITS3F (5′-GCATCGATGAAGAACGCAGC-3′) 和ITS4R (5′-TCC TCCGCTTATTGATATGC-3′)[13]。PCR扩增体系为20 μL: 5×FastPfu Buffer 4 μL, 2.5 mmol·L-1 dNTPs 2 μL, 正反向引物各0.8 μL, FastPfu Polymerase 0.4 μL, BSA 0.2 μL, 模板DNA10 ng, 加ddH2O补足。PCR扩增程序如下: 95 ℃变性3 min; 再进行35个循环(95 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸45 s); 最后72 ℃延伸10 min。PCR产物取3 μL用2%琼脂糖凝胶电泳检测, 使用DNA凝胶回收试剂盒(Axygen公司, 美国) 切胶回收PCR产物, Tris-HCl洗脱; 2%琼脂糖电泳检测。采用Illumina MiSeq PE300测序平台对PCR产物进行高通量测序。
数据分析 采用Quantitative Insights into Microbial Ecology (QIIME, version 1.9.1, http://qiime.org) 软件对测得的fq数据进行过滤处理[14]。利用UPARSE (version 7.1, http://drive5.com/uparse/)[15]基于97%的相似度水平对所有序列进行OTU聚类, 使用USEARCH (version 8.1.1861, http://www.drive5.com/usearch/)[16]去除嵌合体。采用RDP classifier贝叶斯算法对OTU代表序列进行分类学分析, 基于UNITE 8.0数据库[17]在界、门、纲、目、科、属和种水平注释群落物种信息。基于国际核苷酸序列数据库(International Nucleotide Sequence Database, INSD), 以100%序列相似性为标准, 通过手动BLAST对总丰度前20的OTU在种水平的分类进行验证。利用mothur[18]进行稀释性曲线(rarefaction curve) 分析, 使用Venn图统计不同分组样本中共有和独有OTU数目。采用Chao 1、Ace、Shannon、Simpson指数来估计群落的Alpha多样性。基于主坐标分析(principal co-ordinates analysis, PCoA) 阐明不同样本组成的相似性。选用单因素方差分析(one-way ANOVA) 比较不同分组样品中真菌群落分布在不同分类水平是否存在显著性差异。利用R语言工具制作曲线图。
结果 1 苦杏仁中真菌多样性分析质控后, 各样本中有效ITS2序列为51 624~73 468条, 总序列数为780 218条, 平均序列长度为349 bp。稀释性曲线分析图中所有样品几乎平行于x轴, 表明获得的reads数量足以代表总体真菌群落多样性(图 1)。剔除非真菌OTU后, 在12份苦杏仁样品中共获得262个OTU。4个药材市场的燀苦杏仁样品中共有OTU为43个, 独有OTU分别为11、35、45和5个。荷花池药材市场样品的OTU数量最多, 而舜王城药材市场样品的OTU数量最少(图 2a)。在来源于舜王城药材市场的3种不同炮制规格样品中共有OTU为45个, 独有OTU分别为56、5和18个。生苦杏仁样品中OTU数量最多, 而燀苦杏仁样品中OTU数量最少(图 2b)。基于Chao 1、Ace、Shannon、Simpson指数来估计群落的Alpha多样性, 其中Chao1和Ace用来反映样品中群落丰富度, Shannon和Simpson用来反映样品中群落多样性。样品SW1_S和SW2_P分别具有最高的Chao1和Ace指数, 物种丰富度最高。样品HH1 Shannon指数最高且Simpson指数最低, 物种多样性最高(表 2)。基于Bray-Curtis距离矩阵的PCoA分析的结果表明, 对于4个药材市场收集的燀苦杏仁样品, 同一收集地的两样本物种组成更为相似(图 3a)。类似地, 舜王城药材市场所收集样本中相同炮制规格的两样本物种组成更为相似(图 3b)。
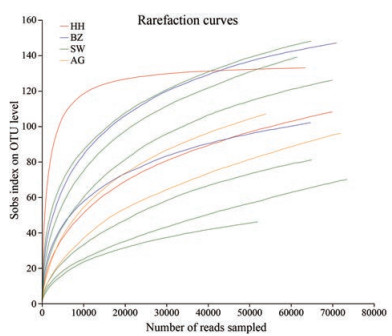
|
Figure 1 Rarefaction curves of OTUs for the ASA samples |
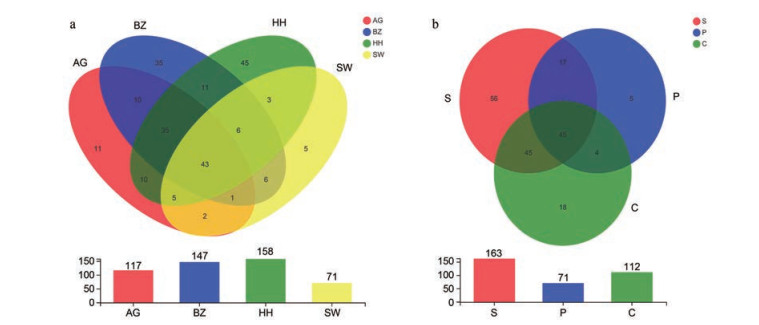
|
Figure 2 Venn diagram of OTUs in the ASA samples from different collection sites (a) and processing approaches (b) |
| Table 2 Alpha diversity of the fungal community in the ASA samples |
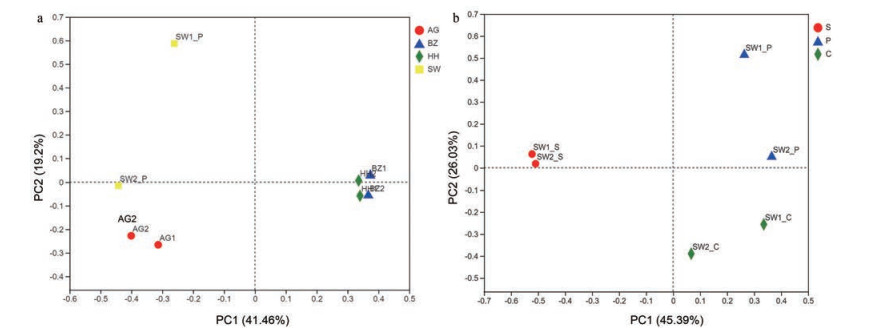
|
Figure 3 PCoA plots based on Bray-Curtis distance matrix in the ASA samples from different collection sites (a) and processing approaches (b) |
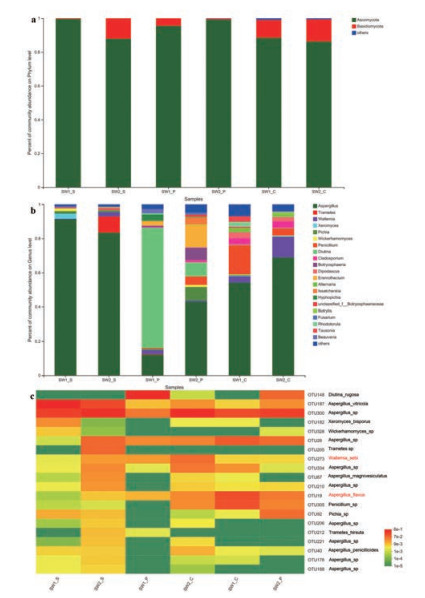
在4个药材市场收集的燀苦杏仁中, 共检测到来源于5门16纲34目77科123属的真菌。在门水平, 子囊菌门Ascomycota是最优势菌门(68.57%~99.20%), 其次是担子菌门Basidiomycota (0.35%~28.63%) (图 4a)。在纲水平, 除样品SW1_P和HH1中最优势菌群分别为酵母纲Saccharomycetes (77.81%) 和座囊菌纲Dothideomycetes (31.90%) 外, 散囊菌纲Eurotiomycetes (49.20%~94.54%) 在其余样品中占据最优势地位。在目水平, 除样品SW1_P中最优势菌群为酵母目Saccharomycetales (77.81%) 外, 其余样品中散囊菌目Eurotiales (27.31%~94.54%) 相对丰度最高。在属水平, 除样品SW1_P中最优势菌群为Diutina (70.07%) 外, 其他样品以曲霉属Aspergillus (25.86%~93.86%) 为最优势菌群。此外, Kazachstania (17.10%) 和青霉属Penicillium (16.45%) 是样品AG2中的优势属, 节担菌属Wallemia (16.54%) 和链格孢属Alternaria (11.83%) 是样品HH1中的优势属, 假囊酵母属Eremothecium (13.20%) 是样品SW2_P中的优势属(图 4b)。共准确鉴定到3种有害真菌, 分别是黄曲霉Aspergillus flavus (0.12%~9.06%)、Wallemia sebi (0.18%~7.88%) 和少根根霉Rhizopus arrhizus (0~3.81%) (图 4c)。与其他3个药材市场相比, 亳州药材市场的燀苦杏仁药材中有害真菌总相对丰度更高。
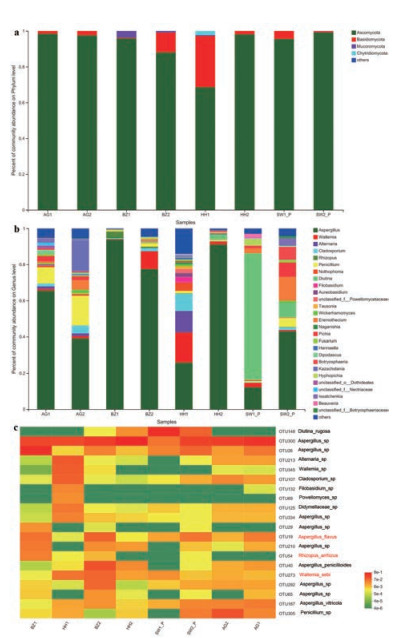
|
Figure 4 Fungal composition of the ASA samples from different collection sites at the phylum (a), genus (b), and OTU (c) levels |
在源自舜王城药材市场的3种炮制规格样品中, 检测到来自3门11纲28目61科95属的真菌。在门水平, 子囊菌门Ascomycota是最优势菌门(86.29%~99.65%), 其次是担子菌门Basidiomycota (0.35%~13.09%) (图 5a)。在纲和目水平, 除样品SW1_P中最优势菌群为酵母纲Saccharomycetes (77.81%) 和酵母目Saccharomycetales (77.81%) 外, 散囊菌纲Eurotiomycetes (49.20%~94.53%) 和散囊菌目Eurotiales (49.00%~94.49%) 在其余样品中占据最优势地位。在科水平, 除样品SW1_P外, 其余样品中曲霉科Aspergillaceae相对丰度最高(48.00%~94.44%)。在属水平, 除样品SW1_P中最优势菌群为Diutina (70.07%) 外, 其他样品以曲霉属Aspergillus (43.00%~91.22%) 为最优势菌群。此外, 与生苦杏仁样品相比, 燀苦杏仁样品中Diutina和假囊酵母属Eremothecium相对丰度更高, 炒苦杏仁样品中节担菌属Wallemia、青霉属Penicillium、枝孢属Cladosporium和双足囊菌属Dipodascus相对丰度更高(图 5b)。共准确鉴定到2种有害真菌, 分别是黄曲霉Aspergillus flavus (0.05%~16.42%) 和Wallemia sebi (0.26%~7.15%)。与生苦杏仁相比, 燀苦杏仁和炒苦杏仁中的黄曲霉相对丰度更高(图 5c)。
|
Figure 5 Fungal composition of the ASA samples from different processing approaches at the phylum (a), genus (b), and OTU (c) levels |
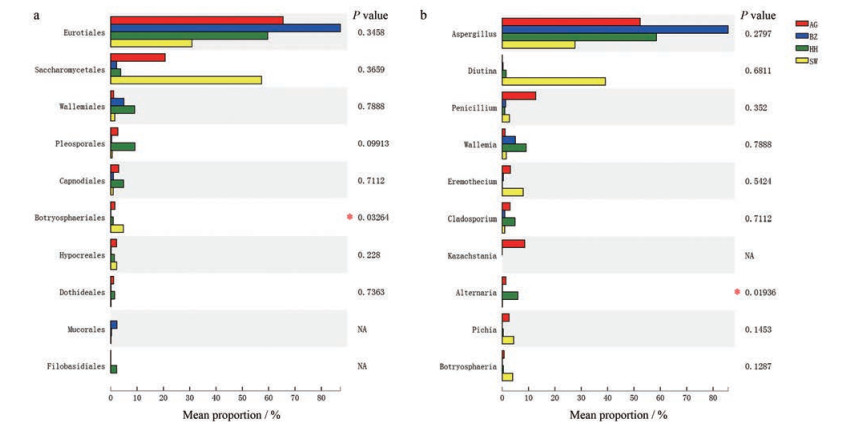
单因素方差分析结果表明, 收集于4个药材市场的燀苦杏仁中真菌群落在目水平和属水平均存在显著差异。舜王城药材市场样品中葡萄座腔菌目Botryosphaeriales的相对丰度显著高于其他药材市场的样品(图 6a), 荷花池药材市场样品中链格孢属Alternaria的相对丰度显著高于其他药材市场的样品(图 6b)。
|
Figure 6 Significant difference among the ASA samples from different collection sites at the order (a) and genus (b) levels. Statistical analysis was performed by the one-way ANOVA method. *P < 0.05 |
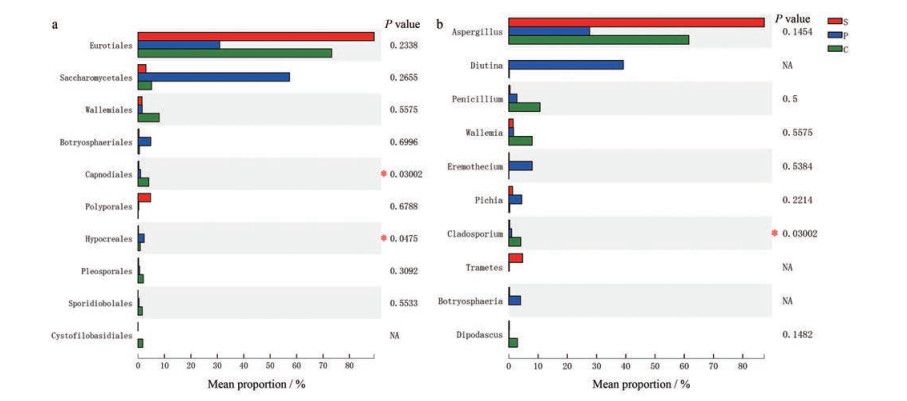
此外, 舜王城药材市场3种不同炮制规格的样品中真菌群落在目水平和属水平上也存在显著差异。在目水平, 炒苦杏仁样品中煤炱目Capnodiales的相对丰度显著高于生苦杏仁和燀苦杏仁, 而燀苦杏仁样品中肉座菌目Hypocreales的相对丰度显著高于生苦杏仁和炒苦杏仁(图 7a)。在属水平, 炒苦杏仁样品中枝孢属Cladosporium的相对丰度显著高于生苦杏仁和燀苦杏仁(图 7b)。
|
Figure 7 Significant difference among the ASA samples from different processing approaches at the order (a) and genus (b) levels. Statistical analysis was performed by the one-way ANOVA method. *P < 0.05 |
真菌在空气中普遍存在, 是常见的外源污染物之一, 威胁到药材的安全使用。近年来, 中药污染真菌和真菌毒素的现象多有报道, 引发国内外的广泛关注。使用被污染药材会对消费者生命健康造成潜在威胁, 对药材中污染真菌进行快速准确检测显得尤为必要。基于高通量测序的DNA宏条形码技术不需分离培养菌株, 弥补了传统方法中部分菌株不能分离培养的缺陷, 能更加全面反映药材中真菌群落多样性[19]。本课题组前期探索了利用DNA宏条形码技术研究中药中污染真菌多样性的可行性, 发现该技术可实现中药中污染真菌的高效鉴定[20-23]。本研究通过对苦杏仁药材污染真菌的鉴定验证了DNA宏条形码技术对中药污染真菌检测的适用性。前期研究中发现发霉与未发霉的酸枣仁、不同产地与市场的肉豆蔻、不同炮制规格的决明子及污染黄曲霉毒素与未污染黄曲霉毒素的柏子仁药材中污染真菌群落均存在显著差异[20-23]。在本研究中, 来源于不同收集地或不同炮制规格的苦杏仁样品根据分组进行了明显聚类且其真菌群落组成在目水平和属水平均存在显著差异, 说明收集地和炮制加工都是影响苦杏仁中污染真菌群落多样性的重要因素。
曲霉属、青霉属、镰刀菌属和链格孢属是中药中最常见的污染菌, 也是产生真菌毒素的重要菌属[24-26]。本研究表明苦杏仁样品中真菌污染情况普遍存在, 需要引起重视。在来自4个药材市场的燀苦杏仁样品中, 除样品SW1_P中最优势菌群为Diutina外, 其余样品中最优势菌群均为曲霉属。在来自安国药材市场和荷花池药材市场的样品AG2和HH1中, 也检测到相对丰度较高的青霉属、节担菌属和链格孢属真菌。此外, 在燀苦杏仁样品中检测到3种有害真菌, 每个样品中均存在至少2种有害真菌。亳州药材市场样品中有害真菌的总相对丰度比其他3个药材市场的更高, 这可能是因为该地区的温度、湿度等环境条件更适合这些有害真菌生长和繁殖。在3种炮制规格的苦杏仁样品中, 除样品SW1_P外, 其他样品中相对丰度最高的菌群均为曲霉属。在炒苦杏仁样品中也检测到较为丰富的青霉属、节担菌属和枝孢属真菌。在不同炮制规格的苦杏仁样品中均检测到潜在产毒真菌黄曲霉, 燀苦杏仁和炒苦杏仁中的黄曲霉相对丰度比生苦杏仁更高, 这可能是因为在去除种皮后, 苦杏仁中的营养物质直接暴露, 为黄曲霉的生长提供了更加适宜的生长和繁殖条件。
综上, DNA宏条形码技术为苦杏仁中污染真菌的检测提供了有效方法, 阐明了不同收集地和炮制规格药材中真菌群落组成的差异, 高效鉴定药材中潜在产毒真菌, 可为防控真菌毒素污染提供早期风险预警。
作者贡献: 庞晓慧负责研究设计; 郭梦月、于景盛和姜汶君负责实验操作和数据分析; 郭梦月负责论文撰写; 庞晓慧负责论文的审阅和修改。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典一部)[M]. Part 1. Beijing: China Medical Science Press, 2020: 210.
|
| [2] |
Li K, Shi Q, Zhu H, et al. Chemical compositions in bitter almond[J]. J Northwest Forest Univ (西北林学院学报), 2004, 19: 124-126. |
| [3] |
He X, Wu L, Wang W, et al. Amygdalin - a pharmacological and toxicological review[J]. J Ethnopharmacol, 2020, 254: 112717. DOI:10.1016/j.jep.2020.112717 |
| [4] |
Zhou Z, Gao N, Wang Y, et al. Clinical studies on the treatment of novel coronavirus pneumonia with traditional Chinese medicine-a literature analysis[J]. Front Pharmacol, 2020, 11: 560448. DOI:10.3389/fphar.2020.560448 |
| [5] |
Zhang L, Dou XW, Zhang C, et al. A review of current methods for analysis of mycotoxins in herbal medicines[J]. Toxins (Basel), 2018, 10: 65. DOI:10.3390/toxins10020065 |
| [6] |
Tan J, Zheng R, Wang W, et al. Simultaneous determination of aflatoxins and zearalenone in Chinese crude drugs by high performance liquid chromatography-tandem mass spectrometry[J]. Lishizhen Med Mater Med Res (时珍国医国药), 2012, 23: 2469-2472. |
| [7] |
Wang W, Xu H, Chen H, et al. Separation and molecular identification of fungal contamination on surface of 15 Chinese herbal medicines[J]. China J Chin Mater Med (中国中药杂志), 2013, 38: 1910-1914. |
| [8] |
Zheng R, Xu H, Wang W, et al. Determination of aflatoxin B1, B2, G1, G2 in Armeniacae Semen Amarum by high-performance liquid chromatography-tandem mass spectrometry[J]. China J Chin Mater Med (中国中药杂志), 2013, 38: 3534-3538. |
| [9] |
Taberlet P, Coissac E, Pompanon F, et al. Towards next-generation biodiversity assessment using DNA metabarcoding[J]. Mol Ecol, 2012, 21: 2045-2050. DOI:10.1111/j.1365-294X.2012.05470.x |
| [10] |
Nilsson RH, Anslan S, Bahram M, et al. Mycobiome diversity: high-throughput sequencing and identification of fungi[J]. Nat Rev Microbiol, 2019, 17: 95-109. DOI:10.1038/s41579-018-0116-y |
| [11] |
López-Angulo J, de la Cruz M, Chacón-Labella J, et al. The role of root community attributes in predicting soil fungal and bacterial community patterns[J]. New Phytol, 2020, 228: 1070-1082. DOI:10.1111/nph.16754 |
| [12] |
Straumfors A, Foss OAH, Fuss J, et al. The inhalable mycobiome of sawmill workers: exposure characterization and diversity[J]. Appl Environ Microbiol, 2019, 85. |
| [13] |
White TJ, Bruns T, Lee S, et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M] // Gelfand DH, Sninsky JJ, White TJ. PCR Protocols a Guide to Methods and Applications. San Diego: Innis Academic, 1990: 315-322.
|
| [14] |
Caporaso JG, Kuczynski J, Stombaugh J, et al. QⅡME allows analysis of high-throughput community sequencing data[J]. Nat Med, 2010, 7: 335-336. |
| [15] |
Edgar RC. UPARSE: highly accurate OTU sequences from microbial amplicon reads[J]. Nat Methods, 2013, 10: 996-998. DOI:10.1038/nmeth.2604 |
| [16] |
Edgar RC. Search and clustering orders of magnitude faster than BLAST[J]. Bioinformatics, 2010, 26: 2460-2461. DOI:10.1093/bioinformatics/btq461 |
| [17] |
Nilsson RH, Larsson KH, Taylor AFS, et al. The UNITE database for molecular identification of fungi: handling dark taxa and parallel taxonomic classifications[J]. Nucleic Acids Res, 2019, 47: D259-D264. DOI:10.1093/nar/gky1022 |
| [18] |
Schloss PD, Westcott SL, Ryabin T, et al. Introducing mothur: open-source, platform-independent, community-supported software for describing and comparing microbial communities[J]. Appl Environ Microbiol, 2009, 75: 7537-7541. DOI:10.1128/AEM.01541-09 |
| [19] |
Xia F, Chen X, Guo MY, et al. High-throughput sequencing-based analysis of endogenetic fungal communities inhabiting the Chinese Cordyceps reveals unexpectedly high fungal diversity[J]. Sci Rep, 2016, 6: 33437. DOI:10.1038/srep33437 |
| [20] |
Guo M, Jiang W, Luo J, et al. Analysis of the fungal community in Ziziphi Spinosae Semen through high-throughput sequencing[J]. Toxins (Basel), 2018, 10: 494. DOI:10.3390/toxins10120494 |
| [21] |
Guo M, Jiang W, Yang M, et al. Characterizing fungal communities in medicinal and edible Cassiae Semen using high-throughput sequencing[J]. Int J Food Microbiol, 2020, 319: 108496. DOI:10.1016/j.ijfoodmicro.2019.108496 |
| [22] |
Jiang W, Guo M, Yang M, et al. High-throughput analysis of fungal communities in Myristicae Semen[J]. LWT-Food Sci Technol, 2020, 128: 109499. DOI:10.1016/j.lwt.2020.109499 |
| [23] |
Yu J, Guo M, Jiang W, et al. Assessment of the microbiome and potential aflatoxin associated with the medicinal herb Platycladus orientalis[J]. Front Microbiol, 2020, 11: 582679. DOI:10.3389/fmicb.2020.582679 |
| [24] |
Rocha-Miranda F, Venâncio A. Mycotoxigenic fungi in plant-based supplements and medicines[J]. Curr Opin Food Sci, 2019, 30: 27-31. DOI:10.1016/j.cofs.2018.08.003 |
| [25] |
Su C, Hu Y, Gao D, et al. Occurrence of toxigenic fungi and mycotoxins on root herbs from Chinese markets[J]. J Food Prot, 2018, 81: 754-761. DOI:10.4315/0362-028X.JFP-17-405 |
| [26] |
Li T, Jiang D, Hu X, et al. Study on the surface fungus diversity of commercially Platycladi semen based on high-throughput sequencing technology[J]. Acta Pharm Sin (药学学报), 2019, 54: 2100-2105. |
 2021, Vol. 56
2021, Vol. 56


