单抗药物具有靶向性强、疗效明确、不良反应小等优点, 近年来发展迅速, 迄今为止已有上百种单抗类药物被美国FDA批准上市。在单抗类药物中加入辅料聚山梨酯80, 可有效预防单抗的多聚形成和失活, 同时也可用于防止玻璃药瓶或静脉输液管表面的非特异性吸附。
聚山梨酯80是油酸、山梨坦和环氧乙烷聚合而成的聚氧乙烯20山梨醇酐单油酸酯, 是一种亲水型非离子表面活性剂, 具有较好的生物相容性, 当浓度大于其临界胶束浓度时, 在溶液中可以互相缔结形成胶束, 而它的增溶机制是使药物分子进入胶束之中, 而不是增加药物分子在水中的溶解度。聚山梨酯80本身是一种复杂的混合物, 各成分含量波动较大, 且含有微量杂质及降解产物, 而这些杂质和降解产物可进一步氧化降解, 从而产生更多的有毒成分[1, 2]。有证据表明, 单抗药物中微粒与可见异物的形成与聚山梨酯80密切相关[3-6], 且研究表明, 过量的聚山梨酯80可引起溶血等不良反应, 因此, 出于用药安全的考虑, 我国监管机构一般要求在对添加了聚山梨酯80的单抗类药物, 在质量标准中对其含量进行控制。
现行版《中国药典》三部中的聚山梨酯80含量测定法, 依据聚山梨酯80中的聚乙氧基和铵钴硫氰酸盐反应形成蓝色复合物, 可溶于二氯甲烷, 用比色法测定, 建立标准曲线, 再回归计算聚山梨酯80的含量[7], 该方法需要复杂的前期准备和处理, 且铵钴硫氰酸盐有毒性。除此以外, 还有考马斯亮蓝比色法[8]、气相色谱法[9]和高效液相色谱法, 相比较而言, 高效液相色谱法灵敏度更高, 且操作简单, 适用性更广, 也是各大制药企业的质控实验室的常用方法。由于聚山梨酯80分子中不含发色团, 因而无法使用普通的紫外检测器, 因此, 采用的方法有间接分解聚山梨酯80分子并测定其组分, 比如反向色谱(reversed-phase liquid chromatography, RP-LC) 法[10-13], 以及用色谱柱结合非选择性检测器如蒸发光(evaporative light-scattering detector, ELSD) 检测器[14-16]和电喷雾(charged aerosol dector, CAD) 检测器[11, 17]检测分离后的挥发性分子等方法。
HPLC-FMA是将染色法和高效液相色谱法结合使用的一种简单、快捷的方法, 使用苯基萘胺(N-phenyl-1-naphthylamine, NPN) 对聚山梨酯80的基团进行染色, 然后使用荧光检测器检测聚山梨酯80含量的方法。苯基萘胺是一种疏水荧光染料, 在pH值大于6时不带电荷, 微溶于水, 易溶于非极性环境(pH 6~8), 聚山梨酯80是一种多组分的表面活性剂, 在达到临界胶束浓度后, 其分子的疏水部分相互吸引, 结合在一起形成胶束, 胶束亲油基团向内, 亲水基团向外, 形成非极性疏水内核, 苯基萘胺在水溶液中荧光信号值较低, 但在疏水环境(如胶束核心) 中荧光信号值激增, 荧光强度与聚山梨酯80的浓度呈正相关, 因此, 通过测定荧光值可以反映聚山梨酯80的含量。该方法无需色谱柱, 尼龙线圈可以使胶束与苯基萘胺分子充分衍生吸收, 防止频带扩展, 可将含有不同组分的聚山梨酯80作为一个整体来分析, 无需进行复杂的前处理, 检测过程简单高效, 实用性较强, 也是目前生物制药企业使用较多的测定方法之一。
本文选取已上市单抗药物中普遍使用的来源于美国J.T.Baker公司和南京威尔两个厂家的聚山梨酯80作为对照品, 依据ICH Q2的指导原则, 联合7家实验室, 对HPLC-FMA方法进行了方法学验证, 结果表明, 该方法专属性、精密性、准确性和线性良好, 可作为抗体类药物中聚山梨酯80含量放行的检测方法。
材料与方法药品及试剂 聚山梨酯80对照品购自美国J.T.Baker公司, 符合英国药典(BP)、欧洲药典(EP)、美国药典/国家处方集(USP/NF) 和日本药典(JP) 标准, 批号为0000207715; 聚山梨酯80对照品购自南京威尔化工有限公司(供注射用), 执行标准为《中国药典》2015年版四部, 产品批号为20190601。另外组氨酸、蔗糖、甘露醇、苯基萘胺、月桂醇聚氧乙烯醚、氯化钠、二乙基三胺五乙酸、三羟甲基氨基甲烷、柠檬酸钠、醋酸钠、D-山梨醇和L-蛋氨酸均购自美国Sigma公司, 盐酸、氢氧化钠购自中国医药集团有限公司, 色谱级乙腈、异丙醇购自美国Fisher Scientific公司。单抗药物样品mAb-1 (72 mg·mL-1) 为工艺过程中超滤/渗滤(UF/DF) 后样品, 为含除聚山梨酯80外制剂缓冲液的单抗样品, 由本实验室保存。
高效液相色谱系统及参数 使用配有荧光检测器和数据采集系统的HPLC系统, 参与联合验证的7家实验室分别使用了3个厂家(Agilent、Waters和Thermo) 的高效液相系统、3种型号的荧光检测器(Agilent FLD G1321B、Waters acquity class FLR和Thermo FLR) 和两种规格的线圈(Supelco Knitted Reactor Coil 5 m×0.50 mm ID, 货号57405; Thermo REACTION COIL-750 μL, 货号042631), 基本涵盖了目前药企和科研机构使用HPLC-FMA法时常用的仪器和耗材。
色谱条件如下: 流动相为0.15 mol·L-1氯化钠、0.05 mol·L-1三羟甲基氨基甲烷、5%乙腈、5.0 μmol·L-1苯基萘胺、15 μg·mL-1月桂醇聚氧乙烯醚, pH 8.0, 荧光检测器检测波长为激发波长350 nm、发射波长420 nm, 进样体积为10 μL, 柱温箱温度为35 ℃, 样品盘温度为4 ℃, 流速为1.5 mL·min-1, 洗脱时间为2.5 min, 洗脱方式为等度洗脱, PMT增益值为9。
样品制备 所有样品均分别采用美国J.T.Baker公司和南京威尔两个厂家来源的聚山梨酯80配制。空白样品: 超纯水。标准曲线溶液: 用超纯水分别配制浓度为0.05、0.10、0.20、0.40和0.50 mg·mL-1的聚山梨酯80溶液, 作为标准曲线溶液。质控样品: 用超纯水分别配制0.2 mg·mL-1聚山梨酯80作为质控样品。加标样品: 采用超纯水、mAb-1及聚山梨酯80, 配制mAb-1浓度为20 mg·mL-1以及聚山梨酯80浓度分别为0.05、0.10、0.20、0.40和0.50 mg·mL-1聚山梨酯80的系列加标样品溶液。专属性样品: 均为不含聚山梨酯80的制剂缓冲液, 其中制剂缓冲液A1: 20 mmol·L-1组氨酸/组氨酸盐酸、250 mmol·L-1蔗糖, pH 6.0; 制剂缓冲液A2: 20 mmol·L-1 Tris、0.1 mmol·L-1二乙基三胺五乙酸、10%甘露醇、100 mmol·L-1氯化钠, pH 7.0; 制剂缓冲液B1: 20 mmol·L-1柠檬酸钠、50 mmol·L-1氯化钠、3.0%甘露醇、0.02 mmol·L-1二乙基三胺五乙酸, pH值6.0; 制剂缓冲液B2: 25 mmol·L-1盐酸精氨酸、20 mmol·L-1组氨酸、12.5 mmol·L-1醋酸钠、5%蔗糖, pH 5.9。制剂缓冲液C: 10 mmol·L-1 L-组氨酸、252 mmol·L-1 D-山梨醇、10 mmol·L-1 L-蛋氨酸, pH 6.25。
样品进样与数据分析 美国J.T.Baker公司和南京威尔两个厂家来源的样品分批次进行测试, 首先用超纯水平衡系统(进样至少5次), 再用1.0 mg·mL-1的质控样品平衡系统至少20次(使系统的荧光信号值达到稳定) 至峰面积基本稳定(荧光信号稳定后方可进行样品检测, 此步骤不可省略), 然后再进行进样, 以0.2 mg·mL-1的质控样品作为序列中的质控品, 序列前后均上样质控品, 另外每6针加标样品后, 进1针质控品, 最后1针加标样品之后, 再进一针质控品。然后, 选取色谱图中的聚山梨酯80主峰做积分运算, 以聚山梨酯80对照品的浓度为X轴, 聚山梨酯80对照品的峰面积为Y轴, 利用合适的色谱软件线性拟合建立标准曲线Y = mX + b, 线性回归计算质控品和供试品中聚山梨酯80的含量。
系统适用性要求 系统适用性要求为超纯水空白进样中聚山梨酯80主峰位置无明显干扰峰; 标准曲线的相关系数r2 ≥ 0.99; 0.2 mg·mL-1质控品的回收率在90.0%~110.0%之间; 序列中所有质控品回收率的RSD ≤ 10%。
验证方案 使用美国J.T.Baker公司和南京威尔两个厂家来源的聚山梨酯80, 在7个联合验证实验室, 使用0.05、0.10、0.20、0.40和0.50 mg·mL-1共5个浓度梯度的聚山梨酯80做标准曲线。使用0.05、0.10、0.20、0.40和0.50 mg·mL-1共计5个浓度梯度的加标样品, 每个验证实验室对每个浓度的加标样品分别进样3次, 计算每次进样的回收率, 并计算均值, 进行准确性、精密度和线性的验证。准确性计算7家联合验证实验室5个浓度加标样品平行3次进样回收率的均值, 可接受范围为各个浓度水平的回收率在80%~120%内; 精密度为同一验证实验室的重复性和所有验证实验室的重现性, 可接受范围为各个浓度水平回收率的RSD ≤ 10%; 线性计算分别对5个浓度的加标样品在7个联合验证实验室的实测浓度和理论浓度进行了线性拟合, 可接受范围为各个浓度加标样品测定值和理论值所拟合直线的相关系数r2 ≥ 0.98; 专属性使用标准曲线最低点0.05 mg·mL-1的聚山梨酯80和专属性样品进行了专属性验证, 可接受标准为专属性样品在聚山梨酯80出峰位置无干扰, 各浓度点的加标样品准确性符合要求。
结果 1 系统适用性方法空白在加标样品的出峰位置无干扰峰(图 1); 7个联合验证实验室标准曲线的r2值均大于0.99, 拟合良好; 验证过程中所有序列中0.2 mg·mL-1质控品的回收率在92.5%~108.3%之间, RSD均 < 4.8%。符合系统适用性要求。
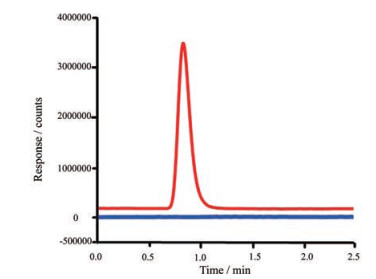
|
Figure 1 Overlapped chromatogram of blank (blue line) and spike sample of 0.05 mg·mL-1 (red line) |
计算结果表明, J.T.Baker公司的聚山梨酯80回收率为92.20%~117.70 %, 南京威尔的回收率为93.90%~117.20%。所有加标样品的回收率均在80%~120%之间(图 2)。
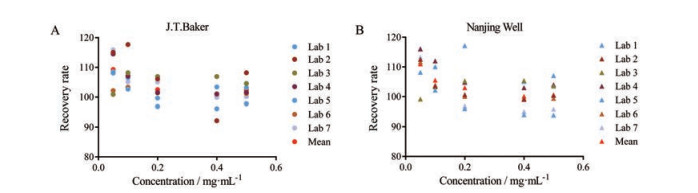
|
Figure 2 Recovery rate range of polysorbate 80 in samples spiked with different concentration levels of polysorbate 80 from J.T.Baker (A) and Nanjing Well (B) in seven labs as indicated |
精密度结果如图 3A和3B所示, J.T.Baker公司来源聚山梨酯80的RSD最大值为4.30%, 南京威尔的RSD最大值为2.60%。重现性为所有7家验证实验室相同浓度加标样品回收率的RSD (n = 21), 结果如图 2C所示, J.T.Baker公司来源聚山梨酯80的RSD最大值为5.45%, 南京威尔的RSD最大值为6.70%, 均小于10%。
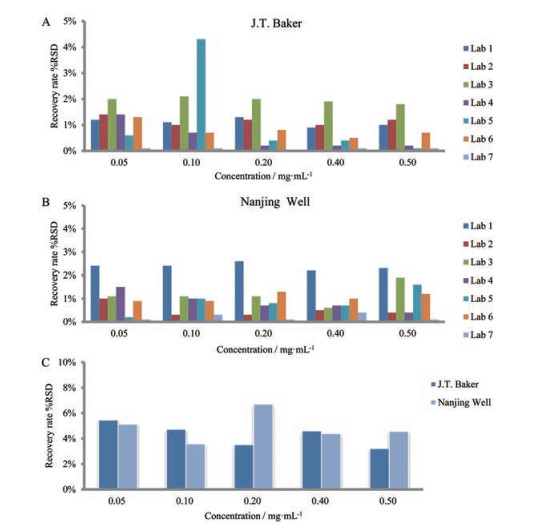
|
Figure 3 Intra-laboratory repeatability of samples spiked with different concentration levels of polysorbate 80 from J.T.Baker (A) and Nanjing Well (B), and inter-laboratory reproducibility (C) |
结果表明, J.T.Baker公司来源的聚山梨酯80, 线性拟合函数的r2值均大于0.98, 南京威尔来源的聚山梨酯80线性拟合函数的r2值均大于0.99。拟合方程如表 1和表 2所示, 说明该方法线性良好。
| Table 1 The correlation of theoretical and measured concentrations of polysorbate 80 from J.T.Baker in seven labs |
| Table 2 The correlation of theoretical and measured concentration of polysorbate 80 from Nanjing Well in seven labs |
各专属性样品在聚山梨酯80出峰位置无干扰; 且准确性验证结果表明, 所有浓度水平下加标样品的准确性研究均符合标准要求, 证明缓冲液无干扰。可认为该方法具有专属性。
6 检测范围根据以上验证结果, 本HPLC-FMA测定单抗药物中聚山梨酯80含量的方法, 在线性范围内(0.05~0.5 mg·mL-1), 准确性和精密度符合要求。
讨论随着国内外单抗药物的快速上市, 对其质量控制方法和策略提出了新的挑战, 聚山梨酯80作为单抗药物中重要的辅料, 亟需快速、灵敏、操作性强的测定方法。
本文为聚山梨酯80含量测定的方法学验证提供了一个可供参考的实例, 依据ICH Q2的指导原则[18], 验证了一种HPLC-FMA的方法, 用于测定单抗药物中聚山梨酯80含量, 该方法在0.05~0.50 mg·mL-1内, 蛋白浓度含量在20 mg·mL-1及以下, 在不同类型的仪器、不同类型的检测器、不同货号的线圈、两种在已上市单抗药物中最常见厂家(J.T.Baker公司和南京威尔) 的聚山梨酯80、7个药物质控实验室中均有良好的专属性, 准确度、精密度和线性均符合要求。在准确性验证中, 低浓度的0.05及0.10 mg·mL-1的加标样品的回收率高于中高浓度加标样品的回收率, 其原因可能为HPLC-FMA法对仪器的清洁度要求较高, 在聚山梨酯80含量较少且较为恒定的情况下, 对低浓度样品的影响较大, 会出现整体趋势高于理论值的情况, 而高浓度的影响较小。但本方法的结果符合验证要求, 故并未进行进一步优化。
本文的研究对象单抗药物mAb-1为工艺过程中超滤/渗滤后的样品, 为含除聚山梨酯80外制剂缓冲液的单抗样品。在其中添加与标准曲线系列点浓度一致的聚山梨酯80制备加标样品, 加标样品除聚山梨酯80外, 其余组分均和实际生产的样品完全一致, 含有完全一样的配方缓冲液和相同浓度的抗体蛋白。方法学验证结果表明, 该HPLC-FMA方法在0.05~0.5 mg·mL-1内, 准确性、精密度和线性的验证结果均符合预设标准, 可认为当单抗药物中含有的聚山梨酯80在该浓度范围内时, 所测得的结果真实、可信。另外值得指出的是, 采用该方法对其他单抗制品进行聚山梨酯80含量测定, 仍需考察其适用性。一般而言, 当将单抗药物浓度稀释至20 mg·mL-1及以下, 聚山梨酯80含量在0.05~0.50 mg·mL-1内时, 该方法可满足适用性, 而对于含有较低浓度聚山梨酯80的高浓度单抗药物, 该方法中的蛋白对聚山梨酯80信号检测的干扰可能会对检测带来一定程度的影响, 导致该方法无法通过验证要求。
总之, HPLC-FMA的方法灵敏、快速、稳定, 且符合ICH Q2所有方法学验证的要求, 在对多种单抗药物进行研究后, 作为潜在的药典方法, 可用于多种单抗药物的放行和质量控制中聚山梨酯80含量的测定。
作者贡献: 俞小娟、于传飞、张荣建负责设计实验思路、完成实验的主要部分、数据分析和文章撰写; 武刚、崔永霏、郭璐韵参与实验和文章润色; 王兰负责实验设计、文章润色和整体规划; 所有作者均对本文有所贡献。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Dwivedi M, Blech M, Presser I, et al. Polysorbate degradation in biotherapeutic formulations identification and discussion of current root causes[J]. Int J Pharm, 2018, 552: 422-436. DOI:10.1016/j.ijpharm.2018.10.008 |
| [2] |
Webster GK, Chang JC, Heflin JL. Stability indicating method for polysorbate 80 in protein formulations[J]. J Chromatogr Sci, 2020, 116: 1-8. |
| [3] |
Vaclaw C, Merritt K, Pringle V, et al. Impact of polysorbate 80 grade on the interfacial properties and interfacial stress induced subvisible particle formation in monoclonal antibodies[J]. J Chromatogr Sci, 2021, 110: 746-759. |
| [4] |
Kishore RS, Kiese S, Fischer S, et al. The degradation of polysorbates 20 and 80 and its potential impact on the stability of biotherapeutics[J]. Pharm Res, 2011, 28: 1194-1210. DOI:10.1007/s11095-011-0385-x |
| [5] |
Glucklich N, Dwivedi M, Carle S, et al. An in-depth examination of fatty acid solubility limits in biotherapeutic protein formulations containing polysorbate 20 and polysorbate 80[J]. Int J Pharm, 2020, 591: 119934. DOI:10.1016/j.ijpharm.2020.119934 |
| [6] |
Larson NR, Wei Y, Prajapati I, et al. Comparison of polysorbate 80 hydrolysis and oxidation on the aggregation of a monoclonal antibody[J]. J Pharm Sci, 2020, 109: 633-639. DOI:10.1016/j.xphs.2019.10.069 |
| [7] |
Kim J, Qiu J. Quantitation of low concentrations of polysorbates in high protein concentration formulations by solid phase extraction and cobalt-thiocyanate derivatization[J]. Anal Chim Acta, 2014, 806: 144-151. DOI:10.1016/j.aca.2013.11.005 |
| [8] |
Cheng Y, Liu Y, Wei H, et al. Quantitation of low concentrations of polysorbates 80 in protein formulations by Coomassie brilliant blue[J]. Anal Biochem, 2019, 573: 67-72. DOI:10.1016/j.ab.2019.03.001 |
| [9] |
Shende N, Karale A, Bhagade S, et al. Evaluation of a sensitive GC-MS method to detect polysorbate 80 in vaccine preparation[J]. J Pharm Biomed, 2020, 183: 113126. DOI:10.1016/j.jpba.2020.113126 |
| [10] |
Adamo M, Dick LW, Qiu D, et al. A simple reversed phase highperformance liquid chromatography method for polysorbate 80 quantitation in monoclonal antibody drug products[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2010, 878: 1865-1870. DOI:10.1016/j.jchromb.2010.04.039 |
| [11] |
Schilling K, Pawellek R, Lovejoy K, et al. Influence of charged aerosol detector instrument settings on the ultra-high-performance liquid chromatography analysis of fatty acids in polysorbate 80[J]. J Chromatogr A, 2018, 1576: 58-66. DOI:10.1016/j.chroma.2018.09.031 |
| [12] |
Hewitt D, Alvarez M, Robinson K, et al. Mixed-mode and reversed-phase liquid chromatography-tandem mass spectrometry methodologies to study composition and base hydrolysis of polysorbate 20 and 80[J]. J Chromatogr A, 2011, 1218: 2138-2145. DOI:10.1016/j.chroma.2010.09.057 |
| [13] |
Degterev MB, Badaukayte RA, Shukurov RR. A development of high-throughput HPLC method for the polysorbate 80 quantitation in protein therapeutic products[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2019, 1133: 121847. DOI:10.1016/j.jchromb.2019.121847 |
| [14] |
Nair LM, Stephens NV, Vincent S, et al. Determination of polysorbate 80 in parenteral formulations by high-performance liquid chromatography and evaporative light scattering detection[J]. J Chromatogr A, 2003, 1012: 81-86. DOI:10.1016/S0021-9673(03)01105-1 |
| [15] |
Hewitt D, Zhang T, Kao YH. Quantitation of polysorbate 20 in protein solutions using mixed-mode chromatography and evaporative light scattering detection[J]. J Chromatogr A, 2008, 1215: 156-160. DOI:10.1016/j.chroma.2008.11.017 |
| [16] |
Mondal B, Kote M, Lunagariya C, et al. Development of a simple high performance liquid chromatography (HPLC) /evaporative light scattering detector (ELSD) method to determine polysorbate 80 in a pharmaceutical formulation[J]. Saudi Pharm J, 2020, 28: 325-328. DOI:10.1016/j.jsps.2020.01.012 |
| [17] |
Fekete S, Ganzler K, Fekete J. Fast and sensitive determination of polysorbate 80 in solutions containing proteins[J]. J Pharm Biomed, 2010, 52: 672-679. DOI:10.1016/j.jpba.2010.02.035 |
| [18] |
ICH Q2(R1): Validation of Analytical Procedures: Text and Methodology[M/OL]. 2005-11[2021-03-24]. https://database.ich.org/sites/default/files/Q2_R1__Guideline.pdf.
|
 2021, Vol. 56
2021, Vol. 56


