肺动脉高压(pulmonary arterial hypertension, PAH) 是指肺动脉压力超过一定界值的血流动力学的病理状态, 其血流动力学诊断标准为: 海平面静息状态下平均肺动脉压≥ 25 mmHg, 运动状态下高于30 mmHg。临床上PAH分类有很多种, 由于缺氧、长期高原暴露等原因所导致的肺动脉高压称为低氧性肺动脉高压(hypoxia pulmonary hypertension, HPH), 属于肺动脉高压国际共识分类的第三组[1]。HPH患者常伴有呼吸困难和乏力头痛, 随着病情的发展, 最终右心室衰竭导致死亡。HPH是由于早期在低氧环境的刺激下, 机体发生代偿反应并导致肺血管发生收缩[2], 长期的低氧导致肺血管持续收缩并造成肺远端血管重构。肺血管重构是HPH重要的病理基础, 表现为血管各层增厚, 其中增厚的主要部位是血管中膜[3], 血管中膜主要由血管平滑肌、弹性纤维及胶原纤维组成, 主要参与调节器官和组织的血流量。重构的肺血管形成永久性增厚, 导致肺血管狭窄, 加重HPH的发展并且不可被逆转。
低氧诱发肺血管重构的机制较为复杂, 例如长期低氧刺激会导致缺氧因子的表达升高, 引起肺血管内皮细胞和平滑肌细胞内各种血管活性因子含量发生变化, 以及使线粒体状态、功能改变, 使血管的内皮和平滑肌过度增殖, 发生肺血管重构。低氧还可通过直接或间接调节多种激酶的活性和信号通路的阻断与开放导致肺血管重构等。低氧刺激肺动脉平滑肌细胞(pulmonary artery smooth muscle cells, PASMCs) 内发生钙超载是导致肺血管发生持续收缩和血管重构的重要因素之一。
在低氧条件刺激下, 细胞内代谢发生异常, 钙分布紊乱, 导致细胞内游离钙浓度异常升高, 这种现象称为钙超载[4], 钙超载可导致细胞结构损伤和功能代谢障碍, 严重者可造成细胞不可逆损伤。在PASMCs中, 细胞内游离Ca2+浓度的增加是血管收缩和肌细胞增殖的重要信号。关于低氧诱发钙超载从而导致肺动脉重构的机制主要包括(图 1): ①低氧诱导钙泵的异常表达; ②低氧导致肺动脉平滑肌细胞质膜钙通道的异常开放; ③低氧诱导细胞钙敏感受体过表达; ④低氧诱导钠钙交换蛋白表达异常。本文将对以上四个方面的研究进展做一总结。
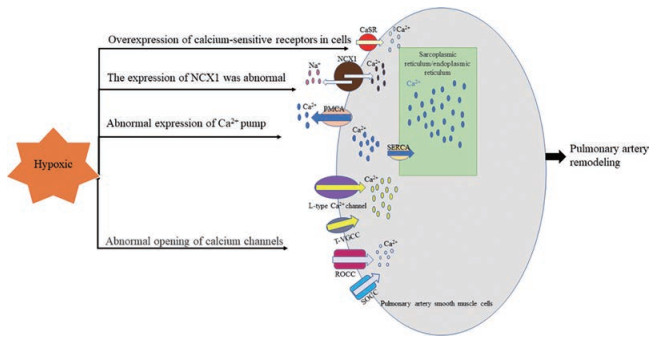
|
Figure 1 Mechanisms of hypoxia-induced calcium overload leading to pulmonary artery remodeling. CaSR: Calcium-sensing receptor; NCX1: Na+/Ca2+ exchanger type-1; PMCA: Plasma membrane Ca2+-ATPase; SERCA: Sarcoplasmic and endoplasmic reticulum Ca2+-ATPase; T-VGCC: T-type voltage gated calcium channels; ROCC: Receptor operated calcium channels; SOCC: Store operated calcium channels |
细胞质膜中的钙泵称为质膜钙ATP酶(plasma membrane Ca2+-ATPase, PMCA), 正常情况下, 当细胞内Ca2+浓度升高时, Ca2+通过与钙调蛋白(calmodulin, CaM) 结合刺激PMCA活动, PMCA每分解1分子的ATP, 可将其结合的1个Ca2+由胞质转运至胞外, 从而降低细胞内Ca2+浓度, PMCA对维持细胞内的钙稳态起重要作用[5]。PMCA是一种ATP驱动的钙泵, 由4个独立的基因编码组成(PMCA1~4), 分布于不同组织且有不同功能, PMCA1在所有细胞中均存在, PMCA2和PMCA3存在于可兴奋细胞中, PMCA4在心脏和平滑肌细胞中广泛表达[6]。研究发现[7], 抑制PMCA4的表达可减少Ca2+外流, 干扰PASMCs的钙稳态, 导致PASMCs内游离Ca2+浓度上升而引发钙超载。研究还发现, 将PASMCs中的PMCA4基因敲除后, 促进了PASMCs增殖, 同时实验研究了低氧诱导的肺动脉高压大鼠模型, 发现大鼠肺动脉内PMCA4的表达下降, 进一步证明了低氧可使PASMCs内的PMCA4表达下降从而引发钙超载, 使PASMCs发生增殖。
1.2 肌质网/内质网钙泵异常表达肌质网/内质网膜中的钙泵称为肌质网/内质网钙ATP酶(sarcoplasmic and endoplasmic reticulum Ca2+-ATPase, SERCA), 正常情况下, SERCA每分解1分子ATP可将2个Ca2+从胞质转运至肌质网/内质网中, PMCA和SERCA的共同作用使胞内游离的Ca2+浓度保持在0.1~0.2 μmol·L-1的低水平。SERCA是Ca2+从细胞质到肌质网/内质网膜唯一的转运体, 具有多种亚型且具有物种特异性和组织特异性, SERCA1在成人骨骼肌中表达, SERCA2a在心肌和平滑肌中表达, SERCA2b在所有细胞中广泛表达[8]。研究发现, 在肺动脉高压患者和野百合碱诱导的肺动脉高压大鼠模型的PASMCs中, SERCA2a表达下降, 破坏了细胞内钙稳态[9]。另外, 在低氧诱导的肺动脉高压小鼠模型中, SERCA2a的表达下降[10], 且PASMCs内游离Ca2+浓度异常升高造成钙超载, 导致了细胞的异常增殖。
2 低氧导致肺动脉平滑肌细胞质膜钙通道的异常开放 2.1 电压依赖性钙通道电压依赖性钙通道(voltage dependent calcium channel, VDCC) 是位于细胞膜的跨膜异源多聚体蛋白质, 其开放与电压有关, 根据钙通道传导性和对电压敏感性不同, 进一步分为L、P、Q、R、N、T共6种亚型[11]。
研究发现, 长期的低氧环境刺激会导致K+通道功能受到抑制, K+外流受到抑制使细胞膜去极化, 激活L型钙通道从而导致PASMCs内的游离Ca2+浓度升高, 发生细胞内钙超载并引起肺血管收缩[12]。
血管平滑肌上主要存在4种类型的K+通道, 分别是电压门控钾通道(voltage-dependent K+ channels, KV)、钙激活钾通道(Ca2+-activated K+ channels, KCa)、ATP敏感钾通道(ATP-sensitive K+ channels, KATP) 和内向整流钾通道(inward rectifier K+ channels, KIR)。其中KV通道包括延迟整流性钾通道、瞬时外向钾通道和缓慢激活的非失活性钾通道, KV通道电流是细胞膜静息电位的主要成分, 同时也是参与肺动脉平滑肌收缩和重构的主要K+通道亚型。
L型钙通道不仅与肺血管收缩有关, 也与细胞增殖有关。研究发现, 在体外胎牛血清诱导的大鼠血管平滑肌细胞增殖实验中, L型钙通道抑制剂(硝苯地平) 对血管平滑肌细胞的增殖有显著抑制作用[13, 14]。
T型电压门控钙通道(T-type voltage gated calcium channels, T-VGCC) 对血管张力也有调控作用, T-VGCC主要有3种类型, 分别是Cav3.1、Cav3.2和Cav3.3, 其中Cav3.1和Cav3.2在血管系统中已被鉴定出来, 在肺动脉中Ca2+通过Cav3.1通道内流诱导肺动脉收缩, 并参与血管的重构[15]。研究发现T-VGCC在低氧性肺动脉高压大鼠模型中高表达[16], PASMCs胞质内游离Ca2+浓度升高, 通过使用T-VGCC的特异性抑制剂TTA-A2或NNC550396可减少钙内流从而改善低氧性肺动脉高压。T-VGCC的特异性抑制剂可能是一种有价值的治疗低氧性肺动脉高压的有效药物。
2.2 非电压依赖性钙通道非电压依赖性钙通道主要包括受体操纵性钙通道(receptor operated calcium channels, ROCC) 和钙库操纵性钙通道(store operated calcium channels, SOCC), 它们对维持细胞内钙稳态具有重要作用[17]。
ROCC位于细胞膜, 在PASMCs中与G蛋白共同调节Ca2+内流, 当内皮素等配体与G蛋白偶联受体结合后, 可激活磷脂酶C (phospholipase C, PLC), 而后催化磷脂酰肌醇4, 5-二磷酸(phosphatidylinositol 4, 5-bisphosphate, PIP2) 裂解成三磷酸肌醇(inositol 1, 4, 5-trisphosphate, IP3) 和二酰基甘油(diacyl glycerol, DAG), 第二信使DAG可直接激活ROCC, 发生受体操纵性钙内流(receptor-operated Ca2+ entry, ROCE), 导致胞质内游离Ca2+浓度上升而引发钙超载[18]。
经典瞬时受体电位通道(transient receptor potential, TRP) 是非选择性阳离子通道, TRPC是其超家族中的一个子家族, 含有7个非选择性阳离子通道家族成员(TRPC1~7)。TRPC蛋白作为SOCC和ROCC的分子组分, 在平滑肌功能调控中发挥重要作用。证据表明[19], 在大鼠和人的肺动脉平滑肌细胞中发现了多种TRPC亚型, 低氧诱导的TRPC表达增加主要引起了PASMCs内游离Ca2+浓度的升高, 进而引起PASMCs的张力、增殖和迁移增加, 导致肺动脉重构。经典瞬时受体电位通道6 (transient receptor potential channel 6, TRPC6) 已被证实是ROCC的主要分子基础, 慢性低氧诱发的肺动脉高压大鼠模型TRPC6蛋白的表达增加表现出ROCC介导的Ca2+内流增加, 而PASMCs中游离Ca2+浓度升高进而引发了钙超载, 导致PASMCs增殖。
研究发现, 慢性低氧不仅可以诱导PASMCs中ROCC的作用增强, 也可以使肺静脉平滑肌细胞(pulmonary venous smooth muscle cells, PVSMCs) 中ROCC的作用增强[20], 在慢性低氧诱导的肺动脉高压大鼠的PVSMCs中, ROCE增强, 且慢性低氧大鼠的PVSMCs和肺静脉平滑肌中的TRPC6蛋白的表达水平均高于正常组, 在低氧处理的PVSMCs中采用RNA沉默技术敲除TRPC6可显著抑制ROCE增强, 并有效减弱了慢性低氧诱导的PVSMCs增殖。
SOCC存在于细胞膜, 在PASMCs中主要参与调控肌质网钙储存耗竭而引发的胞质中Ca2+浓度的上升, 同时也促进钙库重新充盈。当细胞膜相关G蛋白偶联受体被激活后, 通过PLC介导的信号水解PIP2为IP3和DAG, IP3结合肌质网上的IP3受体, 激活配体门控通道从而诱导肌质网Ca2+释放到细胞质中, 当肌质网中储存的Ca2+耗竭后, 激活细胞膜上的SOCC, 从而发生钙库操纵性钙内流(store-operated calcium entry, SOCE), 导致PASMCs中Ca2+浓度缓慢持续上升, 引发钙超载, 这是肺动脉发生持续血管收缩和血管重构的重要原因。目前已证实SOCC的主要构成者是TRPC1和TRPC6, 研究发现慢性低氧性肺动脉高压大鼠的PASMCs中的TRPC1、TRPC6表达上调, SOCE增强, 使细胞内Ca2+浓度升高, 促进细胞增殖[21-23]。另有研究发现, SOCC分子机制中还包括M型瞬时受体电位通道8 (transient receptor potential melastatin 8, TRPM8), 其在低氧性肺动脉高压大鼠模型中表达下调, 而TRPM8特异性激动剂可使血管舒张且抑制Ca2+内流[24], 提示TRPM8特异性激动剂可能是治疗HPH的新方法。
3 低氧诱导细胞钙敏感受体过表达钙敏感受体(calcium-sensing receptor, CaSR) 属于G蛋白偶联受体, 包括胞外氨基结构域、7个跨膜螺旋结构域和胞内羧基结构域, 其主要功能是维持细胞内稳定的钙浓度以及其他金属离子浓度, 可调节细胞增殖、分化以及离子通道的开放。研究发现, CaSR可通过激活G蛋白-PLC-IP3通路增加细胞内游离Ca2+浓度导致钙过剩并引发钙超载[25]。研究发现, 低氧性肺动脉高压大鼠PASMCs的CaSR表达上调, 且发现苹果多酚能有效调控PASMCs上CaSR的表达, 使其表达降低从而减少Ca2+内流, 抑制平滑肌兴奋-收缩偶联, 达到缓解肺血管收缩并减少PASMCs增殖的作用[26]。另外, Yan等[27]研究发现儿茶素中的对立异构体—(+)-儿茶素也可通过下调低氧诱导PASMCs的CaSR表达, 逆转胞质内的升钙效应从而达到抑制平滑肌增殖的作用。
4 低氧诱导钠钙交换蛋白表达异常钠钙交换蛋白(Na+/Ca2+ exchanger type-1, NCX1) 由938个氨基酸构成, 包含8个疏水性跨膜片段, 是细胞膜上的一个逆向转运系统, 也是一种双向离子转运体。NCX1有前向型和反向型两种工作方式: 前向型以转入3个Na+和排出1个Ca2+的化学计量联合转运; 反向型是在一些病理状态下如缺氧时会将Ca2+转运至胞内将Na+转运至胞外, 造成细胞内钙超载[28]。研究发现, 在肺动脉高压患者的PASMCs中, Ca2+通过NCX1的反向模式进入细胞, 增加细胞内游离Ca2+浓度, 使肺动脉收缩并刺激PASMCs增殖[29]。对NCX1基因敲除和药物抑制对低氧性肺动脉高压作用的研究发现, 低氧诱导的肺动脉高压小鼠肺动脉中的NCX1表达上调, NCX1特异性抑制剂SEA0400可有效抑制PASMCs的Ca2+内流并改善小鼠肺动脉重构[30]。NCX1参与低氧性肺动脉高压的发病机制, 提示NCX1特异性抑制剂可能成为治疗该种疾病的新方法。
5 总结与展望HPH是由低氧、长期高原暴露等诱导肺血管持续收缩及肺血管重构, 从而导致平均肺动脉压升高而引发的疾病。由于重构会导致肺血管增厚、狭窄, 加重HPH发展, 且这种发展不可逆转, 所以该疾病也无法逆转并具有较高死亡率。目前针对低氧性肺动脉重构尚无有效治疗药物, 临床治疗HPH常用的药物主要是通过缓解低氧性肺血管收缩进行降压治疗, 例如: 口服药包括依那普利、氢氯噻嗪、螺内酯等, 静脉给药可以选择盐酸川穹嗪氯化钠注射液等, 这些药物的主要作用是扩张血管, 具有降压作用。
低氧诱导肺动脉重构的机制较为复杂, 低氧诱导细胞内发生钙超载是导致低氧性肺动脉重构的重要机制。细胞内钙超载不仅会导致肺动脉发生持续性收缩, 还会导致细胞结构损伤、功能代谢障碍等不可逆损伤, 进而发生肺动脉重构。深入研究导致细胞内发生钙超载的不同机制, 从而掌握抑制细胞内发生钙超载的有效途径, 有望为治疗低氧性肺动脉高压提供新思路。
作者贡献: 王金宇负责综述整体结构设计及撰写; 赵悦孚和赵恩麒负责文献收集整理; 盖祥云负责对文章进行指导。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Pulmonary Embolism and Pulmonary Vascular Disease Group, Respiratory Society, Chinese Medical Association. Chinese guidelines for the diagnosis and treatment of pulmonary hypertension (The 2021 version)[J]. Natl Med J China (中华医学杂志), 2021, 101: 11-51. |
| [2] |
Zhu X, Li N, He Q, et al. The role and influencing factors of calcium reservoir controlled calcium channels in mediating hypoxia-induced pulmonary hypertension[J]. Adv Cardiovasc Dis (心血管病学进展), 2019, 40: 88-91. |
| [3] |
Xiao L, Tong XD. Advances in molecular biological mechanisms of vascular remodeling in the development of pulmonary hypertension[J]. J Zhejiang Univ (Med Sci) (浙江大学学报(医学版)), 2019, 48: 102-110. |
| [4] |
Wang M, Tan J, Miao Y, et al. Role of Ca2+ and ion channels in the regulation of apoptosis under hypoxia[J]. Histol histopathol, 2018, 33: 237-246. |
| [5] |
Zhang L, Qiao H. Regulating mechanism of calcium homeostasis in vascular endothelial cells[J]. Chin J Cardiovasc Rehabil Med (心血管康复医学杂志), 2019, 28: 688-690. |
| [6] |
Bruce JIE. Metabolic regulation of the PMCA: role in cell death and survival[J]. Cell Calcium, 2018, 69: 28-36. DOI:10.1016/j.ceca.2017.06.001 |
| [7] |
Deng L, Chen J, Wang T, et al. PDGF/MEK/ERK axis represses Ca2+ clearance via decreasing the abundance of plasma membrane Ca2+ pump PMCA4 in pulmonary arterial smooth muscle cells[J]. Am J physiol Cell Physiol, 2021, 320: C66-C79. DOI:10.1152/ajpcell.00290.2020 |
| [8] |
Chemaly ER, Troncone L, Lebeche D. SERCA control of cell death and survival[J]. Cell Calcium, 2018, 69: 46-61. DOI:10.1016/j.ceca.2017.07.001 |
| [9] |
Lin PS, Xie LD, Xu CS. Effect of diltiazem and benazepril on pulmonary artery remodeling in rats with monocylline-induced pulmonary hypertension[J]. Chin J Hypertens (中华高血压杂志), 2011, 19: 636-641. |
| [10] |
Liu B, Wang D, Luo E, et al. Role of TG2-mediated SERCA2 serotonylation on hypoxic pulmonary vein remodeling[J]. Front Pharmacol, 2019, 10: 1611. |
| [11] |
Qing Q, Hu RC, Zhu LM, et al. Research progress of resistin-like molecule family and calcium channel in hypoxic pulmonary hypertension[J]. Int J Respir (国际呼吸杂志), 2019, 39: 147-151. |
| [12] |
Dunham-Snary KJ, Wu D, Sykes EA, et al. Hypoxic pulmonary vasoconstriction: from molecular mechanisms to medicine[J]. Chest, 2017, 151: 181-192. DOI:10.1016/j.chest.2016.09.001 |
| [13] |
Zhang SS. Electrophysiological Characteristics of Potassium and Calcium Channels in Rat Pulmonary Artery Smooth Muscle Cells and Changes in Pulmonary Hypertension (大鼠肺动脉平滑肌细胞中钾通道和钙通道的电生理特征以及在肺高压中的变化) [D]. Fuzhou: Fujian Medical University, 2017.
|
| [14] |
Sung JY, Choi HC. Nifedipine inhibits vascular smooth muscle cell proliferation and reactive oxygen species production through AMP-activated protein kinase signaling pathway[J]. Vascul Pharmacol, 2012, 56: 1-8. DOI:10.1016/j.vph.2011.06.001 |
| [15] |
Gilbert G, Courtois A, Dubois M, et al. T-type voltage gated calcium channels are involved in endothelium-dependent relaxation of mice pulmonary artery[J]. Biochem Pharmacol, 2017, 138: 61-72. DOI:10.1016/j.bcp.2017.04.021 |
| [16] |
Chevalier M, Gilbert G, Roux E, et al. T-type calcium channels are involved in hypoxic pulmonary hypertension[J]. Cardiovasc Res, 2014, 103: 597-606. DOI:10.1093/cvr/cvu166 |
| [17] |
Mcfadzean I, Gibson A. The developing relationship between receptor-operated and store-operated calcium channels in smooth muscle[J]. Br J Pharmacol, 2002, 135: 1-13. DOI:10.1038/sj.bjp.0704468 |
| [18] |
Wei GP, Cheng Y, Huang Y, et al. The role of Ca2+ in hypoxic pulmonary vasoconstriction[J]. Chin Crit Care Med (中华危重病急救医学), 2019, 31: 647-649. |
| [19] |
Lin MJ, Leung GP, Zhang WM, et al. Chronic hypoxia-induced upregulation of store-operated and receptor-operated Ca2+ channels in pulmonary arterial smooth muscle cells: a novel mechanism of hypoxic pulmonary hypertension[J]. Circ Res, 2004, 95: 496-505. DOI:10.1161/01.RES.0000138952.16382.ad |
| [20] |
Peng G, Li S, Hong W, et al. Chronic hypoxia increases intracellular Ca2+ concentration via enhanced Ca2+ entry through receptor-operated Ca2+ channels in pulmonary venous smooth muscle cells[J]. Circ J, 2015, 79: 2058-2068. DOI:10.1253/circj.CJ-15-0067 |
| [21] |
Mu YP. Activation of TRPM 8 Channels Regulates Calcium Pool Manipulative Calcium Influx (SOCE) in the Pulmonary Artery of Normal and Chronic Hypoxic Pulmonary Hypertension Rats (激活TRPM8通道对正常和慢性低氧肺高压大鼠肺动脉上钙池操纵性钙内流(SOCE) 的调控) [D]. Fuzhou: Fujian Medical University, 2018.
|
| [22] |
Lu W, Ran P, Zhang D, et al. Sildenafil inhibits chronically hypoxic upregulation of canonical transient receptor potential expression in rat pulmonary arterial smooth muscle[J]. Am J Physiol Cell Physiol, 2010, 298: C114-C123. DOI:10.1152/ajpcell.00629.2008 |
| [23] |
He X, Song S, Ayon RJ, et al. Hypoxia selectively upregulates cation channels and increases cytosolic[Ca2+] in pulmonary, but not coronary, arterial smooth muscle cells[J]. Am J Physiol Cell Physiol, 2018, 314: C504-C517. DOI:10.1152/ajpcell.00272.2017 |
| [24] |
Mu YP, Lin DC, Zheng SY, et al. Transient receptor potential melastatin-8 activation induces relaxation of pulmonary artery by inhibition of store-operated calcium entry in normoxic and chronic hypoxic pulmonary hypertensive rats[J]. J Pharmacol Exp Ther, 2018, 365: 544-555. DOI:10.1124/jpet.117.247320 |
| [25] |
Zhang H, Chang Z, Mehmood K, et al. Calcium-sensing receptor arbitrates hypoxia-induced proliferation of pulmonary artery smooth muscle cells via the G protein-PLC-IP3 pathway[J]. Crit Rev Eukaryot Gene Expr, 2019, 29: 69-76. DOI:10.1615/CritRevEukaryotGeneExpr.2019025189 |
| [26] |
Meng HY, Zhao J, Hua CY, et al. Apple polyphenols ameliorate hypoxic pulmonary hypertension in rats by down-regulating calcium-sensitive receptors[J]. Chin J Appl Physiol (中国应用生理学杂志), 2018, 34: 242-246. |
| [27] |
Yan JJ, Chen FZ, Chen LW, et al. Effect and mechanism of (+) -catechin in alleviating hypoxic pulmonary hypertension in rats[J]. J Tea Sci (茶叶科学), 2019, 39: 55-62. |
| [28] |
Zhang S, Dong H, Rubin LJ, et al. Upregulation of Na+/Ca2+ exchanger contributes to the enhanced Ca2+ entry in pulmonary artery smooth muscle cells from patients with idiopathic pulmonary arterial hypertension[J]. Am J Physiol Cell Physiol, 2007, 292: C2297-C2305. DOI:10.1152/ajpcell.00383.2006 |
| [29] |
Zhang S, Yuan JX, Barrett KE, et al. Role of Na+/Ca2+ exchange in regulating cytosolic Ca2+ in cultured human pulmonary artery smooth muscle cells[J]. Am J Physiol Cell Physiol, 2005, 288: C245-C252. DOI:10.1152/ajpcell.00411.2004 |
| [30] |
Nagata A, Tagashira H, Kita S, et al. Genetic knockout and pharmacologic inhibition of NCX1 attenuate hypoxia-induced pulmonary arterial hypertension[J]. Biochem Biophys Res Commun, 2020, 529: 793-798. DOI:10.1016/j.bbrc.2020.06.045 |
 2021, Vol. 56
2021, Vol. 56


