2. 江苏省食品药品监督检验研究院, 江苏 南京 210019
2. Jiangsu Institute of Food and Drug Control, Nanjing 210019, China
马兜铃酸是近年来中药毒性研究中的重要内容, 马兜铃酸类化合物包括多种马兜铃酸(AAs) 和马兜铃内酰胺(ALs), 目前已发现110余个马兜铃酸类化合物在马兜铃科植物中分布, 包括50余个马兜铃酸和60余个马兜铃内酰胺[1]。马兜铃科不少植物用作中药, 如马兜铃属植物马兜铃(Aristolochia debilis Sieb. et Zucc.) 的果称马兜铃, 能清肺降气、止咳平喘、清肠消痣, 其炮制方法为除杂、搓碎、蜜炙; 地上部分称天仙藤, 有行气活血、通络止痛之功效, 其炮制方法为除杂、切断[2]; 根称青木香, 有平肝止痛、解毒消肿之功效, 其炮制方法为除杂、洗净、润透、切片、晒干[3]。广防己(广防己Aristolochia fangchi Y.C. Wu ex L.D. Chou et S.M. Hwang的干燥根) 可以祛风止痛、清热利水, 其炮制方法为除杂、洗净、润透、切片、干燥[3]。朱砂莲(四川朱砂莲Aristolochia cinnabarina C.Y. Cheng et J.L.Wu的干燥块根) 能清热解毒、消肿止痛, 其炮制方法为洗净, 蒸至透心, 干燥[4]。关木通(东北马兜铃Aristolochia manshuriensis Kom.的干燥藤茎) 有清心火、利小便、通经下乳之功效, 其炮制方法为洗净、润透、切片、晒干[3]。寻骨风(绵毛马兜铃Aristolochia mollissima Hance的干燥全草) 能祛风、活络、止痛, 其炮制方法为除杂、洗净、切段、干燥[4]。细辛属植物杜衡(杜衡Asarum forbesii Maxim.的干燥全草) 有祛风、散寒、止痛之功效, 其炮制方法为除杂、切段[5]。细辛来源于北细辛[Asarum heterotropoides Fr. Schmidt var. mandshuricum (Maxim.) Kitag.]、汉城细辛(Asarum sieboldii Miq. var. seoulense Nakai) 或华细辛(Asarwmsieboldii Miq.) 的干燥根和根茎, 能祛风散寒、祛风止痛、通窍、温肺化饮, 其炮制方法为除杂、稍润、切段、阴干[2]。上述列举的马兜铃科药材中除马兜铃采用蜜炙, 朱砂莲蒸至透心外, 其他药材均采用净选润切加工方法, 没有采用特殊的炮制方法。中国药典(2020版) 只收载了其中的细辛。
马兜铃酸具有抗感染、抗早孕及增强吞噬细胞活性等多种药理作用, 但同时也具有肾毒性和致癌性, 马兜铃酸在人体内代谢成马兜铃内酰胺, 进而与DNA结合, 损害肾脏细胞[6], 长期小剂量服用或者短期大剂量服用, 都有可能导致肾毒性反应的发生[7, 8]。因此马兜铃内酰胺是直接导致毒性的成分, 其不仅是马兜铃酸的代谢产物, 而且在马兜铃属和细辛属植物中也天然存在[9]。近年来对马兜铃酸毒性的报道远超过对其药理活性的报道, 其导致的临床不良反应已引起国内外学者的广泛重视[10-17]。Ng等[18]提示马兜铃酸与肝癌之间有很强的相关性, 将马兜铃酸推到了舆论的风口浪尖。Lu等[19]在此前研究的基础上, 进一步深层揭示了马兜铃酸可以导致肝癌的发生, 是人类肝癌的主要危险因素之一。
目前, 关于马兜铃酸的研究报道较多, 定性定量及药理毒理研究多集中于马兜铃酸Ⅰ和Ⅱ[20-23], 分析方法主要采用HPLC法[24-26]、HPLC-MS法[27]等, 但对马兜铃酸Ⅰ、Ⅱ以外的其他马兜铃酸类成分的药理毒理、定性定量研究均很少[28-31]。鉴于马兜铃属和细辛属药材中含有大量的马兜铃酸Ⅰ和Ⅱ以外的其他马兜铃酸类成分[9], 这些成分的毒性及在马兜铃属和细辛属药材中的具体存在情况尚不完全清楚。此外, 我国尚有以此类药材作为药味的复方成药在上市销售, 例如复方蛇胆川贝散(马兜铃)、杜仲壮骨胶囊(寻骨风)、和胃降逆胶囊(天仙藤)、小青龙颗粒(细辛) 等[32]。因此有必要对此类药材中马兜铃酸类物质存在情况进行摸底研究, 以期在此类药材和相关成药中进行马兜铃酸类物质的合理控制, 保证人民用药安全。本文选取马兜铃属和细辛属9种中药材, 对药材中存在的马兜铃酸类成分进行了定性和定量分析, 明确了此类药材中马兜铃酸类成分的种类、数量及含量, 对此类药材及其制剂的安全性控制将具有重要的意义, 为其质量标准中马兜铃酸类成分控制项的合理制定奠定基础。
材料与方法仪器 Waters 2996高效液相色谱仪(具二极管阵列紫外检测器), Agilent 1290高效液相色谱仪-Bruker四极杆飞行时间质谱仪, 电子天平(瑞士Mettler Toledo XSE205型、XPR2型、德国Sartorius BS21S型), HC-300超声清洗机(江苏禾创), 高速万能粉碎机(天津市泰斯特仪器有限公司), Milli-Q净化器(美国Milli-Q公司)。
试药与试剂 对照品: 马兜铃酸Ⅰ (A) (批号: 110746-201611, 纯度98.9%) 购自中国食品药品检定研究院; 马兜铃酸Ⅱ (批号: J17N8T48269, 纯度≥ 98%)、马兜铃酸Ⅲa (批号: P20N8F48641, 纯度≥ 98%)、马兜铃酸Ⅳa (批号: P27A9S59965, 纯度≥ 98%)、马兜铃酸Ⅶa (批号: Z13N9S74959, 纯度≥ 95%)、马兜铃内酰胺Ⅰ (批号: P27N10S104067, 纯度≥ 95%) 购自上海源叶生物科技有限公司; 马兜铃内酰胺Ⅱ (纯度为95.36%) 由西安交通大学师仁义特聘研究员合成制备纯化, 乙腈(德国Merck公司)、乙酸(上海阿拉丁生化科技股份有限公司) 为色谱纯, 水为超纯水, 其他试剂均为分析纯。
9种药材样品共52批: 杜衡(DH) 5批, 寻骨风(XGF) 9批, 由徐州市药检所提供; 细辛(XX) 7批, 2批购自亳州市药材市场, 5批购自辽宁省新宾县; 朱砂莲(ZSL) 5批, 关木通(GMT) 5批, 马兜铃(MDL) 6批, 青木香(QMX) 6批, 天仙藤(TXT) 6批, 广防己(GFJ) 3批, 均购自亳州市药材市场; 杜衡、寻骨风、关木通、青木香、广防己均为净选润切后饮片, 朱砂莲为洗净、蒸至透心后饮片; 细辛、马兜铃未经炮制, 所有样品经南京中医药大学药学院吴啟南教授鉴定为正品。
液相色谱条件 色谱柱: Agilent ZORBAX SB-Aq色谱柱(250 mm×4.6 mm, 5 μm); 流动相: 0.2%乙酸水溶液(A)~乙腈(B); 梯度洗脱: 0~20 min, 18%~28% B; 20~38 min, 28%~35% B; 38~41 min, 35%~42% B; 41~45 min, 42%~43% B; 45~60 min, 43%~60% B; 流速: 1.0 mL·min-1; 检测波长: 254 nm; 柱温: 30 ℃; 进样量: 20 μL。
质谱条件 采用电喷雾离子源(ESI), 在正离子模式下采集数据, 质量扫描范围: m/z 50~1 000。ESI离子源参数: 干燥气温度: 180 ℃; 干燥气流速: 6 L·min-1; 鞘气温度: 180 ℃; 鞘气流速: 6 L·min-1; 雾化气压力: 150 kPa; 毛细管电压: 4 500 V; 裂解电压: 500 V; 碰撞能量: 5 eV。
供试品溶液的制备 取药材粉末(过三号筛) 约0.5 g, 精密称定, 置具塞锥形瓶中, 精密加入70%甲醇25 mL, 密塞, 称定重量, 超声处理(720 W, 40 kHz) 40 min, 放冷, 再称定重量, 用70%甲醇补足减失重量, 摇匀, 用微孔滤膜(0.45 μm) 滤过, 取续滤液, 即得供试品溶液。
对照品溶液的制备 分别取马兜铃酸Ⅰ、马兜铃酸Ⅱ、马兜铃酸Ⅲa、马兜铃酸Ⅳa、马兜铃酸Ⅶa、马兜铃内酰胺Ⅰ、马兜铃内酰胺Ⅱ 7种对照品适量, 精密称定, 加入70%甲醇制成浓度分别为1.96、2.13、1.05、0.55、1.04、2.46和3.57 mg·mL-1的单个对照品储备液, 用70%甲醇稀释配置得浓度分别为39.27、24.12、16.80、24.12、20.80、32.32和3.57 μg·mL-1的混合对照品溶液。
阴性溶液的制备 不加药材按照供试品溶液制备方法制备成溶液作为阴性溶液。
定性分析 分别精密吸取7种对照品单标溶液和9种药材样品的供试品溶液各20 μL, 注入高效液相色谱仪, 记录色谱图, 获取对照品色谱图中单峰的紫外光谱图和供试品色谱图中每个色谱峰的紫外光谱图。供试品色谱图中与对照品紫外光谱相似的色谱峰被筛选为马兜铃酸类成分。
分别精密吸取混合对照品溶液及供试品溶液各20 μL, 注入液相色谱质谱联用仪, 按上述色谱和质谱条件操作, 记录总离子流图, 得到一级和二级质谱各分子离子峰及碎片离子峰信息, 结合文献数据, 在总结对照品裂解规律基础上与对照品数据比对, 对上述筛选出的样品中色谱峰进行化合物身份推测和确认。
方法学验证
专属性 取阴性溶液, 再分别取7种对照品混合溶液和9种药材的供试品溶液, 分别进样, 记录色谱图。
精密度 精密吸取对照品混合溶液20 μL, 注入液相色谱仪, 连续进样6次, 测定峰面积, 计算RSD。
线性关系 取对照品混合溶液适量, 按不同倍数稀释, 进样测定, 以对照品溶液的浓度为横坐标, 峰面积为纵坐标, 计算线性回归方程。
检测限和定量限 取对照品混合溶液分别稀释至信噪比约为3和10, 进样, 依法测定, 计算检测限和定量限。
稳定性 精密吸取同一份马兜铃药材供试品溶液(批号20160706), 于0、3、6、12、21和24 h分别进样, 记录色谱图峰面积值, 计算RSD, 考察供试品溶液在24 h内的稳定性。
重复性 分别取同一批马兜铃药材供试品(批号20160706) 6份, 按供试品溶液项下方法制备, 依法测定含量, 计算RSD。
加样回收率 取已知含量的马兜铃药材供试品(批号20200625) 6份, 精密称定, 精密加入浓度分别为39.27、24.12、16.80、24.12、20.80、32.32和3.57 μg·mL-1的对照品溶液5 mL, 按供试品制备方法制备供试品溶液, 依法测定, 计算回收率。
定量分析 将筛选出的马兜铃酸类成分按照紫外光谱的相似性进行分类, 对已有对照品的成分直接采用对照品测定, 对没有对照品的成分选取与其光谱最为相似成分的对照品作为对照品进行含量测定。取9种药材共52批, 依法分别制成供试品溶液, 另取7种对照品混合溶液, 分别进样, 依法测定, 按上述化合物分类原则选取各自对照品以外标一点法计算含量。
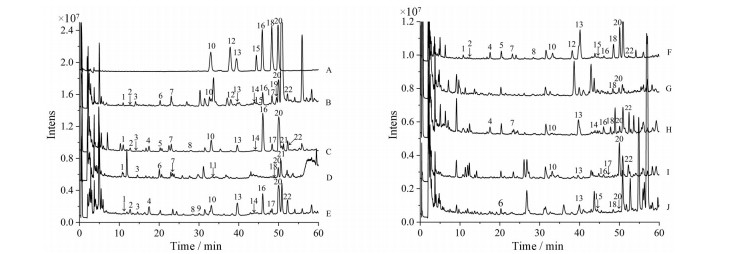
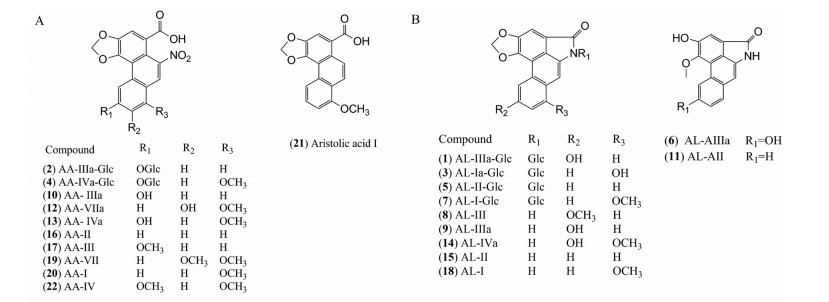
结果 1 定性分析结果 1.1 马兜铃酸类化合物指认9种药材中鉴定出马兜铃酸类化合物共22个(表 1[29, 33-40]), 混合对照品和供试品的总离子流图见图 1, 其分子结构如图 2所示, 22个化合物的定性结果在同品种药材的不同批次间基本一致。
| Table 1 Aristolochic acid components in the nine medicinal materials. *Compound used as reference substances |
|
Figure 1 Total ion chromatogram (TIC) of the reference substances and samples. A: Mixed standard; B: The roots of Aristolochia debilis; C: The tuber of Aristolochia cinnabarina; D: The roots of Aristolochia fangchi; E: The stems of Aristolochia manshuriensis; F: The fruits of Aristolochia debilis; G: The herbs of Asarum forbesii; H: The stems and leaf of Aristolochia debilis; I: The herbs of Aristolochia mollissima; J: The roots of Asarum heterotropoides var. mandshuricum. Peaks 1- 22: See Table 1 |
|
Figure 2 Chemical structures of aristolochic acids (A) and aristololactams (B) in the nine medicinal materials |
从9种药材中共鉴定出11个马兜铃酸, 分别为马兜铃酸Ⅲa-O-β-D-葡萄糖苷(2)、马兜铃酸Ⅳa-O-β-D-葡萄糖苷(4)、马兜铃酸Ⅲa (10)、马兜铃酸Ⅶa (12)、马兜铃酸Ⅳa (13)、马兜铃酸Ⅱ (16)、马兜铃酸Ⅲ (17)、马兜铃酸Ⅶ (19)、马兜铃酸Ⅰ (20)、去硝基马兜铃酸Ⅰ (21)、马兜铃酸Ⅳ (22), 马兜铃酸类成分的裂解途径共有4类。正离子模式下, 第一类裂解途径的化合物一级质谱易形成[M+H]+、[M+NH4]+分子离子峰; 二级质谱易形成[M+H-H2O]+、[M+H-NO2]+、[M+H-H2O-Glc]+、[M+H-NO2-Glc]+碎片峰。如化合物2, 其一级质谱出现了m/z 490.098 0 [M+H]+的准分子离子峰和m/z 507.124 9 [M+NH4]+的加和峰, 二级质谱可见碎片离子m/z 472.087 7 [M+H-H2O]+, m/z 444.120 8 [M+H-NO2]+, m/z 310.045 9 [M+H-H2O-Glc]+, m/z 282.061 2 [M+H-NO2-Glc]+, 根据此质谱裂解规律并结合相关文献, 推断化合物2为马兜铃酸Ⅲa-O-β-D-葡萄糖苷[33, 34], 化合物4的裂解规律与此相同。第二类裂解途径的化合物其一级质谱易形成[M+H]+准分子离子峰和[M+NH4]+的加和峰, 二级质谱可见[M+H-H2O]+、[M+H-NO2]+、[M+H-CO2]+离子碎片峰。如化合物10, 准分子离子峰为m/z 328.045 1 [M+H]+, 二级质谱可见碎片离子m/z 310.034 5 [M+H-H2O]+, 284.037 8 [M+H-CO2]+, 282.055 6 [M+H-NO2]+, 与对照品比对并结合参考文献[38]确认其为马兜铃酸Ⅲa, 同此类裂解规律的还有化合物16。第三类裂解途径的化合物其一级质谱易形成[M+H]+准分子离子峰和[M+NH4]+分子离子峰; 二级质谱可见[M+H-H2O-CO]+、[M+H-H2O-CO-CH3]+、[M+H-H2O-CO-OCH2]+碎片离子峰。如化合物19, MS中可观察到m/z 372.071 4 [M+H]+的准分子离子峰, 二级碎片离子为m/z 354.060 0 [M+H-H2O]+, m/z 326.089 9 [M+H-NO2]+, m/z 311.065 4 [M+H-NO2-CH3]+, m/z 283.069 7 [M+H-NO2-CH3-CO]+, 与参考文献[38]对比, 确认化合物19为马兜铃酸Ⅶ, 同此类裂解规律的还有化合物22。第四类裂解途径的化合物其一级质谱易形成[M+H]+准分子离子峰; 二级质谱可见[M+H-H2O]+、[M+H-NO2]+、[M+H-NO2-CH3]+离子碎片峰。如化合物17的准分子离子峰为m/z 342.060 8 [M+H]+, 二级碎片离子为m/z 324.049 7 [M+H-H2O]+, m/z 296.078 6 [M+H-NO2]+, m/z 281.052 6 [M+H-NO2-CH3]+, 结合文献[33]数据, 推断该化合物为马兜铃酸Ⅲ, 此类裂解规律的马兜铃酸类化合物还有化合物12、13、20、21。
1.3 马兜铃内酰胺类成分的鉴定从9种药材中共鉴定出11个马兜铃内酰胺, 分别为马兜铃内酰胺Ⅲa-N-β-D-葡萄糖苷(1)、马兜铃内酰胺Ⅰa-N-β-D-葡萄糖苷(3)、马兜铃内酰胺Ⅱ-N-β-D-葡萄糖苷(5)、马兜铃内酰胺AⅢa (6)、马兜铃内酰胺Ⅰ-N-β-D-葡萄糖苷(7)、马兜铃内酰胺Ⅲ (8)、马兜铃内酰胺Ⅲa (9)、马兜铃内酰胺AⅡ (11)、马兜铃内酰胺Ⅳa (14)、马兜铃内酰胺Ⅱ (15)、马兜铃内酰胺Ⅰ (18)。马兜铃内酰胺类成分的裂解途径共有3类。第一类裂解途径的化合物一级质谱易形成[M+H]+准分子离子峰; 二级质谱易形成[M+H-Glc]+碎片峰。如化合物1准分子离子峰为m/z 442.113 0 [M+H]+, MS/MS中碎片离子为m/z 280.069 6, 推测其为[M+H-Glc]+, 经查阅相关文献[29], 推断化合物1为马兜铃内酰胺Ⅲa-N-β-D-葡萄糖苷, 化合物3、5、7的裂解规律与此相同。第二类裂解途径的化合物一级质谱易形成[M+H]+准分子离子峰; 二级质谱易形成[M+H-CH3]+、[M+H-CH3-CO]+碎片峰。如化合物8的准分子离子峰为m/z 294.076 1 [M+H]+, 其二级碎片离子为m/z 279.062 7 [M+H-CH3]+和m/z 251.066 8 [M+H-CH3-CO]+, 结合参考文献[37], 推断鉴定化合物8为马兜铃内酰胺Ⅲ, 此类裂解规律的马兜铃内酰胺类其他化合物还有化合物6、11、14、18。第三类裂解途径的化合物一级质谱易形成[M+H]+准分子离子峰; 二级质谱易形成[M+H-OCH2]+、[M+H-OCH2-CO]+碎片峰。如化合物15的准分子离子峰为m/z 264.065 8 [M+H] +, 其MS/MS碎片离子m/z 234.057 2, 206.062 0分别对应[M+H-OCH2]+和[M+H-OCH2-CO]+, 与对照品比对并结合参考文献[35]确认其为马兜铃内酰胺Ⅱ, 化合物9的裂解规律与此相同。
2 方法学验证 2.1 专属性测得阴性溶液色谱图中在22个待测成分色谱峰处未出现色谱峰, 表明阴性无干扰。
2.2 精密度马兜铃酸Ⅰ、马兜铃酸Ⅱ、马兜铃酸Ⅲa、马兜铃酸Ⅳa、马兜铃酸Ⅶa、马兜铃内酰胺Ⅰ、马兜铃内酰胺Ⅱ峰面积的RSD (n = 6) 分别为0.41%、0.84%、0.74%、0.78%、0.50%、0.88%、0.69%, 表明仪器的精密度良好。
2.3 线性关系马兜铃酸Ⅰ、马兜铃酸Ⅱ、马兜铃酸Ⅲa、马兜铃酸Ⅳa、马兜铃酸Ⅶa、马兜铃内酰胺Ⅰ、马兜铃内酰胺Ⅱ质量浓度在各自范围内与峰面积线性关系良好, 结果见表 2。
| Table 2 Calibration curves, limits of detection and limits of quantitation of seven aristolochic acids |
马兜铃酸Ⅰ、马兜铃酸Ⅱ、马兜铃酸Ⅲa、马兜铃酸Ⅳa、马兜铃酸Ⅶa、马兜铃内酰胺Ⅰ、马兜铃内酰胺Ⅱ的检测限和定量限结果见表 2。
2.5 稳定性计算得到马兜铃酸Ⅰ、马兜铃酸Ⅱ、马兜铃酸Ⅲa、马兜铃酸Ⅳa、马兜铃酸Ⅶa、马兜铃内酰胺Ⅰ、马兜铃内酰胺Ⅱ峰面积的RSD (n = 6) 分别为1.03%、1.17%、1.45%、0.95%、1.51%、0.49%和1.31%, 表明上述样品溶液在24 h内稳定。
2.6 重复性6份马兜铃样品中马兜铃酸Ⅰ、马兜铃酸Ⅱ、马兜铃酸Ⅲa、马兜铃酸Ⅳa、马兜铃酸Ⅶa、马兜铃内酰胺Ⅰ和马兜铃内酰胺Ⅱ的平均含量分别为0.072%、0.007%、0.037%、0.047%、0.041%、0.064%和0.006%, RSD (n = 6) 分别为0.63%、1.12%、0.45%、1.58%、0.51%、0.49%和1.12%, 表明重复性良好。
2.7 加样回收率计算得到马兜铃酸Ⅰ、马兜铃酸Ⅱ、马兜铃酸Ⅲa、马兜铃酸Ⅳa、马兜铃酸Ⅶa、马兜铃内酰胺Ⅰ和马兜铃内酰胺Ⅱ的加样回收率分别为97.40%、95.46%、91.34%、89.77%、93.19%、97.06%和95.11%, RSD (n = 6) 分别为0.44%、0.86%、0.99%、1.26%、0.23%、0.40%和0.93%, 表明该方法的准确度良好。
3 定量分析本研究中定量采用紫外检测, 灵敏度比质谱低, 因此色谱图只能检出22个化合物中的18个成分, 将这18个成分按照紫外光谱的相似性进行分类, 对已有对照品的成分直接采用对照品测定, 对没有对照品的成分选取与其光谱最为相似成分的对照品作为对照品进行含量测定。其分类结果共有6类, 如表 3所示。
| Table 3 The UV of aristolochic acid components |
52批药材样品测定结果, 整体而言, 马兜铃酸Ⅰ和马兜铃酸Ⅱ的含量普遍高于其他马兜铃酸类物质, 其中朱砂莲、杜衡、关木通、马兜铃、青木香、寻骨风中马兜铃酸Ⅰ和马兜铃酸Ⅱ的含量之和占总量的30%以上, 寻骨风中最高达78%。9种药材中马兜铃酸类物质总量在0.04~13.40 mg·g-1之间, 药材的总量依次为ZSL ≈ GMT > QMX > MDL > GFJ > TXT > XGF > XX > DH; 其中, 马兜铃酸总量为0.02~12.63 mg·g-1, 药材的含量依次为GMT ≈ ZSL > QMX > MDL > GFJ > TXT > XGF > XX > DH; 马兜铃内酰胺总量为未检出~1.36 mg·g-1, 药材的含量依次为ZSL > MDL > QMX > XX > GMT > GFJ > DH ≈ TXT > XGF。
讨论鉴定出的22个化合物中, 马兜铃酸和马兜铃内酰胺各有11个。其中马兜铃属的马兜铃、关木通、朱砂莲、青木香中马兜铃酸类物质的种类较多, 均超过10种; 细辛属的杜衡中马兜铃酸类物质最少, 只有两种。定量结果发现9种药材中均有马兜铃酸Ⅰ, 但细辛药材以根部入药, 其马兜铃酸Ⅰ含量甚微。不同药材之间的马兜铃酸类物质的种类和含量均存在较大差异, 从所收集的药材样品看, 同品种药材中的不同批次间的马兜铃酸类物质的定性结果差异不大, 定量结果有一定差异, 但大体上各成分含量的相对高低在批间趋于一致。
采用HPLC-Q-TOF-MS技术, 9种药材共定性鉴定出22个马兜铃酸类成分, 其中AL-AⅢa、AL-Ⅲ、AL-AⅡ和AL-Ⅳa在质谱中响应很低, 在紫外检测上则未出峰, 因此定量结果为未检出。
当未知化合物和已知化合物的紫外吸收光谱一致或相似时, 可以认为两者具有相同或者相似的分子骨架和发色基团, 在多个成分同时定量分析但缺少对照品的情况下, 采用紫外光谱相似的其他物质的对照品作为对照通过外标法进行含量计算, 是初步了解待测成分含量的可行做法[41, 42]。后续研究可根据本研究的定性定量结果进行网络毒理分析分别推导9种药材的各自毒性, 或开展体外毒性实验来获得各药材的毒性数据。
致谢: 马兜铃内酰胺Ⅱ对照品由西安交通大学师仁义特聘研究员合成制备纯化。
作者贡献: 米士丽负责了实验研究方案的设计、研究过程实施及论文的起草; 施海蔚、谭力、叶晓芸和李忠红负责了技术及材料支持及指导性支持工作; 郭青负责了研究选题提出、研究方案设计及论文修改。
利益冲突: 本研究不存在任何利益冲突。
| [1] |
Kumar V, Prasad AK, Parmar VS. Naturally occurring aristolactams, aristolochic acids and dioxoaporphines and their biological activities[J]. Nat Prod Rep, 2003, 20: 565-583. DOI:10.1039/b303648k |
| [2] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. 2015 Ed. Vol 1. Beijing: China Medical Science Press, 2015: 52, 55, 231.
|
| [3] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. 2000 Ed. Vol 1. Beijing: China Medical Science Press, 2000: 31, 114, 154.
|
| [4] |
Guizhou Drug Administration. Quality Standard of Traditional Chinese Medicine and Ethnic Medicine in Guizhou Province (贵州省中药材民族药材质量标准)[S]. Guiyang: Guizhou Science and Technology Press, 2003: 13, 179.
|
| [5] |
Hubei Food and Drug Administration. Quality Standard of Chinese Crude Drugs in Hubei Province (湖北省中药材质量标准)[S]. Wuhan: Hubei Science and Technology Press, 2009: 70.
|
| [6] |
Wang NS. Toxic effect of aristolochic acid[J]. Tradit Chin Drug Res Clin Pharmacol (中药新药与临床药理), 2001, 22: 394-395. |
| [7] |
Tu Y, Wan YG, Sun W, et al. Clinical features, molecular mechanisms and therapeutic strategies of aristolochic acid-induced nephrotoxicity[J]. J Nanjing Univ Tradit Chin Med (南京中医药大学学报), 2018, 34: 12-18. |
| [8] |
Chu CX, Zhu GF. Research progress of aristolochic acid nephro-pathy[J]. Chin Tradit Pat Med (中成药), 2020, 42: 2407-2412. |
| [9] |
Cosyns JP. Aristolochic acid and 'Chinese herbs nephropathy': a review of the evidence to date[J]. Drug Saf, 2003, 26: 33-48. DOI:10.2165/00002018-200326010-00004 |
| [10] |
Zhao H, Liu XH. Review on the studies of Chinese Aristolochia. L herbs[J]. J Henan Univ (河南大学学报), 2003, 24: 73-77. |
| [11] |
Jiang TL. On the carcinogenicity of some plants of Aristolochia and aristolochic acid[J]. Chin J Inf Tradit Chin Med (中国中医药信息杂志), 2002, 9: 73-75. |
| [12] |
Debelle FD, Nortier JL, De Prez EG, et al. Aristolochic acids induce chronic renal failure with interstitial fibrosis in salt-depleted rats[J]. J Am Soc Nephrol, 2002, 13: 431-436. DOI:10.1681/ASN.V132431 |
| [13] |
Arlt VM, Stiborova M, Schmeiser HH. Aristolochic acid as a probable human cancer hazard in herbal remedies: a review[J]. Mutagenesis, 2002, 17: 265-277. DOI:10.1093/mutage/17.4.265 |
| [14] |
Mc Daniel LP, Elander ER, Guo X, et al. Mutagenicity and DNA adduct formation by aristolochic acid in the spleen of Big Blue® rats[J]. Environ Mol Mutagen, 2012, 53: 358-368. DOI:10.1002/em.21696 |
| [15] |
Chen CH, Dickman KG, Moriya M, et al. Aristolochic acid-associated urothelial cancer in Taiwan[J]. Proc Natl Acad Sci U S A, 2012, 109: 8241-8246. DOI:10.1073/pnas.1119920109 |
| [16] |
Grollman AP, Shibutani S, Moriya M, et al. Aristolochicacid and the etiology of endemic (Balkan) nephropathy[J]. Proc Natl Acad Sci U S A, 2007, 104: 12129-12134. DOI:10.1073/pnas.0701248104 |
| [17] |
Moriya M, Slade N, Brdar B, et al. TP53 Mutational signature for aristolochic acid: an environmental carcinogen[J]. Int J Cancer, 2011, 129: 1532-1536. DOI:10.1002/ijc.26077 |
| [18] |
Ng AWT, Poon SL, Huang MN, et al. Aristolochic acids and their derivatives are widely implicated in liver cancers in Taiwan and throughout Asia[J]. Sci Transl Med, 2017, 9: eaan6446. DOI:10.1126/scitranslmed.aan6446 |
| [19] |
Lu ZN, Luo Q, Zhao LN, et al. The mutational features of aristolochic acid-induced mouse and human liver cancers[J]. Hepatology, 2020, 71: 929-942. DOI:10.1002/hep.30863 |
| [20] |
Han N, Lu JC, Bi KS, et al. Determination of aristolochic acid A in 14 kinds of Chinese medicinal materials by RP-HPLC[J]. J Shenyang Pharm Univ (沈阳药科大学学报), 2008, 25: 115-118. |
| [21] |
Liang S, Yang Q, Li RL, et al. Assaying of aristolochic acid A in 14 traditional Chinese medicines by RP-HPLC[J]. West China J Pharm Sci (华西药学杂志), 2020, 35: 78-81. |
| [22] |
Jing SL, Ma HY, Chen SH, et al. HPLC method for determination of aristolochic acid I and aristolochic lactam I in Radix tetrandris[J]. J Nanjing Univ Tradit Chin Med (南京中医药大学学报), 2009, 25: 275-276. |
| [23] |
Cosyns JP, Jadoul M, Squifflet JP, et al. Urothelial malignancy in nephropathy due to Chinese herbs[J]. Lancet, 1994, 344: 188. |
| [24] |
Schaneberg BT, Applequist WL, Khan IA. Determination of aristolochic acid I and Ⅱ in North American species of Asarum and Aristolochia[J]. Pharmazie, 2002, 57: 686-689. |
| [25] |
Ioset JR, Raoelison GE, Hostettmann K. Detection of aristolochic acid in Chinese phytomedicines and dietary supplements used as slimming regimens[J]. Food Chem Toxicol, 2003, 41: 29-36. DOI:10.1016/S0278-6915(02)00219-3 |
| [26] |
Seto T, Hamano T, Shioda H, et al. Analysis of aristolochic acid I and Ⅱ in Kampo medicine preparations[J]. J Health Sci, 2002, 48: 412-417. DOI:10.1248/jhs.48.412 |
| [27] |
Liu Y, Han S, Feng J, et al. Determination of aristolochic acids A and B in Chinese herbals and traditional Chinese patent medicines using ultra high performance liquid chromatography-triple quadrupole mass spectrometry[J]. Chin J Chromatogr (色谱), 2011, 29: 1076-1081. |
| [28] |
Lu JZ, Sun Y, Wei F. Determination of six aristolochic acids in Aristolochia by HPLC-MS[J]. Pharm J Chin PLA (解放军药学学报), 2005, 21: 204-205, 216. |
| [29] |
Tian HM, Cheng XM, Wang CH, et al. Simultaneous determination of four constituents in Aristolochia debilis by HPLC[J]. Chin Tradit Pat Med (中成药), 2016, 38: 560-565. |
| [30] |
Yuan JB. HPLC Technique and Application of Aristolochic Acids(马兜铃酸类物质的液相色谱联用技术及应用)[D]. Changsha: Hunan University, 2008.
|
| [31] |
Zhang CY. Preliminary Study on Nephrotoxic Components of Six Aristolochic Acid Containing Chinese Herbal Medicines in Chinese Pharmacopoeia (中国药典收载的六种含马兜铃酸中药肾毒性成分的初步研究)[D]. Beijing: Beijing University, 2004.
|
| [32] |
Yu QH, Guo X, Wang M, et al. Biopharmaceutical classification of aristolochic acid A in 17 Chinese patent medicines[J]. Chin Tradit Pat Med (中成药), 2020, 42: 1596-1599. |
| [33] |
Kuo PC, Li YC, Wu TS. Chemical constituents and pharmacology of the Aristolochia (mădōu ling) species[J]. J Tradit Complement Med, 2012, 2: 249-266. DOI:10.1016/S2225-4110(16)30111-0 |
| [34] |
Yu J, Ma CM, Wang X, et al. Analysis of aristolochic acids, aristololactams and their analogues using liquid chromatography tandem mass spectrometry[J]. Chin J Nat Med, 2016, 14: 626-640. |
| [35] |
Yin H, Chen SJ, Tian XT, et al. Identifying the constituents in aristolochia contorta water decoction by HPLC-Q-TOF/MS[J]. World Sci Technol/Mod Tradit Chin Med Mater Med (世界科学技术-中医药现代化), 2019, 21: 1319-1324. |
| [36] |
Mao WW, Gao W, Liang ZT, et al. Characterization and quantitation of aristolochic acid analogs in different parts of Aristolochiae Fructus, using UHPLC-Q/TOF-MS and UHPLC-QqQ-MS[J]. Chin J Nat Med, 2017, 15: 392-400. |
| [37] |
Kong DQ, Gao HY, Li X, et al. Rapid determination of eight aristolochic acids in five species of aristolochiaceae by UHPLC-Q/TOF-MS[J]. J Chin Pharm Sci, 2015, 24: 364-375. |
| [38] |
Liu XX, Wu XF, Pan Y, et al. Analysis of aristolochic acid derivates in Aristolochia debilis and its fermented product by HPLC-ESI-TOF-MS[J]. Chin J Nat Med, 2010, 8: 456-460. |
| [39] |
Ding H, Shen JZ, Fei WJ, et al. Determination of aristolochic acid A, B, C, D in Aristolochia herbs by UPLC-MS/MS[J]. Chin J Ethnomed Ethnopharm (中国民族民间医药), 2018, 27: 38-43. |
| [40] |
Yuan JB, Liu Q, Zhu WF, et al. Simultaneous analysis of six aristolochic acids and five aristolactams in herbal plants and their preparations by high-performance liquid chromatography-diode array detection-fluorescence detection[J]. J Chromatogr A, 2008, 1182: 85-92. DOI:10.1016/j.chroma.2007.12.076 |
| [41] |
Xiao T, Wang C, Yao SC, et al. Application of an HPLC correction factor method in pharmaceutical analysis[J]. Acta Pharm Sin (药学学报), 2020, 55: 2854-2861. |
| [42] |
He H, Ma SC, Zhang QM, et al. Simultaneous determination by HPLC of 6 components in zedoary turmeric oil and its related injections with replacement method of chemical reference substance[J]. Chin J Pharm Anal (药物分析杂志), 2009, 29: 1892-1899. |
 2021, Vol. 56
2021, Vol. 56


