心血管疾病范围是全球造成死亡的最主要原因, 其死亡人数约占1/3。自1990年以来, 心血管疾病的患病人数从2.71亿增长到2019年的5.23亿; 心血管疾病的死亡人数从1 210万增长到2019年的1 860万。其中, 缺血性心脏病(ischemic heart disease, IHD) 的致残和死亡人数也一直在增加, 到2019年, 因缺血性心脏病导致死亡人数达到914万[1]。
近10年来我国缺血性心脏病的死亡率上升54.5%[2, 3], 这表明缺血性心脏病仍旧是对公共健康的主要威胁, 并且随着缺血性心脏病的发病人数绝对值的不断增加, 对缺血性心脏病的相关预防及治疗服务的需求日益增长, 治疗缺血性心脏病的医疗考验更加艰巨, 研发安全性、有效性更高的天然药物对缺血性心脏病的预防和治疗尤为重要。
近年来, 许多研究表明天然药物可以通过调控线粒体自噬水平来治疗缺血性心脏病, 本文就线粒体自噬的定义、分类和具体机制进行概述, 并且举例说明最新的线粒体自噬为靶点的抗缺血性心脏病天然药物的研究进展。
1 细胞自噬细胞自噬在约60年前首次被描述, 该过程是当细胞内环境发生变化, 分子或细胞器受到损伤, 细胞可以通过双层膜包裹损伤分子或细胞器, 形成自噬体, 运送至与溶酶体融合形成自噬溶酶体, 随后降解内容物, 清除受损分子, 维持机体代谢稳定。因此, 细胞自噬的异常对于多种疾病的产生非常重要, 主要包括心血管疾病、神经退行性疾病和肿瘤等。
细胞自噬主要分为三大类: 巨自噬(macroautophagy)、微自噬(microautophagy) 和分子伴侣介导的自噬(chaperone-mediated autophagy)[4]。按照自噬识别的特异性, 又可分为选择性和非选择性, 其中选择性细胞自噬包括线粒体自噬(mitophagy)、聚集体自噬(aggrephagy) 和过氧化物酶体自噬(pexophagy) 等, 相比于非选择性细胞自噬, 选择性自噬依赖于待降解物质与自噬泡之间的特异性受体结合作用, 从而可以识别特定的分子进行细胞自噬[5]。
2 线粒体自噬线粒体是真核生物中进行能量转换和物质代谢的重要场所, 可以通过氧化磷酸化生成ATP, 维持正常细胞功能提供能量, 也会产生活性氧自由基对细胞造成氧化损伤。2005年Lemasters[6]首次提出“线粒体自噬”的概念, 它是一种选择性清除受损线粒体的特异性自噬现象, 常被认为是线粒体质量控制的主要机制。其整个过程可以大致分为3个时期: ①线粒体受到损伤后膜通透性发生改变, 膜电位降低导致线粒体去极化, 激活线粒体自噬相关蛋白; ②自噬体包裹并隔离受损线粒体, 形成线粒体自噬体; ③线粒体自噬体与溶酶体融合形成线粒体自噬溶酶体, 并在酸性环境下降解内容物[7]。
目前, 介导线粒体自噬的调节机制主要包括PTEN诱导假定激酶1 (PTEN induced putative kinase 1, PINK1)-Parkin通路和受体介导的线粒体自噬途径。
2.1 PINK1-Parkin通路介导的线粒体自噬泛素化过程调节线粒体自噬, PINK1是泛素的激酶, Parkin是泛素化反应的E3连接酶。首先在线粒体损伤状态下, 膜电位降低, PINK1进入线粒体受到阻碍, 于是在线粒体外膜发生堆积。PINK1通过不同的磷酸化作用调控Parkin的活性, 激活线粒体自噬。其一是Ser228和Ser402自身磷酸化, 招募Parkin[8]; 其二是磷酸化Parkin泛素样结构域(ubiquitin-like domain, Ubl domain) 的Ser65, 直接增加Parkin的活性; 最后在Parkin Ubl区缺失时, PINK1通过磷酸化泛素蛋白Ser65, 最终导致Parkin的激活[9]。随后Parkin泛素化标记线粒体外膜蛋白质, 招募自噬受体蛋白P62/SQSTM1 (P62/sequestosome 1)、NDP52 (nuclear dot protein 52)、OPTN (optineurin) 和NIX (Nip3-like protein X) 等[10], 使得损伤线粒体与自噬泡特异性识别, 引起选择性的线粒体自噬。
2.2 受体介导的线粒体自噬目前, 已确认的线粒体自噬受体包括BNIP3 (BCL2/adenovirus E1B 19 kDa protein-interacting protein 3)/NIX、FUNDC1 (FUN14 domain containing 1) 和Atg32 (autophagy-related protein 32)。这些蛋白的共同特点是具有一个LIR (LC3-interacting region) 区, 它是一段W/FxxL/L/V的保守序列, 当与待自噬分子结合后, 受体可以通过LIR区连接自噬体表面微管结合蛋白LC3, 使待自噬分子与自噬体结合, 以备下一步的融合[10]。
2.2.1 BNIP3/NIX介导的线粒体自噬BNIP3和NIX是定位于线粒体外膜的同源蛋白。二者的区别在于BNIP3调控缺氧期间的线粒体自噬, 并可能诱发过度自噬导致细胞死亡, 而NIX在红细胞谱系成熟时起作用, 不会导致过度线粒体自噬[11]。在缺氧环境下, BNIP3的LIR区与自噬体膜上LC3相互作用, 同时通过LIR区附近的丝氨酸残基磷酸化增强活性, 共同促进线粒体自噬[12]。另外, NIX通过LIR区与LC3和GABA受体相关蛋白结合, 介导线粒体自噬[13]。
2.2.2 FUNDC1介导的线粒体自噬FUNDC1介导的线粒体自噬也是在缺氧条件下发挥作用。FUNDC1含三个跨膜结构域及一个LIR, 可结合LC3和其他Atg蛋白, CK2激酶(casein kinase 2)、Src激酶(Src family kinase) 和PGAM5磷酸酶(PGAM family member 5, mitochondrial serine/threonine protein phosphatase) 均影响FUNDC1的磷酸化状态, 从而影响线粒体自噬途径[14]。
2.2.3 Atg32介导的线粒体自噬Atg32介导酵母细胞中的线粒体自噬, 可以与Atg11相互作用, 或者通过WxxL序列直接作用于Atg8, 最终与含Atg8的自噬体结合[15]。
目前, 针对线粒体自噬的研究仍旧不完善。为此, 研究在病理条件下哪些药物可以诱发线粒体自噬反应, 又由哪些药物特异性抑制线粒体自噬通路, 都是当今亟待解决的关键科学问题。
3 缺血性心脏病与线粒体自噬缺血性心脏病指的是因冠状动脉粥样硬化病变引致冠状血流与心肌需氧之间的不平衡, 而导致的以心肌缺血缺氧为主要特征的心脏病, 病情严重者可诱导心肌梗死, 多表现为急性ST段抬高型心肌梗死(ST-segment elevation myocardial infarction, STEMI)[16]。在急性缺血时, 心肌细胞短时间内出现大量凝固性坏死, 而慢性长期供血不足则会引起心肌组织发生营养萎缩和障碍, 使心肌细胞无法修复损伤, 进一步恶化心功能。其中, 主要的病理基础就是线粒体功能障碍, 起因是线粒体通透性过渡孔(mitochondrial permeability transition pore, mPTP) 的开放和线粒体通透性的增强, 活性氧(reactive oxygen species, ROS) 的产生, Ca2+、细胞色素C和凋亡诱导因子(apoptosis inducing factor, AIF) 的释放, 从而触发线粒体依赖性细胞凋亡和不可逆的心肌损伤[17]。
使用直接经皮冠状动脉介入治疗(primary percutaneous coronary intervention, PPCI) 再灌注损伤是保护缺血心肌, 减少心肌梗塞大小, 预防STEMI患者心力衰竭发作的首选治疗方法。线粒体自噬在缺血再灌注中的作用是一把“双刃剑”。受损的心肌细胞可以通过激活AMPK [adenosine 5'-monophosphate (AMP)-activated protein kinase] 途径诱导线粒体自噬来清除受损的线粒体, 从而起到保护缺血心肌的作用[18]。但是, 如果线粒体过度自噬, 可能会降解正常的线粒体, 对心肌细胞造成进一步的损伤[19]。
因此, 调控和监测细胞内线粒体自噬水平、找出线粒体自噬水平的有效平衡点、维持线粒体稳态对调控心脏能量代谢至关重要。线粒体自噬在缺血性心脏病的发生发展中是双刃剑, 在不同情况下可通过激活或抑制线粒体自噬途径来治疗缺血性心脏病。
4 调控线粒体自噬的天然药物 4.1 激活线粒体自噬的天然药物 4.1.1 白藜芦醇白藜芦醇(resveratrol) 是一种天然多酚类药物, 具有抗氧化、抗衰老等作用, 其多种药理活性归因于对沉默信息调节因子SIRT1的激活[20]。原代培养的大鼠心肌细胞用终浓度5和20 μmol·L-1白藜芦醇预处理12 h, 再进行缺氧12 h复氧12 h以构建缺血/缺氧模型, 结果表明, 白藜芦醇会上调LC3-Ⅱ和Parkin的表达, 提高Parkin与P62的结合程度。其中, P62是泛素结合蛋白, 当细胞受损时, Parkin可通过泛素化吸引P62, 启动线粒体自噬, 而LC3B是LC3家族蛋白, 在自噬体的形成中LC3B-Ⅰ被脂质化为LC3B-Ⅱ, 二者均对自噬过程的形成起着重要作用。表明白藜芦醇通过激活PINK1-Parkin信号通路介导的线粒体自噬以减轻心肌细胞缺血/再灌注损伤[21]。
4.1.2 丹皮酚丹皮酚(paeonol) 是一种从毛茛科植物牡丹的干燥根皮中提取出来的有效成分。分别进行体内体外实验, 验证丹皮酚对缺血性心脏病的作用。在结扎左冠状动脉前降支构建的SD大鼠心肌梗死模型中, 以12 mg·kg-1丹皮酚的剂量灌胃处理4周, 另外通过缺氧2 h构建H9c2心肌细胞缺氧模型进行体内外实验, 100 μmol·L-1丹皮酚显著降低P62表达, 升高PINK1、Parkin表达, 升高LC3-Ⅱ/LC3-Ⅰ比值, 通过激活PINK1-Parkin介导的线粒体自噬减轻心肌细胞损伤[22]。
4.1.3 五味子乙素中药五味子具有抗炎、抗肿瘤和抗心肌缺血损伤等作用, 其主要活性成分是五味子乙素(schisandrin B)。通过结扎左冠状动脉前降支45 min, 再灌注2 h构建模型, 以80 mg·kg-1·d-1五味子乙素灌胃给药30天, 结果显示, 五味子乙素可以明显提高自噬标记蛋白HIF-1α和Beclin1的表达, 并且诱导AMPK-mTOR-ULK1通路的激活, 调控心肌细胞线粒体自噬, 抑制缺氧损伤诱导的心肌细胞凋亡[23]。
4.1.4 三七总皂苷三七总皂苷(panax notoginseng saponins) 是中药中常用的治疗心血管疾病的天然产物成分, 其作用机制尚不明确。通过结扎冠状动脉左前降支构建SD大鼠缺血/再灌注模型, 腹腔注射30和60 mg·kg-1三七总皂苷预处理7天, 发现其显著增加大鼠心肌组织中HIF-1α、BNIP3和Beclin1的表达, 通过激活BNIP3/NIX途径增强线粒体自噬, 有效防御缺血/再灌注损伤[24]。
4.1.5 梓醇梓醇(catalpol) 是中药地黄中的主要活性成分, 发挥神经保护、抗炎等作用。使用28 μmol·L-1梓醇处理24 h后, 糖剥夺6 h对H9c2心肌细胞进行无糖饥饿处理, 梓醇干预可以上调Beclin1、LC3和Parkin表达, 下调P62、PINK1表达, 并出现明显的自噬小体, 其中包裹着破损的线粒体。提示梓醇通过上调PINK1-Parkin通路, 激活线粒体自噬, 减轻心肌缺血损伤[25]。
4.2 抑制线粒体自噬的天然药物 4.2.1 丹参酮IIA丹参广泛应用于心血管疾病, 其主要活性成分包括丹参酮和丹酚酸等。其中丹参酮ⅡA (tanshinone ⅡA) 是丹参酮中一个单体成分。在冠状动脉结扎的急性心肌梗死大鼠模型中, 连续腹腔注射3周20、50和100 mg·kg-1的丹参酮IIA, 能够上调心肌细胞中PI3K-Akt-mTOR通路表达, 提高P62的表达, 降低LC3B-Ⅱ/LC3B-Ⅰ比值, 从而抑制线粒体自噬, 发挥抗心肌缺血作用[26, 27]。
4.2.2 丹酚酸B丹参中另一类活性成分丹酚酸B (salvianolic acid B) 是一种酚类化合物, 也对缺血性心肌具有保护作用。在通过缺氧4 h复氧2 h构建H9c2心肌细胞模型中, 50 μmol·L-1丹酚酸B处理3 h, 可显著升高线粒体膜电位, 降低LC3-Ⅱ/LC3-Ⅰ比值与NIX蛋白表达水平, 表明丹酚酸B通过抑制NIX介导的线粒体自噬, 对缺血心肌细胞起保护作用[28]。
4.2.3 荭草苷苗药都木油是陵齿蕨科乌蕨属植物乌蕨的全草和根茎, 其主要活性成分荭草苷(orientin) 具有保护心血管系统的作用。在通过结扎冠状动脉左前降支缺血30 min、再灌注120 min的SD大鼠中, 连续7天腹腔注射1.0、2.0和4.0 mg·kg-1·d-1荭草苷, 显著降低P62和Parkin的表达水平, 减少P62与Parkin的结合, 降低自噬体对于受损线粒体的识别, 抑制再灌注中过度的线粒体自噬, 改善心肌缺血再灌注损伤[29]。
4.2.4 黄芪甲苷黄芪甲苷(astragaloside Ⅳ) 是中药黄芪中的活性成分, 在心血管疾病的治疗方面有一定的作用。通过左冠状动脉前降支结扎法构建心肌缺血/再灌注大鼠模型, 每日3次连续7天以30 mg·kg-1黄芪甲苷进行灌胃给药, 可以减轻心肌损伤, 同时, 可以降低PINK1、Parkin蛋白的表达, 提示黄芪甲苷对于心肌缺血的保护作用可能与抑制PINK1-Parkin介导的线粒体自噬有关[30]。
4.2.5 表没食子儿茶素没食子酸酯表没食子儿茶素没食子酸酯(epigallocatechin gallate, EGCG) 是从茶叶中分离得到的儿茶素类单体, 具有抗氧化和抗肿瘤活性。在利用结扎左冠状动脉前降支缺血30 min、再灌注2 h构建大鼠模型中, 再灌注前10 min进行舌下静脉注射10 mg·kg-1 EGCG, 测定自噬相关蛋白表达含量。结果显示, 缺血/再灌注会导致自噬的异常增加, 导致自噬流损伤, EGCG会恢复异常升高的LC3-Ⅱ/LC3-Ⅰ比值以及Beclin1和P62的表达水平, 修复自噬流[31]。
4.3 既激活又抑制线粒体自噬的天然药物 4.3.1 黄连素黄连素(berberine) 是黄连中的主要活性成分, 临床中常用于治疗痢疾杆菌和大肠杆菌引起的肠道感染。近些年有研究表明, 黄连素对缺血性心脏病有独特的调控作用。用50 μmol·L-1黄连素预处理H9c2心肌细胞1、3和5 h, 随后缺氧4 h、复氧3 h处理细胞, 黄连素通过上调PINK1、Parkin蛋白含量, 激活PINK1-Parkin信号通路, 促进线粒体自噬, 减轻心肌缺血再灌注损伤[32]。另外在最近的体内外研究中, 体外使用50 μmol·L-1黄连素预处理H9c2细胞3 h, 经过缺氧4 h复氧3 h, 构建体外缺血/缺氧细胞模型。利用左前降支冠状动脉结扎缺血30 min、再灌注120 min体内模型, 提前用300 mg·kg-1黄连素灌胃3天, 体内体外实验结果均表明, 黄连素处理会增加LC3-Ⅱ/LC3-Ⅰ比值、BNIP3和NIX含量, 通过激活BNIP3/NIX通路介导的线粒体自噬减轻心肌细胞及模型大鼠的缺血/再灌注损伤[33]。
另一方面, 在通过缺氧6 h复氧1 h处理的体外H9c2心肌细胞中, 以5、10和25 μmol·L-1浓度黄连素预处理4 h, 可通过降低ROS水平以及抑制BNIP3/NIX信号通路抑制过度自噬[34, 35]。黄连素对线粒体自噬的双重作用提示其可在缺血性心脏病中调控线粒体自噬的平衡。
4.3.2 人参皂苷人参作为一种中药材已经在亚洲国家广泛使用了数千年。其衍生制剂参麦注射液是经CFDA批准并在中国销售的用于治疗各种心脏功能障碍, 尤其是心肌缺血/再灌注损伤的中草药注射剂。参麦注射液主要由红参、麦冬组成, 其主要活性成分是人参皂苷(ginsenoside)。线粒体自噬不平衡在缺血/再灌注损伤期间持续存在, 使用参麦注射液1、2.5和5 μmol·L-1预处理24 h, 再经缺氧12 h复氧2 h处理H9c2心肌细胞, 参麦注射液可以升高PINK1、Parkin、LC3和Beclin1的蛋白表达, 增强线粒体自噬, 抑制线粒体过度分裂, 增加线粒体融合以改善心肌缺血性损伤[36]。
从人参中提取的原人参二醇型人参皂苷的主要肠道代谢物是人参皂苷化合物K (ginsenoside compound K, GCK)。2018年进行的一项研究构建缺氧缺糖3、6、9、12 h复氧复糖4、8、12、16、20 h的H9c2心肌细胞模型, 并通过2、4、8 μmol·L-1 GCK预处理48 h或者通过4、8 μmol·L-1预处理24 h, 发现GCK可降低ROS积累和线粒体损伤, 其机制可能与激活PI3K-Akt信号通路, 激活mTOR, 抑制过度的线粒体自噬, 从而发挥心肌保护作用相关[37]。另外, 体外通过缺氧12、24、48 h构建H9c2缺氧模型, 0~200 μmol·L-1人参皂苷Rg1 (ginsenoside-Rg1) 处理, 体内在缺血前60 min进行灌胃给药10 mg·kg-1人参皂苷Rg1, 结扎SD大鼠左冠状动脉前降支缺血30 min, 再灌注180 min, 结果显示, 模型组LC3-Ⅱ/LC3-Ⅰ水平和Beclin1的表达水平显著升高, P62的表达水平降低, 激活线粒体自噬, 人参皂苷Rg1及时改善由缺氧诱导的上述变化, 并通过激活PI3K-Akt-mTOR信号通路抑制过度的线粒体自噬, 保护心肌细胞缺氧损伤及体内大鼠心肌缺血/再灌注损伤[38]。这种结果可能是由于自噬在缺血/再灌注损伤中的双重作用所导致的。
4.3.3 姜黄素姜黄中的主要活性成分是姜黄素(curcumin), 被报道具有心脏保护作用。在体外缺氧1.5 h复氧24 h构建小鼠原代心肌细胞模型, 以10 μmol·L-1浓度的姜黄素预处理24 h, 随后检测自噬相关蛋白的表达量以表征其自噬程度; 体内通过左冠状动脉前降支结扎术缺氧30 min复氧3天, 尾静脉注射100 mg·kg-1·d-1姜黄素连续3天。体内体外实验结果均表明, 姜黄素可以升高LC3-Ⅱ水平, 降低mTOR下游信号分子4EBP1 (eukaryotic translation initiation factor 4E-binding protein 1) 的磷酸化, 激活AMPK信号, 抑制mTOR信号, 促进自噬[39]。
除了激活线粒体自噬作用, 姜黄素还可抑制线粒体自噬来保护缺血性心肌。使用1、5、10、20、40和80 μmol·L-1姜黄素预处理H9c2细胞1 h, 随后缺氧1 h复氧3 h, 姜黄素处理组细胞活力明显上升, LC3B-Ⅱ/LC3B-Ⅰ比值降低, 自噬相关蛋白Beclin1和BNIP3水平显著下降, 提示姜黄素可能通过抑制BNIP3介导的线粒体自噬途径发挥作用[40]。
另外, 去甲氧基姜黄素(demethoxycurcumin, DMC) 是姜黄素的天然衍生物, 二者具有相似的化学结构及药理活性, 关于其对心血管疾病的研究较少。在经过结扎左冠状动脉前降支缺血30 min、再灌注120 min大鼠模型中, 以10、15和30 mg·kg-1·d-1剂量的DMC腹腔注射给药连续7天后发现, LC3-Ⅱ/LC3-Ⅰ比值与Beclin1蛋白表达水平均降低, P62蛋白表达水平升高, 抑制线粒体过度自噬, 减轻心肌损伤。并且, p-mTOR蛋白表达水平和p-mTOR/mTOR比值升高, 说明DMC发挥抑制线粒体自噬的作用是通过激活PI3K-Akt-mTOR途径介导的[41]。
4.3.4 九龙藤总黄酮九龙藤(bauhinia championii) 是广西特色中草药, 富含黄酮类成分。通过结扎左冠状动脉前降支30 min, 再灌注60 min建立心肌缺血/再灌注模型, 以10和20 mg·kg-1的剂量于造模前10 min舌下静脉给药。结果表明, 九龙藤总黄酮(bauhinia championii flavones, BCF) 上调缺血期LC3-Ⅱ和Beclin1蛋白表达水平, 下调再灌注期LC3-Ⅱ和Beclin1蛋白表达水平, 在缺血、再灌注阶段均降低mTOR蛋白水平。推测BCF发挥抗缺血性心脏病的作用依赖于在缺血期促进自噬, 在再灌注期抑制自噬[42]。
另外, 结扎左冠状动脉前降支30 min, 再灌注3 h, 舌下静脉注射20 mg·kg-1 BCF后, 能明显降低大鼠心肌细胞的自噬水平, PI3K-Akt下游靶点mTOR、P70S6K的磷酸化水平升高, 推测BCF通过激活PI3K-Akt信号通路, 减少再灌注期自噬的过度表达[43]。
研究证明, 很多抗缺血性心脏病的天然药物具有激活线粒体自噬途径或抑制线粒体自噬途径的作用, 也有天然药物可以通过激活和抑制线粒体自噬途径, 调控其之间的平衡来发挥缺血性心肌保护作用, 请参见调控线粒体自噬的天然药物及其可能的作用机制汇总表(表 1)[21-26, 28-33, 35-43]。
| 表 1 Regulatory effect of natural drugs on mitochondrial autophagy. ig: Intragastric administration; ip: Intraperitoneal injection; iv: Intravenous injection |
综上所述, 可以得到针对激活或抑制线粒体自噬、靶向不同信号通路或受体分子的天然药物(图 1)。线粒体功能异常在缺血性心脏病的发病中起重要作用, 线粒体自噬在缺血性心脏病中具有两个方面的重要作用。一方面, 适度的自噬可以清除受损线粒体从而保护心肌, 另一方面, 过度自噬会吞噬正常线粒体进一步损伤心肌, 因此线粒体自噬程度的平衡在缺血性心脏病的治疗中尤为重要。现已发现能够同时发挥激活线粒体自噬和抑制线粒体自噬途径的天然药物, 是否暗示其可以灵活调控线粒体自噬的水平?其具体原因是中药多成分、多靶点的特性, 可靶向多条信号通路或受体分子, 当自噬缺乏时, 激活线粒体自噬途径; 当自噬过度时, 抑制线粒体自噬途径。从上述研究中可以看出, 给药浓度及方式差别不大, 又因为自噬过程是一个动态的过程, 其自噬程度逐步增加, 因此有可能缺血情况下, 天然药物发挥激活线粒体自噬作用, 增强缺血性适应, 但随着给药时间的延长, 线粒体自噬越过稳定值, 达到过度自噬, 此时天然药物转换靶向节点分子, 发挥抑制线粒体自噬作用, 从而达到调控线粒体自噬平衡的目的。因此作者认为, 之所以黄连素、人参皂苷、姜黄素和九龙藤总黄酮4种天然药物能够发挥调控线粒体自噬的双重作用, 很大程度上取决于多个节点分子的靶向性。
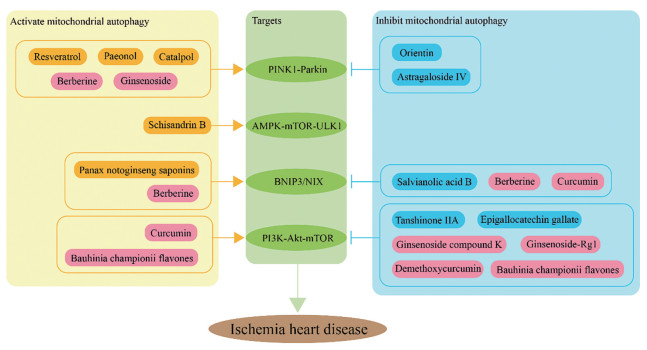
|
图 1 Natural drugs from plants targeting the main signaling pathway and receptor molecules of mitochondrial autophagy |
缺血/再灌注早期, 线粒体自噬的增强可以清除损伤线粒体, 挽救缺血性心肌损伤, 而在缺血/再灌注的后期, 则需要更多关注线粒体自噬水平。过高水平的线粒体自噬可能会损伤缺血性心肌。然而, 针对缺血性心脏病中线粒体自噬调控的相关研究仍存在许多不足。目前, 针对缺血后自噬水平升高还是降低的推论仍旧存在争议。在缺血再灌注期间, 自噬是否有助于心肌细胞存活或死亡也没有明确的定论, 同时, 很多研究仅仅关注于给药前后自噬水平的变化, 以此展现天然药物的调控作用, 但作者认为应同样关注造模前后自噬水平的变化, 这样才能从根本上了解线粒体自噬对缺血性心脏病的发生发展的影响, 有利于后续天然药物的研究。对判断天然药物究竟是增强自身的缺血后适应, 还是进行损伤后修复, 都有很大帮助。另外, 大部分研究的给药方式、给药途径和给药浓度/剂量都不同, 导致不同的结果, 使得横向比较较为困难。因此, 今后研究方向应重点在探究线粒体自噬在缺血性心脏病中双重作用的具体机制, 发现更多的信号通路及受体分子, 寻找适度增强线粒体自噬途径的天然药物, 灵活地调控心肌缺血性损伤。天然药物常常具有多靶点、多组分的特性, 因此当探究抗缺血性心脏病的天然药物时, 许多活性组分都调控多种线粒体自噬通路, 产生激活和抑制线粒体自噬的作用。这种多重作用可以更好地调控线粒体功能, 维持线粒体自噬的平衡, 使得线粒体自噬可以发挥清除损伤的作用的同时, 不带来因过度自噬而产生的心肌持续性损伤。将来, 可以考虑使用组合疗法来更灵活地控制线粒体自噬的程度, 以维持组织的稳态, 并依赖于不同患者的症状通过个性化医疗来治疗缺血性心脏病。
作者贡献: 龚迪菲负责文献检索和文章撰写; 方莲花和杜冠华指导论文写作与修改, 对整体结构和质量进行把控。
利益冲突: 无任何经济利益或版权冲突。
| [1] |
Roth GA, Mensah GA, Johnson CO, et al. Global burden of cardiovascular diseases and risk factors, 1990-2019:update from the GBD 2019 study[J]. J Am Coll Cardiol, 2020, 76: 2982-3021. |
| [2] |
Yin P, Qi JL, Liu YN, et al. Burden of disease in the Chinese population from 2005 to 2017[J]. Circ J, 2019, 34: 1145-1154. |
| [3] |
Zhou M, Wang H, Zeng X, et al. Mortality, morbidity, and risk factors in China and its provinces, 1990-2017:a systematic analysis for the global burden of disease study 2017[J]. Lancet, 2019, 394: 1145-1158. DOI:10.1016/S0140-6736(19)30427-1 |
| [4] |
Galluzzi L, Green DR. Autophagy-independent functions of the autophagy machinery[J]. Cell, 2019, 177: 1682-1699. DOI:10.1016/j.cell.2019.05.026 |
| [5] |
Gatica D, Lahiri V, Klionsky DJ. Cargo recognition and degradation by selective autophagy[J]. Nat Cell Biol, 2018, 20: 233-242. DOI:10.1038/s41556-018-0037-z |
| [6] |
Lemasters JJ. Selective mitochondrial autophagy, or mitophagy, as a targeted defense against oxidative stress, mitochondrial dysfunction, and aging[J]. Rejuvenation Res, 2005, 8: 3-5. DOI:10.1089/rej.2005.8.3 |
| [7] |
Saito T, Sadoshima J. Molecular mechanisms of mitochondrial autophagy/mitophagy in the heart[J]. Circ Res, 2015, 116: 1477-1490. DOI:10.1161/CIRCRESAHA.116.303790 |
| [8] |
Aerts L, Craessaerts K, De Strooper B, et al. PINK1 kinase catalytic activity is regulated by phosphorylation on serines 228 and 402[J]. J Biol Chem, 2015, 290: 2798-2811. DOI:10.1074/jbc.M114.620906 |
| [9] |
Aguirre JD, Dunkerley KM, Mercier P, et al. Structure of phosphorylated UBL domain and insights into PINK1-orchestrated parkin activation[J]. Proc Natl Acad Sci U S A, 2017, 114: 298-303. DOI:10.1073/pnas.1613040114 |
| [10] |
Randow F, Youle RJ. Self and nonself: how autophagy targets mitochondria and bacteria[J]. Cell Host Microbe, 2014, 15: 403-411. DOI:10.1016/j.chom.2014.03.012 |
| [11] |
Ney PA. Mitochondrial autophagy: origins, significance, and role of BNIP3 and NIX[J]. Biochim Biophys Acta, 2015, 1853: 2775-2783. |
| [12] |
Chourasia AH, Macleod KF. Tumor suppressor functions of BNIP3 and mitophagy[J]. Autophagy, 2015, 11: 1937-1938. DOI:10.1080/15548627.2015.1085136 |
| [13] |
Panigrahi DP, Praharaj PP, Bhol CS, et al. The emerging, multifaceted role of mitophagy in cancer and cancer therapeutics[J]. Semin Cancer Biol, 2020, 66: 45-58. DOI:10.1016/j.semcancer.2019.07.015 |
| [14] |
Chen M, Chen Z, Wang Y, et al. Mitophagy receptor FUNDC1 regulates mitochondrial dynamics and mitophagy[J]. Autophagy, 2016, 12: 689-702. DOI:10.1080/15548627.2016.1151580 |
| [15] |
Farré JC, Burkenroad A, Burnett SF, et al. Phosphorylation of mitophagy and pexophagy receptors coordinates their interaction with Atg8 and Atg11[J]. EMBO Rep, 2013, 14: 441-449. DOI:10.1038/embor.2013.40 |
| [16] |
Hausenloy DJ, Yellon DM. Ischemic conditioning and reperfusion injury[J]. Nat Rev Cardiol, 2016, 13: 193-209. DOI:10.1038/nrcardio.2016.5 |
| [17] |
Ong SB, Samangouei P, Kalkhoran SB, et al. The mitochondrial permeability transition pore and its role in myocardial ischemia reperfusion injury[J]. J Mol Cell Cardiol, 2015, 78: 23-34. |
| [18] |
Zhao B, Qiang L, Joseph J, et al. Mitochondrial dysfunction activates the AMPK signaling and autophagy to promote cell survival[J]. Genes Dis, 2016, 3: 82-87. |
| [19] |
Jin Q, Li R, Hu N, et al. DUSP1 alleviates cardiac ischemia/reperfusion injury by suppressing the Mff-required mitochondrial fission and Bnip3-related mitophagy via the JNK pathways[J]. Redox Biol, 2018, 14: 576-587. |
| [20] |
Xiang F, Li MH, Xu L, et al. Resveratrol alleviates cerebral ischemia/reperfusion injury in mice by promoting mitophagy[J]. Chin Pharmacol Bull (中国药理学通报), 2019, 35: 815-821. |
| [21] |
Sun XX. Molecular Mechanism of Resveratrol against Hypoxia/reoxygenation Injury of Cardiomyocytes based on Mitochondrial Quality Control (白藜芦醇基于线粒体质量控制的抗心肌细胞缺氧/复氧损伤的分子机制研究)[D]. Beijing: Minzu University of China, 2018.
|
| [22] |
Liu C, Wang MJ, Fan YF, et al. The improved effect of paeonol on cardiac function after myocardial infarction in rats and its influence on Pink1/Parkin[J]. World Sci Technol Mod Tradit Chin Med (世界科学技术——中医药现代化), 2020, 22: 1428-1436. |
| [23] |
Lu CQ, Jia HL, Lei Z, et al. Schisandrin B alleviates myocardial ischemia/reperfusion injury via maintaining mitophagy[J]. Acta Univ Med Anhui (安徽医科大学学报), 2019, 54: 418-428. |
| [24] |
Liu XW, Lu MK, Zhong HT, et al. Panax notoginseng saponins attenuate myocardial ischemia-reperfusion injury through the HIF-1α/BNIP3 pathway of autophagy[J]. J Cardiovasc Pharmacol, 2019, 73: 92-99. |
| [25] |
Wang SY, Lu Y, Cai DF, et al. Effect of catalpol on glucose deprivation cardiomyocyte injury based on estrogen receptor[J]. Chin Pharmacol Bull (中国药理学通报), 2019, 35: 786-792. |
| [26] |
Wang JN, Lin JA, Du MM. Effects of tanshinone ⅡA on cardiac function and mitophagy of myocardial infraction rats[J]. Mol Immunol, 2019, 35: 418-423. |
| [27] |
Li Q, Shen L, Wang Z, et al. Tanshinone ⅡA protects against myocardial ischemia reperfusion injury by activating the PI3K/Akt/mTOR signaling pathway[J]. Biomed Pharmacother, 2016, 84: 106-114. |
| [28] |
Xin GJ, Fu JH, Han X, et al. Salvianolic acid B regulates mitochondrial autophagy mediated by NIX to protect H9c2 cardiomyocytes from hypoxia/reoxygenation injury[J]. China J Chin Mater Med (中国中药杂志), 2020, 45: 2960-2965. |
| [29] |
Sun XY, Xu J, Wu YX, et al. Mechanism study of orientin protecting rat heart from myocardial ischemia/reperfusion injury based on mitochondrial quality control[J]. Chin Tradit Herb Drugs (中草药), 2018, 49: 4337-4343. |
| [30] |
Zhang DW, Zhao HY, Li QS, et al. Effect of astragaloside Ⅳ and ginsenoside Rg1 on autophagy of myocardial tissue injury induced by ischemia-reperfusion injury in hyperlipidemic mice[J]. Chin Arch Tradit Chin Med (中华中医药学刊), 2020, 38: 60-64. |
| [31] |
Xuan F, Jian J. Epigallocatechin gallate exerts protective effects against myocardial ischemia/reperfusion injury through the PI3K/Akt pathway-mediated inhibition of apoptosis and the restoration of the autophagic flux[J]. Int J Mol Med, 2016, 38: 328-336. |
| [32] |
Zhu N, Cao X, Hao P, et al. Berberine attenuates mitochondrial dysfunction by inducing autophagic flux in myocardial hypoxia/reoxygenation injury[J]. Cell Stress Chaperones, 2020, 25: 417-426. |
| [33] |
Zhu N, Li J, Li Y, et al. Berberine protects against simulated ischemia/reperfusion injury-induced H9C2 cardiomyocytes apoptosis in vitro and myocardial ischemia/reperfusion-induced apoptosis in vivo by regulating the mitophagy-mediated HIF-1α/BNIP3 pathway[J]. Front Pharmacol, 2020, 11: 367. |
| [34] |
Zhou YY, Li Y, Jiang WQ, et al. MAPK/JNK signaling: a potential autophagy regulation pathway[J]. Biosci Rep, 2015, 35: e00199. |
| [35] |
Jia Z, Lin L, Huang S, et al. Inhibition of autophagy by berberine enhances the survival of H9C2 myocytes following hypoxia[J]. Mol Med Rep, 2017, 16: 1677-1684. |
| [36] |
Yu J, Li Y, Liu X, et al. Mitochondrial dynamics modulation as a critical contribution for Shenmai injection in attenuating hypoxia/reoxygenation injury[J]. J Ethnopharmacol, 2019, 237: 9-19. |
| [37] |
Li X, Huang Q, Wang M, et al. Compound K inhibits autophagy-mediated apoptosis through activation of the PI3K-Akt signaling pathway thus protecting against ischemia/reperfusion injury[J]. Cell Physiol Biochem, 2018, 47: 2589-2601. |
| [38] |
Qin L, Fan S, Jia R, et al. Ginsenoside Rg1 protects cardiomyocytes from hypoxia-induced injury through the PI3K/AKT/mTOR pathway[J]. Pharmazie, 2018, 73: 349-355. |
| [39] |
Yang K, Xu C, LI X, et al. Combination of D942 with curcumin protects cardiomyocytes from ischemic damage through promoting autophagy[J]. J Cardiovasc Pharmacol Ther, 2013, 18: 570-581. |
| [40] |
Huang Z, Ye B, Dai Z, et al. Curcumin inhibits autophagy and apoptosis in hypoxia/reoxygenation-induced myocytes[J]. Mol Med Rep, 2015, 11: 4678-4684. |
| [41] |
Cui JK, Geng NZ, Meng FJ, et al. Protective effect of demethoxycurcumin on myocardial ischemia reperfusion injury in rats by regulating cell autophagy through PI3K-AKT-MTOR signal pathway[J]. Acta Chin Med Pharmacol (中医药学报), 2020, 48: 19-24. |
| [42] |
Sun Y, Zhang C, Jian J. Effects of Bauhinia championii flavones on adjusting autophagy against myocardial ischemia/reperfusion injury[J]. Chin Pharmacol Bull (中国药理学通报), 2015, 31: 232-236. |
| [43] |
Xuan FF. Study on the Regulation and Its Mechanism of Bauhinia championii Flavones on PI3K/Akt Signaling Pathway in Myocardial Ischemia Reperfusion Injury Rats (九龙藤总黄酮对心肌缺血再灌注损伤大鼠PI3K/Akt信号通路的调控作用及机制研究)[D]. Guangxi: Guangxi Medical University, 2016.
|
 2021, Vol. 56
2021, Vol. 56


