2. 山西大学体育学院, 山西 太原 030006
2. School of Physical Education, Shanxi University, Taiyuan 030006, China
抑郁症是一种常见的情感障碍性精神疾病, 患者表现出心情郁闷、丧失兴趣、带有负罪感等心理状态, 具有高患病率、高疾病负担、高致残率和高异质性等特点, 是世界性公共卫生难题[1]。预计到2030年, 抑郁症将成为居于首位的疾病[2]。截至目前, 抗抑郁药物仍然是治疗抑郁症的经典手段, 虽然可使一些患者的病情得到缓解, 但这些患者也会伴有一些功能障碍, 如神经功能异常、心血管功能异常、泌尿功能异常等[3]。近年来, 越来越多的证据指向抑郁症的发病机制与肠道菌群的结构和功能改变密切相关, 为抑郁症的发病和治疗研究提供了新思路。
自2007年底美国国立卫生研究院启动“人物微生物组计划”以来, 肠道菌群在机体的生理及病理学研究中的地位越来越突出。人类肠道中定植了数以万计的肠道菌群, 是一个复杂的微生物群落系统, 其作为一个动态整体, 受到多种因素影响。肠道菌群参与机体代谢为其提供底物和能量, 参与构成肠黏膜免疫屏障等, 对宿主的正常生理功能产生重要影响。由于肠道菌群具有显著的宿主特异性, 易受到宿主内外环境的影响, 在一定程度上使得肠道菌群的数量和种类发生变化。对于越来越多的疾病来说, 微生物群的改变逐渐成为疾病的诊断和疗效判定的指标, 且在病理学中发挥着重要作用[4]。临床研究发现, 肠道菌群在抑郁症等精神疾病的发病中也扮演重要角色, 重性抑郁症患者与健康人在肠道菌群的多样性、菌群丰度以及比例方面存在显著差异[5]。这些研究为抑郁症的治疗及预防提供了新的见解。但是, 临床研究很难在人体中进行直接干预实验以探究肠道菌群改变与疾病核心机制的因果关系, 因此应用人源化粪菌移植实验动物模型探讨疾病与肠道菌群的关系, 并阐释药物通过干预肠道菌群发挥治疗作用的药理机制尤为重要。
随着菌群移植技术的不断发展和成熟, 人们开始尝试将人类粪便菌群移植到实验动物体内进行科学研究, 通过这种技术手段建立人源化粪菌移植实验动物模型[6]。与其他实验动物模型相比, 粪菌移植动物模型不仅可有效控制宿主遗传背景、环境因素及菌群等因素, 还可提供非常丰富的生物学信息“大数据”。此外, 人源化粪菌移植还缩小了动物与人之间在肠道微生态方面的差异。因此, 利用人源化粪菌移植实验动物模型模拟人的胃肠道系统以及肠道菌群的生活环境, 已成为揭示中医药与肠道菌群相互作用关系的关键研究策略之一。
本文对粪菌移植技术的发展历程及其应用、菌群与抑郁症之间的密切联系、人源化粪菌移植实验动物模型在抑郁症研究中的应用, 以及人源化菌群制备的方法和关键技术进行综述, 为人源化粪菌移植实验动物模型在抑郁症发病机制研究及抗抑郁药物作用机制研究方面的合理应用提供参考依据。
1 粪菌移植技术的发展历程及其应用 1.1 粪菌移植技术的发展历程为了恢复患者正常的肠道生态, 将健康个体的粪便处理成混悬液, 通过多种途径输注到患者胃肠道内, 以期重建肠道菌群, 即粪菌移植技术(fecal microbiota transplantation, FMT)。FMT最早可以追溯到1 700多年前的东晋时期, 《肘后备急方》首次记载了用粪清治疗食物中毒、严重腹泻和发热并濒临死亡患者的方子: “绞粪汁, 饮数合至一二升, 谓之黄龙汤, 陈久者佳”。之后的大量中医学书籍, 如《本草纲目》、《伤寒论》等都不断更新其用法、治疗危重疾病状态及效果评估。国外关于FMT的最早报道可追溯至1958年美国Eiseman等[7]报道的FMT可有效治疗伪膜性肠炎患者, 由于当时对抗生素认识的局限性和错误地认为金葡菌感染是伪膜性肠炎的主因, FMT并未引起关注。1978年, 梭状芽胞杆菌感染被发现是伪膜性肠炎的主因, 并与抗生素的使用密切相关, 粪菌治病的方法才逐渐得到重视[8, 9]。此后, 有关FMT研究的文献出现井喷式的增加。
1.2 粪菌移植技术的应用现状研究结果表明, 宿主的遗传特性、饮食结构和肠道菌群的组成存在着复杂的相互作用关系。人体微生物特别是肠道微生物, 其基因数目远超宿主本身, 并且因为其在宿主代谢和免疫调节等方面发挥的重要作用而备受研究者关注[10]。越来越多的研究揭示了菌群和人类疾病之间的密切关联, 表明肠道菌群的紊乱极有可能是多种疾病的关键风险因素[11]。目前, 随着有关肠道菌群基础研究的不断深入, 已有研究发现肠道菌群应用于临床常规治疗或临床实验的疾病包括消化系统疾病(结肠炎、顽固性便秘、炎症性肠病)、内分泌系统疾病(糖尿病、肥胖)、自身免疫性疾病、慢性疲劳综合征、心血管疾病、神经精神疾病(抑郁症、自闭症、焦虑) 以及慢性肾病、肿瘤和衰老等多病因异质性疾病[12-16]。
2 人源化粪菌移植实验动物模型制备 2.1 研究策略在临床中, 研究肠道菌群在抑郁状态下的作用机制存在巨大挑战, 不论是在健康还是疾病状态下, 要探索人体自身的生物学问题, 都需要特定观察对象和大量实验素材。在涉及人体的研究中, 人为引入病原体、致癌物或者毒性物质, 在伦理上是严格禁止的, 且很难从人体获得所需的各种组织样本等。尽管体外细胞培养可解决部分问题, 但仍难以再现有机体的整体性及生物体各系统之间的相互作用, 而且由于不同环境因素(工作环境、居住地、饮食习惯等) 造成个体间菌群组成存在巨大差异, 通常需要数量较大的样本[17, 18]。因此, 亟需选择一种合适的实验动物模型替代人体应用于科学研究。
啮齿类动物具有繁殖速度快、可形成近交系、饲养方便等特点, 使其成为最为理想的实验动物研究对象之一[19]。然而, 动物与人体的肠道菌群组成具有一定的差异性, 因此动物体内的实验结果并不能完全等同于人体结果。利用接种了人体肠道菌群的小鼠, 构建出具有人源化菌群的实验动物模型, 可为研究人体肠道菌群生态系统和疾病发病机制提供有效的研究手段。
目前, 解析与疾病表型相关的肠道菌群改变与疾病核心病理机制因果关系的关键研究策略主要是将人源粪便菌群通过基因组测序, 鉴定出与疾病或证候相关的特异性菌属, 然后将菌液或纯化的特异性菌群以灌胃方式注入无菌小鼠或者伪无菌小鼠(将无特定病原体的小鼠通过给予混合抗生素处理后得到的小鼠) 体内, 最后通过表型鉴定建立肠道菌群和疾病证候的因果关系。
2.2 实验设计依据上述研究策略, 利用粪菌移植揭示抑郁症与肠道微生物群改变相关性因果关联实验设计示意图如图 1所示。首先, 通过汉密尔顿抑郁量表(hamilton depression scale) 和抑郁自评量表(self-rating depression scale) 对临床招募的受试者进行筛选, 分别收集健康者和抑郁患者的粪便样本, 并在采集后2 h内进行处理, 然后采用宏基因组测序分析, 筛选和鉴定出与疾病或证候相关的特异性菌群。在测序的同时, 对供试者依据证候或疾病诊断标准进行分组。对样品进行粪便悬液制备后, 挑选不同背景的无菌小鼠或者伪无菌小鼠, 通过灌胃给予无菌/伪无菌小鼠粪便悬液建立粪菌移植抑郁症实验动物模型, 进一步监测无菌/伪无菌小鼠不同组别的代谢表型, 探讨抑郁症发生发展的机制, 给予中药或者化药进行药效与机制研究。最后整合临床信息、粪菌移植实验动物表型及宏基因组测序结果, 进一步阐释肠道菌群与抑郁症的因果关系。
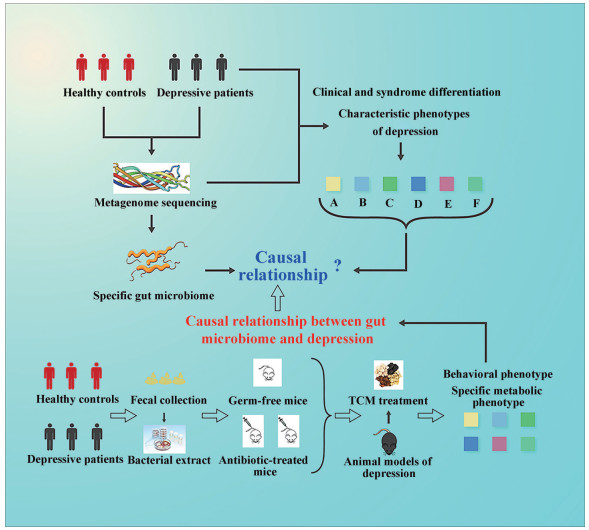
|
图 1 The application of the experimental animal model of human fecal bacteria transplantation in the study of the pathogenesis of depression. TCM: Traditional Chinese medicine |
粪菌移植类似于现代医学外科手术中的器官移植, 存在传播疾病的风险, 必须对供体进行严格筛查, 排除潜在危害问题[20]。在供体选择时要制定严格的纳入排除标准, 包括遗传背景、表型特征、传染病、常见病原体检查等指标, 确保供体选择恰当, 保证研究结果准确可靠。
2.3.2 菌液制备人源粪便悬液的制备一般在洁净工作台进行, 其制备标准尚未统一。收集到供体粪便样本后, 应经过混悬、离心、过滤等过程。首先以无菌生理盐水或磷酸盐缓冲盐溶液稀释粪便样本, 溶剂体积为3~5倍, 均匀搅拌15 min使粪便均匀化, 达到液体浆液浓度; 接着使用物理方法过滤、离心粪便匀浆液, 去除较大的颗粒物, 最后将粪便悬液置于密闭容器中, 在-80 ℃条件下冷冻保存[21-24]。因为粪便微生物主要是厌氧菌, 所以减少粪便制备过程中的氧气暴露时间对于确保粪便微生物的生存能力至关重要[25]。
2.3.3 粪菌移植成功的评价标准对于粪菌移植的成功与否, 目前并没有明确的评价标准和体系[26]。因为肠道菌群被移植到不同物种的宿主体内, 因此人源化动物模型中的宿主和微生物群关系不一定能反映人类中的真实关系。目前常用的评价标准是, 首先通过受试小鼠的行为学表型判断菌群移植是否出现与人源供体相似的特异性表型, 然后对临床受试者和人源化粪菌移植后受试小鼠的肠道菌群进行宏基因组测序分析, 查看菌属的丰度和物种是否具有相似性。因此, 为使粪菌移植能更广泛应用于药物防治精神系统疾病, 需不断制定和完善相应的评价标准。
3 抑郁症动物模型的发生发展及其与肠道菌群的相互作用 3.1 抑郁症动物模型的发生发展抑郁症研究的重要手段之一是动物模型, 理想的动物模型应具有良好的表面效度、结构效度和预测效度。然而, 目前多数动物模型都只能模拟抑郁症症状的一个或者几个方面, 且每个模型仍存在一些缺陷, 如模型制备耗时长、操作过于复杂、科研成本高及科研设备要求严格等。当前抑郁症实验动物模型主要分为药物诱导模型、社会环境应激模型、基因改变遗传模型和脑损伤模型等。2016年, Zheng等[27]首次证实了肠道菌群失衡是抑郁症发生的关键因素, 抑郁症与肠道微生物群之间存在双向交流, 移植抑郁患者粪便的小鼠相对于对照组小鼠表现出明显的抑郁样行为。此外, 大鼠粪菌移植模型也表现出类似结果。这些研究均表明肠道菌群可能在抑郁症发病的复杂机制中发挥重要作用, 粪菌移植实验动物模型将会广泛应用于抑郁症发病机制及治疗药物作用机制的研究中。
3.2 抑郁症与肠道菌群的相互作用关系抑郁症的病因非常复杂, 目前认为生物、心理和社会环境因素都参与了抑郁症的发生。抑郁情绪可能诱导特定肠道微生物群物种的改变, 并最终导致严重的抑郁症疾病发生。Zheng等[27]通过将抑郁症和正常人的菌群植入无菌小鼠体内, 结果发现, 前者表现出明显抑郁样行为, 且发现放线菌显著增多, 而拟杆菌减少。Aizawa等[28]研究发现, 抑郁症患者的肠道菌群组成与健康者不同, 存在明显的微生态失衡现象。在菌群门水平上, 放线菌、拟杆菌增多, 而厚壁菌减少; 在菌群属水平上, 普氏菌群丰度表现丰富, 粪杆菌和反刍球菌丰度减少, 乳酸菌和双歧杆菌的数目明显减少。由此可见, 菌群多样性的变化与抑郁症存在高度相似性, 表明人源肠道菌群的定植可以影响宿主的行为或者诱发相关疾病的发生。
在机体肠壁上有很多肠神经, 它们可以把肠道消化、吸收、免疫的信息传到丘脑, 所以大脑可接受到肠道的很多信号。同时, 大脑作为机体的中枢, 可通过微生物-肠-脑轴影响抑郁症患者和实验动物肠道菌群的物种组成多样性及其丰度变化, 也可通过副交感神经影响肠道的功能[29-31]。下丘脑-垂体-肾上腺轴(hypothalamic-pituitary-adrenal axis, HPA轴) 是脑-肠之间非常重要的一个通路, 而HPA轴功能亢进、皮质醇分泌增高是抑郁症患者常见的神经生物学表现之一, 皮质醇的释放也使得肠壁T细胞释放大量促炎因子, 产生一些炎症因子的释放并通过血脑屏障, 继而影响大脑的应激反应, 这些应激反应可改变机体的肠道通透性、破坏肠道黏膜屏障, 激活肠黏膜免疫并导致肠道菌群结构紊乱, 引起炎症反应[32]。此外, 脑-肠之间的肠道微生物还会产生很多影响大脑功能的神经递质, 如单胺类[5-羟色胺(5-hydroxytryptamine, 5-HT)、犬尿氨酸(kynurenine, Kyn)、色氨酸(tryptophan, Trp)和多巴胺(dopamine, DA)]、氨基酸类[γ-氨基丁酸(γ-aminobutyric acid, GABA) 和谷氨酸(glutamic acid, Glu)] 等抑制性神经递质。这些产物不仅可直接作用于肠神经系统和迷走神经系统, 还可通过调节肠内分泌细胞以内分泌和旁分泌的方式影响中枢神经系统的活动, 从而导致抑郁行为发生[33]。已有证据表明, 与健康对照组相比, 抑郁症患者和抑郁小鼠中白介素(interleukin, IL)-6、IL-8、肿瘤坏死因子(tumor necrosis factor-α, TNF-α)、Kyn和C反应蛋白(C-reactive protein, CRP) 等水平明显升高, 以及Trp代谢紊乱[34]。由此可见, 神经递质水平、HPA轴功能调控、炎症因子表达等不仅与抑郁症疾病有密切关系, 同时也与肠道菌群的变化密切相关。
3.3 人源化粪菌移植抑郁实验动物模型的建立与行为学评价Turnbaugh等[35]首次将肥胖和健康者的微生物群移植到健康的无菌动物体内, 直接证明了肠道菌群改变可导致疾病。随后人源化粪菌移植模型被广泛应用到抑郁症、结肠炎和糖尿病等研究中。
3.3.1 粪菌移植到无菌小鼠体内引发抑郁样行为无菌动物是一种体内不存在任何细菌的动物或现有检测手段在其体内不能检测出任何细菌的动物, 与普通动物相比, 具有干扰因子少、操作可控等优势, 可更明确研究新移植微生物群的生物功能和机制。人体肠道菌群一旦在无菌小鼠体内成功定植, 就可维持较长时间[36]。Zheng等[27]首次将抑郁症患者和健康人体的“粪便微生物群”移植到无菌小鼠中, 在人源化粪菌移植2周后, 先后进行了悬尾实验、强迫游泳实验和旷场实验, 与健康对照组相比, 接受抑郁患者粪菌移植的小鼠不动时间显著增长, 表明肠道微生物紊乱可诱导无菌小鼠产生抑郁样行为。
3.3.2 粪菌移植到伪无菌小鼠体内引发抑郁样行为由于无菌设施需大量资源来建立和维护, 对于许多基因型小鼠模型没有无菌选择。而且使用无菌小鼠造模并不会导致供体菌群完全转移到受体小鼠中[37]。因此为了克服这种局限性, 通过混合抗生素预处理后建立与人类微生物群相关的动物模型是有效研究手段之一[38]。研究表明, 在粪菌移植之前使用混合抗生素可能有助于改变受体体内的肠道微生物群, 从而使供体肠道菌群在受体内更好定植[39]。常用的抗生素组合为0.5 g·L-1万古霉素、1 g·L-1硫酸新霉素、1 g·L-1甲硝唑和1 g·L-1氨苄青霉素, 该抗生素混合物已被证明可非选择性清除肠道微生物[40]。Staley等[41]通过使用不同混合抗生素(氨苄西林、头孢哌酮和盐酸克林霉素等) 清除小鼠体内固有的肠道菌群, 然后将人类肠道菌群单次植入无特定病原体(specific pathogen free, SPF) 小鼠体内, 这种经抗生素处理的伪无菌小鼠在人类肠道菌群植入程度上与无菌小鼠受体模型相当; 并且, 这种伪无菌小鼠可很容易地应用到不同小鼠基因型和与不同疾病状态相关的人类微生物群的研究中。Zhao等[42]用带有酒精中毒患者粪便的微生物群移植到经过混合抗生素处理3周后的C57BL/6J小鼠体内, 先后进行了酒精偏好、社会交互、旷场和高架十字迷宫实验, 结果发现小鼠表现出自发的酒精偏好、焦虑和抑郁样行为以及社交障碍。Kelly等[43]通过将抑郁症患者和健康人体的“粪便悬液”移植到微生物群减少的伪无菌鼠中, 通过糖水偏爱、旷场、高架十字迷宫和强迫游泳实验检测, 结果发现受试动物表现出类似的抑郁样和焦虑样行为。以上结果均表明, 肠道微生物群紊乱可诱导伪无菌鼠产生抑郁样行为。
综上所述, 人源化粪菌移植实验动物模型不仅可移植人的菌群, 还可使动物表现出类似的抑郁样行为。这一模型的发展为人类研究抑郁障碍发病机制以及药物作用机制提供新思路的同时, 也给研究人员带来了一些问题, 在选择无菌或是SPF级动物时, 应当根据课题组环境而定, 而在实验过程中是否使用抗生素、抗生素种类的选择以及其产生的不良反应都应当进行合理充分的考虑。
4 人源化粪菌移植抑郁实验动物模型的应用前期已有大量研究表明, 传统中医药可有效改善抑郁症的核心症状, 通过影响肠道菌群的多样性、结构、组成以及代谢产物等调节肠道菌群失调是治疗抑郁症的潜在靶点[44]。而动物模型作为药物研发过程中不可缺少的环节, 对于评价创新药物的有效性和安全性有重要意义。Wang等[45]通过接种健康志愿者的粪便悬液构建菌群人源化小鼠(human flora-associated, HFA) 模型后给予不同浓度黑枸杞多糖, 乳酸杆菌、双歧杆菌数量显著增加, 而肠杆菌、肠球菌数量显著下降, 说明黑枸杞多糖可调节HFA小鼠肠道菌群结构, 增加有益菌在HFA小鼠肠道中的定植力。当前很少有研究使用人源化粪菌移植抑郁动物模型对抗抑郁药物进行药效学评价, 大多是将抑郁鼠的鼠源粪便移植到受试鼠中, 然后使用一些抗抑郁西药或者外源补充一些前体物质或者抑制剂来改善抑郁样行为。Siopi等[46]通过将慢性应激引起小鼠抑郁后的粪便移植给无菌小鼠, 受体小鼠表现出明显的抑郁样行为, 但是由于受体小鼠Trp代谢中的5-HT途径受损, 通过给予氟西汀并未改善其抑郁样行为, 但是补充5-HT的直接前体5-羟基色氨酸可改善其抑郁样行为。Chevalier等[47]分别将抑郁小鼠的粪便移植给无菌和伪无菌小鼠, 同样都表现出抑郁样行为, 但并没有通过给予抗抑郁药物来进行治疗性给药, 而是外源性补充一些前体物质或抑制剂来改善其抑郁样行为。因此, 当前对于该模型的应用, 仍面临着巨大挑战, 需要在理论和技术层面不断的发展和完善。
5 总结与展望人源化粪菌移植抑郁实验动物模型与其他动物模型相比, 更加贴合抑郁症的临床表型, 在阐明发病机制、药物作用机制等方面具有明显的优势和广泛的应用前景。通过粪菌移植可更好地模拟一些特殊的精神和行为表型, 同样也能揭示其生物学机制。而人源化粪菌移植实验动物模型复制成功的前提是筛选出更符合构建人源化实验动物模型的粪便菌群以及优化供体粪菌的制备方法, 这将为人源化粪菌移植实验动物模型成功建立及合理应用奠定基础。
作者贡献: 田俊生和秦雪梅负责提供论文框架及修改; 赵慧亮负责论文的撰写; 向欢、王琦和杨晨负责收集整理文献资料。所有作者阅读并认可终稿。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Otte C, Gold SM, Penninx BW, et al. Major depressive disorder[J]. Nat Re Dis Primers, 2016, 2: 16066. DOI:10.1038/nrdp.2016.66 |
| [2] |
Malhi GS, Mann JJ. Depression[J]. Lancet, 2018, 392: 2299-2312. DOI:10.1016/S0140-6736(18)31948-2 |
| [3] |
Pan E. Analysis of adverse reactions of antidepressants[J]. Electron J Clin Med Lit (临床医药文献电子杂志), 2020, 7: 128-129. |
| [4] |
Goodrich JK, Di Rienzi SC, Poole AC, et al. Conducting a microbiome study[J]. Cell, 2014, 158: 250-262. DOI:10.1016/j.cell.2014.06.037 |
| [5] |
Jiang HY, Ling ZX, Zhang YH, et al. Altered fecal microbiota composition in patients with major depressive disorder[J]. Brain Behav Immun, 2015, 48: 186-194. DOI:10.1016/j.bbi.2015.03.016 |
| [6] |
Hintze KJ, Cox JE, Rompato G, et al. Broad scope method for creating humanized animal models for animal health and disease research through antibiotic treatment and human fecal transfer[J]. Gut Microbes, 2014, 5: 183-191. DOI:10.4161/gmic.28403 |
| [7] |
Eiseman B, Silen W, Bascom GS, et al. Fecal enema as an adjunct in the treatment of pseudomembranous enterocolitis[J]. Surgery, 1958, 44: 854-859. |
| [8] |
Freeman J, Bauer MP, Baines SD, et al. The changing epidemiology of clostridium difficile infections[J]. Clin Microbiol Rev, 2010, 23: 529-549. |
| [9] |
Kelly CP, LaMont JT. Clostridium difficile--more difficult than ever[J]. N Engl J Med, 2008, 359: 1932-1940. DOI:10.1056/NEJMra0707500 |
| [10] |
Sommer F, Bäckhed F. The gut microbiota--masters of host development and physiology[J]. Nat Rev Microbiol, 2013, 11: 227-238. DOI:10.1038/nrmicro2974 |
| [11] |
Berer K, Gerdes LA, Cekanaviciute E, et al. Gut microbiota from multiple sclerosis patients enables spontaneous autoimmune encephalomyelitis in mice[J]. Proc Natl Acad Sci U S A, 2017, 114: 10719-10724. DOI:10.1073/pnas.1711233114 |
| [12] |
Lee P, Yacyshyn BR, Yacyshyn MB. Gut microbiota and obesity: an opportunity to alter obesity through faecal microbiota transplant (FMT)[J]. Diabetes Obes Metab, 2019, 21: 479-490. DOI:10.1111/dom.13561 |
| [13] |
Lasheras I, Seral P, Latorre E, et al. Microbiota and gut-brain axis dysfunction in autism spectrum disorder: evidence for functional gastrointestinal disorders[J]. Asian J Psychiatr, 2020, 47: 101874. DOI:10.1016/j.ajp.2019.101874 |
| [14] |
Sun Y, Han H. Gut microbiota and aging-related diseases[J]. Int J Geriatr (国际老年医学杂志), 2020, 41: 413-416. |
| [15] |
Fond GB, Lagier JC, Honore S, et al. Microbiota-orientated treatments for major depression and schizophrenia[J]. Nutrients, 2020, 12: 1024. DOI:10.3390/nu12041024 |
| [16] |
Peng Y, Xu XJ, Li JP, et al. Strategy to delay the progression of chronic kidney disease by targeting gut microbiota and uremic toxins metabolism pathway[J]. Acta Pharm Sin (药学学报), 2021, 56: 37-49. |
| [17] |
Paigen K. One hundred years of mouse genetics: an intellectual history. Ⅱ. The molecular revolution (1981-2002)[J]. Genetics, 2003, 163: 1227-1235. DOI:10.1093/genetics/163.4.1227 |
| [18] |
Xiao YQ, Liu C, Xiao L. The role of model animals in the study of symbiotic microorganisms[J]. Biodiv Sci (生物多样性), 2019, 27: 505-515. DOI:10.17520/biods.2019042 |
| [19] |
Yu Q, Yang N, Liu YY. Application of behavioral experiments of common rodents in depression research[J]. Tibet Sci Technol (西藏科技), 2020, 6: 10-13. |
| [20] |
Azimirad M, Yadegar A, Asadzadeh Aghdaei H, et al. Enterotoxigenic clostridium perfringens infection as an adverse event after faecal microbiota transplantation in two patients with ulcerative colitis and recurrent clostridium difficile infection: a neglected agent in donor screening[J]. J Crohns Colitis, 2019, 13: 960-961. DOI:10.1093/ecco-jcc/jjz006 |
| [21] |
Hamilton MJ, Weingarden AR, Sadowsky MJ, et al. Standardized frozen preparation for transplantation of fecal microbiota for recurrent clostridium difficile infection[J]. Am J Gastroenterol, 2012, 107: 761-767. DOI:10.1038/ajg.2011.482 |
| [22] |
De Leon LM, Watson JB, Kelly CR. Transient flare of ulcerative colitis after fecal microbiota transplantation for recurrent clostridium difficile infection[J]. Clin Gastroenterol Hepatol, 2013, 11: 1036-1038. DOI:10.1016/j.cgh.2013.04.045 |
| [23] |
Cui B, Feng Q, Wang H, et al. Fecal microbiota transplantation through mid-gut for refractory crohn's disease: safety, feasibility, and efficacy trial results[J]. J Gastroenterol Hepatol, 2015, 30: 51-58. DOI:10.1111/jgh.12727 |
| [24] |
Cammarota G, Ianiro G, Tilg H, et al. European consensus conference on faecal microbiota transplantation in clinical practice[J]. Gut, 2017, 66: 569-580. DOI:10.1136/gutjnl-2016-313017 |
| [25] |
Rossen NG, Fuentes S, van der Spek MJ, et al. Findings from a randomized controlled trial of fecal transplantation for patients with ulcerative colitis[J]. Gastroenterology, 2015, 149: 110-118. DOI:10.1053/j.gastro.2015.03.045 |
| [26] |
Wu JM, Gao X, Xie K, et al. Key technology and challenges in the transplantation of human fecal microflora into animal models for the investigation of therapeutic effect of Chinese medicine on glucolipid metabolic disorders[J]. World Chin Med (世界中医药), 2019, 14: 33-38. |
| [27] |
Zheng P, Zeng B, Zhou C, et al. Gut microbiome remodeling induces depressive-like behaviors through a pathway mediated by the host's metabolism[J]. Mol Psychiatry, 2016, 21: 786-796. DOI:10.1038/mp.2016.44 |
| [28] |
Aizawa E, Tsuji H, Asahara T, et al. Possible association of bifidobacterium and lactobacillus in the gut microbiota of patients with major depressive disorder[J]. J Affect Disord, 2016, 202: 254-257. DOI:10.1016/j.jad.2016.05.038 |
| [29] |
Zhang Y, Wen J, Zhou TT. Gut microbial diversity and neurological diseases[J]. Chin Pharmacol Bull (中国药理学通报), 2019, 35: 597-602. DOI:10.1186/s12974-019-1434-3/fulltext.html |
| [30] |
Zhang ZW, Zhao ZX, Wang Y, et al. Research progress on the interaction of neuropsychiatric drugs with the gut microbiota[J]. Acta Pharm Sin (药学学报), 2021, 56: 643-653. |
| [31] |
Gao LB, Huang SH, Tang K, et al. Advances in traditional Chinese medicine research of depression based on microbiota-gut-brain axis[J]. Microbiol China (微生物学通报), 2020, 47: 2582-2596. |
| [32] |
Yu QY, Zuo HJ, Ji RY, et al. Progress in research on intestinal flora associated with depression[J]. Chin J Microecol (中国微生态学杂志), 2018, 30: 358-361. |
| [33] |
Li B, Shi RH, Li ZJ. Relationship between gut gut brain axis and psychosomatic diseases[J]. Prog Physiol Sci (生理科学进展), 2018, 49: 221-226. |
| [34] |
Mo HJ, Lao LM, Liu Y, et al. Research advances on the correlation between gut microbiota and depression[J]. Chin J Gen Pract (中华全科医师杂志), 2020, 19: 654-657. |
| [35] |
Turnbaugh PJ, Ley RE, Mahowald MA, et al. An obesity-associated gut microbiome with increased capacity for energy harvest[J]. Nature, 2006, 444: 1027-1031. DOI:10.1038/nature05414 |
| [36] |
Barc MC, Bourlioux F, Rigottier-Gois L, et al. Effect of amoxicillin-clavulanic acid on human fecal flora in a gnotobiotic mouse model assessed with fluorescence hybridization using group-specific 16S rRNA probes in combination with flow cytometry[J]. Antimicrob Agents Chemother, 2004, 48: 1365-1368. DOI:10.1128/AAC.48.4.1365-1368.2004 |
| [37] |
Wos-Oxley M, Bleich A, Oxley AP, et al. Comparative evaluation of establishing a human gut microbial community within rodent models[J]. Gut Microbes, 2012, 3: 234-249. DOI:10.4161/gmic.19934 |
| [38] |
Manichanh C, Reeder J, Gibert P, et al. Reshaping the gut microbiome with bacterial transplantation and antibiotic intake[J]. Genome Res, 2010, 20: 1411-1419. DOI:10.1101/gr.107987.110 |
| [39] |
Ji SK, Yan H, Jiang T, et al. Preparing the gut with antibiotics enhances gut microbiota reprogramming efficiency by promoting xenomicrobiota colonization[J]. Front Microbiol, 2017, 8: 1208. DOI:10.3389/fmicb.2017.01208 |
| [40] |
Reikvam DH, Erofeev A, Sandvik A, et al. Depletion of murine intestinal microbiota: effects on gut mucosa and epithelial gene expression[J]. PLoS One, 2011, 6: e17996. DOI:10.1371/journal.pone.0017996 |
| [41] |
Staley C, Kaiser T, Beura L K, et al. Stable engraftment of human microbiota into mice with a single oral gavage following antibiotic conditioning[J]. Microbiome, 2017, 5: 87. DOI:10.1186/s40168-017-0306-2 |
| [42] |
Zhao W, Hu Y, Li C, et al. Transplantation of fecal microbiota from patients with alcoholism induces anxiety/depression behaviors and decreases brain mGluR1/PKC ε levels in mouse[J]. Biofactors, 2020, 46: 38-54. DOI:10.1002/biof.1567 |
| [43] |
Kelly JR, Borre Y, O' Brien C, et al. Transferring the blues: depression-associated gut microbiota induces neurobehavioural changes in the rat[J]. J Psychiatr Res, 2016, 82: 109-118. DOI:10.1016/j.jpsychires.2016.07.019 |
| [44] |
Tao ZP, Long Y, Li CW, et al. Role of gut microbiota in the treatment of ulcerative colitis with traditional Chinese medicine[J]. Acta Pharm Sin (药学学报), 2021, 56: 391-402. |
| [45] |
Wang L, Lin ZY, Pang XT, et al. Regulation research of lycium ruthenicum polysaccharide on gut microbes in HFA mice[J]. J Anhui Agric Sci (安徽农业科学), 2020, 48: 178-180. |
| [46] |
Siopi E, Chevalier G, Katsimpardi L, et al. Changes in gut microbiota by chronic stress impair the efficacy of fluoxetine[J]. Cell Rep, 2020, 30: 3682-3690. DOI:10.1016/j.celrep.2020.02.099 |
| [47] |
Chevalier G, Siopi E, Guenin-Macé L, et al. Effect of gut microbiota on depressive-like behaviors in mice is mediated by the endocannabinoid system[J]. Nat Commun, 2020, 11: 6363. DOI:10.1038/s41467-020-19931-2 |
 2021, Vol. 56
2021, Vol. 56


