菟丝子是旋花科植物菟丝子(Cuscuta chinensis Lam.) 或南方菟丝子(Cuscuta australis R. Br.) 的干燥、成熟种子, 主要含有黄酮类、生物碱类、挥发油类、糖类、有机酸类、甾体类等化学成分[1]。始载于《神农本草经》, 具有补肾益肝、固精缩尿、安胎、明目、止泻等功效。在临床上常作为补肾中药用于改善绝经期妇女的肾气不足, 调节体内雌激素水平。现代药理研究表明菟丝子具有延缓白内障形成、免疫调节、保护心血管、抗衰老、治疗骨质疏松、改善内分泌等作用[2-7]。
女性进入更年期后, 其体内的雌激素水平明显降低, 导致出现一系列的更年期综合征及骨质疏松、冠心病、动脉粥样硬化等其他疾病[8]。尽管传统的雌激素替代疗法可以治疗或减轻雌激素缺乏引起的疾病, 但是这种疗法在治疗疾病时, 会伴随着一些潜在的不良反应[9]。有研究显示, 这种治疗方法用于绝经期妇女, 使其患乳腺癌和子宫内膜癌风险大大增加[10]。因此, 寻找更安全的雌激素替代治疗药物受到医学界的关注。近年来, 植物雌激素引起了人们的广泛关注, 有望成为更安全的雌激素替代品。
课题组前期研究表明黑龙江产小粒菟丝子具有显著的拟雌激素作用, 并发现了菟丝子固有成分中与雌激素活性相关的质量标志物, 但经口服吸收后在体内的直接作用物质尚不清楚[11]。因此本研究以黑龙江产小粒菟丝子不同极性部位灌胃给予去势(卵巢摘除) 雌性大鼠, 采用UPLC/Q-TOF-MS技术建立不同给药次数的血清指纹图谱, 同时检测相应血清中的雌激素水平, 通过“代谢产物-效应检识”模式进行相关性分析, 初步明确菟丝子在体内发挥拟雌激素作用的直接作用物质。
材料与方法实验动物 SPF级雌性Wistar大鼠, 体质量(220 ± 10) g, 购自哈尔滨医科大学实验动物学部, 实验动物许可证号: SCXK-(黑) 2018-011。所有对实验大鼠的处理和操作均通过哈尔滨商业大学伦理委员会的同意和批准(批准号: HSDU2020-065)。
药材与试剂 菟丝子药材(产地: 黑龙江省) 为本地药材供应商提供, 经哈尔滨商业大学药学院曲中原教授鉴定为旋花科植物菟丝子Cuscuta chinensis Lam.的干燥成熟种子。对照品金丝桃苷、山柰酚、槲皮素、芹菜素、紫云英苷(中国食品药品检定研究院, 质量分数均 > 98%, 批号分别为: 20140713、20130621、20151225、20170224、20180718); 己烯雌酚(陕西圣瑞医药科技有限公司, 批号: 9606); 大鼠雌二醇(E2)、卵泡生成激素(FSH)、促黄体生成素(LH) 试剂盒(北京诚林生物科技有限公司, 批号: 20190612); D101大孔树脂(东鸿化工有限公司批号: Q/GSX021-2004); 甲醇、乙腈为质谱纯, 甲酸为色谱纯, 乙醇、正丁醇为分析纯。
仪器 Acquity UPLC色谱仪、Xevo G2 Q TOF (美国Waters公司); 电子分析天平AR1140 (美国奥豪斯国际有限公司); Neofuge 13R高速冷冻离心机(上海力申科学仪器有限公司); 快速混匀器(常州国华电器有限公司)。
菟丝子乙醇提取物灌胃溶液的制备 称取菟丝子药材适量, 粉碎, 过4号筛, 用3倍量体积分数为95%的乙醇浸泡过夜, 88~92 ℃加热回流提取3次, 每次3 h, 滤过, 滤液合并后减压浓缩得浸膏。取浸膏适量加蒸馏水制成质量浓度为0.7 g·mL-1 (以生药计) 的灌胃药液。
正丁醇萃取部位灌胃溶液的制备 取菟丝子乙醇提取物的浸膏加水溶解, 用水饱和正丁醇萃取两次, 取有机相层, 减压浓缩至浸膏备用。取浸膏适量加蒸馏水制成质量浓度为0.7 g·mL-1 (以生药材计) 的灌胃药液。
大孔树脂40%乙醇洗脱部位灌胃溶液的制备 将处理好的大孔树脂装入色谱柱中, 上样液浓度为0.5 g·mL-1 (以生药计), 静态吸附12 h, 先用大量水除杂, 用20 BV的体积分数为40%的乙醇溶液进行洗脱, 收集洗脱液, 减压浓缩成浸膏。取浸膏适量加蒸馏水制成质量浓度为0.7 g·mL-1 (以生药材计) 的灌胃药液。
对照品溶液的制备 分别取金丝桃苷、山柰酚、槲皮素、异鼠李素、芹菜素、槲皮苷、紫云英苷适量, 以甲醇溶解, 定容于10 mL的量瓶中, 过0.22 μm滤膜得到混合对照品溶液。
阳性药液的制备 称取己烯雌酚适量, 以蒸馏水配制成20 μg·mL-1的混悬液, 备用。
动物分组 健康雌性大鼠随机分为6组(每组6只): 正常对照组、模型对照组、假手术组、95%乙醇提取物给药组(A)、大孔树脂40%乙醇洗脱部位给药组(B)、正丁醇萃取部位给药组(C)。
去势模型的建立 去势模型大鼠: 对大鼠施双侧卵巢摘除术, 具体方法参照文献[12]中的描述。术后, 连续3 d给大鼠腹腔注射青霉素(40 000 U·kg-1·d-1), 期间自由饮食饮水。并连续5 d观察大鼠的阴道上皮角化细胞有无动情周期性变化, 判断去势是否成功。假手术大鼠的操作方法同上, 找到卵巢不摘除, 摘除少许脂肪。
给药方案和不同时间点含药血清的采集 称定大鼠体重, 各给药组按照11.2 g·kg-1·d-1 (以生药计) 的剂量灌胃给药, 每天早晚2次, 连续给药4 d。分别于第4、6、8次给药后的30、60 min后眼眶静脉丛取血0.5 mL, 静置2 h, 14 000 r·min-1离心15 min, 取上层血清, 合并。分别取200 μL和3份20 μL的血清置于EP管中, 于-80 ℃冰箱中保存待测。其他各组每天灌胃等量蒸馏水, 于最后一次灌胃后取血, 操作同上。
血清样品的预处理 血清用SPE小柱处理, 取ProElut PLS通用型亲水亲脂平衡SPE小柱, 先用甲醇6 mL进行活化, 再用去离子水3 mL进行平衡, 取4 ℃下解冻的200 μL血清加入固相萃取柱, 依次以去离子水3 mL和甲醇3 mL洗脱, 收集甲醇洗脱液, 将溶剂挥干, 加入40%色谱乙腈1 mL充分溶解残留物, 14 000 r·min-1转速离心10 min, 取上清液过0.22 μm微孔滤膜。
检测条件 色谱柱: Waters ACQUITY UPLC BEH C18 (1.7 μm, 100 mm×2.1 mm), 体积流量0.4 mL·min-1, 柱温30 ℃; 进样量1 μL, 流动相为乙腈(A)-0.1%甲酸水溶液(B), 梯度洗脱(v/v): 0 min, 10% A; 2 min, 19% A; 5 min, 19% A; 6 min, 44% A; 10 min, 60% A; 11 min, 95% A; 12 min, 100% A。每个样品进样前的平衡时间为8 min。
采用电喷雾离子源ESI, 离子源温度120 ℃; 脱溶剂气体积流量700 L·h-1, 脱溶剂气温度450 ℃; 锥孔气体积流量50 L·h-1; 毛细管电压3 000 V。选择正、负离子扫描方式, 数据采集模式采用MSE模式, 记录范围m/z 50~1 000, 碰撞能20~45 mV。
血清中雌激素水平检测 分别取4 ℃下解冻的20 μL血清, 用酶标仪在450 nm波长下测定吸光度(OD值), 按说明书检测不同采血时间点样品中的E2、FSH、LH的水平。采用SPSS25.0软件进行单因素方差分析, 数据统计结果以x± s表示。
血清指纹图谱的建立及共有峰的选择 将不同给药组、不同给药次数采集到的9张含药血清图谱, 导入中药色谱指纹图谱相似度评价系统, 选择谱图中峰面积大、出峰时间适中的色谱峰为参照峰, 进行多点校正、自动匹配, 建立血清指纹图谱并生成对照图谱(R)。选择重现好的药源性色谱峰作为共有峰。
谱-效相关性分析 以均值化后的指纹图谱共有峰峰面积与大鼠血清中的E2、LH、FSH水平为变量, 采用SPSS25.0统计分析软件中的双变量相关分析法进行数据处理, 计算各变量之间的Pearson相关系数。采用均值化法对原始数据进行无量纲化处理, 以指纹图谱共有峰峰面积为子序列, 以大鼠血清中的E2、LH、FSH水平为母序列, 利用DPS数据分析系统进行灰关联度分析。将子序列与母序列的关联度由大到小排序得到关联序。
结果 1 血清中雌激素水平检测结果如表 1所示。通过比较正常对照组、模型对照组和假手术组的血清雌激素变化情况发现, 大鼠经摘除卵巢造模后, 血清中E2水平显著降低, FSH、LH水平明显升高。E2是卵巢分泌的主要雌激素, 模型组大鼠施卵巢摘除术后, 血中的E2水平必然显著下降, 同时由于雌激素分泌的大幅减少, 必将阻碍其对垂体的负反馈作用, 刺激垂体释放FSH、LH, 使二者在血清中的含量升高, 与本研究结果一致[13]。与模型对照组比较, 阳性对照组和给药组不同组别第4、6、8次给药后的含药血清雌激素水平整体呈现不同程度的回调趋势(个别给药组无变化), 且差异具有显著性(P < 0.05)或极显著性(P < 0.01)。
| Table 1 E2, FSH and LH levels in serum at different time points. Data are presented and analyzed by one tailed ANOVA test (n = 6, x± s). *P < 0.05, **P < 0.01 vs model group. E2: Estradiol; FSH: Follicle-stimulating hormone; LH: Luteinizing hormone. A4: 95% ethanol extract was administered 4 times; A6: 95% Ethanol extract was administered 6 times; A8: 95% Ethanol extract was administered 8 times; B4: 40% Ethanol elution part was administered 4 times; B6: 40% Ethanol elution part was administered 6 times; B8: 40% Ethanol elution part was administered 8 times; C4: n-Butanol extract part was administered 4 times; C6: n-Butanol extract part was administered 6 times; C8: n-Butanol extract part was administered 8 times |
采用UPLC-Q-TOFMS技术得到正、负离子模式下9个不同含药血清的指纹图谱(S1~S3为95%乙醇提取液的不同给药次数的含药血清图谱, S4~S6为大孔树脂40%乙醇洗脱部位的不同给药次数的含药血清图谱, S7~S9为正丁醇萃取部位的不同给药次数的含药血清图谱), 如图 1所示, 正离子模式下共标记了27个共有峰, 负离子模式下共标出11个共有峰。
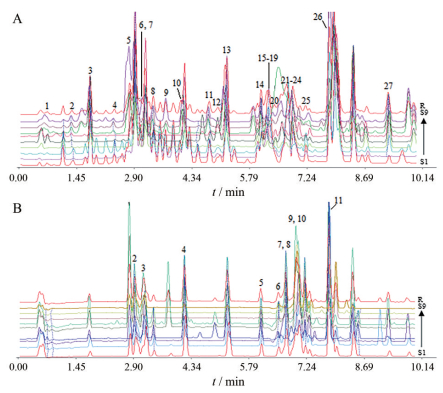
|
Figure 1 Fingerprints of different serum in positive (A) and negative (B) ion mode and control spectra. S1-S9: Serum atlas of 95% ethanol extract, 40% ethanol elution part and n-butanol extract part that were administered 4, 6 and 8 times respectively; R: Control atlas generated from S1-S9 |
在双变量相关分析中, 相关系数的绝对值越大, 表明两个变量之间的线性相关性越强; 在灰关联度分析里, 关联度可以直接反映各子序列对母序列的贡献程度, 根据关联度的大小进行排序, 一般认为Pearson相关系数具有显著性、关联度大于0.5的数据可作为峰选择的依据。据此, 寻找与菟丝子雌激素样作用相关性和贡献度较大的峰, 二者交集所对应的化学成分极可能是菟丝子雌激素样作用的体内直接作用物质。
在正离子模式下, 双变量分析结果表明: 共有9个峰所代表的化学成分与血清中的E2、FSH、LH水平呈现出显著的正相关(P < 0.05或P < 0.01), 分别为5、6、9、15、16、19、21、22、23号峰。灰关联度分析结果表明: 关联序里前16位的共有峰里有15个峰(峰1、6、7、8、9、12、13、15、16、18、19、21、22、24、26) 所代表的成分与血清中E2、FSH、LH的关联度均大于0.5, 认为这些成分与“雌激素作用”具有较强的关联性。综上所述, 正离子模式下的血清指纹图谱中, 共有峰6、9、15、16、19、21、22所对应的化学成分可能是菟丝子雌激素样作用的体内直接作用物质。
负离子模式下, 双变量分析结果表明: 共有4个峰所代表的化学成分呈现出显著的正相关(P < 0.05或P < 0.01), 分别为3、7、8、10号峰。灰关联度分析结果表明: 关联序里前7位的共有峰(峰2、3、4、6、8、10、11所代表的成分) 与血清中E2、FSH、LH的关联度均大于0.5, 表明这些成分与“雌激素作用”具有较强的关联性。综上所述, 负离子模式下的血清指纹图谱中, 共有峰3、8、10所对应的化学成分可能是菟丝子雌激素样作用的体内直接作用物质。
4 体内直接作用物质的化学表征采用Waters Masslynx 4.1软件对谱效分析得到的正、负离子模式下与雌激素作用高度相关的共有峰进行质谱分析和结构表征。根据精确的准分子离子峰的质荷比(m/z) 可以初步判断化合物的相对分子质量、元素组成和分子式, 结合已有文献报道对化合物进行初步推测[14, 15], 并与对照品的保留时间和质谱信息进行比对。对于无对照品比对的化合物, 根据化合物裂解规律由碎片离子做进一步验证。正、负离子模式下雌激素相关共有峰的质谱信息及成分识别见表 2。
| Table 2 Chemical identification of common peaks. +: Positive ion mode; -: Negative ion mode |
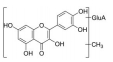
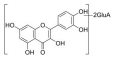
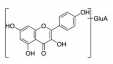
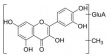
综上所述, 结合表6的成分表征结果可知, 采用双变量相关分析和灰关联度分析法在正、负离子模式下的含药血清中发现9个与雌激素作用高度相关的体内直接作用物质, 分别是: 金丝桃苷、紫云英苷、甲基化槲皮素葡萄糖醛酸苷、槲皮素-二葡萄糖醛酸苷、槲皮素、芹菜素、异槲皮苷、山柰酚葡萄糖醛酸苷、山柰酚。关于菟丝子拟雌激素活性的体内直接作用物质此前尚未见报道, 上述9个入血成分均为首次发现的菟丝子与雌激素活性相关的体内直接作用物质, 为菟丝子雌激素作用药效物质的揭示和质量标志物的确证提供了可靠依据。
讨论中药是一个化学成分和生物效应都具有多样性的复杂体系, 谱效相关性研究从“整体观”角度将中药的化学成分与药效学指标相结合, 采用化学计量学方法进行关联分析, 从而实现快速、高效地筛选中药的有效成分, 近年来应用较为广泛[16-18]。对于口服中药而言, 发挥药效的前提是吸收入血[19]。中药血清谱效学通过建立能够全面反映中药入血后的动态血清指纹图谱, 弥补了传统谱效研究未将中药在体内的滤过和代谢考虑在内的弊端[20]。卵巢摘除模型(又称去势模型), 通过手术摘除小鼠或大鼠双侧卵巢以模拟女性进入围绝经期, 卵巢功能衰竭后的状态。国内外学者常用去势模型研究雌激素水平低下和卵巢功能缺乏导致的许多疾病。因此本研究以去势雌性大鼠为雌激素缺乏模型, 建立了菟丝子不同极性提取部位不同给药次数的含药血清指纹图谱, 并同时测定相应血清中的雌激素水平, 利用血清谱效相关性研究发现菟丝子拟雌激素作用的体内直接作用物质。
E2是卵巢分泌的主要雌激素, 模型组大鼠施卵巢摘除术后, 血中的E2水平必然显著下降, 同时由于雌激素分泌的大幅减少, 必将阻碍其对垂体的负反馈作用, 刺激垂体释放FSH、LH, 使二者在血清中的含量升高, 据此, 血清中的E2、FSH、LH能很好地反映女性体内雌激素水平[21]。可通过监测去势模型动物给药后的血清中E2、FSH、LH水平的变化情况, 评价药物的拟雌激素活性。己烯雌酚是人工合成的非甾体雌激素物质, 能产生与天然雌二醇相同的所有药理与治疗作用, 常作为阳性药用于雌激素活性的研究。本研究中, 与模型组相比较, 给药组和阳性药组血清中E2、FSH、LH水平变化趋势一致, 都产生了回调作用, 表明菟丝子可能具有与己烯雌酚相似的拟雌激素作用机制, 阳性药的选择合理、可靠。
作者贡献: 孙向明、宋辉、赵丽珠和胡扬负责完成相关实验研究, 辛科颖负责数据采集与处理分析工作, 孙向明负责完成撰写论文工作, 李文兰和丁振铎负责对本课题实验设计思路进行指导与修改论文工作。
利益冲突: 所有作者声明不存在利益冲突。
| [1] |
Ahmad A, Tandon S, Xuan TD, et al. A review on phytoconstituents and biological activities of Cuscuta species[J]. Biomed Pharmacother, 2017, 92: 772. DOI:10.1016/j.biopha.2017.05.124 |
| [2] |
Donnapee S, Li J, Yang X, et al. Cuscuta chinensis Lam.: a systematic review on ethnopharmacology, phytochemistry and pharmacology of an important traditional herbal medicine[J]. J Ethnopharmacol, 2014, 157: 292-308. DOI:10.1016/j.jep.2014.09.032 |
| [3] |
Lin MK, Lee MS, Huang HC, et al. Cuscuta chinensis and C. campestris attenuate scopolamine-induced memory deficit and oxidative damage in mice[J]. Molecules, 2018, 23: E3060. DOI:10.3390/molecules23123060 |
| [4] |
Sun SL, Guo L, Ren YC, et al. Anti-apoptosis effect of polysaccharide isolated from the seeds of Cuscuta chinensis Lam on cardiomyocytes in aging rats[J]. Mol Biol Rep, 2014, 41: 6117-6124. DOI:10.1007/s11033-014-3490-1 |
| [5] |
Kang SY, Jung HW, Lee MY, et al. Effect of the semen extract of Cuscuta chinensis on inflammatory responses in LPS-stimulated BV-2 microglia[J]. Chin J Nat Med, 2014, 12: 573-581. |
| [6] |
Kim HJ, Yang H, Jung DH, et al. Ameliorating effects of Cuscuta chinensis Lamak extract on hindlimb ischemia, and angiogenic-or inflammatory associated factors in ovariectomized mice[J]. Mol Med Rep, 2019, 19: 3321-3329. |
| [7] |
Zhao PW, Wang DW, Niu JZ, et al. Evaluation on phytoestrogen effects of ten kinds of Chinese medicine including Flos Carthami[J]. Chin J Chin Mater Med (中国中药杂志), 2007, 32: 436-439. |
| [8] |
Bittner V. Menopause, age and cardiovascular risk: a complex relationship[J]. J Am Coll Cardiol, 2009, 54: 2374. DOI:10.1016/j.jacc.2009.10.008 |
| [9] |
Liu W, Tao T, Qi YC. Advantages and disadvantages of female hormone replacement therapy[J]. Chin J Endocrinol Metab (中华内分泌代谢杂志), 2020, 36: 277-282. |
| [10] |
Decensi A, Bonanni B, Maisonneuve P, et al. A phase-Ⅲ prevention trial of low-dose tamoxifen in postmenopausal hormone replacement therapy users: the HOT study[J]. Ann Oncol, 2013, 24: 2753. DOI:10.1093/annonc/mdt244 |
| [11] |
Sun XM, Song H, Yan XJ, et al. Screening and determination of estrogen-like quality markers of Cuscuta chinensis[J]. Chin Tradit Herb Drugs (中草药), 2020, 51: 2671-2679. |
| [12] |
Zhang Y, Hua F, Ding K, et al. Angiogenesis changes inovariectomized rats with osteoporosis treated with estrogen replacement therapy[J]. Bio Res Int, 2019, 2019: 1-9. |
| [13] |
Wang YD, Zhang ZP, Liu SB. Detection and clinical significance of serum FSH, LH and E2 in perimenopausal women[J]. J Radioimmunol, 2009, 22: 123-124. |
| [14] |
Morand C, Creapy V, Manach C, et al. Plasma metabolites of quercetin and their antioxidant properties[J]. Am J Physiol, 1998, 275: 212-219. |
| [15] |
Wang ZX. Determination of quercetin and its main metabolites in plasma by HPLC-MS[J]. Chin Tradit Pat Med (中成药), 2012, 34: 750-753. |
| [16] |
Wei Q, Liu KM. Research progress on spectrum-effect relationship of traditional Chinese medicine[J]. Tradit Chin Drug Res Pharmacol (中药新药与临床药理), 2019, 30: 634-638. |
| [17] |
Qu Y, Wang L, Guo W. Screening and identification of antipyretic components in the postfrost leaves of Morus alba based on multivariable and continuous-index spectrum-effect correlation[J]. J Anal Methods Chem, 2019, 8796276. DOI:10.1155/2019/8796276 |
| [18] |
Hong Y, Liu XH, Chen YL, et al. Multi-index integrated evaluation of spectrum-effect relationship on immunocompetence of Radix Astragali[J]. Acta Pharm Sin (药学学报), 2017, 52: 785-789. |
| [19] |
Wang XL, Liu X, Han YQ, et al. Overview on main research method of effective material basis of Chinese materia medica[J]. Chin Tradit Herb Drugs (中草药), 2018, 49: 941-947. |
| [20] |
Zhu SC, Jiang ZX, Li JJ, et al. Overview research status in serum spectrum-effect of Chinese materia medica[J]. Chin Tradit Herb Drugs (中草药), 2020, 51: 3569-3574. |
| [21] |
Cai YY, Huang XH. Effect of hormone replacement therapy on perimenopausal syndrome and its influence on serum estradiol, follicle stimulating hormone and luteinizing hormone[J]. Matern Child Health Care China (中国妇幼保健), 2015, 30: 5396-5398. |
 2021, Vol. 56
2021, Vol. 56