2. 中国科学院上海药物研究所, 上海 201210
2. Shanghai Institute of Materia Medica, Chinese Academy of Sciences, Shanghai 201210, China
化疗药物甲氨蝶呤(methotrexate, MTX) 用于治疗急性白血病[1, 2]、绒毛膜上皮癌[3]和肺癌[4]等, 但注射用MTX存在半衰期短、生物利用度低[5, 6]和毒副作用大等缺陷[7, 8]。已有许多关于MTX给药系统的研究, 用于改善MTX注射给药的缺陷, 目前延缓MTX释放的给药系统包括植入剂、微球和聚合物胶束等。Liu等[9]通过热熔挤出法制备MTX缓释植入剂, 可在大鼠皮下持续释放15天。Modu等[10]采用O/W溶剂挥发法制备MTX微球, 可在体外持续释放30天, 明显延缓MTX的释放。Madhwi等[11]通过甘氨酸系聚乳酸聚合物胶束递送甲氨蝶呤, 包载在纳米结构中的MTX在大鼠中生物利用度增加了约4倍, 保留时间增加了2倍。以上方法制备的MTX缓释微粒虽具有显著的缓释效果, 但制备工艺相对复杂。本研究拟采用溶剂孵育法将MTX装载入水稳定的新型骨架材料中, 而MTX几乎不溶于所有的有机溶剂。因此, 制备MTX@COF缓释微粒是本研究的一个难点。
环糊精金属有机骨架(cyclodextrin metal-organic framework, CD-MOF) 是一类新型的多孔超分子材料, 具有比表面积大、负载能力高和生物相容性好等[12, 13]特点, 作为药物载体显示出巨大的发展潜力, 成功包载了阿齐沙坦[14]、布地奈德[15]、丹皮酚[16]和地塞米松[17]等药物, 用于改善药物的溶解性、吸收度和实现肺部递药。但CD-MOF遇水不稳定, 在潮湿环境中会迅速崩解, 不利于肿瘤药物的递送。基于CD-MOF上的羟基可进一步修饰和功能化的特点, 采用碳酸二苯酯作为交联剂, 通过化学反应将碳酸酯键与CD-MOF上的羟基交联制备交联环糊精金属有机骨架(crosslinked cyclodextrin metal-organic framework, COF)。该方法提高了CD-MOF在水中的稳定性且不影响颗粒的大小和形状, 在水中放置24 h后仍保持其立方体结构, 拓展了其在药物递送方面的应用[18]。另外, COF由环糊精组成, 具有良好的生物相容性, 在生物应用方面具有独特的优势。研究确证COF具有高度的肺靶向功能, 由靶头RGD多肽和COF组成的新型肺癌靶向递药系统, 可以显著抑制肺癌的生长和转移, 降低多柔比星的给药剂量和毒副作用[19]。作为一种药物储库, COF负载多柔比星类抗肿瘤药物的能力较环糊精海绵提高了8倍[18]。另外, 脂质材料的修饰在延缓药物的释放方面发挥了很大的作用, 但制备脂质体工艺相对复杂[20-23]。阳离子脂质材料(2, 3-二油酰基-丙基)-三甲胺[(2, 3-dioleyl-propyl)-trimethylamine, DOTAP] 是一种非病毒载体, 在体内可生物降解, 能通过静电作用与带负离子的基团相互作用, 是一种良好的缓释材料[24, 25]。
本文采用溶剂孵育法将MTX装载在稳定性较好的COF孔隙中制备MTX@COF载药微粒, 并通过溶剂蒸发法将DOTAP包裹在MTX@COF微粒表面, 延缓MTX的体内外释药。
材料与方法仪器 Agilent 1260高效液相色谱仪、G6460A三重四级杆质谱仪(美国安捷伦科技有限公司); S3400N扫描电子显微镜(日本日立公司); Nicolet 6700傅里叶变换红外光谱仪(美国赛默飞世尔科技公司); PYRIS 1热重分析仪(美国珀金埃尔默公司)。
药品与试剂 γ-环糊精(γ-CD, 广州泰龙化学有限公司); 甲氨蝶呤(纯度≥ 98%, 武汉润泽伟业科技有限公司); 乙腈(色谱纯)、N, N-二甲基甲酰胺(N, N-dimethyl formamide, DMF) (北京百灵威科技有限公司); 碳酸二苯酯(diphenyl carbonate, DPC, 99%, 上海阿拉丁生化科技股份有限公司); 三乙胺(triethylamine, TEA)、氢氧化钾、聚乙二醇20000、盐酸、柠檬酸、无水磷酸氢二钠、氢氧化钠和生理盐水购自国药集团试剂有限公司, 所有试剂均为分析纯; (2, 3-二油酰基-丙基)-三甲胺(DOTAP, 上海艾伟拓医药科技有限公司)。
实验动物 18只雄性Sprague-Dawley (SD) 大鼠购自上海实验动物中心, 体重250~270 g。所有动物实验参照中国科学院上海药物研究所“实验动物管理和使用委员会(IACUC)”规定, 实验动物的IACUC审批号为2020-04-ZJW-27。
色谱条件 色谱柱Dikma Diamonsil C18 (250 mm×4.6 mm, 5 μm); 保护柱Phenomenex C18 (4 mm×3.0 mm, 5 μm); 流速1 mL·min-1; 柱温25 ℃; 进样量10 μL; 检测波长302 nm; 流动相: 乙腈-7.0%枸橼酸溶液-2.0%无水磷酸氢二钠溶液为10∶10∶80 (v/v/v, pH 6.0)。
交联环糊精金属有机骨架的制备 根据本课题组前期报道的方法[26]合成CD-MOF。按照nCD-MOF∶nDPC的投料摩尔比为1∶7, 将收集的CD-MOF晶体与DPC加入到DMF中孵育, 以适量TEA作为催化剂加速反应, 400 r·min-1, 80 ℃反应24 h。交联反应完成后, 冷却至室温, 加入等体积的95%乙醇终止反应, 离心, 弃上清, 沉淀用等体积的纯水和丙酮各洗涤2次, 最后在40 ℃真空干燥箱中干燥4 h。
MTX@COF的制备与含量测定 按照MTX∶COF的投料摩尔比为5∶1, 称取MTX 1.80 g, 溶于30 mL 0.1 mol·L-1碳酸铵溶液, 加入相应质量的COF, 25 ℃、400 r·min-1条件下, 搅拌4 h后, 离心, 弃上清。沉淀中加入适量10%乙酸石油醚溶液, 调节pH, 石油醚洗涤3次后, 于真空干燥箱40 ℃干燥12 h。称取适量MTX@COF, 加入1 mol·L-1氢氧化钠溶解COF后, 再加入等量盐酸溶液中和, 滤过, 按照上述“色谱条件”项下要求测定MTX含量。MTX的载药量按公式(1) 计算。
| $ W = \frac{{{M_{{\rm{MTX}}}}}}{{{M_{{\rm{MTX}}@{\rm{COF}}}}}} \times 100\% $ | (1) |
其中, W为甲氨蝶呤的载药量, MMTX为MTX的测得量, MMTX@COF为MTX@COF的称样量。
MTX@COF@DOTAP的制备 称取MTX@COF 200 mg于烧杯中, 少量多次加入DOTAP乙醇溶液(DOTAP 20 mg溶于0.3 mL无水乙醇) 0.3 mL, 快速搅拌均匀后于60 ℃鼓风干燥箱中干燥。包裹后的载药量同MTX@COF中载药量测定和计算。
粉体表征
扫描电子显微镜(scanning electron microscope, SEM) 取少量样品粉末固定于样品台, 喷金, 以加速电压10 kV进行扫描并采集图像。
热重分析(thermogravimetric analyzer, TGA) 和差示扫描量热法(differential scanning calorimetry, DSC) 将5~10 mg样品粉末放入铂金坩埚中, 设定升温范围为25~400 ℃, 升温速度为10 ℃·min-1, N2流速为20 mL·min-1。
傅里叶变换红外光谱(Fourier transform infrared spectroscopy, FTIR) 分别将MTX、COF、MTX@COF、物理混合物MTX&COF (PM) 和MTX@COF@DOTAP与溴化钾(1∶100) 混合均匀, 置于压片装置上压制成均匀透明的薄片。设置扫描参数为红外显微镜光栏10 μm×10 μm, 光谱范围400~4 000 cm-1, 分辨率4 cm-1。
Zeta电位 分别吸取1 mg·mL-1的待测样品混悬液(分散介质为纯水) 1 mL, 运用动态光散射法测定COF、MTX@COF和MTX@COF@DOTAP混悬液的zeta电位。
体外释放研究 分别称取MTX、MTX@COF和MTX@COF@DOTAP (相当于MTX含量1 mg) 于50 mL离心管中, 加入磷酸盐缓冲介质(pH 7.4) 30 mL, 置于50 r·min-1, 37 ℃的恒温摇床, 分别于0、0.5、1、2、4、6、8和12 h取样1 mL, 并补加等体积溶出介质。吸取样品溶液, 过滤后, 经HPLC法测定, 记录峰面积, 外标法计算MTX的累积释放量。
药代动力学考察 18只雄性健康SD大鼠(250±20 g) 随机分成3组, 每组6只。于大鼠右侧背部皮下注射给药, 给药组分别为MTX原料药组、MTX@COF组和MTX@COF@DOTAP组, 给药体积约0.3 mL, 给药剂量为5 mg·kg-1 (以MTX计)。实验动物在给药12 h前禁食, 实验期间自由饮水。MTX原料药组、MTX@COF组和MTX@COF@DOTAP组分别于给药前和给药后0.5、1、1.5、2、3、4、6和8 h眼眶后静脉取血; 血样置肝素化的离心管中, 3 500 r·min-1离心10 min, 分离血浆, 冻存待测。
血浆样品前处理 取血浆样品50 μL, 加二硫苏糖醇(10 mg·mL-1)、抗氧化剂溶液(含柠檬酸、抗坏血酸和二硫苏糖醇, 其浓度均为100 μg·mL-1) 和内标(叶酸溶液400 ng·mL-1) 各10 μL, 涡旋60 s, 加入乙腈120 μL, 涡旋120 s, 12 000 r·min-1离心20 min。将上清液转移至干净的离心管中, 并在37 ℃的温和氮气下吹干, 用50 μL上述抗氧化剂溶液复溶, 并精密移取样品20 μL, 注入HPLC-MS/MS分析。
HPLC-MS/MS条件 色谱柱Phenomenex XB-C18 (150 mm×4.6 mm, 5 μm); 保护柱Phenomenex C18 (4 mm×3.0 mm); 流速0.7 mL·min-1; 柱温25 ℃; 进样量20 μL; 流动相为0.2%甲酸和0.2%乙酸水溶液(A)-甲醇(B); 梯度洗脱: 0~2 min, 2% B; 2~5 min, 2%~70% B; 5~5.9 min, 70% B; 5.9~6 min, 70%~95% B; 6~8 min, 95% B; 8~8.1 min, 95%~2% B; 8.1~13 min, 2% B。采用正离子电喷雾电离模式检测, 检测模式为多反应监测, 毛细管电压3.5 kV; 雾化器压力35 psi; 鞘气温度350 ℃; 干燥气体温度300 ℃; 鞘气和干燥气体的流速均为10 L·min-1。叶酸的检测条件为m/z 442.1→295.1, 碰撞能量为12 eV; MTX的检测条件为m/z 455.1→308.1, 碰撞能量为16 eV。
统计学方法 实验数据以平均值±标准差表示, 样本均数间比较采用t检验。使用DAS 2.0软件通过非房室分析来计算分析药代动力学参数。P < 0.05时被认为具有统计学意义。
结果与讨论 1 载药量与粉体表征 1.1 载药量COF中的碳酸酯键在强碱环境中易被破坏, 为准确测定MTX@COF的载药量, 本研究采用适量1 mol·L-1氢氧化钠将其溶解, 加入等量的盐酸调节, 以保护色谱柱。溶剂孵育法制备的MTX@COF载药量为(9.62±0.19)%。COF超分子中存在氢键、疏水相互作用和范德华力等多种相互作用, 使得其对难溶性药物表现出极强的亲和力。本文采用溶剂孵育法, 反应4 h, 使得MTX分子与COF充分接触, 强亲和力使得MTX分子进入COF空腔。DOTAP带正电, 可以与带负电的载体相互作用, 通过静电吸附作用可包裹在MTX@COF的表面, 经DOTAP修饰后, MTX@COF@DOTAP载药量为(9.18±0.04)%, 表明DOTAP的修饰对MTX@COF的载药量基本无影响。
1.2 SEM以CD-MOF为基础, DPC作为交联剂制备出的COF微粒呈立方结构, 不仅保持了CD-MOF原本的形态及粒径, 还可以提高粉体在水中的稳定性[18]。SEM图中COF、MTX@COF和MTX@COF@DOTAP粉体粒径均在2 μm左右, 且COF在负载MTX前后的形态未发生明显变化, 仍保持立方形态; DOTAP包裹后MTX@COF粒子边缘圆润, 可能是由于DOTAP涂层紧密贴合在MTX@COF表层所致(图 1A~C)。
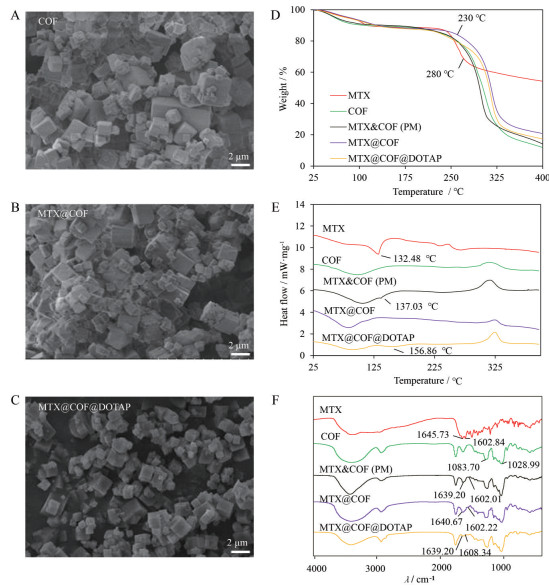
|
Figure 1 Characterizations of methotrexate (MTX), crosslinked cyclodextrin metal-organic framework (COF), MTX loaded in COF particles (MTX@COF), physical mixture of MTX and COF particles [MTX&COF (PM)] and MTX loaded in COF particles coated with DOTAP (MTX@COF@DOTAP). A, B, C: Scanning electron microscope (SEM) images; D: Thermogravimetric analyzer (TGA) curves; E: Differential scanning calorimetry (DSC) thermograms; F: Fourier transform infrared spectroscopy (FTIR) |
样品在25~100 ℃时均约有14%的质量损失, 这可能是由于MTX、MTX@COF和MTX@COF@ DOTAP微粒中的自由水脱水造成的。MTX的主要质量损失在230~280 ℃; COF负载MTX后, 在相同温度下质量损失速率减缓, 且热稳定性高于COF, 表明MTX被成功载入COF空腔; 而相应物理混合物MTX&COF (PM) 质量损失速率较COF加快, 可能是由于MTX原料不受COF保护, 表现出典型的混合物质量损失特征; DOTAP修饰MTX@COF后, 在相同温度下质量损失速率较MTX减缓, 但弱于MTX@COF, 可能是由于DOTAP本身的热稳定性较低所致(图 1D)。
1.4 DSC采用DSC获取负载MTX前后的热行为, MTX在132.48 ℃具有显著的吸热峰; 在MTX@COF中, MTX的吸热峰消失, 此结果表明药物分子以非晶态的形式分布在COF中(图 1E); 而物理混合物MTX&COF (PM) 在137.03 ℃出现小的吸热峰, 表明两种物质之间相互作用力较弱, 没有产生新的物质; MTX@COF@ DOTAP在156.86 ℃有一个显著的吸热峰, 可能是DOTAP固有的吸热分解峰。
1.5 FTIR在FTIR光谱中, MTX的酰胺键的特征峰在1 602.84 cm-1和1 645.73 cm-1处; MTX@COF中MTX在1 602.84 cm-1处的特征峰减弱, 在1 645.73 cm-1的特征峰转移到1 640.67 cm-1, 表明MTX被成功负载到COF分子空腔中; 而MTX&COF (PM) 中MTX的特征峰与MTX@COF几乎一致, 可能是测定样品研磨过程中部分药物被载入COF中所致; DOTAP包裹MTX@COF后, MTX在1 640.67 cm-1处的特征峰减弱(图 1F)。
1.6 Zeta电位DOTAP带正电, 可以与带负电的载体相互作用, 考察COF、MTX@COF及MTX@COF@ DOTAP zeta电位的变化, 评价DOTAP的包裹效果。COF分散在纯水中, zeta电位约为-43 mV, MTX@COF在纯水中的zeta电位上升到-16.9 mV, DOTAP修饰后MTX@COF的zeta电位上升至-0.04 mV。Zeta电位的上升表明DOTAP包裹在MTX@COF的表面, 改变了MTX@COF表面的荷电特征。
2 体外释药测定MTX体外累积释放曲线表明MTX@COF和MTX@COF@DOTAP的缓释特征。MTX原料药以水为释放介质, 0.5 h时即释放43.23%, 6 h后达到92.70%, 而MTX@COF在6 h时仅释放36.31%, 表明COF负载MTX后可显著延缓MTX于水中的释放; 经DOTAP进一步修饰后, MTX@COF@DOTAP在6 h仅释放18.19% (图 2A), 释放速度进一步延缓。为更好地模拟体内释放情况, 采用磷酸盐缓冲液(pH 7.4) 为释放介质, MTX在磷酸盐缓冲介质中0.5 h即释放78.38%, 4 h后达到90.82%; MTX@COF在0.5 h释放43.08%, 4 h为79.37%; MTX@COF@DOTAP在0.5 h释放24.95%, 4 h仅为58.30%, 表明DOTAP修饰的MTX@COF较MTX原料药有显著的缓释效果(图 2B)。
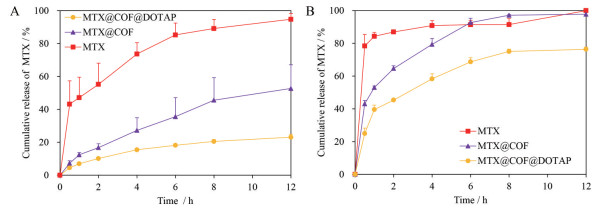
|
Figure 2 Release profiles of MTX, MTX@COF and MTX@COF@DOTAP in water (A) and phosphate buffer (B). n=3, x±s |
采用内标法测定血浆中MTX的含量, 以MTX浓度为横坐标x, MTX与内标物的峰面积比值为纵坐标y, 用加权(W=1/x2) 最小二乘法进行回归运算, MTX的线性回归方程为y=0.007 0 x+0.112 1 (r=0.997 3), 表明该方法在5.00~1 000.00 ng·mL-1内有良好的线性关系。最低定量限达到5.00 ng·mL-1。低、中、高3个浓度的质控样品日内RSD ≤ 15%, 准确度在84.93%~95.79%之间, 提取回收率为79.48%~84.35%, 基质效应为97.96%~101.59%, 符合生物样品分析方法的要求。
3.2 MTX缓释微粒的药代动力学为评价COF载药及DOTAP修饰载药微粒MTX@COF后, MTX在体内的缓释行为, 选择SD大鼠为动物模型, 采用相同的给药剂量, 测定其药时曲线(图 3), MTX@COF@DOTAP的药代动力学曲线显示出明显的缓释特征。
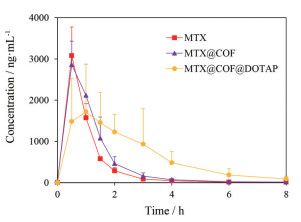
|
Figure 3 Plasma drug level-time profiles of MTX, MTX@COF and MTX@COF@DOTAP in rats. n=6, x±s |
应用非房室模型计算药代动力学参数(表 1)。结果表明, MTX原料药组皮下注射后, 达峰时间Tmax仅为0.50 h, 平均滞留时间MRT(0-t)为1.06 h, 药物被快速吸收分布, 血药浓度迅速下降; MTX@COF组皮下注射后血液浓度下降相对缓慢, Tmax为0.67 h, MRT(0-t)延长至1.22 h, 表明MTX@COF微粒可延长MTX在体内的驻留时间; MTX@COF@DOTAP组的Tmax达到1.42 h, MRT(0-t)延长至2.36 h, 其中MRT(0-t)较MTX@COF组延长1.9倍, 较MTX原料药组延长2.2倍, 与MTX原料药相比具有显著性差异, 表明DOTAP修饰MTX@COF后, 显著延长MTX在体内的释放时间, 与体外释放结果一致, 且MTX@COF@DOTAP组AUC(0-t)为MTX组的1.8倍, 即DOTAP修饰MTX@COF后可显著提高MTX的生物利用度。
| Table 1 Pharmacokinetic parameters of MTX, MTX@COF and MTX@COF@DOTAP. n=6, x±s. *P < 0.05, ***P < 0.001 vs MTX group |
MTX结构的特殊性导致MTX缓释制剂的开发存在很大难度。本研究通过溶剂孵育法将MTX装载在COF中制备MTX@COF, 并用阳离子脂质材料DOTAP修饰MTX@COF来制备MTX的缓释微粒, 从而达到MTX的双重缓释效果。本研究分别以水和磷酸盐缓冲液为释放介质考察缓释微粒的体外释放特征, MTX@ COF和MTX@COF@DOTAP的体外释放结果表明, 两者均有显著的缓释作用, 其中MTX@COF@DOTAP比MTX@COF的缓释作用更明显。大鼠药代动力学研究结果显示, 皮下注射后MTX@COF@DOTAP组的MRT(0-t)比MTX组延长了2.2倍。本研究制备的MTX@COF@ DOTAP微粒可以延长药物在体内的驻留时间, 并能够有效提高药物的生物利用度, 其缓释机制和应用价值有待深入研究。
作者贡献: 王勤负责文献查阅、实验设计和实施、论文初稿撰写; 伍丽、王彩芬、陈晓锦和孙宏宇参与实验设计、协助论文撰写和核对参考文献; 张继稳和桂双英负责实验指导。
利益冲突: 本论文所有作者均不存在利益冲突。
| [1] |
Alsdorf W, Karagiannis P, Langebrake C, et al. Standardized supportive care documentation improves safety of high‐dose methotrexate treatment[J]. Oncologist, 2020, 26: e327-e332. |
| [2] |
Guo ZR. Chemical synthesis driven development of pemetrexed[J]. Acta Pharm Sin (药学学报), 2020, 55: 2486-2490. |
| [3] |
Boyce J, Tawagi K, Cole J. Primary colon adenocarcinoma with choriocarcinoma differentiation: a case report and review of the literature[J]. J Med Case Rep, 2020, 14: 220. DOI:10.1186/s13256-020-02544-0 |
| [4] |
Barei M, Jei I, Simeti L, et al. Rituximab as a treatment option in a patient with rheumatoid arthritis and a history of malignancy-intracranial chondrosarcoma/osteochondroma-case based review[J]. Rheumatol Int, 2020, 41: 463-468. |
| [5] |
Xing E, Du Y, Yin J, et al. Multi-functional nanodrug based on a three-dimensional framework for targeted photo-chemo synergetic cancer therapy[J]. Adv Healthc Mater, 2021, 10: e2001874. DOI:10.1002/adhm.202001874 |
| [6] |
Li J, Chen D, Zhang T, et al. Highly sensitive electrochemical determination of methotrexate based on a N-doped hollow nanocarbon sphere modified electrode[J]. Anal Methods, 2021, 13: 117-123. DOI:10.1039/D0AY01996H |
| [7] |
Paroha S, Verma J, Dubey R, et al. Recent advances and prospects in gemcitabine drug delivery systems[J]. Int J Pharm, 2021, 592: 120043. DOI:10.1016/j.ijpharm.2020.120043 |
| [8] |
Zhao XF. Synthesis of pH-Sensitive Nanocomposite and Its Application in Drug Delivery (pH敏感的纳米复合材料合成及其在药物递送中的应用)[D]. Nanjing: Nanjing Normal University, 2019.
|
| [9] |
Liu XX, Gao L, Xia LY, et al. Methotrexate sustained-release implants for delay of sarcoma recurrence in mice[J]. Chin New Drug J (中国新药杂志), 2017, 26: 2846-2852. |
| [10] |
Modu LR, Chen H, Li XM, et al. Preparation and the in vitro and in vivo release of PLGA microspheres containing methotrexate for intra-articular injection[J]. Chin New Drug J (中国新药杂志), 2007, 16: 1187-1191. |
| [11] |
Madhwi, Kumar R, Kumar P, et al. In vivo pharmacokinetic studies and intracellular delivery of methotrexate by means of glycine-tethered PLGA-based polymeric micelles[J]. Int J Pharm, 2017, 519: 138-144. DOI:10.1016/j.ijpharm.2017.01.021 |
| [12] |
He Y, Hou X, Liu Y, et al. Recent progress in the synthesis, structural diversity and emerging applications of cyclodextrin-based metal-organic frameworks[J]. J Mater Chem B, 2019, 7: 5602-5619. DOI:10.1039/C9TB01548E |
| [13] |
Zhang W, Guo T, Wang C, et al. MOF capacitates cyclodextrin to mega-load mode for high-efficient delivery of valsartan[J]. Pharm Res, 2019, 36: 117. DOI:10.1007/s11095-019-2650-3 |
| [14] |
He Y, Zhang W, Guo T, et al. Drug nanoclusters formed in confined nano-cages of CD-MOF: dramatic enhancement of solubility and bioavailability of azilsartan[J]. Acta Pharm Sin B, 2019, 9: 97-106. DOI:10.1016/j.apsb.2018.09.003 |
| [15] |
Hu X, Wang C, Wang L, et al. Nanoporous CD-MOF particles with uniform and inhalable size for pulmonary delivery of budesonide[J]. Int J Pharm, 2019, 564: 153-161. DOI:10.1016/j.ijpharm.2019.04.030 |
| [16] |
Li H, Zhu J, Wang C, et al. Paeonol loaded cyclodextrin metal-organic framework particles for treatment of acute lung injury via inhalation[J]. Int J Pharm, 2020, 587: 119649. DOI:10.1016/j.ijpharm.2020.119649 |
| [17] |
Zhao K, Guo T, Wang C, et al. Glycoside scutellarin enhanced CD-MOF anchoring for laryngeal delivery[J]. Acta Pharm Sin B, 2020, 10: 1709-1718. DOI:10.1016/j.apsb.2020.04.015 |
| [18] |
Singh V, Guo T, Wu L, et al. Template-directed synthesis of a cubic cyclodextrin polymer with aligned channels and enhanced drug payload[J]. RSC Adv, 2017, 7: 20789-20794. DOI:10.1039/C7RA02306E |
| [19] |
He Y, Xiong T, He S, et al. Pulmonary targeting crosslinked cyclodextrin metal-organic frameworks for lung cancer therapy[J]. Adv Funct Mater, 2020, 31: 2004550. |
| [20] |
Pawar V, Manjappa A, Murumkar P, et al. Drug-fortified liposomes as carriers for sustained release of NSAIDs: the concept and its validation in the animal model for the treatment of arthritis[J]. Eur J Pharm Sci, 2018, 125: 11-22. DOI:10.1016/j.ejps.2018.09.009 |
| [21] |
San Roman B, Gomez S, Irache JM, et al. Co-encapsulated CpG oligodeoxynucleotides and ovalbumin in PLGA microparticles; an in vitro and in vivo study[J]. J Pharm Pharm Sci, 2014, 17: 541-553. DOI:10.18433/J33892 |
| [22] |
Ye L, Ye J, Lu J, et al. Co-loaded docetaxel and verapamil liposomes to reverse tumor drug resistance[J]. Acta Pharm Sin (药学学报), 2020, 55: 1035-1041. |
| [23] |
Ou G, Ma JQ, Zhu L, et al. Preparation of adenosine triphosphate liposome nasal gel and its anti-hypoxia effect[J]. Acta Pharm Sin (药学学报), 2020, 55: 1288-1295. |
| [24] |
N'Diaye M, Michel J, Rosilio V. Relevance of charges and polymer mechanical stiffness in the mechanism and kinetics of formation of liponanoparticles probed by the supported bilayer model approach[J]. Phys Chem Chem Phys, 2019, 21: 4306-4319. DOI:10.1039/C8CP06955G |
| [25] |
Maity P, Saha B, Suresh Kumar G, et al. Effect of zwitterionic phospholipid on the interaction of cationic membranes with monovalent sodium salts[J]. Langmuir, 2018, 34: 9810-9817. DOI:10.1021/acs.langmuir.8b01792 |
| [26] |
Liu B, Li H, Xu X, et al. Optimized synthesis and crystalline stability of γ-cyclodextrin metal-organic frameworks for drug adsorption[J]. Int J Pharm, 2016, 514: 212-219. DOI:10.1016/j.ijpharm.2016.09.029 |
 2021, Vol. 56
2021, Vol. 56


