2. 中国中医科学院中药资源中心, 道地药材国家重点实验室培育基地, 北京 100700
2. State Key Laboratory Breeding Base of Dao-di Herbs, National Resource Center for Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China
薏苡(Coix lacryma-jobi L.) 是我国传统的药食兼用中药植物, 具有悠久的栽培驯化史[1, 2], 目前在全国各地均有分布[3]。薏苡仁是薏苡干燥成熟的种仁[4], 含有丰富的脂肪酸, 约占薏苡仁油脂的85%[5]。研究表明, 薏苡仁油脂中的不饱和脂肪酸对癌细胞具有显著的抑制作用[6, 7]。此外, 以薏苡仁油为主要成分的“康莱特”抗癌注射剂可明显提高胃癌、肝癌、肺癌等恶性肿瘤的临床治疗效果, 并降低不良反应[8-12]。
油脂在自然界的分布十分广泛, 各种植物的种子中都存在一定数量的油脂。而不饱和脂肪酸作为油脂的主要组分之一, 不仅在调节细胞生理功能方面发挥着重要的作用, 且有助于人类保持健康[13-15]。基于不饱和键的数目, 不饱和脂肪酸可分为单不饱和脂肪酸和多不饱和脂肪酸, 包括棕榈油酸、油酸、亚油酸、亚麻酸和花生四烯酸等, 其中亚油酸和亚麻酸是人和动物生长发育的必需多不饱和脂肪酸, 且在人体内不能自行合成只能通过食物获取, 而亚油酸又是合成亚麻酸的前体[16]。因此, 研究亚油酸的合成和调控机制具有十分重要的理论和现实意义。为明确植物油脂中脂肪酸的生物合成过程, 国内外学者已对不同物种脂肪酸合成基因进行了分析和研究。Wu等[17]利用白屈菜4个不同发育时期的转录组, 筛选到508个脂质代谢基因, 包括显著差异表达基因41个, 其中omega-6脂肪酸去饱和酶(fatty acid desaturase, FAD) 参与亚油酸的合成; Zhao等[18]从玉米中共鉴定出30个FADs基因, 系统发育分析发现它们都具有高度保守的FADs结构域, 进一步的研究表明这些FADs的表达会受到冷热胁迫诱导。虽然现在对薏苡的组学分析已有相关报道, 但是薏苡油脂的合成通路尚不明晰, 因此本研究着重薏苡脂肪酸去饱和酶基因分子结构特征的解析及功能验证。
在植物油脂的生物合成过程中, delta-12脂肪酸去饱和酶(FAD2) 是油脂积累过程中的关键酶, 在不饱和脂肪酸的生物合成途径中起着极其重要的作用, 是控制亚油酸合成的限速酶, 其合成过程是以油酸为底物, 在delta-12脂肪酸去饱和酶的催化下而形成的[19]。近年来, 产油酵母已被广泛应用于油脂类化合物的功能验证, 其中圆红冬孢酵母由于其胞内油脂量可达到细胞干重的70%以上而受到学者们的广泛青睐。为了对薏苡delta-12脂肪酸去饱和酶基因FAD2的分子结构特征和功能进行研究, 本文基于薏苡转录组测序数据获得delta-12脂肪酸去饱和酶基因序列, 从薏苡的cDNA中克隆FAD2基因, 利用生物信息学软件分析其氨基酸的理化性质、跨膜结构域、细胞定位、蛋白质结构及进化树等, 并通过在酵母中的异源表达验证其功能。此研究不仅可以深入了解薏苡delta-12脂肪酸去饱和酶的性质、结构和功能, 而且为今后利用该基因调控不饱和脂肪酸的生物合成研究奠定基础。
材料与方法植物材料 在河北省安国市伊康药业有限公司的薏苡种植基地, 采集不同时期的纯种薏苡全株, 并将植物材料贮存于-80 ℃冰箱。
实验试剂 实验所用试剂包括TaKaRa公司的植物RNA小量提取试剂盒和DNA marker; OMEGA公司的Gel Extraction Kit; TransGen Biotech公司的TransScript® All-in-One First-Strand cDNA Synthesis SuperMix for qPCR、pEASY-Blunt Zero Cloning Kit和Trans T1感受态细胞; Thermo Fisher Scientific公司的PhusionTM High-Fidelity DNA Polymerase; 实验所用引物及测序结果均由北京睿博兴科生物技术有限公司完成; 实验中FAD2基因的密码子偏好性优化及pCAMBIA2300-pPGK-FAD2-tHSP载体的构建由苏州泓讯生物科技股份有限公司完成; 其他试剂均为分析纯。
总RNA的提取和反转录 按照植物RNA小量提取试剂盒要求提取薏苡总RNA, 然后使用1.2%琼脂糖凝胶电泳, 并结合分光光度计检测总RNA提取效果。样品检测合格后, 采用TransGen Biotech公司的反转录试剂盒, 按照以下体系完成薏苡总RNA到cDNA的转录, RNA 1 μg, 5×TransScript® All-in-One SuperMix for PCR 4 μL混合均匀, 加无菌水补足至20 μL, 混合均匀, 42 ℃反应30 min, 85 ℃加热5 s, 冰上冷却, 然后将其储存于-20 ℃冰箱。
薏苡FAD2基因的克隆 从薏苡转录组测序数据库中筛选出注释为FAD2的基因, 基于基因全长序列, 设计特异性引物FAD2-F (ATGGCGGAGAAGAAGG CGAG) 和FAD2-R (TTAGAACTTGTTGTTGTACCA GTAGACGC)。以薏苡cDNA作为模板, FAD2-F和FAD2-R作为引物, 使用Phusion酶进行FAD2基因的PCR扩增。然后取2 μL回收纯化的PCR产物, 加至1 μL (30 ng) pEASY-Blunt Zero载体中, 加入无菌水至5 μL, 室温下孵育15 min后置于冰上, 待冷却后加入50 μL Trans T1感受态细胞, 混合均匀, 冰浴30 min, 42 ℃加热30 s, 冰浴2 min。转化成功后使用含有氨苄霉素的LB固体培养基筛选阳性克隆, 并送至北京睿博兴科生物技术有限公司测序。测序结果用DNA-MAN 8.0软件对其基因序列进行对比验证。
薏苡FAD2的生物信息学分析 应用NCBI的ORF finder对薏苡FAD2基因进行蛋白翻译, 分析该基因的最大开放阅读框; 采用ProtParam (http://web.expasy.org/protparam) 分析FAD2蛋白的理化性质; 应用ProtScale (http://web.expasy.org/prots-cale/) 分析蛋白的亲水性; 利用TMHMM Server 2.0 (http://www.cbs.dtu.dk/services/TMHMM-2.0) 预测蛋白质序列的跨膜结构域; 使用Signal P 5.0 server (http://www.cbs.dtu.dk/services/SignalP) 分析蛋白质的信号肽; 应用PSORT (http://psort.hgc.jp/) 预测蛋白质的亚细胞定位; 运用SOPMA (https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html) 在线工具预测蛋白的二级结构; 通过MEGA 7.0软件中的Neighbor-joining算法构建系统进化树[20, 21]。
圆红冬孢酵母表达 载体的构建与酵母表达为提高FAD2基因在圆红冬孢酵母中的表达, 将其基因序列按照圆红冬孢酵母的密码子偏好性优化, 将优化后的FAD2基因进行合成, 然后插入到pCAMBIA2300-pPGK-MCS-tHSP改造载体的KpnI酶切位点, 获得pCAMBIA2300-pPGK-FAD2-tHSP表达载体。按照常规方法进行圆红冬孢酵母的农杆菌介导转化, 将筛选获得的含有pCAMBIA2300-pPGK-FAD2-tHSP载体的酵母菌株置于YPD液体培养基中, 在30 ℃、200 r·min-1条件下培养100 h[22, 23]。
脂肪酸组分及含量的检测分析 采用酸热法从发酵液中提取油脂[24], 然后将油脂样品用氯仿1 mL溶解, 取油脂样品50 μL至5 mL圆底烧瓶内, 氮气吹干溶剂后, 加入1%硫酸-甲醇溶液2 mL复溶, 70 ℃回流40 min进行甲酯化反应。回流结束后, 冷却至室温, 然后加入正己烷2 mL萃取, 离心后取上清液用于气相色谱检测[25]。色谱条件如下[26]: FFAP石英毛细管(30 m×0.32 mm×0.25 μm) 为色谱柱; 检测器为氢火焰离子检测器(FID); 进样方式为分流进样, 分流比为10∶1, 进样量为1 μL; 进样口温度250 ℃; N2流速25 mL·min-1; 载气为氦气(He), 压力为13 psi (1 psi = 6.9 kPa); 检测器温度为280 ℃; H2流速30 mL·min-1, 空气300 mL·min-1; 程序升温条件为: 初始温度190 ℃, 以5 ℃·min-1升至230 ℃, 保持10 min。脂肪酸通过对照样品定性, 采用面积归一法确定其相对含量。
结果 1 薏苡FAD2基因的克隆与序列分析对薏苡总RNA进行琼脂糖凝胶电泳检测, 结果表明RNA没有降解, 且28S rRNA和18S rRNA条带清晰, 说明总RNA提取效果较好, 可用于cDNA的合成以及FAD2基因的克隆。通过分析Illumina Hiseq 2000平台的薏苡转录组测序结果获得FAD2基因序列, 并设计特异性引物, 进行PCR扩增, 将获得的基因片段连接到载体, 并转化至Trans T1菌株, 最终获得936 bp的薏苡FAD2基因全长cDNA序列。为进一步验证基因序列的正确性, 利用NCBI的ORF Finder和DNA-MAN 8.0对FAD2基因序列进行序列分析, 结果表明FAD2基因全长cDNA包含完整的开放阅读框, 编码311个氨基酸残基, 起始密码子为ATG, 终止密码子TAA (图 1)。

|
Figure 1 Sequence of gene and amino acid sequence |
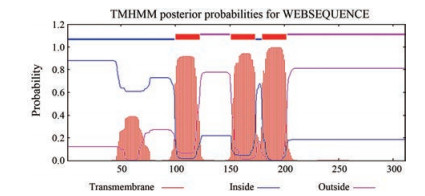
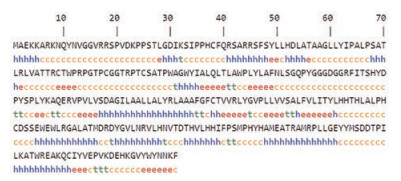
应用在线工具ProtParam对FAD2蛋白的理化性质进行分析, 推测该蛋白质的分子式为C1594H2437N431O426S13, 分子质量为34 871.30 Da, 理论等电点(theoretical pI) 为9.17, 亲水性平均系数(GRAVY) 为-0.077, 不稳定指数(instability index) 为45.61, 说明FAD2蛋白属于碱性亲水不稳定蛋白。利用Signal P 5.0 server预测蛋白的信号肽, 结果显示FAD2蛋白不含信号肽, 不属于分泌蛋白。运用TMHMM Server 2.0在线工具对FAD2蛋白的结构域进行预测, 结果如图 2所示, 其中1~99和174~179为FAD2蛋白的胞内区, 123~150和203~311为胞外区, 100~122、151~173和180~202为跨膜结构域位置, 由此表明该蛋白属于跨膜蛋白; 亚细胞定位结果显示FAD2定位于细胞质体膜。通过SOPMA在线软件预测FAD2蛋白的二级结构, 结果如图 3所示, 无规则卷曲(c) 占44.69%、α-螺旋(h) 占33.12%、延伸链(e) 占15.76%、β-折叠(t) 占6.43%, 由此表明α-螺旋和无规则卷曲是FAD2的大量结构元件。
|
Figure 2 The result of transmembrane helices analysis of FAD2 protein |
|
Figure 3 Secondary structure prediction of FAD2 protein by SOPMA |
为进一步研究薏苡FAD2氨基酸残基的相似性, 对克隆得到的FAD2基因进行Blastp分析, 其中薏苡FAD2基因编码的氨基酸与玉米(Zea mays) 中同类蛋白的同源性为87.02%; 与狗尾草(Setaria viridis) 的同源性为66.35%; 与短柄草(Brachypodium distachyon) 的同源性为66.35%; 与谷子(Setaria italica) 的同源性为65.87%; 与粟米(Panicum miliaceum) 的同源性为65.87%; 与黍(Panicum hallii) 的同源性为65.87%; 与大麦(Hordeum vulgare) 的同源性为65.38%; 与节节麦(Aegilops tauschii) 的同源性为65.38%; 与薏苡(Coix lacryma-jobi) 中已报道的脂肪酸去饱和酶同源性为65.38%; 与高粱(Sorghum bicolor) 的同源性为64.90%。利用DNAMAN 8.0软件对FAD2基因的氨基酸序列与其他10种植物中同种基因的序列信息进行多重比对, 结果如图 4所示, 该蛋白N端保守性较高, C端保守性较低, 但是整个基因序列存在缺失位点。此外, 目前已报道的delta-12脂肪酸去饱和酶的保守位点是3个, 分别是HXXXH、HXXHH和HXXHH, 其他10种植物的蛋白均有3个保守位点(蓝色框和红色框标注)[27, 28], 而该蛋白仅具有一个组氨酸保守位点“HXXHH” (红色框标注)。

|
Figure 4 Multiple comparisons of FAD2 protein in Coix lacryma-jobi L. and other plants |
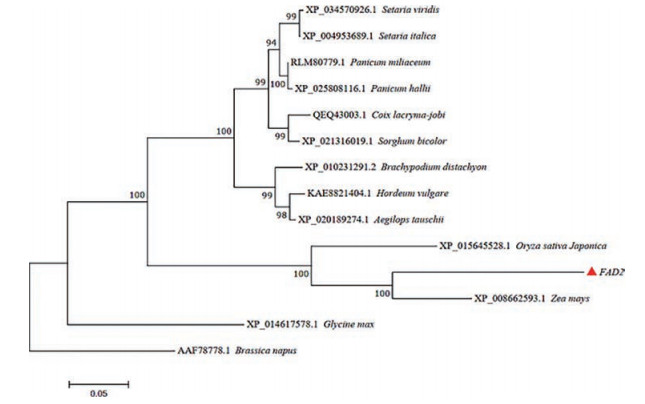
从NCBI中挑选出与FAD2基因编码蛋白相似性比较高的13条蛋白序列, 并分为单子叶植物和双子叶植物。基于MEGA 7.0软件中的Neighbor-Joining (NJ) 算法构建薏苡FAD2氨基酸序列的系统进化树。结果如图 5所示, 薏苡FAD2与同为单子叶植物的玉米、粳稻(Oryza sativa japonica)、狗尾草、短柄草、谷子、粟米、薏苡、黍、大麦、节节麦和高粱聚为一大类, 而双子叶植物甘蓝型油菜(Brassica napus) 和大豆(Glycine max) 单独聚为一类; 说明其在不同植物中的分布比较广泛, 且与单子叶植物的进化保持一致。此外, 薏苡FAD2与玉米聚为一类, 其次是水稻, 由此推测其与玉米和水稻中同类基因的功能更相似。
|
Figure 5 Phylogenetic trees of FAD2 protein from other plants |
FAD2基因编码催化油脂中的饱和或不饱和脂肪酸在烃链不同位置形成双键的去饱和酶。本课题组保存了不同油脂含量薏苡在不同时期的转录组数据, 通过分析FAD2基因的转录水平, 结果如表 1所示, S/M/L分别指的是从抽穗期以后每隔20天采样的时间, FPKM (reads per kilobase of exon per million reads mapped) 代表的是FAD2基因的表达水平, 其中在低油脂含量薏苡中, 并未检测到FAD2基因的表达, 而高油脂含量薏苡在不同时期均可检测到基因的表达, 并随着植物的成熟表达水平呈现出逐渐降低的趋势。
| Table 1 Analysis of the expression level of FAD2 gene from different Coix lacryma-jobi L. resources. S/M/L refers to the sampling time every 20 days after the heading date, respectively. FPKM: Reads per kilobase of exon per million reads mapped |
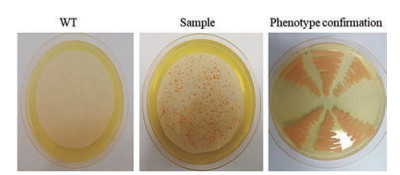
将pCAMBIA2300-pPGK-FAD2-tHSP载体转入野生型圆红冬孢酵母菌株, 然后从诱导平板上随机挑取转化子, 并划线于含有300 μg·mL-1头孢克肟和20 μg·mL-1新霉素的YEPD筛选平板, 同时以野生型圆红冬孢酵母作为对照, 30 ℃培养至菌落长起, 验证转化子表型的正确性。随后挑取筛选平板上生长的菌株, 接入含有300 μg·mL-1头孢克肟和20 μg·mL-1新霉素的YPD液体培养基中继续培养, 观察菌体生长情况, 并进一步确认。结果如图 6所示, 农杆菌工程菌株与野生型圆红冬孢酵母结合共转化后, 均在含有新霉素的筛选平板上成功获得了转化子, 而没有和农杆菌工程菌株互相作用的野生型圆红冬孢酵母, 不能在筛选平板上获得转化子。
|
Figure 6 The R. toruloides resulted from Agrobacterium-mediated transformation with pCAMBIA2300-pPGK-FAD2-tHSP |
将转化获得的工程菌株在30 ℃、200 r·min-1的摇床中摇瓶发酵, 并从发酵液中提取油脂, 使用气相色谱鉴定。结果如表 2所示, 总共检测到7类脂肪酸, 分别是肉豆蔻酸(C14∶0)、棕榈酸(C16∶0)、棕榈油酸(C16∶1)、硬脂酸(C18∶0)、油酸(C18∶1)、亚油酸(C18∶2) 和亚麻酸(C18∶3), 其中FAD2基因的表达产物中, 检测到C18∶1和C18∶2的相对含量分别为57.6%和7%。与野生型酵母菌株相比, C18∶1相对含量提高了4.5%, 而C18∶2降低了1.2%, 由此表明该基因编码的产物未催化C18∶1到C18∶2的去饱和, 从而使得C18∶1的相对含量有所提高。基于表达产物中油酸和亚油酸的含量变化规律, 推测FAD2蛋白可能没有活性。
| Table 2 Fatty acid composition analysis of FAD2 gene |
不饱和脂肪酸是细胞膜的主要组分, 也是人体生长发育所必需的一类营养物质, 其主要在质体和内质网中, 通过一系列的脂肪酸去饱和酶催化各类型的脂肪酸去饱和而合成, 并受到环境胁迫以及发育的调控[29]。本研究通过在线软件对薏苡脂肪酸生物合成途径中的delta-12脂肪酸去饱和酶(FAD2) 进行了理化性质和结构功能等分析。理化性质预测结果显示, 薏苡FAD2基因全长cDNA为936 bp, 编码一个311氨基酸构成的碱性亲水不稳定蛋白, 分子质量为34 871.30 Da, 含有3个跨膜螺旋结构域, 不含信号肽剪切位点, 亚细胞定位主要在质体膜。系统发育树分析表明, 薏苡FAD2与同为单子叶植物的玉米、粳稻、狗尾草、短柄草、谷子、粟米、薏苡、黍、大麦、节节麦和高粱聚为一大类, 而双子叶植物甘蓝型油菜和大豆单独聚为一类, 由此推测其在单子叶植物的进化过程中比较保守。
在植物合成不饱和脂肪酸的过程中, 除了delta-12脂肪酸去饱和酶以外, 还包括delta-6、delta-9和delta-15脂肪酸去饱和酶等, 这些不同类型的去饱和酶均含有3个极度保守的组氨酸富集区: His Box Ⅰ、His Box Ⅱ和His Box Ⅲ, 其中delta-12脂肪酸去饱和酶的3个组氨酸保守位点依次为HXXXH、HXXHH和HXXHH。在本研究中, 薏苡FAD2编码的蛋白序列仅具有一个His Box Ⅲ保守位点“HXXHH”。有研究表明His Box Ⅰ和Ⅱ的缺失或取代可能会导致酶活性下降, His Box Ⅲ的缺失或取代可能会导致酶失去活性[30-32]。Libisch等[33]将玻璃苣delta-6脂肪酸去饱和酶中的HISⅠ区和HISⅡ区的氨基酸和delta-8脂肪酸去饱和酶的HIS Ⅲ区进行重组, 结果发现重组酶丧失催化C18脂肪酸脱氢的功能, 但可以催化棕榈烯酸(C16∶1) 和肉豆蔻烯酸(C14∶1) 脱氢, 且提出HISⅠ和HISⅡ参与了底物结合位点的形成, 而这个位点似乎限制了脂肪酸底物的链长。为了验证脂肪酸去饱和酶功能位点的缺失对其功能的影响, 将FAD2基因在圆红冬孢酵母中进行了异源表达, GC的检测结果显示C18∶1的含量升高, C18∶2的含量降低, 若此蛋白在C18∶1到C18∶2的不饱和脂肪酸之间发挥作用, GC的检测结果应为C18∶1的含量降低, C18∶2的含量上升, 但是GC检测结果与此相反。由此推测C18∶1的相对含量比对照株系有所提高, 是由于该基因的HXXHH位点有利于在C18∶0到C18∶1的去饱和反应。此外, 转录水平分析显示, 高油脂含量薏苡中该基因的表达水平较低, 且呈现逐渐下降的趋势, 而低油脂含量薏苡中并未检测到该基因的表达。基于上述分析, 推测组氨酸保守位点的缺失可能会造成FAD2蛋白活性降低甚至失活, 以至于无法催化油酸合成亚油酸。
此研究从薏苡中克隆出脂肪酸去饱和酶基因, 并对其进行生物信息学分析和功能验证, 不仅有助于进一步研究薏苡中其他类脂肪酸去饱和酶的结构和功能, 而且也为其他植物油脂合成途径同类基因的研究提供了一定的参考。
作者贡献: 魏小艳和李勇是本研究的实验设计者和执行人; 魏小艳完成了数据分析及论文初稿的撰写; 谭宇萍参与文章的修改; 郭娟、王雅南、黄璐琦是项目的构思者及负责人, 指导实验设计、数据分析、论文写作与修改。全体作者都阅读并同意最终的文本。
利益冲突: 本文不存在利益冲突。
| [1] |
Shen JQ, Li Z, Zhou LB, et al. Progress on main components and functions of Coix seed oil[J]. China Oils Fats (中国油脂), 2020, 45: 90-95. |
| [2] |
Li XK, Gu K, Liang MW, et al. Research progress on chemical constituents and pharmacological effects of Coicis Semen[J]. Chin Tradit Herb Drugs (中草药), 2020, 51: 5645-5657. |
| [3] |
Luo YY, Du WF, Kang XJ, et al. Process of application history and modern research of Coix seed[J]. Chin J Tradit Chin Med Pharm (中华中医药杂志), 2018, 33: 5666-5673. |
| [4] |
State Pharmacopoeia Committee. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. Vol 1. Beijing: China Medical Science Press, 2020.
|
| [5] |
Hou JJ, Cao CM, Xu YW, et al. Exploring lipid markers of the quality of Coix seeds with different geographical origins using supercritical fluid chromatography mass spectrometry and chemometrics[J]. Phytomedicine, 2018, 45: 1-7. DOI:10.1016/j.phymed.2018.03.010 |
| [6] |
Xi XJ, Zhu YG, Tong YP, et al. Assessment of the genetic diversity of different Job's Tears (Coix lacryma-jobi L.) accessions and the active composition and anticancer effect of its seed oil[J]. PLoS One, 2016, 11: e0153269. DOI:10.1371/journal.pone.0153269 |
| [7] |
Yu F, Gao J, Zeng Y, et al. Inhibition of Coix seed extract on fatty acid synthase, a novel target for anticancer activity[J]. J Ethnopharmacol, 2008, 119: 252-258. DOI:10.1016/j.jep.2008.07.015 |
| [8] |
Hou DR, Yang LJ, Xiong J, et al. Efficacy and safety of Kanglaite injection for gastric cancer: a protocol for systematic review and meta-analysis[J]. Medicine (Baltimore), 2020, 99: e21619. DOI:10.1097/MD.0000000000021619 |
| [9] |
Qi FH, Zhao L, Zhou AY, et al. The advantages of using traditional Chinese medicine as an adjunctive therapy in the whole course of cancer treatment instead of only terminal stage of cancer[J]. Biosci Trends, 2015, 9: 16-34. DOI:10.5582/bst.2015.01019 |
| [10] |
Pan P, Wu Y, Guo ZY, et al. Antitumor activity and immunomodulatory effects of the intraperitoneal administration of Kanglaite in vivo in Lewis lung carcinoma[J]. J Ethnopharmacol, 2012, 143: 680-685. DOI:10.1016/j.jep.2012.07.025 |
| [11] |
Chung C, Hsia S, Lee M, et al. Gastroprotective activities of adlay (Coix lachryma-jobi L. var. ma-yuen Stapf) on the growth of the stomach cancer AGS cell line and indomethacin-induced gastric ulcers[J]. J Agric Food Chem, 2011, 59: 6025-6033. DOI:10.1021/jf2009556 |
| [12] |
Fang T, Jiang YX, Chen L, et al. Metabonomics study of Coix seed oil on suppressing the growth of triple negative breast cancer[J]. Shanghai J Tradit Chin Med (上海中医药杂志), 2020, 54: 78-84. |
| [13] |
Nie LJ, Sun ZS, Cheng XF, et al. Effect of unsaturated fatty acid on PSⅡ function in chrysanthemum (Dendranthema morifolium) leaves under low temperature stress[J]. J Northeast Forest Univ (东北林业大学学报), 2020, 48: 61-65. |
| [14] |
Bazinet RP, Layé S. Polyunsaturated fatty acids and their metabolites in brain function and disease[J]. Nat Rev Neurosci, 2014, 15: 771-785. DOI:10.1038/nrn3820 |
| [15] |
Wiktorowska-Owczarek A, Berezińska M, Nowak JZ. PUFAs: structures, metabolism and functions[J]. Adv Clin Exp Med, 2015, 24: 931-941. DOI:10.17219/acem/31243 |
| [16] |
Tvrzicka E, Kremmyda LS, Stankova B, et al. Fatty acids as biocompounds: their role in human metabolism, health and disease——a review. Part 1:classification, dietary sources and biological functions[J]. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub, 2011, 155: 117-130. DOI:10.5507/bp.2011.038 |
| [17] |
Wu JY, Peng LL, Dong SB, et al. Transcriptome analysis of Chelidonium majus elaiosomes and seeds provide insights into fatty acid biosynthesis[J]. PeerJ, 2019, 7: e6871. DOI:10.7717/peerj.6871 |
| [18] |
Zhao X, Wei J, He L, et al. Identification of fatty acid desaturases in maize and their differential responses to low and high temperature[J]. Genes (Basel), 2019, 10: 445. DOI:10.3390/genes10060445 |
| [19] |
Lamers D, Visscher B, Weusthuis RA, et al. Overexpression of delta-12 desaturase in the yeast Schwanniomyces occidentalis enhances the production of linoleic acid[J]. Bioresour Technol, 2019, 289: 121672. DOI:10.1016/j.biortech.2019.121672 |
| [20] |
Wei XY, Li Y, Guo J, et al. Cloning and bioinformatic analysis of the 3-ketoacyl-CoA synthase gene in Coix lacryma-jobi L[J]. Acta Pharm Sin (药学学报), 2021, 56: 610-617. |
| [21] |
Zheng H, Yu MY, Pu CJ, et al. Cloning and expression analysis of 3-hydroxy-3-methylglutaryl coenzyme A reductase (CcHMGR) genes in Cinnamomum camphora (L.) Presl[J]. Acta Pharm Sin (药学学报), 2020, 55: 152-159. |
| [22] |
Lin XP, Wang YN, Zhang SF, et al. Functional integration of multiple genes into the genome of the oleaginous yeast Rhodosporidium toruloides[J]. FEMS Yeast Res, 2014, 14: 1-17. DOI:10.1111/1567-1364.12130 |
| [23] |
Wang YN, Zhang SF, Pötter M, et al. Overexpression of Δ12-fatty acid desaturase in the oleaginous yeast Rhodosporidium toruloides for production of linoleic acid-rich lipids[J]. Appl Biochem Biotechnol, 2016, 180: 1497-1507. DOI:10.1007/s12010-016-2182-9 |
| [24] |
Li ZF, Zhang L, Shen XJ, et al. A comparative study on four method of fungi lipid extraction[J]. Microbiol China (微生物学通报), 2001, 28: 72-75. |
| [25] |
Li Y, Wei XY, Guo J, et al. The study of lipid production by reusing of herb residues of Songling Xuemaikang capsule[J]. China J Chin Mater Med (中国中药杂志), 2020, 45: 4392-4397. |
| [26] |
Li YC, Zhao JF, Liu HY. The content of fatty acids in fish oil was determined by GCMS[J]. Heilongjiang Environ J (黑龙江环境通报), 2008, 32: 58-60. |
| [27] |
Dehghan Nayeri F, Yarizade K. Bioinformatics study of delta-12 fatty acid desaturase 2(FAD2) gene in oilseeds[J]. Mol Biol Rep, 2014, 41: 5077-5087. DOI:10.1007/s11033-014-3373-5 |
| [28] |
Yang TQ, Wang XJ, Dong TN, et al. Isolation and functional analyses of PvFAD2 and PvFAD3 involved in the biosynthesis of polyunsaturated fatty acids from Sacha Inchi (Plukenetia volubilis)[J]. PeerJ, 2020, 8: e9169. DOI:10.7717/peerj.9169 |
| [29] |
Wang LM, Fu ZZ, Gao J, et al. Molecular mechanism of unsaturated fatty acids synthesis and regulation in plant[J]. Gen Appl Biol (基因组学与应用生物学), 2020, 39: 254-258. |
| [30] |
Zhang Y. Clone and Functional Verification of Δ9- and Δ15-Fatty Acid Desaturase Gene from Lipomyces kononenkoae (橘林油脂酵母Δ9-和Δ15-脂肪酸去饱和酶基因的克隆及功能验证)[D]. Wuhan: Huazhong Agricultural University, 2011.
|
| [31] |
Zhang Q, Li MC, Sun HY, et al. Progress on molecular biology of Δ6-fatty acid desaturases[J]. Chin J Biotechnol (生物工程学报), 2004, 20: 319-324. |
| [32] |
Sayanova O, Shewry PR, Napier JA. Histidine-41 of the cytochrome b5 domain of the borage Δ6 fatty acid desaturase is essential for enzyme activities[J]. Plant Physiol, 1999, 121: 641-646. DOI:10.1104/pp.121.2.641 |
| [33] |
Libisch B, Michaelson LV, Lewis MJ, et al. Chimeras of delta6-fatty acid and delta8-sphingolipid desaturases[J]. Biochem Biophys Res Commun, 2000, 279: 779-785. DOI:10.1006/bbrc.2000.4023 |
 2021, Vol. 56
2021, Vol. 56


