二甲双胍是世界上最常用的口服降糖药, 每年有超过1.5亿人服用, 美国FDA于1995年批准二甲双胍在美国治疗2型糖尿病, 经过几十年的临床使用, 二甲双胍已被证明是安全且低价的抗糖尿病药物[1]。近十几年的研究表明除降糖作用外, 二甲双胍作为AMPK的间接激动剂, 还能调节脂质、抗肿瘤、调节免疫、改变肠道菌群, 维持肠道屏障的完整性[2-4]。降血脂的经典药物为他汀类药物, 他汀类药物作为HMG-CoA酶的抑制剂, 可降低血浆胆固醇水平, 通常作为心血管疾病患者, 特别是动脉粥样硬化和高脂血症患者的首选药物, 其中最主要的是辛伐他汀和阿托伐他汀[5]。中药小檗碱对于糖脂代谢有一定的调节作用, 马晓蕾等[6]发现小檗碱可能通过影响p-AMPKα及PPARγ的表达来抑制脂肪组织中前脂肪细胞分化, 减少脂肪组织堆积, 调节血糖和血脂。近些年来, 随着研究不断深入, 一些新型调血脂靶点和药物也逐渐被发现, 除HMG-CoA还原酶外, 前蛋白转化酶枯草溶菌素/kexin9型、载脂蛋白B、微粒体甘油三酯转移蛋白、ATP柠檬酸裂合酶、过氧化物酶体增殖物激活受体等均在脂质代谢中扮演着重要的角色[7]。除此之外, AMPK的脂代谢作用被广泛研究, 研究[8]表明AMPK可通过关键底物的磷酸化来调节脂质的合成、脂解和脂肪酸氧化, 如乙酰辅酶A羧化酶、固醇调节元件结合蛋白、3-磷酸甘油酰基转移酶等。二甲双胍降脂原理包括[9]降低肠上皮细胞脂质分泌; 减轻肝脂肪变性; 增加脂肪组织和肌肉中的脂肪酸氧化; 通过调节肠道微生物促进降脂作用, 其可以通过AMPK和非AMPK的方式调节血脂, 但研究者们认为二甲双胍在脂质代谢中扮演的角色还未被充分认识, 所以仍需对其药理作用进一步研究和发现[1]。
当前, 多组学整合研究已经被用来揭示药物对生命系统的影响以及疾病本身发病和药物治疗的机制[10], 包括基因组学、转录组学、代谢组学等在内的各种组学, 通过这些组学技术的联合应用, 能够从基因、蛋白、代谢和微生物作用的角度全方位展示生物体信息, 更有利于疾病诊断和药物新靶点的发现[11]。其中, 代谢组学是以代谢物为基础, 连接基因和蛋白表型, 是二者下游信号的放大, 易于发现相关的热点代谢途径, 直观展示机体发生的变化[12, 13]。但是它反映的是多个单独途径贡献的总体水平, 无法体现单一代谢途径的变化情况。同位素示踪的代谢流分析通过追踪标记原子的代谢历程并进行定量分析, 从而量化不同代谢途径的改变程度, 弥补了代谢组学的不足。目前, 该技术已经被用于糖、脂和肿瘤等方面的研究[14-16]。将该分析技术应用于代谢组学研究中, 能够验证通过代谢组学发现的热点代谢途径, 量化该热点途径的变化, 使能更加清晰地认识代谢网络改变的确切机制[17]。
本课题组前期对于脂代谢紊乱金黄地鼠动物模型的代谢组学研究表明, 该模型易于造模, 具有高度可重复性, 而且基于该模型的药效学研究日渐增多[18, 19], 表明金黄地鼠的确是一种研究脂代谢紊乱的优选动物模型。本研究旨在用该模型结合代谢组学和代谢流技术探讨二甲双胍的降脂作用以及其对脂代谢紊乱中的关键代谢通路改变的影响。采用高脂膳食诱导形成高脂血症金黄地鼠, 进行二甲双胍干预, 运用1H NMR的代谢组技术, 分析代谢轮廓变化, 同时结合13C代谢流技术, 量化三羧酸循环的变化, 探讨二甲双胍调节高脂血症金黄地鼠代谢紊乱的作用, 希望能够直观地发现二甲双胍作用下一些关键变化途径以及明确其变化的通量, 同时为阐明其代谢调控的位点和机制以及识别特异性作用靶点提供线索[20]。
材料与方法实验动物 50只雄性金黄地鼠, 5~6周龄, 由北京维通利华实验动物技术有限公司提供[合格证号: SCXK (京) 2016-0011], 饲养于中国医学科学院药物研究所动物实验中心屏障环境设施中。动物自由摄食饮水, 饲养温度为20~24 ℃, 空气湿度为35%~55%, 光照黑暗各12 h。
动物饲料 基础饲料(control diet, CD), 由中国医学科学院实验动物研究所提供, 高脂饲料按以下方法配制: 胆固醇0.2%, 猪油20%, 基础饲料79.8%。由本实验室提供配方, 北京华阜康生物科技股份有限公司加工混匀后, 压制成高脂饲料, 进行饲喂。
试剂 羧甲基纤维素钠[carboxymethyl cellulose sodium, CMC-Na, 批号(F20170810)]、氯化钠(分析纯)、氢氧化钾(分析纯, 批号: 20140920) 均购自国药集团化学试剂有限公司; 盐酸二甲双胍片(批号: H20023370) 购自中美上海施贵宝制药有限公司; 辛伐他汀片剂(批号: M036505) 购自Merck Sharp & Dohme B.V.公司; 3-(三甲基甲硅烷硅基)-1-丙磺酸钠[3-(trimethylsilyl)-1-propanesulfonic acid-d6 sodium salt, DSS] 由Sigma-Aldrich生产(批号BCBH4842V), 氘代三甲基硅烷基丙酸(sodium 3-trimethylsilyl-propionate-2, 2, 3, 3-d4, TSP) 由Cambridge Isotope Laboratories, Inc生产(批号l1-12486), 两者均购于青岛腾龙微波有限公司; 重水(deuterium oxide, D2O) 由Sigma-Aldrich生产, 购自北京金鸥翔科贸有限公司; D-葡萄糖(U-13C6, 99%, 批号PR-28591) 由Cambridge Isotope Laboratories, Inc.生产, 购自热耳化工原料(上海) 有限公司; 甲醇(色谱纯, 批号: 20131005) 购自北京市通广精细化工公司; 丙酮(分析纯, 批号20180514)、乙酸乙酯(分析纯, 批号: 20180126)、无水碳酸钠(分析纯, 批号: 20131223)、浓硫酸(分析纯) 和高氯酸(73%, 分析纯) 均购自北京化学工业集团有限责任公司。氘代乙腈(acetonitrile-d3, 批号: #MBBB2146V), 购自Sigma-Aldrich公司。
试剂盒 胆固醇测定试剂盒(批号: 192061)、甘油三酯测定试剂盒(批号: 188021)、低密度脂蛋白胆固醇测定试剂盒(批号: 201441)、高密度脂蛋白胆固醇测定试剂盒(批号: 201361) 和葡萄糖测定试剂盒(批号: 200901) 均购自中生北控生物科技股份有限公司, 规格为通用型, 2~8 ℃保存。
实验仪器 多用途低温高速离心机(型号: 3K15), 德国Sigma公司产品; SeperateTM Max 190酶标仪, Molecular Devices公司产品; Bead Ruptor多样品研磨珠均质仪, Omni Intenational公司(美国); Bruker AVANCE Ⅲ-500和600超导傅里叶变化核磁共振波谱仪, 瑞士布鲁克公司产品; 天平(型号: BT124S), 德国赛多利斯公司产品。
模型建立 本实验采用高脂饲料饲喂法(high-fat diet, HFD) 诱导金黄地鼠高脂模型的形成。50只金黄地鼠适应性饲养一周后, 除空白对照组(10只), 每日给予基础饲料外, 其余动物(40只) 均给予高脂饲料喂养, 用以诱导高脂血症模型。建立高脂模型时, 动物自由摄食饮水, 饲养温度为20~24 ℃, 空气湿度为(35~55) %, 光照12 h, 黑暗12 h。
二甲双胍干预模型建立 高脂饲料喂养1周后, 除空白对照组外(10只), 将高脂饲料喂养金黄地鼠(40只) 按照体重依据随机分组原则分成4组, 各组饲喂及给药方案如下: 空白对照组(C), 灌胃给予对照溶剂(2.5%的CMC-Na); 模型对照组(M), 灌胃给予对照溶剂(2.5%的CMC-Na); 辛伐他汀对照组(S), 灌胃给予剂量为每天6 mg·kg-1; 二甲双胍低剂量给药组(Met1), 灌胃给予剂量为每天100 mg·kg-1; 二甲双胍高剂量给药组(Met2), 灌胃给予剂量为每天200 mg·kg-1。给药剂量参照文献[21, 22]确定。给药组每日下午灌胃给予药物, 灌胃体积为10 mL·kg-1, 空白对照组与模型对照组给予等体积2.5%的CMC-Na溶剂。本实验连续给药11周。
血清生化指标检测 第2、6周给药后半小时眼内眦静脉取血0.2 mL, 第9周给药后半小时眼内眦静脉取血0.5 mL, 静置半小时以4 000 r·min-1, 10 min, 4 ℃离心, 收集上清液(血清), 按血脂和血糖测试试剂盒说明书要求, 测定各样本吸光度, 计算血清中总胆固醇(total cholesterol, TC)、甘油三酯(triglyceride, TG)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol, LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol, HDL-C) 和葡萄糖浓度。每个样品重复检测两次。
1H NMR代谢组学血清、尿液和粪便样品收集和前处理[23] 给药9周后收集血清200 μL, 用于1H NMR核磁代谢组学测试。给药3、5、9周后, 用代谢笼收集金黄地鼠尿液和粪便12 h, 用于1H NMR代谢组学测试。血清和尿液的核磁前处理和信号采集参考文献[23]。
粪便进行核磁检测前, 称取粪便约250 mg, 加入钢珠和磷酸盐缓冲液(100% H2O, 0.15 mol·L-1 NaH2PO4/K2HPO4, pH 7.4) 1.25 mL进行匀浆破碎。破碎后于4 ℃下, 10 000 r·min-1离心10 min, 取上清液约700 μL, 再次在4 ℃下, 以13 000 r·min-1离心5 min, 取上清500 μL于0.5 mL超滤管(3 kDa) 内, 在4 ℃下, 以13 000 r·min-1离心30 min, 取滤液300 μL加入内标溶液(100% D2O, 5 mmol·L-1 DSS) 300 μL, 混匀, 转移至5 mm核磁管, 于25 ℃进行1D NOESY 1H NMR测试。
13C NMR代谢流血清样品收集和前处理[24] 11周给药后, 禁食12 h, 称取地鼠体重, 从眼内眦静脉丛给予[U-13C6]葡萄糖生理盐水溶液, 注射给药剂量为500 mg·kg-1, 注射体积为2.5 mL·kg-1。随后动物可自由活动和饮水。用2 mL·kg-1的3%戊巴比妥钠溶液麻醉金黄地鼠, 心脏取血4~5 mL, 静置半小时后, 4 ℃下以3 500 r·min-1离心20 min, 收集上清, 保存于-80 ℃冰箱, 用于13C NMR代谢流分析。
进行13C核磁检测前, 需要将葡萄糖转化为单丙酮葡萄糖(monoacetone glucose, MAG), 因为MAG具有较宽的化学位移分布, 每个13C信号都易分辨, 且MAG提供了内参, 即通过葡萄糖衍生化添加的甲基碳中的代表自然丰度的13C信号, 利于定量。具体操作如下: 取血清2~3 mL, 加入70%高氯酸溶液使其终浓度为7%, 4 ℃下, 13 000 r·min-1离心10 min后取出上清液。用10%的KOH溶液调节pH至7, 4 ℃下, 13 000 r·min-1离心10 min后取出上清液, 冻干。冻干残余物用50%甲醇溶液800 μL分3次超声溶解, 用80%甲醇溶液过凝胶色谱柱除盐, 收集馏分, 点薄层板, 根据点板情况合并馏分并旋干。旋干残余物用3 mL丙酮(含120 μL浓硫酸) 超声溶解, 转移至50 mL圆底烧瓶, 室温搅拌4 h后, 用1.5 mol·L-1 Na2CO3溶液调至pH 2, 继续搅拌24 h以产生MAG。然后用1.5 mol·L-1的Na2CO3溶液调至pH 8, 旋蒸除去丙酮。用3 mL乙酸乙酯萃取5遍, 将乙酸乙酯萃取部分旋干。干燥残留物溶于160 μL氘代乙腈和10 μL D2O, 转移至3 mm核磁管中采集核磁碳谱。
血清样品13C核磁图谱采集: P1 = 10.5 μs, 谱宽24 509.80 Hz, 数据点73 526, 采集时间1.5 s, 弛豫时间0.8 s, 采用标准的WALTZ-16脉冲序列进行氢去耦, 采集16 000次, 采集时间约10.37 h。
1H NMR图谱处理与多元统计分析 NMR测试所得谱图经过傅里叶变换、调相位、调基线和定标。除血清BPP-LED 1H NMR谱图以TSP小分子信号作为定标基准外, 其余1D NOESY 1H NMR谱图均用DSS (δ 0.00) 定标。核磁波谱数据调用AMIX (Analysis of mixtures software v. 3.0, Bruker Topspin) 软件中的程序处理。血清1D NOESY 1H NMR图谱按δ 0.8~9.0 (除去水峰δ 4.67~5.20, DSS峰δ 1.74~1.80和δ 2.89~2.97) 的范围分段积分, 其中每段为0.01, 血清BPP-LED 1H NMR图谱按δ 0.5~6 (除去水峰δ 4.7~5.2) 的范围分段积分, 其中每段为0.04, 尿液1D NOESY 1H NMR图谱按δ 0.65~10.0 (除去水峰δ 4.7~5.0, 尿素峰δ 5.46~6.0) 的范围分段积分, 其中每段为0.04, 粪便1D NOESY 1H NMR图谱按δ 0.65~10.0 (除去水峰δ 4.68~5.15, DSS峰δ 2.90~2.93) 的范围分段积分, 其中每段为0.01。将积分数据归一化之后, 以Excel文件贮存, 用于模式识别分析。
代谢物鉴定 血清、尿液、粪便1D NOESY 1H NMR谱图和血清BPP-LED 1H NMR谱图中的内源性代谢物用人类代谢物数据库(www.hmdb.ca) 和Chenomx NMR Suite (V. 7.5, Chenomx, Edomonton, Canada) 软件进行鉴定, 并结合文献[23]进行归属。血清中单不饱和脂肪酸和多不饱和脂肪酸的比例计算方法参考文献[23]进行计算。
13C NMR图谱分析 本研究重点关注三羧酸循环(tricarboxylic acid cycle, TCA) 的代谢通量, 葡萄糖进入体内后迅速参与代谢, 全标记的葡萄糖经过糖酵解生成[U-13C3]丙酮酸, 它可以通过丙酮酸羧化酶(pyruvate carboxylase, PC) 或丙酮酸脱氢酶(pyruvate dehydrogenase, PDH) 进入TCA循环, 如图 1, 最终会生成四种标记模式的磷酸烯醇式丙酮酸(phosphoenolpyruvate, PEP)[24, 25]: [2, 3-13C2]PEP、[1, 2-13C2]PEP、[U-13C3]PEP、[3-13C1]PEP从而离开TCA循环, 接着转化为3-磷酸甘油醛(D-glyceraldehyde 3-phosphate, GA3P) 和磷酸二羟丙酮(dihydroxyacetone phosphate, DHAP), 最后产生[2, 3-13C2] GA3P、[1, 2-13C2] GA3P、[U-13C3] GA3P、[3-13C1] GA3P和[1-13C1] GA3P, 再经过果糖二磷酸酶-1和葡萄糖-6-磷酸酶产生三标记、双标记和单标记的葡萄糖。单标记同位素异构体(如[3-13C1] 葡萄糖) 在核磁图谱上无法与天然丰度13C信号进行区分, 新产生的全标记葡萄糖和注射的示踪剂无法区分, 所以[1, 2-13C2]、[2, 3-13C2]、[4, 5-13C2]和[5, 6-13C2]葡萄糖成为主要的观察对象。而除了TCA循环, 还有三种主要的途径影响13C葡萄糖的代谢情况: 磷酸甘油醛异构酶(triose phosphate isomerase, TPI) 的平衡程度, 转醛酶反应和磷酸戊糖途径(pentose phosphate pathway, PPP), 然而, 转醛酶和TPI无法破坏1~3位和4~6位的碳-碳键, 所以不会影响三碳单元内13C分布的信息, 而PPP不会破坏4-6碳-葡萄糖中的碳-碳键, 因此[4, 5-13C2]-或[5, 6-13C2]葡萄糖的存在表明了TCA循环代谢通量[26]。定量时以MAG两个天然丰度(1.1%) 的甲基作为内标峰, 根据其他13C信号与这两个峰的面积之比即可计算出相对丰度。
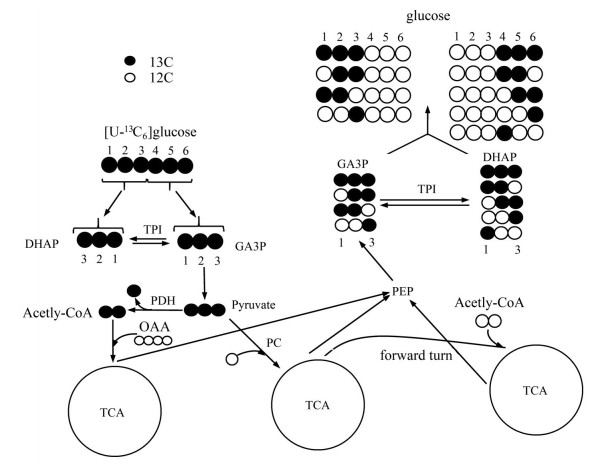
|
Figure 1 [U-13C6] glucose metabolism in the TCA cycle. DHAP: Dihydroxyacetone phosphate; GA3P: D-Glyceraldehyde 3-phosphate; PEP: Phosphoenolpyruvate; PC: Pyruvate carboxylase; PDH: Pyruvate dehydrogenase; TPI: Triose phosphate isomerase; PPP: Pentose phosphate pathway. Open circles: 12C; black circles: 13C |
给药后第2、6、9周时测量的血清生化指标如表 1和图 2所示。在给药第12天时, 辛伐他汀给药组有一只地鼠死亡。在给药2、6、9周时高脂模型组与对照组相比, 血清中TC、TG、LDL-C和血糖水平显著增加, 表明HFD成功导致了金黄地鼠血清中的脂质积聚以及血糖升高, 二甲双胍不同剂量给药组和阳性药辛伐他汀组血清脂质和血糖水平均显著降低。
| Table 1 Effects of metformin on serum TC, TG, LDL-C, HDL-C, and glucose levels in hyperlipidemia hamsters at week 2, 6, and 9 after drug dosing. *P < 0.05, **P < 0.01, ***P < 0.001 vs HFD group |
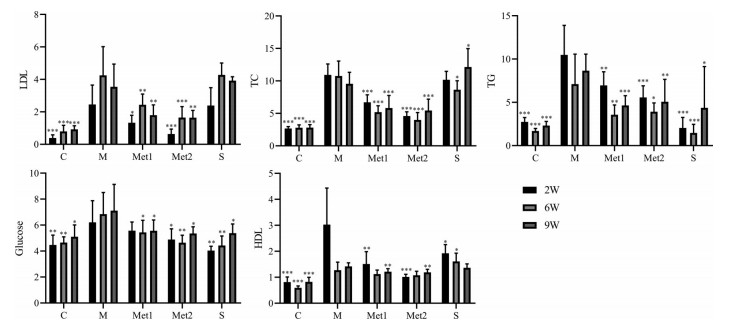
|
Figure 2 Effects of metformin on serum TC, TG, LDL-C, HDL-C, and glucose levels in hyperlipidemia hamsters at week 2, 6, and 9 after drug dosing. TC: Total cholesterol; TG: Triglyceride; LDL-C: Low density lipoprotein-cholesterol; HDL-C: High density lipoprotein-cholesterol; C: Control group; M: Model group; Met1: Metformin-treated group (100 mg·kg-1 per day); Met2: Metformin-treated group (200 mg·kg-1 per day); S: Simvastatin treated group. n = 10, ± s. *P < 0.05, **P < 0.01, ***P < 0.001 vs HFD group |
本研究采用OPLS-DA方法研究了空白对照组、模型组及给药组地鼠血清、尿液和粪便中代谢轮廓的总体变化。由于取血时个别金黄地鼠的血液取出量不足, 故未做血清核磁检测。实际进行血清核磁检测的金黄地鼠数量为: 空白对照组8只; 模型组10只; 辛伐他汀组7只; 二甲双胍低、高剂量组各10只。OPLS-DA结果显示空白对照组和模型组指标R2和Q2均大于0.5且接近于1, P < 0.05。图 3展示了给药后9周金黄地鼠血清、尿液和粪便的二甲双胍高剂量与模型组之间的1H NOESY得分图。具体OPLS-DA模型相关参数见表 2。结果表明本实验成功建立了高脂血症金黄地鼠模型, 且给药后能够显著回调。
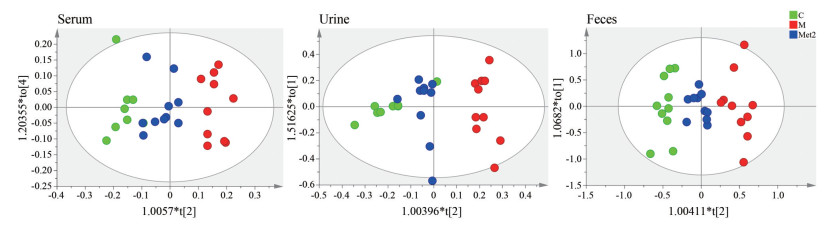
|
Figure 3 OPLS-DA scores plots derived from 1H NOESY NMR spectra of serum, feces, and urine samples between C, M, and Met2 groups for 9 weeks |
| Table 2 Parameters of OPLS-DA for serum, urine, and feces samples at 9 weeks |
血清、粪便中各组间主要差异代谢物结果如图 4B, 尿液的差异代谢物见表 3, 三者的代谢通路分析见图 4A。VIP > 1.0的相应变量并且具有显著性统计学差异的代谢物被选择为主要差异代谢物(P < 0.05)。给药9周后模型组相比空白对照组血清中的3-羟基丁酸、甜菜碱、与糖酵解和糖异生相关的丙酮酸和葡萄糖水平均显著上升; 氨基酸类和肠道菌群相关代谢物也显著变化。从BPP-LED NMR谱图中能观察到N-乙酰糖蛋白(N-acetyl glycoproteins, N-Ac) 和VLDL/LDL水平升高, 磷脂酰胆碱(phosphatidylcholine, PtdCho) 水平降低。二甲双胍和辛伐他汀给药后, 相应代谢物水平部分出现转归。此外, 通过计算金黄地鼠血清中多种饱和与不饱和脂肪酸比例的变化研究HFD和二甲双胍干预对金黄地鼠血清脂质成分的影响, 结果显示HFD显著升高了金黄地鼠血清中不饱和脂肪酸/总脂肪酸、单不饱和脂肪酸/总脂肪酸、单不饱和脂肪酸/不饱和脂肪酸的比例, 同时降低了饱和脂肪酸/总脂肪酸、饱和脂肪酸/不饱和脂肪酸、多不饱和脂肪酸/单不饱和脂肪酸等的比例。二甲双胍高、低剂量和辛伐他汀给药后显著回调。对血清中的差异代谢物进行通路富集, 富集程度较高的是肠菌相关的两个通路: 苯丙氨酸、酪氨酸和色氨酸生物合成、苯丙氨酸代谢, 还有糖和能量相关的代谢通路: 三羧酸循环、糖酵解和糖异生、丙酮酸代谢、淀粉和蔗糖代谢。
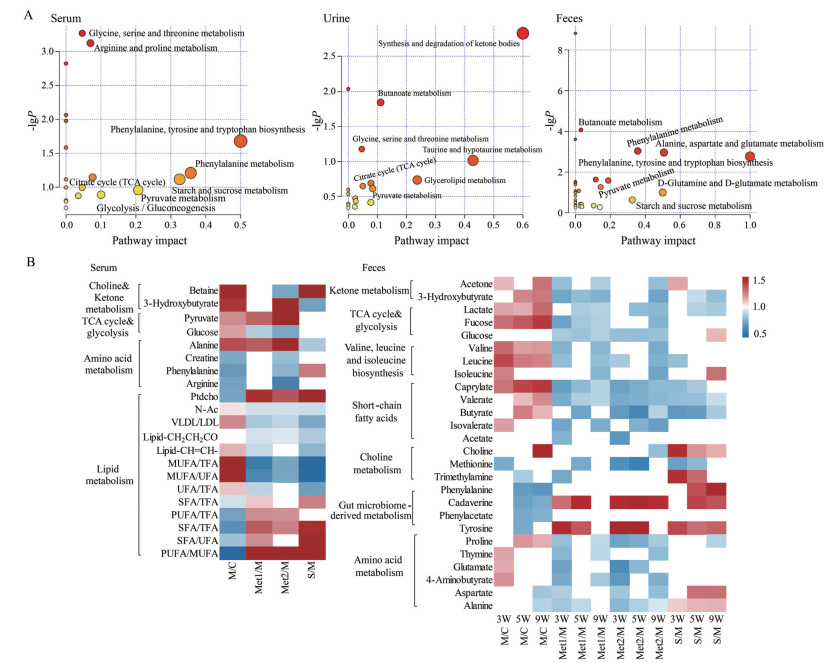
|
Figure 4 Metabolic pathway changes of serum, feces, and urine (A) and dynamic changes in the serum (left) and fecal (right) metabolomes in hamsters treated with HFD and metformin (B). The red cells indicate increases in metabolite levels, whereas the blue cells indicate decreases in metabolite levels (P < 0.05 and VIP > 1) |
| Table 3 Dynamic changes in the urine metabolomes in hamsters treated with HFD and metformin in 3, 5, 9 weeks. *P < 0.05, **P < 0.01, ***P < 0.001 vs HFD group |
给药3、5、9周后尿液的模型组相较于空白对照组, 其酮体持续上升, 2-羟基丁酸和乳酸含量持续增加, 胆碱持续降低, 还伴随着氨基酸的下降, 如脯氨酸、苏氨酸的降低。二甲双胍给药后, 2-羟基丁酸出现显著回调趋势, 但酮体类和胆碱类及氨基酸类代谢物均未有显著回调趋势。而在粪便中, 相比空白对照组, 模型组酮体、糖类、支链氨基酸、短链脂肪酸类均持续增高, 二甲双胍给药后, 这几类物质均显著回调。粪便中肠道菌群相关的代谢物, 如甲硫氨酸、苯丙氨酸、酪氨酸、苯乙酸, 在高脂模型组中显著降低, 二甲双胍给药后部分显著回调, 且逆转氨基酸类水平, 如谷氨酸、天冬氨酸、脯氨酸等。对尿液和粪便的差异代谢物进行通路富集, 影响因子较高的通路主要为糖代谢相关、能量代谢相关以及肠菌相关的代谢通路, 具体包括三羧酸循环、丙酮酸代谢、酮体代谢、甘油磷脂代谢、苯丙氨酸、酪氨酸和色氨酸生物合成等代谢通路, 与血清的富集结果类似。
3 高脂膳食和二甲双胍干预对TCA途径代谢通量的影响给予[U-13C6]葡萄糖后, 正常组和模型组血清13C NMR图谱中均显示出较强的[4, 5-13C2]、[5, 6-13C2]葡萄糖碳信号, 如图 5A所示。这表明[U-13C6]葡萄糖掺入代谢网络中, 经过不同的代谢途径产生了不同13C标记模式的代谢物。通过TCA循环产生的[5, 6-13C2]葡萄糖的丰度在正常组为(0.85 ± 0.18) %, 在模型组为(0.53 ± 0.10) %, 在二甲双胍低剂量和高剂量给药组分别为(1.06 ± 0.25) %和(1.25 ± 0.32) %, 辛伐他汀给药组为(0.71 ± 0.13) %。HFD引起TCA循环通量降低37.48% (P < 0.000 1), 二甲双胍低剂量和高剂量干预后, 引起TCA循环通量增加98.14% (P < 0.000 1) 和143.10% (P < 0.000 1), 辛伐他汀干预后引起TCA循环通量增加33.18% (P = 0.007), 如图 5B。
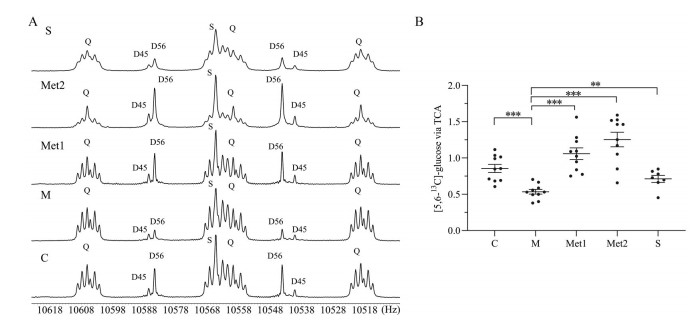
|
Figure 5 [U-13C6] glucose metabolism in the TCA cycle. A: C5 signals 13C NMR spectrum of MAG derived from [U-13C6] glucose and blood glucose of hamsters given [U-13C6] glucose; B: Hamsters treated with metformin and simvastatin given [U-13C6] glucose had less [5, 6-13C2] glucose from TCA cycle compared with HFD hamsters. Q: Doublet of doublets, or quartet, arising from coupling of C5 with both C4 and C6; D45: Doublet from coupling of C4 with C5; D56: Doublet from coupling of C5 with C6; S, singlet. **P < 0.01, ***P < 0.001 vs HFD group |
血清生化分析表明, 模型组血清中TC、TG、LDL-C和血糖水平在2~9周持续升高, 且其代谢组学结果显示, HFD组中VLDL/LDL、N-Ac含量升高, PtdCho和多不饱和脂肪酸/单不饱和脂肪酸降低, 这些结果表明金黄地鼠成功造模, 造模稳定, 并伴有炎症和氧化应激[23, 27]。二甲双胍给药后, 血清中的TC、TG、LDL-C和血糖水平均显著降低, 同时血清中VLDL/LDL、N-Ac、多不饱和脂肪酸/单不饱和脂肪酸和PtdCho回调, 表明二甲双胍降血糖以及降血脂, 而且可能具有一定的抗炎作用。
对血清、粪便和尿液的差异代谢物进行通路富集分析, 发现三种介质中的关键代谢通路基本一致, 主要反应在三个方面: ①以TCA循环、丙酮酸代谢和酮体代谢为主的糖代谢和脂肪酸氧化相关代谢通路; ②肠道菌群相关的代谢通路-苯丙氨酸、酪氨酸和色氨酸的代谢; ③氨基酸的代谢。
二甲双胍主要通过激活AMPK发生作用, AMPK的激活会抑制脂肪酸生成, 促进脂肪酸氧化, 降低甘油三酯和胆固醇, 改善脂质代谢[28, 29], 结果显示二甲双胍干预后血清和尿液的脂肪酸氧化产物-酮体(包括3-羟基丁酸、乙酰乙酸、丙酮) 显著增加, 血清甘油三酯显著降低, 这从侧面验证二甲双胍作为AMPK激动剂促进脂肪酸氧化分解的作用。
糖代谢紊乱是高脂血症的一个重要特征。二甲双胍给药9周后, 血清中葡萄糖水平降低、丙酮酸水平增高, 给药3、5、9周, 尿液中TCA循环中间体顺乌头酸持续降低, 粪便中的糖类, 如海藻糖降低, 且通路分析中糖代谢相关代谢途径被高度富集, 表明二甲双胍干预可影响金黄地鼠糖代谢紊乱。
肠道菌群与脂代谢紊乱密不可分, 二甲双胍可通过增加肠源性激素分泌、促进产短链脂肪酸菌群生长、调节胆汁酸和增强肠道屏障功能来治疗代谢性疾病[30]。本研究中, 二甲双胍给药后肠菌相关的代谢通路被富集, 并且观察到肠道菌群相关代谢物的显著变化, 如血清中的甜菜碱、尿液中的胆碱类、4-羟基苯乙酸酯、马尿酸、二甲胺以及粪便中的胆碱类和短链脂肪酸(short chain fatty acids, SCFAs)。胆碱和甜菜碱主要存在于食物中, 在肠道菌群作用下为氧化三甲胺的产生提供碳源[31, 32]。循环系统中氧化三甲胺水平与心血管疾病风险直接相关[33]。本结果显示, 二甲双胍高剂量干预显著降低了由HFD造成的血清甜菜碱水平的升高。SCFAs由膳食纤维在结肠中经肠道菌群发酵产生, 研究表明其在糖脂代谢以及结直肠的炎症和癌变中发挥作用[34-38], 本文二甲双胍给药后粪便中SCFAs水平显著降低, 说明其可能通过影响肠菌来发挥作用。
除了与肠道菌群相关的氨基酸被观察到, 本研究还观察到血清中苯丙氨酸、丙氨酸、精氨酸显著变化, 粪便中支链氨基酸(缬氨酸、亮氨酸、异亮氨酸) 水平, 天冬氨酸、甲硫氨酸、赖氨酸、苯丙氨酸水平均显著变化, 且血清、尿液和粪便的氨基酸相关代谢通路也被富集。二甲双胍干预后, 支链氨基酸作为一种重要的氨基酸, 不仅提供蛋白质合成底物并调节其合成过程, 同时还可以作为信号分子控制机体能量平衡, 包括葡萄糖分配和脂质代谢[39]。大量的研究表明高脂血症、动脉粥样硬化和糖尿病等慢性疾病中, 高水平的支链氨基酸和胰岛素抵抗相关[40]。二甲双胍干预后, 显著降低了由HFD导致的支链氨基酸的升高。研究表明, 氨基酸可以通过转氨作用和分解代谢进入到三羧酸循环, 作为能量的底物[41], 影响三羧酸循环的变化通量。
TCA循环是三大营养物质, 蛋白质、脂质、糖代谢的关键步骤。在炎症状态下TCA循环会被抑制, 造成线粒体能量代谢失衡, 研究表明二甲双胍可以促进脂肪酸氧化, 降低糖异生, 通过调节肠道微生物促进降糖降脂作用等, 从而抑制脂代谢紊乱引起的炎症, 对TCA循环起到修复作用, 使线粒体功能趋于稳定[2, 8, 42]。本研究通过静脉注射给予高脂血症金黄地鼠[U-13C6]葡萄糖, 根据血清中不同标记模式葡萄糖的丰度及比例量化TCA循环的通量, 计算发现, 相较于模型组, 二甲双胍低剂量和高剂量干预后TCA循环通量分别增加了98.14%和143.10%, 该代谢流的结果与血清差异代谢物、血清和粪便通路富集结果、血糖水平相互验证, 表明TCA循环可能在二甲双胍的降糖降脂过程中发挥重要作用, 而且从侧面验证了二甲双胍抗炎的作用, 但具体的联系和其间的关系还需要更深入研究。
本研究对二甲双胍干预后的高脂血症金黄地鼠血清、尿液和粪便三种生物介质中的生物标志物进行了跟踪研究。结果表明, HFD导致金黄地鼠的糖代谢、脂质代谢、氨基酸代谢、酮体生成、短链脂肪酸代谢及肠道菌群相关代谢的紊乱, 同时伴随着炎症反应和氧化应激的出现。相关代谢途径表现出相同的变化趋势, 二甲双胍干预后部分代谢途径回调且可显著改善糖、脂质和氨基酸的代谢, 并表现出对肠道菌群相关代谢物的影响, 通过13C同位素示踪技术验证了脂代谢紊乱导致的三羧酸循环降低及二甲双胍对其的修复作用。本研究利用代谢组和代谢流结合的方式展示了二甲双胍改变血清TCA循环的作用, 并为其药效和作用机制的研究提供了有用的信息, 也为基于该模型上的调脂药物的筛选提供了实用的技术方法。
作者贡献: 刘启凤和王映红负责整体实验设计和文章撰写, 吕雪琪和郭聪聪负责动物实验, 孙珊珊负责代谢流实验, 王亚男和靳香菊负责核磁谱的测试。
利益冲突: 本文无利益冲突。
| [1] |
He L, Wondisford F. Metformin action: concentrations matter[J]. Cell Metab, 2015, 21: 159-162. DOI:10.1016/j.cmet.2015.01.003 |
| [2] |
Ling He. Metformin and systemic metabolism[J]. Trends Pharmacol Sci, 2020, 41: 868-881. DOI:10.1016/j.tips.2020.09.001 |
| [3] |
Franciosi M, Lucisano G, Lapice E, et al. Metformin therapy and risk of cancer in patients with type 2 diabetes: systematic review[J]. PLoS One, 2013, 8: e71583. DOI:10.1371/journal.pone.0071583 |
| [4] |
Ursini F, Russo E, Pellino G, et al. Metformin and autoimmunity: a "new deal" of an old drug[J]. Front Immunol, 2018, 9: 1236. DOI:10.3389/fimmu.2018.01236 |
| [5] |
USPST Force, Bibbins-Domingo K, Grossman DC, et al. Statin use for the primary prevention of cardiovascular disease in adults: US preventive services task force recommendation statement[J]. JAMA, 2016, 316: 1997-2007. DOI:10.1001/jama.2016.15450 |
| [6] |
Ma XL, Jiang W, Fan WM, et al. Berberine ameliorates dexamethasone-induced metabolic disorder in C57 mice[J]. Acta Pharm Sin (药学学报), 2020, 55: 2636-2641. |
| [7] |
Min WJ, Qi LW, Yang P. Advances in studies on novel hypolipidemic drugs[J]. Chin J New Drugs (中国新药杂志), 2019, 28: 2367-2374. |
| [8] |
Wang Q, Liu SD, Zhai AH, et al. AMPK-Mediated regulation of lipid metabolism by phosphorylation[J]. Biol Pharm Bull, 2018, 41: 985-993. DOI:10.1248/bpb.b17-00724 |
| [9] |
Shen SP, Zhang RY, Wei YY, et al. Research progress on multi-omics integrative analysis methods[J]. Chin J Dis Control Prev (中华疾病控制杂志), 2018, 22: 763-765. |
| [10] |
Yang L, Hao YR. Research progress in pharmacological effects of metformin[J]. Med Recapitul (医学综述), 2019, 25: 1816-1821. |
| [11] |
Töpfer N, Kleessen S, Nikoloski Z. Integration of metabolomics data into metabolic networks[J]. Front Plant Sci, 2015, 6: 49. |
| [12] |
Peng B, Li H, Peng XX. Functional metabolomics: from biomarker discovery to metabolome reprogramming[J]. Protein Cell, 2015, 6: 628-637. DOI:10.1007/s13238-015-0185-x |
| [13] |
Klupczyńska A, Dereziński P, Kokot ZJ. Metabolomics in medical sciences-trends, challenges and perspectives[J]. Acta Pol Pharm, 2015, 72: 629-641. |
| [14] |
Kreyenschulte D, Paciok E, Regestein L, et al. Online monitoring of fermentation processes via non-invasive low-field NMR[J]. Biotechnol Bioeng, 2015, 112: 1810-1821. DOI:10.1002/bit.25599 |
| [15] |
Ipsen DH, Lykkesfeldt J, Tvedennyborg P. Molecular mechanisms of hepatic lipid accumulation in non-alcoholic fatty liver disease[J]. Cell Mol Life Sci, 2018, 18: 3313-3327. |
| [16] |
Clendinen CS, Stupp GS, Ajredini R, et al. An overview of methods using 13C for improved compound identification in metabolomics and natural products[J]. Front Plant Sci, 2015, 6: 611. |
| [17] |
Shi X, Tasdogan A, Huang F, et al. The abundance of metabolites related to protein methylation correlates with the metastatic capacity of human melanoma xenografts[J]. Sci Adv, 2017, 3: eaao5268. DOI:10.1126/sciadv.aao5268 |
| [18] |
Wang C, Hu NH, Yu LY, et al. Progress in lipid-lowering model research[J]. Chin J Comp Med (中国比较医学杂志), 2020, 30: 121-130. |
| [19] |
Peng X, Li J, Wang M, et al. A novel AMPK activator improves hepatic lipid metabolism and leukocyte trafficking in experimental hepatic steatosis[J]. J Pharmacol Sci, 2019, 140: 153-161. DOI:10.1016/j.jphs.2019.05.008 |
| [20] |
Badur MG, Metallo CM. Reverse engineering the cancer metabolic network using flux analysis to understand drivers of human disease[J]. Metab Eng, 2018, 45: 95-108. DOI:10.1016/j.ymben.2017.11.013 |
| [21] |
Mohamed MT, Abuelezz SA, Atalla SS, et al. The anti-osteoporotic and anti-atherogenic effects of alendronate and simvastatin in ovariectomized rats fed high fat diet: a comparative study of combination therapy versus monotherapy[J]. Biomed Pharmacother, 2017, 89: 1115-1124. DOI:10.1016/j.biopha.2017.02.105 |
| [22] |
Zhang X, Zhao Y, Xu J, et al. Modulation of gut microbiota by berberine and metformin during the treatment of high-fat diet-induced obesity in rats[J]. Sci Rep, 2015, 5: 14405. DOI:10.1038/srep14405 |
| [23] |
Li TQ, Sun SS, Zhang JY, et al. Beneficial metabolic effects of 2', 3', 5'-triacetyl-N6-(3-hydroxylaniline) adenosine in multiple biological matrices and intestinal flora of hyperlipidemic hamsters[J]. J Proteome Res, 2018, 17: 2870-2879. DOI:10.1021/acs.jproteome.8b00330 |
| [24] |
Jin ES, Sherry AD, Malloy CR. Interaction between the pentose phosphate pathway and gluconeogenesis from glycerol in the liver[J]. J Biol Chem, 2014, 289: 32593-32603. DOI:10.1074/jbc.M114.577692 |
| [25] |
Jin ES, Sherry AD, Malloy CR. Metabolism of glycerol, glucose, and lactate in the citric acid cycle prior to incorporation into hepatic acylglycerols[J]. J Biol Chem, 2013, 288: 14488-14496. DOI:10.1074/jbc.M113.461947 |
| [26] |
Neeland IJ, Hughes C, Ayers CR, et al. Effects of visceral adiposity on glycerol pathways in gluconeogenesis[J]. Metab Clin Exp, 2017, 67: 80-89. DOI:10.1016/j.metabol.2016.11.008 |
| [27] |
Ascha MS, Hanouneh IA, Lopez R, et al. The incidence and risk factors of hepatocellular carcinoma in patients with nonalcoholic steatohepatitis[J]. Hepatology, 2015, 52: 2240-2240. |
| [28] |
Smith BK, Marcinko K, Desjardins EM, et al. Treatment of nonalcoholic fatty liver disease: role of AMPK[J]. Am J Physiol Endocrinol Metab, 2016, 311: E730-E740. DOI:10.1152/ajpendo.00225.2016 |
| [29] |
Rena G, Hardie DG, Pearson ER. The mechanisms of action of metformin[J]. Diabetologia, 2017, 60: 1577-1585. DOI:10.1007/s00125-017-4342-z |
| [30] |
Sun R, Zhang NN, Hu HL. The progress on effect and mechanism of metformin on gut microbiota in diabetic patients[J]. Label Immunoass Clin Med (标记免疫分析与临床), 2020, 27: 1089-1092. |
| [31] |
Janeiro M, Ramírez M, Milagro F, et al. Implication of trimethylamine N-oxide (TMAO) in disease: potential biomarker or new therapeutic target[J]. Nutrients, 2018, 10: 1398-1420. DOI:10.3390/nu10101398 |
| [32] |
Wood AP, Warren FJ, Kelly DP. Methylotrophic bacteria in trimethylaminuria and bacterial vaginosis[M]. Berlin Heidelberg: Springer, 2010: 3227-3240.
|
| [33] |
Wang Z, Tang WH, Buffa JA, et al. Prognostic value of choline and betaine depends on intestinal microbiota-generated metabolite trimethylamine-N-oxide[J]. Eur Heart J, 2014, 35: 904-910. DOI:10.1093/eurheartj/ehu002 |
| [34] |
Canfora EE, Meex RCR, Venema K, et al. Gut microbial metabolites in obesity, NAFLD and T2DM[J]. Nat Rev Endocrinol, 2019, 15: 261-273. DOI:10.1038/s41574-019-0156-z |
| [35] |
Makki K, Deehan EC, Walter J, et al. The impact of dietary fiber on gut microbiota in host health and disease[J]. Cell Host Microbe, 2018, 23: 705-715. DOI:10.1016/j.chom.2018.05.012 |
| [36] |
Tilg H, Adolph TE, Gerner RR, et al. The intestinal microbiota in colorectal cancer[J]. Cancer Cell, 2018, 33: 954-964. DOI:10.1016/j.ccell.2018.03.004 |
| [37] |
Belcheva A, Irrazabal T, Robertson SJ, et al. Gut microbial metabolism drives transformation of MSH2-deficient colon epithelial cells[J]. Cell, 2014, 158: 288-299. DOI:10.1016/j.cell.2014.04.051 |
| [38] |
O'Keefe SJ. Diet, microorganisms and their metabolites, and colon cancer[J]. Nat Rev Gastroenterol Hepatol, 2016, 13: 691-706. DOI:10.1038/nrgastro.2016.165 |
| [39] |
Holeček M. Branched-chain amino acids in health and disease: metabolism, alterations in blood plasma, and as supplements[J]. Nutr Metab (Lond), 2018, 15: 33. DOI:10.1186/s12986-018-0271-1 |
| [40] |
Jang C, Oh SF, Wada S, et al. A branched-chain amino acid metabolite drives vascular fatty acid transport and causes insulin resistance[J]. Nat Med, 2016, 22: 421-426. DOI:10.1038/nm.4057 |
| [41] |
Akram M. Citric acid cycle and role of its intermediates in metabolism[J]. Cell Biochem Biophys, 2014, 68: 475-478. DOI:10.1007/s12013-013-9750-1 |
| [42] |
Ji D, Huang XC, Zhu CT. Effect of metformin on mitochondrial function of macrophages via tricarboxylic acid cycle pathway[J]. J Jinan Univ (Nat Sci Med) (暨南大学学报·自然科学与医学版), 2019, 40: 214-224. |
 2021, Vol. 56
2021, Vol. 56


