近年来, 大量研究证实血小板在肿瘤的生长与转移过程中发挥重要作用[1]。血小板通过表面受体与肿瘤细胞相互作用, 帮助肿瘤转移[2]。同时, 肿瘤细胞会进一步活化血小板, 刺激血小板释放活性物质, 优化肿瘤自身生长环境[3]。这些相互作用促使基于血小板的肿瘤靶向治疗策略开始备受关注。研究者们利用血小板与肿瘤之间的相互作用, 构建基于血小板的肿瘤靶向药物递送系统(drug delivery system, DDS), 以期实现肿瘤的靶向治疗。但与其他细胞相比, 血小板复杂且不稳定、体外分离易活化和存储困难等问题为DDS的构建带来了挑战。本文概述了血小板与肿瘤之间的相互作用, 介绍了目前基于血小板的肿瘤靶向治疗策略, 并讨论了限制该策略发展的因素, 为血小板相关肿瘤靶向治疗策略进一步研究提供参考。
1 血小板的形成与特点血小板是小且无核的细胞碎片, 源自骨髓中最大的巨核细胞[4]。巨核细胞是造血干细胞微环境中重要的调控细胞[5], 在血小板生成素的刺激下由骨髓中的造血干细胞分化而成, 能够迁移到肺部产生血小板[6]。为避免血小板在进入血液循环之前活化, 巨核细胞成熟后经过细胞质重塑, 产生钝状凸起, 形成原血小板。随着时间的推移, 原血小板形态不断拉长、变薄, 延伸到血管腔内[7], 在血流剪切应力的作用下, 重塑为血液中的前血小板。然后, 前血小板通过裂变生成血小板[8]。
正常的血小板在血液循环中呈凹形、椭圆形或圆盘状[9]。直径为2~5 µm, 厚度为0.5 µm, 平均细胞体积为6×10-9~10×10-9 L, 是血液循环中最小的细胞。人体内血小板数量为每升150×109~400×109个, 平均循环寿命为5~7天[8, 10-12]。血小板的最外层涂覆有多种糖蛋白, 这些蛋白或由血小板内部颗粒分泌, 或是组成血小板的膜成分, 在血小板黏附和聚集等功能中起着非常重要的作用。多糖蛋白下包被着复杂的血小板膜(platelet membrane, PM) 和血小板收缩蛋白系统, 帮助维持血小板的盘状形态。当血小板活化时, 随着伪足的挤压, 其形态由盘状变为球形[13]。这一看似简单的形态变化, 却为研究者们提供了控制体内药物释放的新思路。同时, 多种复杂的膜蛋白受体, 一方面作为自体蛋白信号, 可以逃避免疫系统识别; 另一方面介导了血小板与肿瘤细胞的相互作用, 促使血小板成为理想的递药平台, 为基于血小板的DDS提供了机会。
2 血小板是肿瘤生长和转移的“帮凶”作为机体局部组织异常增生而形成的新生物, 肿瘤细胞并不是孤立生长的, 会巧妙地创造适合其生长的“土壤”, 即肿瘤微环境(tumor microenvironment, TME), 通过与机体多种细胞相互作用, 促进自身的发展[14]。近年来, 越来越多的研究表明, 血小板是肿瘤进展过程中活跃的参与者, 并发挥着举足轻重的作用。
2.1 血小板归巢有助于肿瘤细胞生长在正常的生理条件下, 循环血小板不会与未激活的内皮细胞发生相互作用。当癌症发生时, 肿瘤细胞释放激活血管内皮细胞的细胞因子和生长因子, 激活内皮细胞并促进其增殖。活化的内皮细胞高表达血管性血友病因子、P-selectin、整合素蛋白和组织因子[15], 通过与血小板表面的黏附受体结合, 介导血小板沿内皮的滚动。血小板与活化内皮细胞的相互作用诱导了血小板的完全活化以及其表面P-selectin的高表达, 使血小板牢固地黏附在内皮上, 从而促进血小板的局部募集[16]。完全活化的血小板会释放促血管生成因子, 进一步激活内皮细胞, 支持血管生成[17], 并调节血管通透性和血管张力[15]。同时, 促血管生成因子与血小板内部储存的活性因子会释放到TME中, 进一步促进血管重建和炎症。有研究表明TME中存在大量的血小板[18], 这些血小板通过释放血小板衍生微粒(platelet-derived microparticles, P-MPs), 帮助构建TME, 支持肿瘤过度生长[19]。
2.2 血小板帮助肿瘤细胞转移在肿瘤转移过程中, 单个肿瘤细胞无法对抗机体的攻击。因此, 为避免血流高速剪切应力的伤害, 肿瘤细胞进入体循环后, 会释放凝血酶迅速招募并激活血小板。肿瘤细胞通过与活化血小板表面高表达的P-selectin结合, 再加上纤维蛋白沉积[20], 迅速形成微血栓屏障[21], 这一过程称为肿瘤细胞诱导的血小板聚集(tumor cell-induced platelet aggregation, TCIPA)[22]。在保护循环肿瘤细胞(circulating tumor cells, CTCs) 完整性的同时, 血小板还可以通过分泌外泌体[23], 将主要组织相容性复合体(major histocompatibility complex, MHC) Ⅰ类分子转移至TCIPA聚集体表面, 干扰循环中自然杀伤细胞的识别, 帮助CTCs逃避免疫监视。在肿瘤细胞向远端定植的过程中, TCIPA聚集体表面的血小板可以稳定肿瘤细胞与内皮的黏附, 激活血管内皮细胞, 增大内皮细胞间隙[18], 同时释放趋化因子5 [chemokine (C-X-C motif) ligand 5, CXCL-5] 和趋化因子7 (CXCL-7), 这可能有助于诱导内皮细胞的凋亡或坏死[24]。此外, 血小板将单核细胞和粒细胞招募到癌细胞阻滞位点, 共同塑造利于转移的促瘤环境[1], 从而使CTCs成功跨越内皮层进入早期转移生态位, 继而形成转移灶。
血小板与肿瘤之间的密切相互作用, 使得利用血小板作为药物递送载体或平台具有极大的吸引力。因此, 基于血小板的靶向治疗策略开始引起研究者们的注意, 并逐渐应用于肿瘤治疗。
3 基于血小板的肿瘤靶向治疗策略目前, 基于血小板的肿瘤靶向治疗策略主要分为血小板模拟纳米载体递药策略、血小板与纳米粒(nanoparticles, NPs) 结合策略以及工程化血小板靶向策略, 具体分类见图 1。
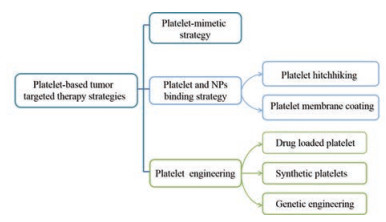
|
Figure 1 Classification of platelet-based tumor treatment strategies. NPs: Nanoparticles |
在过去20年里, 外科手术、化疗、放疗及生物疗法的显著改进已经成功地减轻了原发肿瘤的负担, 但转移性肿瘤仍然是癌症相关发病率和死亡率的主要原因[25]。受血小板生理和病理特性的启发, 研究者们试图构建血小板模拟纳米载体, 赋予NPs以血小板的生理或病理特性, 进而实现转移性肿瘤靶向的治疗目标。Modery-Pawlowski等[26]从活化血小板促进肿瘤转移的机制出发, 开发了一种模拟血小板的脂质体纳米药物载体, 即将肿瘤细胞表面高表达的血小板结合受体的配体多肽修饰在纳米脂质体表面, 该脂质体纳米药物载体可以通过模拟血小板的配体-受体机制增强与转移前的人乳腺癌细胞系MDA-MB-231细胞的相互作用, 且在流动环境中与MDA-MB-231细胞的结合能力增强。在此基础之上, Pan等[27]采用pH梯度法实现了多柔比星在该脂质体纳米载体内的载药, 纳米载体上的血小板模拟机制增强了多柔比星在单一培养及非靶标癌细胞共培养时与MDA-MB-231细胞的结合与传递。这种增强的传递导致了MDA-MB-231细胞在单一培养和共培养体系中更高的杀伤率。此外, 模拟血小板衍生及活化变形特性的纳米载体也开始在血管损伤等疾病中展露头角[28]。这些结果表明, 血小板模拟纳米载体可以为转移性癌症的靶向治疗带来有效的药物递送和诊断技术。
3.2 血小板与NPs结合策略自靶向给药概念提出以来, NPs一直在肿瘤治疗中占据主导地位。然而有文章指出, 静脉注射NPs在肿瘤部位的分布量少于注射剂量的0.7%[29]。NPs由于“非己”特性而被机体识别为异物, 引起免疫反应和毒性作用。为解决这一问题, 研究者们将目光转移到了机体内的固有血液成分, 如红细胞、白细胞和血小板, 在躲避免疫识别的同时, 寻求更低的毒副作用与更好的靶向治疗效果[30]。相比于NPs, 血小板有其独特的优势[31]: ①循环时间长, 可降解, 具有良好的生物相容性; ②天然的血管损伤部位靶向能力和黏附性; ③良好的变形性; ④活化的血小板具有肿瘤归巢、CTCs捕获和靶向迁移能力。因此, 研究者们将血小板与纳米制剂结合, 希望可以构建二者优点兼容的DDS, 用于肿瘤的治疗。
3.2.1 受体-配体介导的血小板搭便车策略机体内静息状态下的血小板, 在受到生理或病理相关信号刺激时, 会迅速活化。同时, 伴随着其膜表面整合素GPIIb/Ⅲa、GPIb-V-IX和P-selectin等受体的高表达[32]。这些受体的高表达确保活化的血小板牢固地黏附在受损的血管壁或CTCs上, 以执行止血、组织修复和帮助肿瘤转移等后续功能[33]。如图 2所示, 通过靶向这些受体, NPs可以附着在血小板上并搭便车至肿瘤细胞以递送抗癌药。此类靶向药物递送依赖于待识别的质膜受体在组织或细胞上的特异性表达, 可以使用选择性结合这些受体的配体对NPs进行功能化。因此, 活性靶向的主要驱动力是配体-受体的特异性相互作用。在生物系统中, NPs表面特定配体的功能化显著增强了NPs的靶向能力。
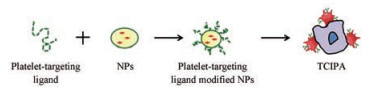
|
Figure 2 Receptor-ligand-mediated platelet hitchhiking strategy. TCIPA: Tumor cell-induced platelet aggregation |
在静息状态下, P-selectin被包裹于血小板细胞质的α-颗粒内。血小板活化后, P-selectin可以迅速转运到膜表面。该特征使P-selectin成为肿瘤治疗的良好靶标, 如P-selectin靶向肽(PSN) 对P-selectin的良好靶向作用[34]。Zhang等[35]制备了PSN修饰的氧化还原反应性紫杉醇胶束, 以三阴性乳腺癌(triple negative breast cancer, TNBC) 荷瘤小鼠为肿瘤模型进行研究。结果表明, PSN修饰的胶束可以轻松黏附到活化血小板的表面, 进而在血液循环中捕获CTCs, 有效抑制了TNBC的肺转移, 降低了远处肝转移的发生率。该胶束也可通过与肿瘤部位浸润的血小板结合, 增强肿瘤靶向性, 从而显著改善治疗效果, 为转移性肿瘤的全面治疗提供了良好前景。
3.2.2 PM涂层的纳米载体仿生策略如图 3所示, 研究人员利用PM的“自我识别”能力和TCIPA效应, 构建PM涂层的仿生纳米DDS。以期延长NPs的体内循环时间, 排除脱靶效应的不确定性, 增强生物相容性, 进而提高肿瘤治疗效果。
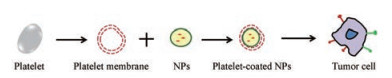
|
Figure 3 Bionic strategy of platelet membrane coating |
早在2015年, Gu课题组[36]制备了PM涂层的纳米载体(PM-NV) 用于小鼠乳腺癌的靶向治疗。体外细胞实验结果表明, 血小板表面过表达的P-selectin可与肿瘤细胞表面的CD44受体特异性结合, 同时, PM上的“自我识别”蛋白可以抑制巨噬细胞的摄取。静脉注射48 h后取出肿瘤及正常组织进行体外成像。结果显示, PM-NV在肿瘤部位的荧光强度远高于没有PM涂层的纳米载体和其他器官。药代动力学结果显示, PM-NV的消除半衰期和曲线下面积明显高于没有PM涂层的纳米载体, 表明PM-NV具有延长循环时间的能力。结合裸鼠乳腺癌模型的药效结果, 证明了PM-NV可以有效地消除体内循环的肿瘤细胞并抑制肿瘤转移的发展。此外, 他们还开发了另一种PM涂层的NPs用于多发性骨髓瘤的强化治疗[37]。Mei等[38]构建了PM涂层的紫杉醇纳米晶体系统(PPNCs) 用于术后化疗等临床情况。体外研究表明, PPNCs颗粒分布均匀、载药量高和稳定性好。在4T1乳腺癌细胞中, PPNCs比紫杉醇纳米晶体表现出更大的细胞摄取和更高的细胞毒性。体内结果表明, NPs可以提供高剂量的化疗药物, 增强抗肿瘤疗效, 降低全身毒性, 在术后化疗中是一种很有前途、高效的给药系统。表 1[39-55]汇总了最近的PM涂层DDS用于肿瘤治疗的研究。
| Table 1 Platelet membrane coated drug delivery system (DDS) in tumor therapy |
血小板是含有线粒体与功能性膜结合蛋白(转运蛋白和酯酶) 的细胞, 可以通过开放的微管系统内化循环中的分子[56, 57], 这些蛋白使血小板能够有效地保留外源性小分子探针和细胞毒素[58]。同时考虑到血小板在肿瘤进展与保护CTCs等方面的作用, 研究者们利用血小板作为递药平台, 通过装载药物、膜表面修饰或基因工程等手段, 具体分类见图 4, 构造血小板相关DDS, 解决PM涂层DDS缺少生物信号串扰能力的问题, 以期实现肿瘤的高靶向治疗。
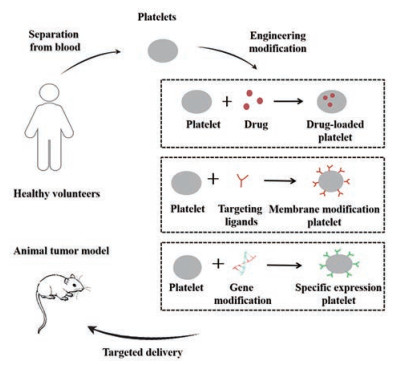
|
Figure 4 Schematic diagram of engineered platelet targeting strategy |
除红细胞外, 无核血小板是细胞核毒性化疗药物如多柔比星(doxorubicin, DOX) 等的优良载体。体外分离血小板后, 可以通过化学法、电穿孔法、胞吞法、低渗法和脂膜融合法[8]等手段来制备血小板介导的DDS。Rao等[59]研究了一种血小板促进的光热肿瘤治疗策略。首先通过电穿孔将金纳米棒加载到健康志愿者的血小板中, 得到加载金纳米棒的血小板。利用基因敲除小鼠肿瘤模型, 证明了使用加载金纳米棒的血小板和激光定位照射可以有效抑制头颈部鳞状细胞癌的生长。最近, Wu等[60]开发了一种可以稳定制备的血小板递药系统, 该系统可由治疗级的自体或异体血小板浓缩物制成。将分离的血小板与DOX悬浮于血小板添加剂溶液, 制备载药血小板, 使用6%二甲亚砜冷冻保存。该方法可以受益于现有的采血和输血医学, 具有较大的实际应用价值。表 2[59-65]汇总了血小板载药系统在肿瘤治疗中的研究。
| Table 2 Platelet delivery system in tumor therapy |
PM表面修饰是指将治疗药物或抗体修饰在未激活的血小板表面, 回输至体内后, 在肿瘤和TME的共同调节下激活血小板, 产生P-MPs, 修饰在血小板表面的药物或抗体随着微粒的释放作用于肿瘤细胞, 实现高靶向性治疗。
Gu课题组[66]受血小板固有特性的启发, 将细胞程序性死亡-配体1 (programmed cell death ligand 1, PD-L1) 的抑制剂结合在血小板表面用于肿瘤的治疗。在血小板的帮助下, PD-L1抑制剂由P-MPs释放后靶向癌细胞, 阻断PD-L1对肿瘤细胞和抗原呈递细胞的作用, 促进T细胞的浸润与增殖。通过将PD-L1抑制剂偶联血小板静脉注射到肿瘤已经被切除的B16黑素瘤和TNBC (约1%剩余) 小鼠体内, 发现PD-L1抑制剂偶联血小板可以促进PD-L1抑制剂转运到手术部位残留的微瘤与CTCs。Han等[67]将PD-L1抑制剂与新鲜分离的血小板结合用于热消融后肿瘤残基的治疗, 也证实了基于血小板的递送平台能够促进免疫检查点抑制剂对小鼠TNBC肿瘤残基的传递。这些结果表明, 血小板有希望作为一种靶向控制PD-L1抑制剂输送, 预防术后癌症复发的手段。
3.3.3 基因工程修饰血小板利用生物技术手段, 在DNA序列中插入目的基因片段或改造原有DNA序列, 对血小板进行基因水平的修饰, 人为干预遗传, 进而调节肿瘤免疫, 实现靶向治疗。但由于血小板是无核细胞, 所以这种方法必须集中在血小板前体细胞上, 如巨核细胞、祖细胞或造血干细胞。Zhang等[68]对巨核细胞进行了基因改造, 使其表达细胞程序性死亡蛋白1 (programmed cell death protein 1, PD-1) 用于肿瘤术后巩固治疗。结果表明, 表达PD-1的血小板及其衍生的微粒可在肿瘤手术创面内聚集, 解除CD8+ T细胞的免疫抑制, 恢复其免疫识别功能, 导致残余的肿瘤细胞被清除。此外, 当将低剂量的环磷酰胺加载到表达PD-1的血小板中以消耗调节性T细胞时, 在术后TME中观察到CD8+ T细胞活化频率增加, 可直接预防肿瘤复发。
4 反思在基于血小板的靶向治疗策略和肿瘤的这场博弈中, 血小板的内源性以及与肿瘤细胞之间的相互作用是实现疗效正收益的强有力支撑。尽管临床前研究表明, 基于血小板的肿瘤靶向治疗策略在动物模型上有显著治疗效果, 但迄今为止依旧没有临床转化成果。这让研究者们不得不重新审视基于血小板的靶向治疗策略中正负收益对于肿瘤治愈的影响, 在看到正收益的同时, 更应该从理论基础、药物递送系统构建和体内命运等方面综合反思限制该策略发展的因素, 以及这些因素可能带来的负收益, 最大化降低负收益, 才能推进研究成果的临床转化。
4.1 细胞间信号通路的中断一般来说, 肿瘤细胞利用3种不同的机制来诱导血小板活化[69]。首先, 一些肿瘤细胞膜上表达的组织因子级联的凝血信号会诱导人血小板活化, 这是血小板活化的主要刺激之一; 其次, 癌细胞分泌的二磷酸腺苷等可溶性介质会直接调控血小板活化的状态; 最后, 血小板活化也受到血小板与肿瘤细胞直接接触形成的信号驱动, 加速不同的细胞内信号事件, 最终导致血小板聚集和细胞因子分泌[69]。体外研究表明, 在没有血浆存在的条件下, 癌细胞不会诱导磷酸缓冲盐溶液洗涤过的血小板聚集。而在体内TCIPA期间, 整合素αIIbβ3由外而内的信号传导加速了血小板活化, 促进纤维蛋白原与活化的血小板结合, 并通过纤维蛋白的形成增强TCIPA[70]。上述过程表明, 信号刺激导致血小板活化, 进而与肿瘤细胞结合。而活化过程需要完整细胞结构的支持。PM涂层NPs不具备血小板自身固有的生化串扰能力, 对肿瘤来源的生化信号保持生物惰性, 无法及时做出反应, 在保证PM涂层侧向一致性的情况下, 与肿瘤细胞的结合能力和肿瘤部位的靶向能力还有待进一步研究。
4.2 无法保证DDS稳定性和安全性 4.2.1 血小板分离过程中易活化与聚集Page等[71]的研究表明, 从健康志愿者体内得到的全血涂片显示, 仅分离接触就可诱导血小板活化, 产生轻微伪足。从2型糖尿病患者体内分离得到的血小板则显示出更明显的活化与聚集[72]。相比于糖尿病患者, 肿瘤患者体内存在更多的炎性因子和促凝因子, 血小板在分离过程中更容易活化。Grill等[73]采用塑料毛细管的收集技术, 在小鼠眼眶后静脉丛穿刺采集的所有血样中均发现了血小板预激活的迹象, 与所使用的抗凝剂种类无关, 即收集容器的表面特性可能是导致血小板体外分离活化的第一步。在体外构建血小板相关DDS的过程中, 分离血小板是前提, 后续离心、洗涤、反复冻融及制备等一系列机械操作更是无法避免血小板活化。活化后伪足的存在, 使得单纯分离的PM无法同脂质体等纳米载体一样, 可以自发地形成稳定、连续且密闭的结构。且血小板提前活化, 可能会引起生化颗粒提前释放, 产生P-MPs, 导致无法利用血小板平台靶向递送药物。此外, 活化的血小板与体内静息状态的血小板在形态、表面蛋白表达和功能上都存在较大差异, 若构建血小板或其膜涂层NPs介导的DDS, 由于肿瘤患者血液处于高凝状态, 活化的血小板可能更容易与凝血酶以及纤维蛋白相互作用, 在很大程度上会促进血小板及其膜包被载体的体内聚集, 失去治疗意义, 还可能意外地导致血小板活化相关疾病的发生。
4.2.2 血小板存储损伤(platelet storage lesions, PSLs)PSLs是从血液收集到输血过程中一系列血小板生化、结构与功能变化的总和[74]。随着储存时间延长, 血小板会分泌具有吸引中性粒细胞和单核细胞趋化因子的细胞外囊泡, 可产生输血不良反应[75]。在体外培养过程中, 血小板与代谢物质之间的相互作用常常导致血小板过早活化[76], 生存能力和功能下降[77]。有研究表明, 体外储存5天后, 血小板在反应基质上的扩散能力丧失[78]。这一结果强调了血小板在储存过程中的功能状态, 同时对血小板质量提出了一个重要的问号。
PSLs加速输血后血小板的清除, 与介质、搅拌方式、储存袋和储存温度等因素有关[79]。在22~24 ℃下, 血小板最多可保存5~7天[80], 然而, 将血小板保持在此温度范围内会增加细菌感染的风险。解决这一问题最直接的办法是冷冻, 研究表明, 低温冷冻会诱发血小板表面糖蛋白聚集, 导致血小板线粒体损伤和膜内磷脂酰丝氨酸暴露[81]。磷脂酰丝氨酸作为血小板被吞噬细胞清除的识别信号[80], 可以加速体内清除。从结构上而言, 暴露磷脂酰丝氨酸的血小板又可以迅速膨胀并转为球囊状, 从而增加其促凝表面并增强与凝结因子的结合能力[82], 促进血栓的形成。此外, 储存期间血小板外膜受体的脱落也与注射血小板的清除密切相关[79]。这些受体脱落降低了细胞间信号传递, 并导致血小板活化和分泌的减少。此外, 这些糖蛋白的脱落使血栓栓子的建立变得更加容易[79]。PSLs是大大阻碍血小板及工程化血小板载药系统构建的重要原因。
4.2.3 血小板自身的异质性血小板是巨核细胞脱落的细胞质, 在形成的过程中伴随着细胞膜和细胞器的随机分离, 造成血小板结构、大小、密度与反应活性的异质性[80]。结构上的差异是造成血小板异质性的主要原因。除此之外, 分离得到的血小板所处的阶段不同, 细胞活力不同, 反应活性也不同, 无法保证DDS的一致性。
4.2.4 血小板功能和表型的变化临床上有些肿瘤患者会随着治疗的进行, 出现血小板计数减少、功能降低及表型改变的现象[83-85]。循环系统中的癌细胞和其他分子可以使血小板“受训(educated)”, 导致其表型改变, 转化为肿瘤相关血小板(tumor-educated platelets, TEPs), TEPs通过释放细胞因子或可溶性信号分子促进肿瘤生长和转移[86]。目前, 尚未深入研究其表型与功能的变化, 以及这种变化对血小板相关DDS的体内命运和治疗效果的影响。对于肿瘤靶向治疗而言, 未知的血小板功能和表型的变化, 可能导致与预期相反的治疗结果。
4.2.5 血小板及其膜分离制备的复杂性同其他载药细胞相比, 对于血小板载药系统的研究少之又少。这可能由于血小板独特的活化变形能力为DDS的构建带来极大的不确定性。此外, 由于载体是活细胞, 所携带和传递的药物可能对载体细胞本身具有细胞毒性, 这就需要仔细优化负载到细胞内的药物含量。在载药方法的选择上, 还有待优化。电穿孔是通过高强度的电场作用, 瞬时提高细胞膜的通透性, 从而吸收周围介质中外源分子的技术。在这种情况下, 细胞暴露于强电场中导致细胞膜暂时丧失半通透性, 形成孔[87]。这种方法中, 膜的破坏导致结构完整性不可逆地恶化、膜蛋白变性和脂质不对称的损失。这也导致了自然膜电位的损失, 无法保证DDS的稳定性。
目前的研究主要采用冻融法从血小板中提取PM。在这种方法中, 血小板在-80 ℃下冷冻, 然后在室温或37 ℃下解冻, 反复的冻融循环导致冰晶破裂而破坏细胞膜, 从而导致细胞质的清除, 留下PM[88]。无法避免的是, 冷冻细胞可能会对细胞膜结构造成破坏, 对蛋白质的稳定性造成明显的压力, 从而导致蛋白质功能损伤。同时, 设计符合临床要求的PM分离和纯化程序是困难的。因此, 分离PM和制备纳米粒涂层在生产规模上具有很高的挑战性。
4.3 DDS体内命运 4.3.1 无法规避免疫系统识别目前, 血小板DDS采用的血小板大多来自健康志愿者, 动物模型为荷瘤小鼠。有研究表明, 异体血小板输注会增加小鼠肿瘤体积, 抵消化疗药物的治疗效果[89]。将人源性血小板输注给动物, 在保留动物大部分吞噬系统的情况下, 会加速血小板的体内清除[90]。人源性PM包覆的NPs回输至小鼠肿瘤模型体内, 不同物种之间存在着免疫排斥的必然反应, 大量的单核-巨噬细胞会识别并吞噬异源性PM-NPs, 导致纳米载体的快速清除, 无法发挥治疗作用。有研究表明, 红细胞膜涂层NPs可以保证84%细胞膜方向正确性[91]。NPs制造工艺可能导致一部分内膜层暴露在外, 具有内外膜的NPs会在循环中迅速被清除, 引起靶毒性, 甚至可能刺激其他免疫反应。因此, 研究PM涂层NPs的膜取向具有重要的意义。
同时, 为了实现膜表面结合所需要的复杂的化学修饰也会破坏膜蛋白结构[92], 可能导致体外分离的PM和体内活化PM不同, 这可能减弱其与癌细胞的相互作用。此外, 血小板可以直接与免疫系统相互作用[93]。血小板表达补体系统经典组分C1q的结合位点, 具有启动经典补体通路的内在能力[94]。PM分离和NPs涂层的处理过程已经造成了足够的膜损伤, 吞噬细胞很容易察觉这些损伤。同时, 纳米粒内壳的刚性与球形结构可能会影响膜的结构和功能, 一个主要的变化是急剧增加的曲率, 膜曲率的变化改变了脂质的堆积和相变[88], 从而触发体内免疫系统的立即识别与清除。
4.3.2 受体-配体靶向结合的特异性与有效性血小板在体内可以由包括癌细胞在内的多种细胞或介质激活, 并且没有癌细胞激活血小板的特异性标记。在活化血小板表面高表达的P-selectin, 同样表达于活化的内皮细胞表面[95]。靶向活化血小板表面P-selectin的PSN, 也可能与血管损伤部位炎性内皮细胞结合, 使PSN修饰的纳米制剂不能准确地借助血小板这一递药平台高效杀伤肿瘤细胞, 还可能由于脱靶或非靶部位的结合, 导致内皮损伤无法愈合, 对机体产生附加的伤害。此外, 对于血小板模拟纳米载体而言, 多肽类配体修饰的有效性还与肽链的空间结构和修饰密度紧密相关[26], 对此还需更进一步的研究。
4.3.3 肿瘤归巢的选择性近年来的研究表明, 肿瘤细胞与TME会通过一系列复杂的相互作用, 招募血小板至肿瘤部位, 以促进其生长和转移。但不是所有的肿瘤类型都可以招募血小板, Chen等[34]观察到胰腺癌的增生环境可以排斥血小板, 而与强“归巢”亲和力无关。不同的肿瘤类型对血小板的“归巢”能力有影响[1], 这使得基于血小板的肿瘤靶向治疗策略应用受到限制, 只有在清楚地了解肿瘤类型与血小板归巢能力之间的关系以后, 才能确定该治疗策略应用的可行性。
5 结语和展望凭借对血小板的理化性质和生物学功能的深入了解, 利用血小板的功能来开发用于治疗各种疾病的DDS的巨大潜力已经显现, 未来在更确切地阐明血小板与肿瘤之间相互作用机制的基础之上, 可以尝试在体外诱导巨核细胞或多功能干细胞分化产生人造血小板, 并改善血小板的保存条件以确保稳定其功能, 进而构建相关DDS。
临床最终的目的是治愈肿瘤, 未来在不断完善和优化治疗策略的同时, 探索准确且高效的肿瘤诊断方式可以更好地服务于肿瘤治疗。有研究表明, 正常血小板的转录谱与从血小板相关疾病患者分离的血小板的转录谱不同[96]。基于这一证据, 血小板的易得性和分离性使其成为一个有吸引力的癌症诊断平台。可以确定有关血小板数量、蛋白质与mRNA谱及其激活状态的信息, 以监测肿瘤的存在, 并在一定程度上监测其位置。此外, 血小板与肿瘤细胞之间的相互作用及其形成TCIPA聚集体的特点可以为体内分离CTCs提供优势, 以帮助确定肿瘤的特征。随着肿瘤分子生物学研究的进展, 基于血小板的RNA测序及其生物学指标的研究, 将有可能为临床肿瘤的早期诊断、预后判定及跟踪随访等提供一系列方便、快捷的分子生物学检测手段。未来的研究应集中于这些相互作用对早期肿瘤诊断和转移性肿瘤患者的益处, 探索并研究TEPs的表型与功能, 对于未来肿瘤的诊断和治疗提供新的思路与希望。
如果把机体内的每一个细胞都看成一个原点, 那么, 每一次发挥细胞功能而致的形态变化都是由原点引出的射线, 众多细胞纵横交错的结果构成了生命的框架。从不同的角度来剖析血小板这一点, 由点及线再到面, 全面地来看待血小板所处的有机整体, 进而挖掘血小板在疾病诊断和治疗中的潜力, 或许会有更多的惊喜。本文在总结了血小板和肿瘤之相互作用的基础上, 概述了基于血小板的靶向治疗策略在肿瘤治疗中的应用, 从多方面对这些治疗策略进行了反思。基于血小板的肿瘤靶向治疗策略还存在客观限制因素与亟待解决的问题, 挑战与机会共存。未来期待血小板可以在肿瘤诊断与治疗中占据一席之地, 早日取得与肿瘤博弈的胜利。
作者贡献: 赖晓雪负责文献调研和文章撰写; 王硕负责文章思路梳理; 闫鑫杨负责参考文献格式整理; 刘欣荣和宋艳志负责文章修改; 邓意辉负责文章指导和修改。, 鞠艳敏和戴建君提供重要的指导和意见。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Li N. Platelets in cancer metastasis: to help the "villain" to do evil[J]. Int J Cancer, 2016, 138: 2078-2087. DOI:10.1002/ijc.29847 |
| [2] |
Walsh TG, Metharom P, Berndt MC, et al. Berndt, the functional role of platelets in the regulation of angiogenesis[J]. Platelets, 2015, 26: 199-211. DOI:10.3109/09537104.2014.909022 |
| [3] |
Yap ML, Mcfadyen JD, Wang X, et al. Targeting activated platelets: a unique and potentially universal approach for cancer imaging[J]. Theranostics, 2017, 7: 2565-2574. DOI:10.7150/thno.19900 |
| [4] |
Nakeff A, Maat B. Separation of megakaryocytes from mouse bone marrow by velocity sedimentation[J]. Blood, 1974, 43: 591-595. DOI:10.1182/blood.V43.4.591.591 |
| [5] |
Day RB, Link DC. Megakaryocytes in the hematopoietic stem cell niche[J]. Nat Med, 2014, 20: 1233-1234. DOI:10.1038/nm.3745 |
| [6] |
Lefranais E, Ortiz-Muoz G, Caudrillier A, et al. The lung is a site of platelet biogenesis and a reservoir for haematopoietic progenitors[J]. Nature, 2017, 544: 105-109. DOI:10.1038/nature21706 |
| [7] |
Richardson JL, Shivdasani RA, Boers C, et al. Mechanisms of organelle transport and capture along proplatelets during platelet production[J]. Blood, 2005, 106: 4066-4075. |
| [8] |
Machlus KR, Italiano JE Jr. The incredible journey: from megakaryocyte development to platelet formation[J]. J Cell Biol, 2013, 201: 785-796. DOI:10.1083/jcb.201304054 |
| [9] |
Du Y, Chen B. Combination of drugs and carriers in drug delivery technology and its development[J]. Drug Des Devel Ther, 2019, 13: 1401-1408. DOI:10.2147/DDDT.S198056 |
| [10] |
Ponomareva AA, Nevzorova TA, Mordakhanova ER, et al. Structural characterization of platelets and platelet-derived microvesicles[J]. Tsitologiia, 2016, 58: 105-114. |
| [11] |
Holinstat M. Normal platelet function[J]. Cancer Metast Rev, 2017, 36: 195-198. DOI:10.1007/s10555-017-9677-x |
| [12] |
Gremmel T, Frelinger AL, Michelson AD. Platelet physiology[J]. Semin Thromb Hemost, 2016, 42: 191-204. DOI:10.1055/s-0035-1564835 |
| [13] |
Kamath S, Blann AD, Lip GYH. Platelet activation: assessment and quantification[J]. Eur Heart J, 2001, 22: 1561-1571. DOI:10.1053/euhj.2000.2515 |
| [14] |
Fiorini E, Veghini L, Corbo V. Modeling cell communication in cancer with organoids: making the complex simple[J]. Front Cell Dev Biol, 2020, 8: 166-173. DOI:10.3389/fcell.2020.00166 |
| [15] |
Gaertner F, Massberg S. Patrolling the vascular borders: platelets in immunity to infection and cancer[J]. Nat Rev Immunol, 2019, 19: 1-14. DOI:10.1038/s41577-018-0096-1 |
| [16] |
Haemmerle M, Stone RL, Menter DG, et al. The platelet lifeline to cancer: challenges and opportunities[J]. Cancer Cell, 2018, 33: 965-983. DOI:10.1016/j.ccell.2018.03.002 |
| [17] |
Palacios-Acedo AL, Mège D, Crescence L, et al. Platelets, thrombo-inflammation and cancer: collaborating with the enemy[J]. Front Immunol, 2019, 10: 1805-1809. DOI:10.3389/fimmu.2019.01805 |
| [18] |
Li R, Ren M, Chen N, et al. Presence of intratumoral platelets is associated with tumor vessel structure and metastasis[J]. BMC cancer, 2014, 14: 167-174. DOI:10.1186/1471-2407-14-167 |
| [19] |
Ortiz-Otero N, Mohamed Z, King MR. Platelet-based drug delivery for cancer applications[J]. Adv Exp Med Biol, 2018, 10: 235-251. |
| [20] |
Jain S, Harris JP, Ware J, et al. Platelets: linking hemostasis and cancer[J]. Arterioscler Thromb Vasc Biol, 2010, 30: 2362-2367. DOI:10.1161/ATVBAHA.110.207514 |
| [21] |
Liebman HA. Thrombocytopenia in cancer patients[J]. Thromb Res, 2014, 133: 63-69. |
| [22] |
Asghar S, Parvaiz F, Manzoor S. Multifaceted role of cancer educated platelets in survival of cancer cells[J]. Thromb Res, 2019, 177: 42-50. DOI:10.1016/j.thromres.2019.02.026 |
| [23] |
Steinbichler TB, Dudás J, Riechelmann H, et al. The role of exosomes in cancer metastasis[J]. Semin Cancer Biol, 2017, 44: 170-181. DOI:10.1016/j.semcancer.2017.02.006 |
| [24] |
Foss A, Muñoz-Sagredo L, Sleeman J, et al. The contribution of platelets to intravascular arrest, extravasation, and outgrowth of disseminated tumor cells[J]. Clin Exp Metast, 2020, 37: 47-67. DOI:10.1007/s10585-019-10009-y |
| [25] |
De la Garza Ramos R, Goodwin CR, Jain A, et al. Development of a metastatic spinal tumor frailty index (MSTFI) using a nationwide database and its association with inpatient morbidity, mortality and length of stay after spine surgery[J]. World Neurosurg, 2016, 95: 548-555. DOI:10.1016/j.wneu.2016.08.029 |
| [26] |
Modery-Pawlowski CL, Master AM, Pan V, et al. A platelet-mimetic paradigm for metastasis-targeted nanomedicine platforms[J]. Biomacromolecules, 2013, 14: 910-919. DOI:10.1021/bm301996p |
| [27] |
Pan V, Siva PN, Modery-Pawlowski CL, et al. Targeted killing of metastatic cells using a platelet-inspired drug delivery system[J]. RSC Adv, 2015, 5: 46218-46228. DOI:10.1039/C5RA05339K |
| [28] |
Nandi S, Brown AC. Platelet-mimetic strategies for modulating the wound environment and inflammatory responses[J]. Exp Biol Med, 2016, 241: 1138-1148. DOI:10.1177/1535370216647126 |
| [29] |
Wilhelm S, Tavares AJ, Dai Q, et al. Analysis of nanoparticle delivery to tumours[J]. Nat Rev Mater, 2016, 1: 1-12. |
| [30] |
Li T, Dong H, Zhang C, et al. Cell-based drug delivery systems for biomedical applications[J]. Nano Res, 2018, 11: 5240-5257. DOI:10.1007/s12274-018-2179-5 |
| [31] |
Sun Y, Su J, Liu G, et al. Advances of blood cell-based drug delivery systems[J]. Eur J Pharm Sci, 2017, 96: 115-128. DOI:10.1016/j.ejps.2016.07.021 |
| [32] |
Liu L, You Y, Liao FR. On shear-induced platelet aggregation and its therapy[J]. Acta Pharm Sin (药学学报), 2020, 55: 2501-2509. |
| [33] |
Lu Y, Hu Q, Jiang C, et al. Platelet for drug delivery[J]. Curr Opin Biotechnol, 2019, 58: 81-91. DOI:10.1016/j.copbio.2018.11.010 |
| [34] |
Chen X, Wang Q, Liu L, et al. Double-sided effect of tumor microenvironment on platelets targeting nanoparticles[J]. Biomaterials, 2018, 183: 258-267. DOI:10.1016/j.biomaterials.2018.07.005 |
| [35] |
Zhang Y, Zhu X, Chen X, et al. Activated platelets-targeting micelles with controlled drug release for effective treatment of primary and metastatic triple negative breast cancer[J]. Adv Funct Mater, 2019, 29: 1806620. DOI:10.1002/adfm.201806620 |
| [36] |
Hu Q, Sun W, Qian C, et al. Anticancer platelet-mimicking nanovehicles[J]. Adv Mater, 2015, 27: 7043-7050. DOI:10.1002/adma.201503323 |
| [37] |
Hu Q, Qian C, Sun W, et al. Engineered nanoplatelets for enhanced treatment of multiple myeloma and thrombus[J]. Adv Mater, 2016, 28: 9573-9580. DOI:10.1002/adma.201603463 |
| [38] |
Mei D, Gong L, Zou Y, et al. Platelet membrane-cloaked paclitaxel-nanocrystals augment postoperative chemotherapeutical efficacy[J]. J Control Release, 2020, 324: 341-353. DOI:10.1016/j.jconrel.2020.05.016 |
| [39] |
Kim MW, Lee G, Niidome T, et al. Platelet-like gold nanostars for cancer therapy: the ability to treat cancer and evade immune reactions[J]. Front Bioeng Biotechnol, 2020, 8: 133-141. DOI:10.3389/fbioe.2020.00133 |
| [40] |
Ye H, Wang K, Lu Q, et al. Nanosponges of circulating tumor-derived exosomes for breast cancer metastasis inhibition[J]. Biomaterials, 2020, 242: 119932. DOI:10.1016/j.biomaterials.2020.119932 |
| [41] |
Mai X, Zhang Y, Fan H, et al. Integration of immunogenic activation and immunosuppressive reversion using mitochondrial-respiration-inhibited platelet-mimicking nanoparticles[J]. Biomaterials, 2020, 232: 119699. DOI:10.1016/j.biomaterials.2019.119699 |
| [42] |
Wu L, Xie W, Zan HM, et al. Platelet membrane-coated nanoparticles for targeted drug delivery and local chemo-photothermal therapy of orthotopic hepatocellular carcinoma[J]. J Mater Chem B, 2020, 8: 4648-4659. DOI:10.1039/D0TB00735H |
| [43] |
Wang H, Wu J, Williams GR, et al. Platelet-membrane-biomimetic nanoparticles for targeted antitumor drug delivery[J]. J Nanobiotechnology, 2019, 17: 60. DOI:10.1186/s12951-019-0494-y |
| [44] |
Chen Y, Zhao G, Wang S, et al. Platelet-membrane-camouflaged bismuth sulfide nanorods for synergistic radio-photothermal therapy against cancer[J]. Biomater Sci, 2019, 7: 3450-3459. DOI:10.1039/C9BM00599D |
| [45] |
Ye H, Wang K, Wang M, et al. Bioinspired nanoplatelets for chemo-photothermal therapy of breast cancer metastasis inhibition[J]. Biomaterials, 2019, 206: 1-12. DOI:10.1016/j.biomaterials.2019.03.024 |
| [46] |
Zhang M, Ye J, Xia Y, et al. Platelet-mimicking biotaxis targeting vasculature-disrupted tumors for cascade amplification of hypoxia-sensitive therapy[J]. ACS Nano, 2019, 13: 14230-14240. DOI:10.1021/acsnano.9b07330 |
| [47] |
Jiang Q, Wang K, Zhang X, et al. Platelet membrane-camouflaged magnetic nanoparticles for ferroptosis-enhanced cancer immunotherapy[J]. Small, 2020, 16: 2001704. DOI:10.1002/smll.202001704 |
| [48] |
Xu L, Gao F, Fan F, et al. Platelet membrane coating coupled with solar irradiation endows a photodynamic nanosystem with both improved antitumor efficacy and undetectable skin damage[J]. Biomaterials, 2018, 159: 59-67. DOI:10.1016/j.biomaterials.2017.12.028 |
| [49] |
Jing L, Qu H, Wu D, et al. Platelet-camouflaged nanococktail: simultaneous inhibition of drug-resistant tumor growth and metastasis via a cancer cells and tumor vasculature dual-targeting strategy[J]. Theranostics, 2018, 8: 2683-2695. DOI:10.7150/thno.23654 |
| [50] |
Bang KH, Na YG, Huh HW, et al. The delivery strategy of paclitaxel nanostructured lipid carrier coated with platelet membrane[J]. Cancers, 2019, 11: 807-906. DOI:10.3390/cancers11060807 |
| [51] |
Zhuang J, Gong H, Zhou J, et al. Targeted gene silencing in vivo by platelet membrane-coated metal-organic framework nanoparticles[J]. Sci Adv, 2020, 6: 6108-6113. DOI:10.1126/sciadv.aaz6108 |
| [52] |
Shang Y, Wang Q, Li J, et al. Platelet-membrane-camouflaged zirconia nanoparticles inhibit the invasion and metastasis of HeLa cells[J]. Front Chem, 2020, 8: 377-382. DOI:10.3389/fchem.2020.00377 |
| [53] |
Shang Y, Wang Q, Wu B, et al. Platelet membrane camouflaged black phosphorus quantum dots enhance anticancer effect mediated by apoptosis and autophagy[J]. ACS Appl Mater Interfaces, 2019, 11: 28254-28266. DOI:10.1021/acsami.9b04735 |
| [54] |
Liu G, Zhao X, Zhang Y, et al. Engineering biomimetic platesomes for pH-responsive drug delivery and enhanced antitumor activity[J]. Adv Mater, 2019, 31: 1900795. |
| [55] |
Xu L, Su T, Xu X, et al. Platelets membrane camouflaged irinotecan-loaded gelatin nanogels for in vivo colorectal carcinoma therapy[J]. J Drug Deliv Sci Technol, 2019, 53: 101190. DOI:10.1016/j.jddst.2019.101190 |
| [56] |
Pokrovskaya ID, Tobin MP, Desai R, et al. Canalicular system reorganization during mouse platelet activation as revealed by 3D ultrastructural analysis[J]. Platelets, 2021, 32: 97-104. DOI:10.1080/09537104.2020.1719993 |
| [57] |
Selvadurai MV, Hamilton JR. Structure and function of the open canalicular system-the platelet's specialized internal membrane network[J]. Platelets, 2018, 29: 319-325. DOI:10.1080/09537104.2018.1431388 |
| [58] |
Marriott G. Engineering platelets for tumour targeting[J]. Aging, 2016, 8: 1572-1573. DOI:10.18632/aging.101014 |
| [59] |
Rao L, Bu L, Ma L, et al. Platelet-facilitated photothermal therapy of head and neck squamous cell carcinoma[J]. Angew Chem Int Ed Engl, 2018, 57: 986-991. DOI:10.1002/anie.201709457 |
| [60] |
Wu YW, Huang CC, Changou CA, et al. Clinical-grade cryopreserved doxorubicin-loaded platelets: role of cancer cells and platelet extracellular vesicles activation loop[J]. J Biomed Sci, 2020, 27: 45-57. DOI:10.1186/s12929-020-00633-2 |
| [61] |
Wang X, Liang G, Hao X, et al. Bioinspired drug delivery carrier for enhanced tumor-targeting in melanoma mice model[J]. J Biomed Nanotechnol, 2019, 15: 1482-1491. DOI:10.1166/jbn.2019.2786 |
| [62] |
Xu P, Zuo H, Chen B, et al. Doxorubicin-loaded platelets as a smart drug delivery system: an improved therapy for lymphoma[J]. Sci Rep, 2017, 7: 42632. DOI:10.1038/srep42632 |
| [63] |
Xu P, Zuo H, Zhou R, et al. Doxorubicin-loaded platelets conjugated with anti-CD22 mAbs: a novel targeted delivery system for lymphoma treatment with cardiopulmonary avoidance[J]. Oncotarget, 2017, 8: 58322-58337. DOI:10.18632/oncotarget.16871 |
| [64] |
Sarkar S, Alam MA, Shaw J, et al. Drug delivery using platelet cancer cell interaction[J]. Pharm Res, 2013, 30: 2785-2794. DOI:10.1007/s11095-013-1097-1 |
| [65] |
Chi C, Li F, Liu H, et al. Docetaxel-loaded biomimetic nanoparticles for targeted lung cancer therapy in vivo[J]. J Nanopart Res, 2019, 21: 144-154. DOI:10.1007/s11051-019-4580-8 |
| [66] |
Wang C, Sun W, Ye Y, et al. In situ activation of platelets with checkpoint inhibitors for post-surgical cancer immunotherapy[J]. Nat Biomed Eng, 2017, 1: 1-10. DOI:10.1038/s41551-016-0001 |
| [67] |
Han X, Chen J, Chu J, et al. Platelets as platforms for inhibition of tumor recurrence post-physical therapy by delivery of anti-PD-L1 checkpoint antibody[J]. J Control Release, 2019, 304: 233-241. DOI:10.1016/j.jconrel.2019.05.008 |
| [68] |
Zhang X, Wang J, Chen Z, et al. Engineering PD-1-presenting platelets for cancer immunotherapy[J]. Nano Lett, 2018, 18: 5716-5725. DOI:10.1021/acs.nanolett.8b02321 |
| [69] |
Schwarz S, Gockel LM, Naggi A, et al. Glycosaminoglycans as tools to decipher the platelet tumor cell interaction: a focus on P-selectin[J]. Molecules, 2020, 25: 1039-1049. DOI:10.3390/molecules25051039 |
| [70] |
Zara M, Canobbio I, Visconte C, et al. Molecular mechanisms of platelet activation and aggregation induced by breast cancer cells[J]. Cell Signal, 2018, 48: 45-53. DOI:10.1016/j.cellsig.2018.04.008 |
| [71] |
Page MJ, Thomson GJ, Nunes JM, et al. Serum amyloid A binds to fibrin (ogen), promoting fibrin amyloid formation[J]. Sci Rep, 2019, 9: 3102-3111. DOI:10.1038/s41598-019-39056-x |
| [72] |
Pretorius L, Thomson GJA, Adams RCM, et al. Platelet activity and hypercoagulation in type 2 diabetes[J]. Cardiovasc Diabetol, 2018, 17: 1-11. DOI:10.1186/s12933-017-0656-x |
| [73] |
Grill A, Kiouptsi K, Karwot C, et al. Evaluation of blood collection methods and anticoagulants for platelet function analyses on C57BL/6J laboratory mice[J]. Platelets, 2020, 31: 981-988. DOI:10.1080/09537104.2019.1701185 |
| [74] |
Ng MSY, Tung JP, Fraser JF. Platelet storage lesions: what more do we know now[J]. Transfus Med Rev, 2018, 32: 144-154. DOI:10.1016/j.tmrv.2018.04.001 |
| [75] |
Castrillo A, Cardoso M, Rouse L, et al. Treatment of buffy coat platelets in platelet additive solution with the mirasol pathogen reduction technology system[J]. Transfus Med Hemother, 2013, 40: 44-48. DOI:10.1159/000345679 |
| [76] |
Nurhayati RW, Ojima Y, Taya M, et al. Recent developments in ex vivo platelet production[J]. Cytotechnology, 2016, 68: 2211-2221. DOI:10.1007/s10616-016-9963-4 |
| [77] |
Pennell EN, Wagner K, Mosawy S, et al. Acute bilirubin ditaurate exposure attenuates ex vivo platelet reactive oxygen species production, granule exocytosis and activation[J]. Redox Biol, 2019, 26: 101250. DOI:10.1016/j.redox.2019.101250 |
| [78] |
Hosseini E, Ghasemzadeh M, Azizvakili E, et al. Platelet spreading on fibrinogen matrix, a reliable and sensitive marker of platelet functional activity during storage[J]. J Thromb Thrombolys, 2019, 48: 430-438. DOI:10.1007/s11239-019-01916-8 |
| [79] |
Amelirad A, Shamsasenjan K, Akbarzadehlaleh P, et al. Signaling pathways of receptors involved in platelet activation and shedding of these receptors in stored platelets[J]. Adv Pharm Bull, 2019, 9: 38-47. DOI:10.15171/apb.2019.005 |
| [80] |
van der Meijden PEJ, Heemskerk JWM. Platelet biology and functions: new concepts and clinical perspectives[J]. Nat Rev Cardiol, 2019, 16: 166-179. DOI:10.1038/s41569-018-0110-0 |
| [81] |
Gitz E, Koekman CA, Den Heuvel DJ, et al. Improved platelet survival after cold storage by prevention of glycoprotein Ibα clustering in lipid rafts[J]. Haematologica, 2012, 97: 1873-1881. DOI:10.3324/haematol.2012.066290 |
| [82] |
Swieringa F, Spronk HMH, Heemskerk JWM, et al. Integrating platelet and coagulation activation in fibrin clot formation[J]. Res Pract Thromb Haemost, 2018, 2: 456-460. |
| [83] |
Sharma D, Brummel-Ziedins KE, Bouchard BA, et al. Platelets in tumor progression: a host factor that offers multiple potential targets in the treatment of cancer[J]. J Cell Physiol, 2014, 229: 1005-1015. DOI:10.1002/jcp.24539 |
| [84] |
Xu XR, Yousef GM, Ni H. Cancer and platelet crosstalk: opportunities and challenges for aspirin and other antiplatelet agents[J]. Blood, 2018, 131: 1777-1789. DOI:10.1182/blood-2017-05-743187 |
| [85] |
Holmes CE, Levis JE, Schneider DJ, et al. Platelet phenotype changes associated with breast cancer and its treatment[J]. Platelets, 2016, 27: 703-711. DOI:10.3109/09537104.2016.1171302 |
| [86] |
In't Veld SGJG, Wurdinger T. Tumor-educated platelets[J]. Blood, 2019, 133: 2359-2364. DOI:10.1182/blood-2018-12-852830 |
| [87] |
Tsong TY. Electroporation of cell membranes[J]. Biophys J, 1991, 60: 297-306. DOI:10.1016/S0006-3495(91)82054-9 |
| [88] |
Thanuja MY, Anupama C, Ranganath SH, et al. Bioengineered cellular and cell membrane-derived vehicles for actively targeted drug delivery: so near and yet so far[J]. Adv Drug Deliv Rev, 2018, 132: 57-80. DOI:10.1016/j.addr.2018.06.012 |
| [89] |
Bottsfordmiller J, Choi HJ, Dalton HJ, et al. Differential platelet levels affect response to taxane-based therapy in ovarian cancer[J]. Clin Cancer Res, 2015, 21: 602-610. DOI:10.1158/1078-0432.CCR-14-0870 |
| [90] |
Josefsson EC, Hartwig JH, Hoffmeister KM, et al. Platelet storage temperature-how low can we go[J]. Transfus Med Hemother, 2007, 34: 253-261. DOI:10.1159/000103920 |
| [91] |
Fan Z, Zhou H, Li PY, et al. Structural elucidation of cell membrane-derived nanoparticles using molecular probes[J]. J Mater Chem B, 2014, 2: 8231-8238. DOI:10.1039/C4TB00980K |
| [92] |
Li Z, Hu S, Cheng K, et al. Platelets and their biomimetics for regenerative medicine and cancer therapies[J]. J Mater Chem B, 2018, 6: 7354-7365. DOI:10.1039/C8TB02301H |
| [93] |
Eriksson O, Mohlin C, Nilsson B, et al. The human platelet as an innate immune cell: interactions between activated platelets and the complement system[J]. Front Immunol, 2019, 10: 1590-1598. DOI:10.3389/fimmu.2019.01590 |
| [94] |
Moghimi SM, Hunter AC, Peer D, et al. Platelet mimicry: the emperor's new clothes[J]. Nanomedicine, 2016, 12: 245-248. DOI:10.1016/j.nano.2015.09.005 |
| [95] |
Barrionuevo N, Gatica S, Olivares P, et al. Endothelial cells exhibit two waves of P-selectin surface aggregation under endotoxic and oxidative conditions[J]. Protein J, 2019, 38: 667-674. DOI:10.1007/s10930-019-09865-0 |
| [96] |
Yuan L, Sun Y, Huang G. Using class-specific feature selection for cancer detection with gene expression profile data of platelets[J]. Sensors, 2020, 20: 1528-1537. DOI:10.3390/s20051528 |
 2020, Vol. 56
2020, Vol. 56


