癌症是世界范围内死亡的主要原因, 据世界卫生组织(WHO) 报告, 到本世纪末, 癌症将成为全球头号杀手, 也是人类预期寿命延长的最大障碍。2018年全球有近1 810万新增癌症病例, 因癌症死亡人数达960万[1]。人类癌症与许多癌基因和抑癌基因的改变有关, 这些基因的改变发生在从癌变到癌细胞生长、大量繁殖和转移的不同阶段。正常细胞在发育到一定程度后会发生细胞凋亡, 从而维持人体正常的新陈代谢。而一些细胞由于失去正常的细胞凋亡功能, 或者由于癌基因的激活以及抑癌基因的丢失, 抑制了细胞凋亡, 便引起了细胞增殖异常, 从而导致了癌症。因此, 研究与细胞凋亡有关的信息传递、蛋白酶活性, 有望为癌症治疗提供新的手段。细胞凋亡过程中各个信号通路的每个细节都可以作为药物开发的靶点, 包括受体、酶、抑癌基因、离子通道等, 5个主要的靶蛋白Bcl-2、p53、IAP、trail以及caspases作为癌症治疗的药物靶点, 受到了广泛的关注[2]。而靶点p53近年来在研究上取得了很大的进展, 其中的一些药物也已经进入了临床试验。
1 MDM2-p53 1.1 简介TP53基因是一种抑癌基因, 该基因定位于人类染色体17p13.1, 共编码393个氨基酸[3], 是细胞生长周期中的调节因子, 与细胞周期调控、DNA修复、细胞分化、细胞凋亡等途径有关。p53蛋白是由TP53基因编码的一个53 kDa的蛋白, 最初发现于1979年, 由于它可以与肉瘤相关病毒SV40的大T抗原结合, 被称为细胞加速器[4]。目前, 对于p53蛋白的研究已经深入到分子水平, p53从N端到C端依次为: N端转录激活区(1~42)、脯氨酸富集区(58~98)、DNA结合区(102~292)、寡聚区(324~355) 和对蛋白酶体敏感的C端开放区(363~393), N端转录激活区域有3个关键氨基酸残基Phe19、Trp23和Leu26, 它们可以与转录辅助因子结合, 参与转录过程(图 1)。当细胞受到DNA损伤或核糖体应激等一系列原因的伤害时, 会激活p53蛋白的表达, 从而修复受损的细胞。p53又分为野生型p53和突变型p53, 在癌症患者中, 超过50%的恶性肿瘤伴随着p53基因突变[5], 突变型p53具有诱导和促进肿瘤发生的作用, 野生型p53具有反式激活和广谱抑瘤作用。

|
Figure 1 Schematic of p53 and MDM2 functional domains |
在研究p53功能的过程中发现, p53的激活受到严格的控制。MDM2是p53最重要的负调控因子[6], 它是1987年从转化的小鼠细胞系3T3-DM中克隆的一种491个氨基酸的蛋白, 后来被证明是一种癌蛋白。MDM2从N端到C端有4个功能区, 依次为p53结合区(18~101)、酸性区(237~288)、锌指区(289~331) 和环区(436~482) (图 1)。MDM2直接与p53结合并与其形成复合物, 参与调控p53蛋白的稳定性和活性, 并与p53转录激活结构域的N端结合, 从而抑制p53的反式激活, 具有抑制细胞生长、诱导细胞凋亡和调节细胞周期[7]的功能。
1.2 MDM2-p53相互作用MDM2与p53之间的蛋白-蛋白相互作用是通过一个自动调节反馈环调节的(图 2)。在应激状态下, p53经过一系列如磷酸化、乙酰化、甲基化的蛋白质翻译过程后被激活; 而在无应激的哺乳动物细胞中, p53通常通过不断的泛素化和26S蛋白酶体系的降解来维持在较低水平[8]。然而, 当细胞面临DNA损伤、缺氧、细胞因子、代谢变化、病毒感染或癌基因等应激时MDM2蛋白表达减少, p53泛素化被抑制, p53在细胞核内积聚、通过磷酸化和乙酰化等多种共价修饰被激活后发挥抗癌作用。同时p53的增多又诱导MDM2的表达[9]。MDM2通过3种方式抑制p53功能[10]: ①作为E3泛素连接酶, MDM2促进p53泛素化并随后被蛋白酶体降解; ②直接与p53反式激活结构域结合, 阻断该活性; ③ MDM2上的核输出信号使其能够将p53运出细胞核, 进入细胞质。

|
Figure 2 MDM2-p53 pathways |
临床研究表明, 许多癌症患者体内都存在着p53野生型功能的丧失。而p53抑癌功能的丧失有两个重要的原因, 一个是p53蛋白内部发生突变, 另一个是MDM2与p53形成负反馈, 从而抑制p53功能[11]。为此使用抑制剂阻断MDM2-p53蛋白之间的相互作用, 使p53从MDM2上游离下来, 激活p53的抑癌功能, 对体内含有野生型p53的癌症患者具有很好的疗效。
2 MDM2-p53通路抑制剂 2.1 MDM2的结构生物学随着科学技术(包括X射线晶体衍射) 的发展, 人们对于MDM2-p53通路的了解也从细胞水平深入到了分子水平。1996年, Kussie等[12]首次报道了人和爪蟾MDM2和p53肽的X射线晶体复合物, 揭示了MDM2表面很深的疏水裂隙为p53的结合位点, p53肽段以α螺旋的形式插入到MDM2形成的疏水裂隙中, 其中p53的3个关键氨基酸Phe19、Trp23、Leu26与MDM2在形状上形成很好的互补并以范德华力结合(图 3)。另外, p53的Phe19氨基和MDM2 Gln72侧链、Trp23上吲哚亚氨基与MDM2 Leu54羰基形成两个分子间氢键。为此, 模拟p53的结构特点可以很好地阻断MDM2-p53之间的相互作用, 重新激活p53途径, 为肿瘤治疗提供新的研究策略。目前, MDM2-p53作用的抑制剂可以分为肽类抑制剂和小分子抑制剂两类。小分子抑制剂包括顺式咪唑啉、苯二氮䓬类、螺吲哚酮类、色三唑嘧啶和哌啶酮等, 这些小分子抑制剂大都进入临床试验, 进行与癌症相关的研究。
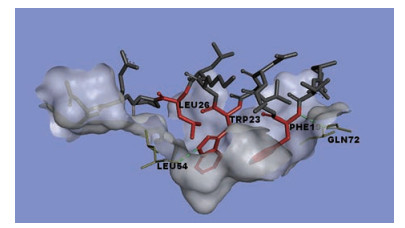
|
Figure 3 The interaction between MDM2-p53 (PDB: 1YCR) |
在有关MDM2-p53相互作用抑制剂的早期研究中, 报道最多的是合成肽类以及真菌环肽氯氟菌素[13]。肽类化合物与小分子抑制剂相比具有高亲和力和特异性, 但由于肽类化合物在体内不稳定以及透膜能力不强, 科学家们在优化上付出了大量的努力。在提高亲和力方面的研究中, 肽类化合物中活性最高的有PMI、PDI、ATSP等几类[14]。
Pazgier等[15]通过十二进位肽噬菌体抗体库, 得到了一类高效的肽类抑制剂PMI, PMI展现了对MDM2-p53相互作用较强的抑制效果, Kd为3.36 nmol·L-1。PMI具有非常好的亲和力, 但缺少细胞膜通透性, 导致该类肽类抑制剂未显示细胞水平的抗增殖作用。利用D-氨基酸原理设计合成的衍生物, 如DPMI-α、DPMI-β、DPMI-γ, 具有很高的体内稳定性, 但亲和度有所降低。PDI是一类设计合成的螺旋多肽, 可以同时与MDM2和MDMX发生作用[16], 通过光诱导烯烃和四唑对酪氨酸残基进行修饰所得到的衍生物具有和PDI相似的蛋白活性[17]。Li等[18]全新设计合成了一系列stingin化合物, 该类化合物以蜂毒明肽apamin的螺旋区域与p53的关键残基Phe19、Trp23、Leu26结合, 具有很高的通透性, 且对于靶蛋白MDM2的Kd值均达到了纳摩尔级别。Chang等[19]发现了一类强效的肽类抑制剂ATSP (图 4), 该肽类具有稳定的α螺旋结构, 而这在MDM2-p53的相互作用中是至关重要的, 其中ATSP-7041的IC50值达到了0.9 nmol·L-1, 且ATSP系列的肽Kd值均达到了纳摩尔级别。ATSP类抑制剂在体外体内都展现出了一定的生物活性, 并还具有良好的药动学性质, 可以抑制细胞内的MDM2, 从而激活p53蛋白的抑癌作用。Hu等[20]设计合成的AA肽是一种由多个N酰化和N乙基化的氨基酸组成的肽类, 具有一定的抗酶水解能力, 所以该类肽抑制剂在细胞体内具有高稳定性。Noguchi等[21]使用化学排列的方法, 通过筛选内部的化合物库, 发现的一系列新的拟肽类抑制剂KPY, 这类抑制剂与MDM2的结合常数基本与p53相近。研究表明该类拟肽抑制剂在细胞水平上表现出一定的活性, 并具有一定的细胞膜通透性。Duncan等[22]从真菌的代谢产物中分离得到了一种MDM2的环肽类的抑制剂chlorofusin, 它的IC50为4.6 μmol·L-1, 表明从天然产物中得到MDM2-p53抑制剂的想法是可行的。
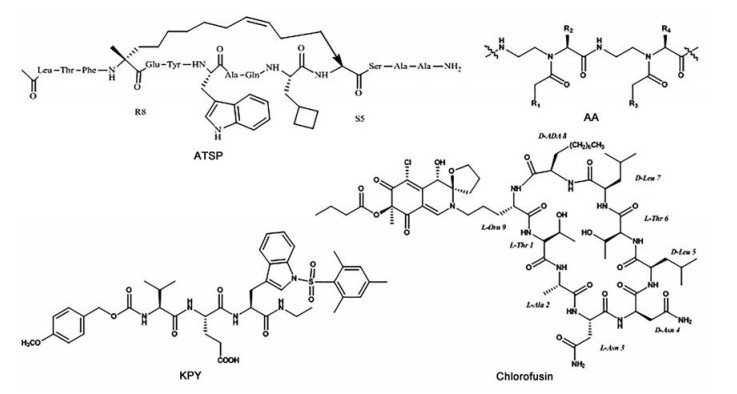
|
Figure 4 Some peptides inhibitors |
除了提高肽类的亲和力, 很多科学家致力于提高肽类抑制剂的通透性。一般的天然氨基酸都是L构型, 虽亲和力高, 但很难透过细胞膜且易于水解。研究表明D型构象肽类抑制剂[23]既可以与MDM2很好的结合, 又大大增加了在体内的稳定性以及细胞膜的通透性。β肽类抑制剂在模仿疏水相互作用时, 可以很好地模拟蛋白之间的相互作用, 使其具有良好的通透性[24]。
2.3 小分子抑制剂与肽类抑制剂相比, MDM2-p53相互作用的小分子抑制剂具有分子量低、特异性高、便于口服的特点, 得到了很多研究者的青睐。经过多年的努力, 人们已经成功设计和开发出一系列结构独特、高效的非肽类MDM2-p53小分子抑制剂。
2.3.1 顺式咪唑啉类(nutlins)2004年, Vassilev等[25]报道了1, 2, 4, 5-四取代-4, 5-齐咪唑啉为母核的第一类MDM2小分子抑制剂, 称为nutlins, 激发了人们对MDM2-p53小分子抑制剂的兴趣。Nutlin-3与MDM2的晶体复合物的研究表明, 它的两个氯苯基分别与Trp23、Leu26口袋结合, 而乙基醚取代基则与Phe19口袋结合, 哌啶侧链暴露在MDM2蛋白表面, 改善化合物的水溶性[26]。Nutlins与MDM2结合竞争性抑制MDM2与p53的结合, 从而诱导p53积聚并恢复其转录活性, 诱导MDM2过度表达的肿瘤细胞凋亡[26]。Nutlins化合物的IC50大都在100~300 nmol·L-1之间, 其中nutlin-1的IC50是260 nmol·L-1, nutlin-2的IC50是140 nmol·L-1。Nutlin-3是外消旋体, 经过手性柱色谱分离得到nutlin-3a (1) 的IC50在90 nmol·L-1, nutlin-3b (2) 的IC50是13.6 μmol·L-1(图 5)。二者都具有足够的细胞通透性, 可以引起剂量依赖性野生型p53的积聚, 但它们均未诱导细胞周期阻滞[27]。其中活性对映体nutlin-3a在p53野生型和突变型癌细胞系中表现出抗增殖活性差异, 而非活性对映体nutlin-3b对它们都没有作用[25]。
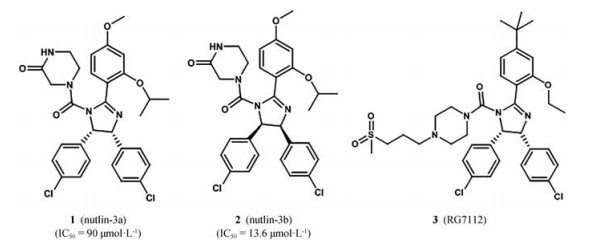
|
Figure 5 Representative examples of cis-imidazoline inhibitors of MDM2-p53 interaction |
目前, 有关nutlin-3的体内外活性已被广泛报道, 它既可以作为单一药物, 也可以与现代化疗、抗癌药物和放射治疗联合使用。Nutlin-3对携带野生型p53的多种肿瘤细胞具有体内外抗肿瘤活性[28]。研究表明, nutlin-3可以抑制骨肉瘤细胞生长, 没有明显毒性和体重减少[25]。低剂量的nutlin-3a活性对映体能够诱导骨肉瘤细胞凋亡, 而其非活性对映体即使在较高浓度下也不起作用[29]。研究者们在nutlin-3的基础上经过不断优化设计, 得到了具有更好细胞通透性以及类药性的化合物。化合物3 (RO5045337) 又称RG7112是罗氏公司研发的MDM2抑制剂, 它是在nutlin-3a结构上进行修饰得到的[30]。与nutlin-3a相比, RG7112具有更好的抑制活性、细胞亲和力、以及化学稳定性, 正在进行临床试验。
2.3.2 咪唑类抑制剂通过对咪唑类MDM2抑制剂的进一步探索, 设计合成了一系列咪唑类MDM2抑制剂(图 6)。这类化合物的3个取代基模拟p53的Phe19、Trp23和Leu26与MDM2结合, 并与MDM2的Val23进行良好的接触。化合物4对MDM2有抑制作用, 同时通过酰胺键将亲水性基团添加到吲哚中得到化合物5。化合物5的活性显著提高, 它的X射线衍射实验表明, 羰基与蛋白质形成水桥氢键, 并观察到氯苄基与MDM2的His96很好的堆积作用[31]。化合物6在咪唑上引入酰胺基, 用3-氯苯基取代4-氯苄基, 将吲哚基团简化为3-氯苯基, 以便于与His96堆积, 有利于氢键的形成, 该化合物表现出中等的MDM2-p53抑制活性。在此基础上合成了一系列化合物, 但后续的研究表明这类化合物的细胞摄取较差[31]。
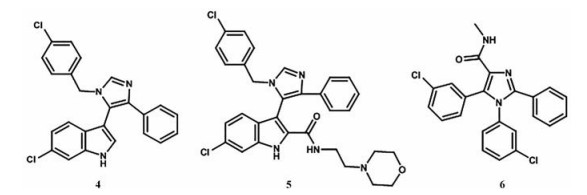
|
Figure 6 Representative examples of imidazoline inhibitors of MDM2-p53 interaction |
苯二氮䓬类化合物(BDP) 作为镇静催眠剂被人们熟知, 之后由于它的多功能性成为药物开发的中流砥柱。强生公司通过热荧光偏振分析筛选公司的化学文库发现, BDP化合物有望成为抑制MDM2-p53相互作用有希望的骨架[32]。X射线晶体衍射实验发现, BDP骨架化合物中两个氯苯基模拟p53的Leu26和Trp23, 碘苯基位于Phe19结合口袋[33]。强生公司在此基础上合成了22 000多个衍生物并测定了它们与MDM2结合的亲和力, 发现含有α-氨基酸的BDP具有很好的抗MDM2-p53相互作用的活性[34], 同时得到了活性较高的化合物7 (TDP222669, 图 7)。研究表明化合物7在表达野生型p53的细胞中IC50为30 μmol·L-1, 而不表达p53的细胞对该化合物不敏感[32]。化合物的体内实验表明, 该化合物利用度差、清除快、溶解度低、不能很好地通过细胞膜, 且大都是外消旋体混合物, 需要进一步的优化。化合物8 (TDP665759) 在苄环上引入氨基, 用非极性基团取代羧酸, 环氮上引入取代基, 显示出很好的细胞活性, 但结合能力稍有下降。该化合物可以与多柔比星协同作用, 在肿瘤细胞中的IC50为0.5 μmol·L-1, 在单独无效的剂量下增强了体内多柔比星的活性, 并抑制肿瘤的生长, 该化合物正在进行临床试验[35]。目前, 在基于BDP结构的基础上得到了一种新型TDZ (1, 4-噻二氮䓬-2, 5-二酮) 结构, 化合物9具有潜在药效团活性, 可以以α-螺旋的形式插入MDM2的空隙中, 从而抑制MDM2-p53之间的相互作用[36]。
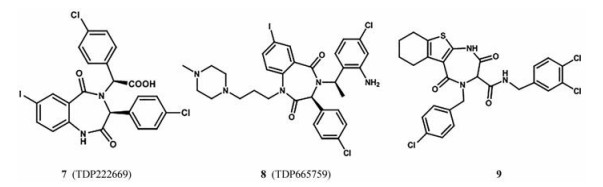
|
Figure 7 Representative examples of benzodiazepinedione inhibitors of MDM2-p53 interaction |
安进公司通过高通量筛选发现色三唑嘧啶是一种有潜力的MDM2-p53抑制剂, IC50为3.88 ± 1.48 μmol·L-1。对合成的色三唑嘧啶化合物进行检验, 发现只有一个立体异构体syn-(1R, 2S) 具有活性。化合物10 (图 8) 的X射线晶体衍射实验表明, 7-对溴苯基与Leu26口袋结合, 除了广泛的范德华接触外, 还与MDM2的His95形成π-π堆积。6-对溴苯基模拟p53的Trp23侧链, 而色烯三唑嘧啶骨架占据p53的Phe19和Val93口袋[37]。为了提高它的活性, 对色三唑嘧啶进行了一系列优化。研究发现, 活性化合物在二甲基亚砜中达到平衡, 转变为非活性的立体异构体, 而在NH上引入甲基化氮可以阻止它的外消旋化而不损失活性[38]。用氯苯取代溴苯, 可以更好地与Trp23口袋结合, 使其活性增加, 而甲基、氟、氰基取代活性都不增加。在色烯三唑嘧啶的主链环上增加取代基可以改善它的活性和类药性。R3、R4氟取代导致活性下降, R5氟取代导致活性增加, R4、R5、R6氯取代或R4、R6氯取代都导致活性减低。然而R3位引入甲氧基使活性显著增加, 引入乙氧基却使活性下降, 推测是因为甲氧基可以使得色三唑并嘧啶核心扭曲, 与MDM2很好的结合, 而乙氧基结构太大, 不能与MDM2很好的结合, 导致活性降低[37]。
|
Figure 8 Representative examples of chromenotriazole pyrimidine inhibitors of MDM2 -p53 interaction |
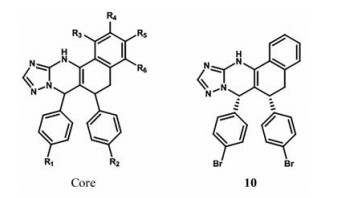
在三唑嘧啶类化合物的研究基础上, 安进公司又合成了一种哌啶酮环骨架(图 9), 用于抑制MDM2-p53的相互作用[39]。该骨架化合物1, 3, 5, 6-四取代哌啶酮, IC50为2.42 μmol·L-1。化合物11对接研究表明, 5-间氯苯基占据Leu26结合口袋, 6-对氯苯基与Trp23口袋结合, 环丙基与Phe19结合口袋形成疏水作用, 同时C2羧酸阴离子与His96的咪唑环形成电荷相互作用。R1位N-环丙基甲基或正丙基衍生物取代, 使它的活性增加, 当烷基尺寸过大时, 化合物活性降低。R1位引入N-环丙基甲基基础上, R2位引入端烯、酯、酰胺或腈, 显著降低了它的活性; R3位引入甲基, 它的活性增加[39]。化合物12 (AM-8553) 对肿瘤生长也表现出剂量依赖性的抑制作用, 且具有较低的人肝细胞固有清除率, 被认为具有较长的人体半衰期(大于12 h), 可能是早期临床开发的合适候选者。对R1进行进一步优化, 得到了化合物13 (AMG232), 该化合物在人肝细胞中表现出最好的稳定性, 在体内的大鼠清除率最低。体内实验表明, 每日口服AMG232 (15 μmol·L-1) 可以抑制SJSA-1移植瘤的生长, 正在进行临床试验[40]。
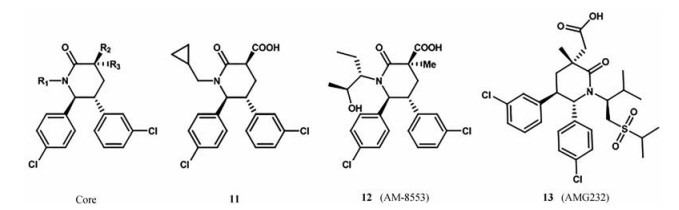
|
Figure 9 Representative examples of piperidone inhibitors of MDM2-p53 interaction |
由于p53的Trp23侧链与MDM2的结合最为紧密, 被认为是MDM2-p53相互作用中最关键的部分。密歇根大学的Ding等[41]通过计算机筛选得到了一类被称为是螺氧吲哚类的化合物。螺氧吲哚环在与MDM2相互作用过程中很完美地模拟了色氨酸侧链, 与MDM2的羰基形成氢键, 并具有疏水相互作用, 这给研究者提供了新的思路。螺氧吲哚环提供一个高度刚性的支架, 两个疏水基团连接在支架上, 占据Phe19和Leu26口袋。依据以上想法设计得到了化合物14 (图 10), 它的苯环模拟p53的Phe19, 但它的结合不紧密, 异丙基模拟p53的Leu26。对它进行FP分析, 结果表明该化合物具有良好的结合活性(8.46 ± 1.44 μmol·L-1), 可以作为先导化合物进一步研究[41]。
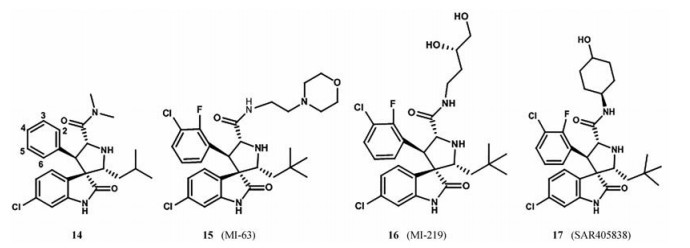
|
Figure 10 Representative examples of spiro-oxindoles inhibitors of MDM2-p53 interaction |
为了进一步提高它的活性, 对化合物14进行了改造。用叔丁基、乙基、异丁基取代异丙基, 都表现出活性的增加, 但使用叔丁基取代时活性增加明显。在苯环上引入氯原子, 发现氯原子在间位时显示出高活性, 而在对位上时则活性相差不大。为了评估氟原子对活性的影响, 在3位氯取代的同时在苯环的2或5位引入氟原子, 发现活性增加, 4位引入氟原子活性降低[42]。在此基础上, 使用2-(吗啉-4-基)乙胺取代N, N-二甲胺部分得到化合物15, 结果表明化合物的活性增加, 可能的原因是2-(吗啉-4-基)乙胺中的氧原子可能靠近MDM2的带电Lys90, 并可能具有很强的氢键潜力。化合物15对LNCaP前列腺癌细胞生长有抑制作用, IC50为280 nmol·L-1, 并对p53缺失的PC-3细胞表现出极好的特异性, 对正常前列腺上皮细胞的毒性最小[43]。为了使化合物易于口服吸收, 用丁基-1, 2-二醇取代吗啉基得到化合物16, 显示出比化合物15更好的活性, 口服利用度也有很好的改善。该化合物对表达野生型p53的细胞株SJSA-1、LNCaP和22Rv1前列腺癌细胞的生长有明显的抑制作用, IC50值为0.4~0.8 μmol·L-1, 对p53缺失的细胞株只有中等活性, 证实了该化合物的细胞生长抑制活性是p53依赖性的[44]。使用3-氨基环烷醇制备得到更稳定的酰胺衍生物, 它们具有良好的细胞活性, 化合物17 (SAR405838) 表现出良好的MDM2结合亲和力和生长抑制活性, 它的晶体衍射实验表明, 酰胺羰基与His96形成氢键, 还可以观察到MDM2的N端折叠[45]。体外实验表明, 单剂量口服化合物17可以抑制SJSA-1小鼠移植瘤, 可以作为一种临床候选药物。为了解决螺氧吲哚系列遇到的立体化学和构象复杂性, 用更简单和更灵活的氰基吡咯烷核心取代螺环酰胺, 得到化合物18 (图 11)[46], 该化合物与化合物16具有相似的取代基, 具有良好的MDM2结合亲和力和适中的细胞活性。通过对化合物18不断的修饰, 得到的化合物19 (RG7388) 显示出高的MDM2的结合亲和力、细胞效力和选择性。同时化合物19具有良好的PK谱[46], 在SJSA-1异种移植瘤模型中, 25 mg·kg-1该化合物可使肿瘤完全消退。
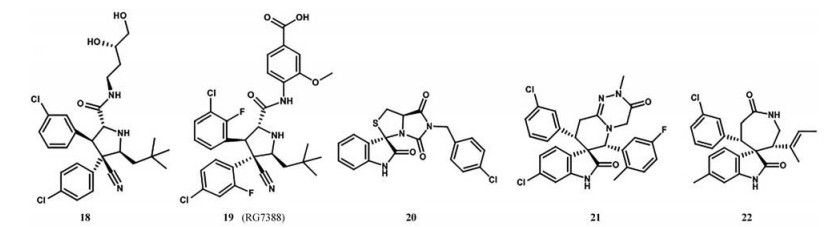
|
Figure 11 Representative examples of spiro-oxindole derivatives inhibitors of MDM2-p53 interaction |
在继续寻找MDM2-p53小分子拮抗剂的过程中, Gomez-Monterrey I等[47]发现了大量的基于螺环-杂环-吲哚酮化合物, 并申请了专利。这些化合物在亚微摩尔范围内可以抑制人类肿瘤细胞的生长, 例如化合物20对人肾细胞系HEK293、黑色素瘤细胞M14和白血病细胞U937的IC50值分别为0.44、0.53和0.87 μmol·L-1。研究证明, 对螺氧吲哚的吡咯烷部分进行修饰是调节p53活性的有效途径, 为寻找更有效更有选择性的螺噻唑烷抑制剂提供了基础[46]。此外还报道了很多其他的结构, 用吡啶三嗪酮支架[48]取代吡咯烷部分(21) 或引入七元环[49] (22), 得到IC50在微摩尔范围内更具有潜力的衍生物。
2.3.7 其他化合物查耳酮化合物是最早确定的MDM2-p53的抑制剂[50], Pereira等[51]通过虚拟筛选和基于酵母筛选的生物活性分析, 得到了8个查耳酮抑制剂, 研究证明化合物23 (图 12) 对肿瘤细胞的抑制作用明显与激活p53途径有关, 但它对于p53的非依赖机制需要进一步证实。最近的一项专利中报道一种基于查尔酮的新型硼酸芳基衍生物, 化合物24在乳腺癌细胞系(MCF-7、MCF-10A、MCF-12A、MDA-MB-231) 中活性最高, IC50值为1.9~4.4 μmol·L-1[52]。研究证明, 一系列硼查尔酮衍生物通过抑制20S蛋白小体间接稳定p53和p21, 诱导细胞死亡, 在这些化合物的存在下, 放射治疗的反应增强[53]。2004年, Issaeva和他的同事在荧光相关光谱的基础上鉴定了一种名为RITA的MDM2-p53的小分子抑制剂25, 该化合物具有2, 5-二噻吩呋喃结构[54]。有人认为化合物25阻止p53与几种负调控因子(包括MDM2) 结合, 通过这种方式, RITA激活了野生型p53的肿瘤抑制功能[53]。近期, 通过电子对接和虚拟筛选, 从苯并噻唑、肼和吡啶基苯基酮反应中发现了一种新的MDM2-p53复合体的抑制剂, 命名为NSC33003 (26), IC50为20 μmol·L-1[55]。
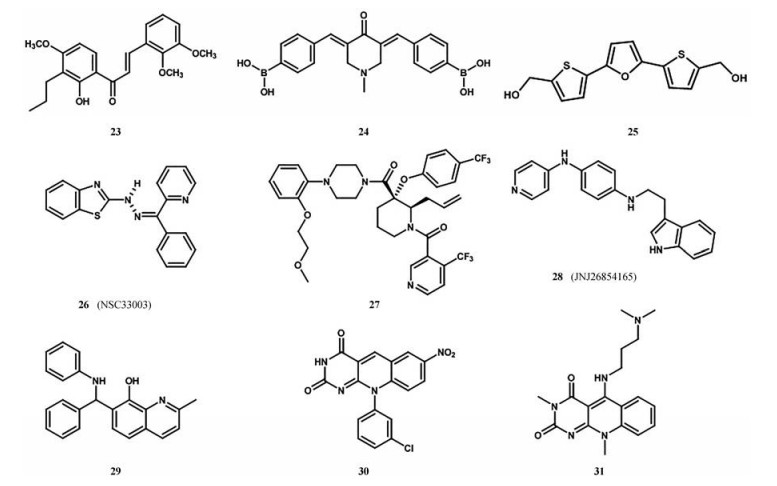
|
Figure 12 Miscellaneous examples of inhibitors of MDM2-p53 interaction |
默克公司通过荧光偏振分析对化合物进行筛选, 发现哌嗪化合物是具有微摩尔效力的MDM2-p53抑制剂[56]。对哌嗪酰胺基团的优化表明, 用烷氧基取代吡啶氮可以提高活性, 在哌啶环的2位增加取代基, 有利于环的构象稳定[57], 如化合物27具有很好的细胞效力。近期, 强生公司开发的一种名为JNJ26854165 (28) 的色胺衍生物最近进入临床试验[58]。已有研究表明, 它通过抑制MDM2-p53复合物与蛋白酶体的结合来阻断p53的降解。化合物28能有效地抑制卵巢、肺、结肠、乳腺和前列腺癌细胞的增殖, IC50值为6.0~7.7 μmol·L-1。在计算机虚拟筛选中, 发现8-羟基喹啉类化合物具有良好的细胞活性和对野生型p53的选择性[59]。化合物29药效最强, Ki值为120 nmol·L-1。在一对等基因的HCT116人结肠癌细胞系中, 该化合物诱导野生型p53细胞中p53、MDM2和p21蛋白的积累。
由于MDM2作为p53的E3泛素连接酶, 抑制这种酶的活性被发现是稳定p53细胞水平的另一种策略。研究表明, 芳基磺酰胺、双芳脲、酰基咪唑酮和去氮黄酮衍生物等都可以抑制MDM2的E3连接酶活性[60]。其中, 去氮黄酮衍生物通过高通量筛选MDM2自身泛素连接酶已被确定为MDM2 E3泛素连接酶活性的抑制剂[61]。化合物30的细胞实验证明该化合物可抑制MDM2的E3泛素连接酶活性, 增加MDM2和p53蛋白水平, 重新激活p53功能, 从而诱导癌细胞p53依赖性凋亡, 但这类化合物作为抗癌剂的效力中等[62]。对化合物29进行优化得到化合物31, 该化合物引入了5-二甲基-氨基丙胺侧链, 同时去除了10-芳基, 具有高度水溶性, 能够抑制MDM2介导的p53泛素化, 细胞活性较低, 导致MDM2和p53蛋白水平增加, 导致多种不同野生型p53癌细胞系选择性地依赖于p53的凋亡[63]。
3 进入临床试验的MDM2-p53抑制剂迄今为止, 有多种MDM2-p53抑制剂进入临床试验。本文将详细讨论这些小分子抑制剂的临床研究进展及发展前景。
3.1 RG7112 (RO5045337)RG7112 (3) 是临床上第一个设计用来占据MDM2的p53结合位点的小分子MDM2抑制剂, 它可口服, 可透过血脑屏障。为了改善顺式咪唑啉类抑制剂的生物学和药代动力学性质, 在nutlin-3a基础上罗氏公司经过不断优化得到的。它与MDM2结合, 从而抑制p53和MDM2的相互作用。这阻止了p53蛋白酶体的降解, 进而导致细胞中肿瘤抑制蛋白p53的稳定和增加。该化合物在体外对高表达MDM2蛋白的SJSA-1骨肉瘤细胞具有生长抑制和杀伤作用。在HCT116和SJSA1细胞中诱导剂量依赖性细胞周期阻滞于G1期和G2/M期[64]。体内实验表明RG7112 (25~200 mg·kg-1, 单次口服) 可在体内激活p53通路, 诱导肿瘤细胞凋亡。RG7112 (100 mg·kg-1,每天灌胃一次, 5天/周, 共3周) 可降低GBM模型的肿瘤生长速度并提高存活率[65]。目前, RG7112进行了多种临床试验, 主要是包括慢性髓细胞白血病、急性髓性白血病、实体瘤、血液瘤在内的Ⅰ期临床试验。
3.2 AMG232AMG232 (13) 是一种有效、选择性高、可口服的MDM2-p53相互作用的哌啶酮类抑制剂, IC50值为0.6 nmol·L-1, 与MDM2结合的Kd为0.045 nmol·L-1。研究表明, AMG232对p53野生型细胞显示出比RG7112更高的选择性。体外实验表明AMG232在3种p53野生肿瘤细胞系模型中(SJSA-1、HCT116和ACHN), 均可诱导p53信号转导并抑制肿瘤细胞增殖[66]。体内实验表明AMG232 (10、25、75 mg·kg-1, 每天一次, 口服) 在体内激活p53途径, 有效地抑制小鼠异种肿瘤的生长, 阻断病毒的DNA合成并诱导细胞凋亡[62], 也可以引起剂量依赖型肿瘤生长抑制, ED50为16 mg·kg-1 [67]。目前, AMG232正在进行临床试验, 以评估AMG232在晚期实体瘤中的临床潜力。其中AMG232用于评估晚期实体瘤或多发性骨髓瘤以及转移性黑色素瘤的临床试验已经完成了Ⅰ期临床, 正在进行浆细胞瘤、急性髓细胞白血病、胶质母细胞瘤等的Ⅰ期临床试验。
3.3 SAR405838SAR405838 (14) 是一种高效、选择性的螺氧吲哚类MDM2抑制剂, 表现出良好的MDM2结合亲和力和生长抑制活性。在SJSA-1模型中, SAR405838能有效地抑制肿瘤细胞株的生长; 对p53突变或缺失的癌细胞株表现出高选择性[68]。SAR405838有效地抑制ABTR1和ABTR2亚系的细胞生长和诱导剂量依赖性凋亡[69]。在良好的耐受剂量方案下, SAR405838在小鼠SJSA1、RS411、LNCaP和HCT-116的异种移植模型中实现了持久的肿瘤消退或完全抑制肿瘤生长[68]。SAR405838被选中进行临床开发, 目前正在进行恶性肿瘤的Ⅰ期临床试验。
3.4 DS-3032DS-3032 (32, 图 13) 又称mliademetan, 是MDM2的一种新型、特异性、可口服的小分子抑制剂, 它破坏了肿瘤细胞中MDM2-p53的相互作用, 可用于急性髓性白血病(AML) 的研究, 正在被开发为一种基于p53再激活机制的癌症治疗药物[70]。

|
Figure 13 Representative examples of MDM2-p53 interaction inhibitors in clinical trials |
APG115 (33) 是亚盛医药自主设计开发的、具有全球知识产权的、作用于新靶点MDM2-p53的抗肿瘤药物, 是国内首个进入临床试验的MDM2-p53抑制剂, 将填补国内在该靶点药物开发领域内的空白。APG115具有显著的活性和给药优势, 且APG115可克服前期临床化合物SAR405838存在慢异构化反应及中性环境溶解性差的药学缺陷, 同时活性为SAR405838的10倍以上。APG115通过诱导带有野生型p53的AGS和MKN45细胞阻滞于G0/G1期而影响进展, 激活p53以增强AGS和MKN45细胞的放射敏感性, 诱导p53野生型细胞株(TPC-1、KTC-1) 发生浓度依赖性的G2/M期阻滞和S期减少[71]。体内实验表明APG115联合放疗可以增强胃腺癌的体内放射抗肿瘤作用[71]。APG115于2016年6月获得美国FDA批准进入临床试验, 目前在美国开展与帕博利珠单抗联合治疗实体瘤的临床Ib/II (NCT03611868) 试验。2017年7月, 获得CFDA批准开展临床试验, 是中国首个进入临床试验的MDM2-p53抑制剂新药。
3.6 RG7388吡咯烷衍生物RG7388 (19), 被称为idasanutlin, 是罗氏开发的全球首个强效口服MDM2蛋白抑制剂, RG7388具有较好的活性和选择性, 能有效激活p53途径, 导致野生型p53表达, 激活细胞周期阻滞或凋亡, 并在裸鼠神经母细胞瘤移植瘤实验中抑制肿瘤增殖[72]。小鼠SJSA骨肉瘤异种移植模型中, RG7388 (25 mg·kg-1, 口服) 导致肿瘤生长抑制和消退, 也具有诱导凋亡和抗增殖的诱导的作用[73]。新药研发监测数据库(CPM) 显示, RG7388目前共开展了15项临床研究, 其中全球最高研发状态为联合阿糖胞苷治疗复发或难治性急性髓细胞白血病(AML) 的III期临床试验(NCT02545283), 但根据中期分析的疗效结果, 该研究已中止。
3.7 HDM201 (NVP-HDM201)HDM201 (34) 又称siremadlin, 是诺华公司研发的一种咪唑并吡咯烷酮类似物, 显示出非常有利的体内特性, 是口服有效的选择性MDM2-p53抑制剂[74], HDM201最近已进入癌症患者的I期临床试验[75]。HDM201通过干扰人和鼠MDM2-p53的相互作用, 阻止p53降解。在临床前研究中每日一次和每三周一次的给药方案显示出可比的长期疗效。目前正在进行的临床试验(NCT02780128) 旨在比较两种给药方案的疗效和耐受性。
3.8 JNJ26854165JNJ26854165 (28) 是一种口服生物利用型化合物, 可以阻止MDM2-p53复合体与蛋白酶体的结合, 抑制p53的降解, 从而恢复p53介导的肿瘤细胞凋亡, 几项重要的临床前研究使该药物进入I期临床试验。临床前研究表明, JNJ26854165在体内和体外对多发性骨髓瘤细胞都显示出很强的活性。然而, 它在p53突变体和nutlin-3a耐药病例中表现出p53非依赖[76]。同时它激活E2F1进一步证实了p53非依赖的的特点。JNJ26854165对p53突变型非霍奇金淋巴瘤细胞株的IC50值高于野生型p53突变型非霍奇金淋巴瘤细胞系, 还分别诱导野生型和突变型p53细胞发生I型和II型程序性死亡[77]。更多的临床前研究报告说, JNJ-26854165增加了U87胶质母细胞瘤移植瘤中p53的水平, 并伴随着凋亡刺激。此外, JNJ26854165还能诱导具有突变型p53的乳腺、肺、结肠和前列腺肿瘤模型的抗肿瘤作用[78]。JNJ26854165与其他抗肿瘤药物(雷帕霉素、多柔比星、Bcl-2抑制剂) 联合使用时, 显示出序列特异性的抗增殖作用, 表现出更高的抗癌效果[77]。
4 总结以MDM2-p53为靶点设计开发全新机制的抗肿瘤药物, 是当下全球肿瘤药物研发领域热点与重点之一。然而MDM2-p53蛋白相互作用的特殊性给小分子抑制剂的开发带来相当大的困难, 导致全球该领域的在研药物屈指可数, 且全球针对该靶点尚未有上市药物。该抑制剂具有一定的局限性: 一是MDM2小分子抑制剂在使用过程中会产生毒性, 究其原因可能是剂量的不正确使用导致骨髓中的p53被激活而产生的血液毒性, 包括血小板减少和中性粒细胞减少, 这些问题需通过优化给药方案解决[79]。二是MDM2-p53相互作用的抑制剂只对含有野生型p53的肿瘤细胞有抑制作用, 故携带突变型p53的癌细胞较容易产生耐药性。为此在临床评估时应将MDM2抑制剂与抑制p53突变的药物联合使用, 从而达到协同抗癌的作用。目前, 大部分小分子抑制剂处于研发阶段, 正在进行临床试验, 但也有部分化合物由于种种原因终止了试验。目前研发进度较快的有罗氏公司的RG7388、安进公司的AMG232及诺华的HDM201。而国内在该领域的在研药物除APG115外尚未见其他报道。为此深入研究MDM2-p53的作用机制, 优化靶向MDM2-p53的小分子抑制剂, 有利于推进靶向MDM2-p53小分子在临床研究中的应用, 具有很好的开发前景。
作者贡献: 王继超负责论文撰写; 杨采彬负责图片的处理; 卓伊琳负责文献检索的整理; 梁冲、王俊钢负责文献检索和资料提取; 董升、李博腾、张淑华负责论文格式和内容合理性的初步检查; 张国刚负责论文整体设计和最终审核。
利益冲突: 所有作者均声明没有利益冲突。
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA: Cancer J Clin, 2018, 68: 394-4234. DOI:10.3322/caac.21492 |
| [2] |
Fan J, Zhang HL, Tan CY, et al. Small molecules targeting tumor apoptosis related proteins and genes[J]. Chem Prog (化学进展), 2007, 19: 120-129. |
| [3] |
Lane DP. Cancer. p53, guardian of the genome[J]. Nature, 1992, 358: 15-16. DOI:10.1038/358015a0 |
| [4] |
Linzer DI, Levine AJ. Characterization of a 54K dalton cellular SV40 tumor antigen present in SV40-transformed cells and uninfected embryonal carcinoma cells[J]. Cell, 1979, 17: 43-52. DOI:10.1016/0092-8674(79)90293-9 |
| [5] |
Hainaut P, Hollstein M. The p53 tumor suppressor gene: the first ten thousand mutations[J]. Adv Cancer Res, 2000, 77: 81-137. |
| [6] |
Cahilly-Snyder L, Yang-Feng T, Francke U, et al. Molecular analysis and chromosomal mapping of amplified genes isolated from a transformed mouse 3T3 cell line[J]. Somat Cell Mol Genet, 1987, 13: 235-244. DOI:10.1007/BF01535205 |
| [7] |
Piette J, Neel H, Maréchal V. MDM2:keeping p53 under control[J]. Oncogene, 1997, 15: 1001-1010. DOI:10.1038/sj.onc.1201432 |
| [8] |
Hanazono K, Natsugoe S, Stein H, et al. Distribution of p53 mutations in esophageal and gastric carcinomas and the relationship with p53 expression[J]. Oncol Rep, 2006, 15: 821-824. |
| [9] |
Zhao YH, Yu HY, Hu WW. The regulation of MDM2 oncogene and its impact on human cancers[J]. Acta Biochem Biophys Sin, 2014, 46: 180-189. DOI:10.1093/abbs/gmt147 |
| [10] |
Michael D, Oren M. The p53-MDM2 module and the ubiquitin system[J]. Semin Cancer Biol, 2003, 13: 49-58. DOI:10.1016/S1044-579X(02)00099-8 |
| [11] |
Shi ZH, Zhang SL, Zhang QG. Binding free energy insight into interaction mechanism of inhibitor PDIQ with MDM2[J]. J Atom Mol Phys (原子与分子物理学报), 2014, 31: 618-623. |
| [12] |
Kussie PH, Gorina S, Marechal V, et al. Structure of the MDM2 oncoprotein bound to the p53 tumor suppressor transactivation domain[J]. Science, 1996, 27: 948-953. |
| [13] |
Duncan SJ, Cooper MA, Williams DH. Binding of an inhibitor of the p53/MDM2 interaction to MDM2[J]. Chem Commun (Camb), 2003, 7: 316-317. |
| [14] |
Li X, Zou Y, Wu MC, et al. Research progress inhibitors of peptides and peptidomimetic acting on p53-MDM2 interface[J]. J Pharm Pract (药学实践杂志), 2015, 33: 494-497. |
| [15] |
Pazgier M, Liu M, Zou G, et al. Structural basis for high-affinity peptide inhibition of p53 interactions with MDM2 and MDMX[J]. Proc Natl Acad Sci U S A, 2009, 106: 4665-4670. DOI:10.1073/pnas.0900947106 |
| [16] |
Hu B, Gilkes DM, Chen J. Efficient p53 activation and apoptosis by simultaneous disruption of binding to MDM2 and MDMX[J]. Cancer Rep, 2007, 67: 8810-8817. |
| [17] |
Madden MM, Muppidi A, Li Z, et al. Synthesis of cell-permeable stapled peptide dual inhibitors of the p53-MDM2/MDMX interactions via photoinduced cycloaddition[J]. Bioorg Med Chem Lett, 2011, 21: 1472-1475. DOI:10.1016/j.bmcl.2011.01.004 |
| [18] |
Li C, Zhan C, Zhao L, et al. Functional consequences of retro-inverso isomerization of a miniature protein inhibitor of the p53-MDM2 interaction[J]. Bioorg Med Chem, 2013, 21: 4045-4050. DOI:10.1016/j.bmc.2013.04.039 |
| [19] |
Chang YS, Graves B, Guerlavais V, et al. Stapled alpha-helical peptide drug development: a potent dual inhibitor of MDM2 and MDMX for p53-dependent cancer therapy[J]. Proc Natl Acad Sci U S A, 2013, 110: 3445-3454. DOI:10.1073/pnas.1303002110 |
| [20] |
Hu Y, Li X, Sebti SM, et al. Design and synthesis of AA peptides: a new class of peptide mimics[J]. Bioorg Med Chem Lett, 2011, 21: 1469-1471. DOI:10.1016/j.bmcl.2011.01.005 |
| [21] |
Noguchi T, Oishi S, Honda K, et al. Affinity-based screening of MDM2/MDMX-p53 interaction inhibitors by chemical array: identification of novel peptidic inhibitors[J]. Bioorg Med Chem Lett, 2013, 23: 3802-3805. DOI:10.1016/j.bmcl.2013.04.094 |
| [22] |
Duncan SJ, Gruschow S, Williams DH, et al. Isolation and structure elucidation of chlorofusin, a novel p53-MDM2 antagonist from a Fusarium sp[J]. J Am Chem Soc, 2001, 123: 554-560. DOI:10.1021/ja002940p |
| [23] |
Liu M, Pazgier M, Li C, et al. A left-handed solution to peptide inhibition of the p53-MDM2 interaction[J]. Angew Chem, 2010, 49: 3649-3652. DOI:10.1002/anie.201000329 |
| [24] |
Harker EA, Schepartz A. Cell-permeable beta-peptide inhibitors of p53/HDM2 complexation[J]. Chembiochem, 2009, 10: 990-993. DOI:10.1002/cbic.200900049 |
| [25] |
Vassilev LT, Vu BT, Graves B, et al. In vivo activation of the p53 pathway by small-molecule antagonists of MDM2[J]. Science, 2004, 303: 844-848. DOI:10.1126/science.1092472 |
| [26] |
Fry DC, Vassilev LT. Targeting protein-protein interactions for cancer therapy[J]. J Mol Med, 2005, 83: 955-963. DOI:10.1007/s00109-005-0705-x |
| [27] |
Hainaut P, Milner JA. A structural role for metal ions in the "wild-type" conformation of the tumor suppressor protein p53[J]. Cancer Res, 1993, 53: 1739-1742. |
| [28] |
Jiang CC, Lucas K, Avery-Kiejda KA, et al. Up-regulation of Mcl-1 is critical for survival of human melanoma cells upon endoplasmic reticulum stress[J]. Cancer Res, 2008, 68: 6708-6717. DOI:10.1158/0008-5472.CAN-08-0349 |
| [29] |
Zhao CY, Grinkevich V, Nikulenkov F, et al. Rescue of the apoptotic-inducing function of mutant p53 by small molecule RITA[J]. Cell Cycle, 2010, 9: 1847-1855. DOI:10.4161/cc.9.9.11545 |
| [30] |
Khoury K, Popowicz GM, Holak TA, et al. The p53-MDM2/MDMX axis: a chemotype perspective[J]. MedChemComm, 2011, 2: 246-260. DOI:10.1039/c0md00248h |
| [31] |
Vaupel A, Bold G, De Pover A, et al. Tetra-substituted imidazoles as a new class of inhibitors of the p53-MDM2 interaction[J]. Bioorg Med Chem Lett, 2014, 24: 2110-2114. DOI:10.1016/j.bmcl.2014.03.039 |
| [32] |
Grassberger BL, Lu T, Schubert C, et al. Discovery and cocrystal structure of benzodiazepinedione HDM2 antagonists that activate p53 in cells[J]. J Med Chem, 2005, 48: 909-912. DOI:10.1021/jm049137g |
| [33] |
Raboisson P, Marugan JJ, Schubert C, et al. Structure-based design, synthesis, and biological evaluation of novel 1, 4-diazepines as HDM2 antagonists[J]. Bioorg Med Chem Lett, 2005, 15: 1857-1861. DOI:10.1016/j.bmcl.2005.02.018 |
| [34] |
Parks DJ, Lafrance LV, Calvo RR, et al. 1, 4-Benzodiazepine-2, 5-diones as small molecule antagonists of the HDM2-p53 interaction: discovery and SAR[J]. Bioorg Med Chem Lett, 2005, 15: 765-770. DOI:10.1016/j.bmcl.2004.11.009 |
| [35] |
Koblish HK, Zhao S, Franks CF, et al. Benzodiazepinedione inhibitors of the HDM2:p53 complex suppress human tumor cell proliferation in vitro and sensitize tumors to doxorubicin in vivo[J]. Mol Cancer Ther, 2006, 5: 160-169. DOI:10.1158/1535-7163.MCT-05-0199 |
| [36] |
Huang Y, Wolf S, Bista M, et al. 1, 4-Thienodiazepine-2, 5-diones via MCR (I): synthesis, virtual space and p53-MDM2 activity[J]. Chem Biol Drug Des, 2010, 76: 116-129. DOI:10.1111/j.1747-0285.2010.00989.x |
| [37] |
Allen JG, Bourbeau MP, Wohlhieter GE, et al. Discovery and optimization of chromenotriazolopyrimidines as potent inhibitors of the mouse double minute 2-tumor protein 53 protein-protein interaction[J]. J Med Chem, 2009, 52: 7044-7053. DOI:10.1021/jm900681h |
| [38] |
Beck HP, DeGraffenreid M, Fox B, et al. Improvement of the synthesis and pharmacokinetic properties of chromentriazolopyrimidine MDM2-p53 protein-protein inhibitors[J]. Bioorg Med Chem Lett, 2011, 21: 2752-2755. DOI:10.1016/j.bmcl.2010.11.027 |
| [39] |
Rew Y, Sun D, Gonzalez-Lopez De Turiso F, et al. Structure-based design of novel inhibitors of the MDM2-p53 interaction[J]. J Med Chem, 2012, 55: 4936-4954. DOI:10.1021/jm300354j |
| [40] |
Sun D, Li Z, Rew Y, et al. Discovery of AMG 232, a potent, selective, and orally bioavailable MDM2-p53 inhibitor in clinical development[J]. J Med Chem, 2014, 57: 1454-1472. DOI:10.1021/jm401753e |
| [41] |
Ding K, Lu Y, Nikolovska-Coleska Z, et al. Structure-based design of potent non-peptide MDM2 inhibitors[J]. J Am Chem Soc, 2005, 127: 10130-10131. DOI:10.1021/ja051147z |
| [42] |
Ding K, Lu Y, Nikolovska-Coleska Z, et al. Structure-based design of spiro-oxindoles as potent, specific small-molecule inhibitors of the MDM2-p53 interaction[J]. J Med Chem, 2006, 49: 3432-3435. DOI:10.1021/jm051122a |
| [43] |
Shangary S, Qin D, McEachern D, et al. Temporal activation of p53 by a specific MDM2 inhibitor is selectively toxic to tumors and leads to complete tumor growth inhibition[J]. Proc Natl Acad Sci U S A, 2008, 105: 3933-3938. DOI:10.1073/pnas.0708917105 |
| [44] |
Zhao Y, Yu S, Sun W, et al. A potent small-molecule inhibitor of the MDM2-p53 interaction (MI-888) achieved complete and durable tumor regression in mice[J]. J Med Chem, 2013, 56: 5553-5561. DOI:10.1021/jm4005708 |
| [45] |
Bykov V, Issaeva N, Shilov A, et al. Restoration of the tumor suppressor function to mutant p53 by a low-molecular-weight compound[J]. Nat Med, 2002, 8: 282-288. DOI:10.1038/nm0302-282 |
| [46] |
Ding Q, Zhang Z, Liu JJ, et al. Discovery of RG7388, a potent and selective p53-MDM2 inhibitor in clinical development[J]. J Med Chem, 2013, 56: 5979-5983. DOI:10.1021/jm400487c |
| [47] |
Gomez-Monterrey I, Bertamino A, Porta A, et al. Identification of the spiro(oxindole-3, 3'-thiazolidine)-based derivatives as potential p53 activity modulators[J]. J Med Chem, 2010, 53: 8319-8329. DOI:10.1021/jm100838z |
| [48] |
Liu JJ, Zhang Z. Preparation of spiroindolepyridotriazinediones as anticancer drugs: WO, 2008141975A1[P]. 2008-11-27.
|
| [49] |
Ding Q, Liu JJ, Zhang Z. Spiroindolinone derivatives: WO, 2007104714A1[P]. 2007-09-20.
|
| [50] |
Stoll R, Renner C, Hansen S, et al. Chalcone derivatives antagonize interactions between the human oncoprotein MDM2 and p53[J]. Biochemistry, 2001, 40: 336-344. DOI:10.1021/bi000930v |
| [51] |
Pereira D, Lima RT, Palmeira A, et al. Design and synthesis of new inhibitors of p53-MDM2 interaction with a chalcone scaffold[J]. Arab J Chem, 2016, S1878535216300399. |
| [52] |
Khan SR. Boronic acid aryl analogs: US, 7829742B2[P]. 2010-11-09.
|
| [53] |
Achanta G, Modzelewska A, Feng L, et al. A boronic-chalcone derivative exhibits potent anticancer activity through inhibition of the proteasome[J]. Mol Pharmacol, 2006, 70: 426-433. DOI:10.1124/mol.105.021311 |
| [54] |
Issaeva N, Bozko P, Enge M, et al. Small molecule RITA binds to p53, blocks p53-HDM2 interaction and activates p53 function in tumors[J]. Nat Med, 2004, 10: 1321-1328. DOI:10.1038/nm1146 |
| [55] |
Lawrence HR, Li Z, Yip ML, et al. Identification of a disruptor of the MDM2-p53 protein-protein interaction facilitated by high-throughput in silico docking[J]. Bioorg Med Chem Lett, 2009, 19: 3756-3759. DOI:10.1016/j.bmcl.2009.04.124 |
| [56] |
Ma Y, Lahue BR, Shipps Jr GW, et al. Substituted piperidines as HDM2 inhibitors[J]. Bioorg Med Chem Lett, 2014, 24: 1026-1030. DOI:10.1016/j.bmcl.2014.01.026 |
| [57] |
Ma Y, Lahue BR, Gibeau CR, et al. Pivotal role of an aliphatic side chain in the development of an HDM2 inhibitor[J]. ACS Med Chem Lett, 2014, 5: 572-575. DOI:10.1021/ml500019s |
| [58] |
Arts J, Page M, Valckx A, et al. Small molecule inhibitors of novel targets: oral JNJ-26854165- a novel hdm2 antagonist in clinical development showing broad-spectrum preclinical antitumor activity against solid malignancies[C]. San Diego, CA: AACR Annual Meeting, 2008.
|
| [59] |
Lu Y, Nikolovska-Coleska Z, Fang X, et al. Discovery of a nanomolar inhibitor of the human murine double minute 2(MDM2)-p53 interaction through an integrated, virtual database screening strategy[J]. J Med Chem, 2006, 49: 3759-3762. DOI:10.1021/jm060023+ |
| [60] |
Lai Z, Yang T, Kim YB, et al. Differentiation of Hdm2-mediated p53 ubiquitination and Hdm2 autoubiquitination activity by small molecular weight inhibitors[J]. Proc Natl Acad Sci U S A, 2002, 99: 14734-14739. DOI:10.1073/pnas.212428599 |
| [61] |
Murray MF, Jurewicz AJ, Martin JD, et al. A high-throughput screen measuring ubiquitination of p53 by human mdm2[J]. J Biomol Screen, 2007, 12: 1050-1058. DOI:10.1177/1087057107308556 |
| [62] |
Yang Y, Ludwig RL, Jensen JP, et al. Small molecule inhibitors of HDM2 ubiquitin ligase activity stabilize and activate p53 in cells[J]. Cancer Cell, 2005, 7: 547-559. DOI:10.1016/j.ccr.2005.04.029 |
| [63] |
Kitagaki J, Agama KK, Pommier Y, et al. Targeting tumor cells expressing p53 with a water-soluble inhibitor of Hdm2[J]. Mol Cancer Ther, 2008, 7: 2445-2454. DOI:10.1158/1535-7163.MCT-08-0063 |
| [64] |
Tovar C, Graves B, Packman K, et al. MDM2 small-molecule antagonist RG7112 activates p53 signaling and regresses human tumors in preclinical cancer models[J]. Cancer Res, 2013, 73: 2587-2597. DOI:10.1158/0008-5472.CAN-12-2807 |
| [65] |
Verreault M, Schmitt C, Glodwiet L, et al. Preclinical efficacy of the MDM2 inhibitor RG7112 in MDM2-amplified and TP53 wild-type glioblastomas[J]. Clin Cancer Res, 2016, 22: 1185-1196. DOI:10.1158/1078-0432.CCR-15-1015 |
| [66] |
Canon J, Osgood T, Olson SH, et al. The MDM2 inhibitor AMG232 demonstrates robust antitumor efficacy and potentiates the activity of p53-inducing cytotoxic agents[J]. Mol Cancer Ther, 2015, 14: 649-648. DOI:10.1158/1535-7163.MCT-14-0710 |
| [67] |
Rew Y, Sun D. Discovery of a small molecule MDM2 inhibitor (AMG232) for treating cancer[J]. J Med Chem, 2014, 57: 6332-6341. DOI:10.1021/jm500627s |
| [68] |
Wang SM, Sun W, Zhao YJ, et al. SAR405838:an optimized inhibitor of MDM2-p53 interaction that induces complete and durable tumor regression[J]. Cancer Res, 2014, 74: 5855-5865. DOI:10.1158/0008-5472.CAN-14-0799 |
| [69] |
Hoffman-Luca CG, Ziazadeh D, Mceachern D, et al. Elucidation of acquired resistance to Bcl-2 and MDM2 inhibitors in acute leukemia in vitro and in vivo[J]. Clin Cancer Res, 2015, 21: 2558-2568. DOI:10.1158/1078-0432.CCR-14-2506 |
| [70] |
Nakamaru K, Seki T, Tazaki K, et al. Abstract B5:preclinical characterization of a novel orally-available MDM2 inhibitor DS-3032b: anti-tumor profile and predictive biomarkers for sensitivity[J]. Mol Cancer Ther, 2015, 14: B5. DOI:10.1186/1476-4598-14-5 |
| [71] |
Yi H, Yan X, Luo Q, et al. A novel small molecule inhibitor of MDM2-p53(APG-115) enhances radiosensitivity of gastric adenocarcinoma[J]. J Exp Clin Cancer Res, 2018, 37: 97. DOI:10.1186/s13046-018-0765-8 |
| [72] |
Lakoma A, Barbieri E, Agarwal S, et al. The MDM2 small-molecule inhibitor RG7388 leads to potent tumor inhibition in p53 wild-type neuroblastoma[J]. Cell Death Discov, 2015, 1: 15026. |
| [73] |
Higgins B, Glenn K, Walz A, et al. Preclinical optimization of MDM2 antagonist scheduling for cancer treatment by using a model-based approach[J]. Clin Cancer Res, 2014, 20: 3742-3752. DOI:10.1158/1078-0432.CCR-14-0460 |
| [74] |
Chapeau EA, Gembarska A, Durand EY, et al. Resistance mechanisms to TP53-MDM2 inhibition identified by in vivo piggyBac transposon mutagenesis screen in an Arf(-/-) mouse model[J]. Proc Natl Acad Sci U S A, 2017, 114: 3151-3156. DOI:10.1073/pnas.1620262114 |
| [75] |
Furet P, Masuya K, Kallen J, et al. Discovery of a novel class of highly potent inhibitors of the p53-MDM2 interaction by structure-based design starting from a conformational argument[J]. Bioorg Med Chem Lett, 2016, 26: 4837-4841. DOI:10.1016/j.bmcl.2016.08.010 |
| [76] |
Kojima K, Burks JK, Arts J, et al. The novel tryptamine derivative JNJ-26854165 induces wild-type p53- and E2F1-mediated apoptosis in acute myeloid and lymphoid leukemias[J]. Mol Cancer Ther, 2010, 9: 2545-2557. DOI:10.1158/1535-7163.MCT-10-0337 |
| [77] |
Stuhmer T, Arts J, King P, et al. A first-in-class HDM2-inhibitor (JNJ-26854165) in phase I development shows potent activity against multiple myeloma (MM) cell in vitro and ex vivo[J]. J Clin Oncol, 2008, 26S: 14694. |
| [78] |
Jones RJ, Arts J, Orlowski RZ. Inhibition of the human double minute (HDM)-2 E3 ubiquitin ligase activates different programmed cell death (PCD) pathways in models of non-Hodgkin lymphoma (NHL) with wild type (wt) and mutant (mut) p53[J]. Blood, 2008, 112: 3618. DOI:10.1182/blood.V112.11.3618.3618 |
| [79] |
Wang SM, Zhao YJ, Aguilar A, et al. Targeting the MDM2-p53 protein-protein interaction for new cancer therapy: progress and challenges[J]. Cold Spring Harb Perspect Med, 2017, 7: a026245. DOI:10.1101/cshperspect.a026245 |
 2020, Vol. 56
2020, Vol. 56


