2. 国家药品监督管理局药品审评中心, 北京 100022;
3. 清华大学附属北京清华长庚医院神经内科, 北京 102218
2. Center for Drug Evaluation, National Medical Product Administration, Beijing 100022, China;
3. Department of Neurology, Beijing Tsinghua Changgung Hospital, Tsinghua University, Beijing 102218, China
焦虑是对未来威胁的预期, 恐惧则是对真实或感知到的威胁的情感反应[1]。焦虑与恐惧都是正常的人类情感, 但当其影响到行为或造成痛苦时则发展成为焦虑障碍[2]。焦虑障碍表现为精神症状和躯体症状, 其中精神症状是指提心吊胆、恐惧和忧虑的内心体验, 伴有紧张不安; 躯体症状则是一系列如心悸、气短、胸闷、口干、出汗、肌紧张性震颤、颤抖或颜面潮红、苍白等的自主神经系统功能亢进症状[3]。美国精神病协会诊断和统计手册对焦虑障碍的分类包括分离性焦虑障碍、选择性缄默症、特定恐怖症、社交焦虑障碍(社交恐惧症)、惊恐障碍(恐慌障碍)、惊恐发作、广场恐惧症、广泛性焦虑障碍、物质/药物诱发的焦虑障碍、由于其他医疗条件所致的焦虑障碍以及其他特定和未特定的焦虑障碍[1]。《中国精神障碍分类及诊断标准》则仅包含惊恐障碍和广泛性焦虑两类。急性应激障碍和创伤后应激障碍现已不再归入焦虑障碍[1]。
研究表明, 全球普通人群中焦虑障碍发病率约7.3%[4], 女性焦虑障碍的发病率显著高于男性[5]; 首次全国性精神障碍流行病学调查结果表明, 焦虑障碍在中国成人精神障碍中发病率最高, 接受调查前12个月内和终生患病率分别为5.0%和7.6%[6], 在癌症[7]、慢性疼痛[8]、帕金森症[9]和脑卒中[10]等患者中的发病率则更高。遗传流行病学研究表明, 焦虑障碍的发生存在中等程度的家族聚集性和遗传度[11]。分子遗传学连锁研究表明, 一些染色体区域与焦虑障碍有关[11]; 进一步的关联研究, 尤其是全基因组关联分析通过对基因组的全面分析给出了一些潜在的相关候选基因, 但尚未发现与焦虑抑郁密切相关的常见变异; 目前的基础和临床研究表明, 焦虑障碍是遗传与环境因素共同作用的结果[11]。在遗传因素方面, 早期的研究主要关注脑内神经递质, 认为神经突触间隙单胺类神经递质, 尤其是5-羟色胺(serotonin, 5-HT) 及其受体和转运体的异常与焦虑的发病有关, 多巴胺、去甲肾上腺素、γ-氨基丁酸(GABA)、谷氨酸和神经肽Y (neuropeptide Y, NPY) 及相关受体也均参与焦虑情绪的调节[12, 13]。进一步研究发现了神经内分泌功能与焦虑发病的相关性, 在应激状态下, 下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal, HPA) 轴的激活造成促肾上腺皮质激素释放激素(CRH) 的释放、促肾上腺皮质激素的分泌和糖皮质激素的释放, 从而直接或间接地参与焦虑的发生[14], 下丘脑-垂体-甲状腺轴[12, 15]和下丘脑-垂体-性腺轴[12, 13, 16]也通过对激素的调节参与调控焦虑情绪。近年来神经解剖学和影像学的研究则发现大脑中杏仁核-前扣带回-岛叶皮质的神经环路, 以及前额叶、下丘脑腹侧核、杏仁核和海马的结构可塑性变化都参与焦虑、恐惧情绪的发生[11]。此外, 神经营养因子系统(如神经营养因子BDNF)[17]和免疫紊乱[12]也与焦虑的发生相关。在环境因素方面, 目前认为心理因素和躯体因素均可以造成焦虑障碍, 但其效果取决于个体独特的遗传构成[18]。早期生活压力等环境风险因素可能通过表观遗传修饰, 如DNA甲基化影响一系列基因的表达, 从而参与焦虑障碍的发病[11]。在心理因素方面, 研究已经表明应激和焦虑抑郁的相关性, 大多数焦虑患者都曾经历严重的心理应激事件[19]。在躯体因素方面, 内分泌疾病如甲状腺功能亢进和肾上腺皮质功能亢进可以直接导致焦虑障碍的发生[20]。药物成瘾与戒断也同样引起焦虑行为[21]。临床发现乳酸钠和肾上腺素能药物等也可以直接诱导焦虑[22]。
目前, 对焦虑障碍的临床干预主要为心理治疗合并药物治疗, 其预后与个体素质和临床类型有关[23]。在临床用药方面, 第一代抗焦虑药为甲丙氨酯, 但患者对其耐受性差, 并往往产生严重的戒断现象; 第二代抗焦虑药物为地西泮等苯二氮卓类药物(benzodizepines, BDZs)[24], 与相应受体结合并通过GABA受体发挥作用, 具有起效快和安全性好的优点, 但易产生耐受性, 长期使用产生依赖性, 可能产生神经运动功能障碍及记忆和辨认功能障碍等不良反应; 第三代抗焦虑药物为螺酮类药物, 如丁螺环酮等, 通过选择性激动突触后膜的5-HT1A受体抑制亢进的5-羟色胺能神经活动, 使5-HT与突触后膜的5-HT1A和5-HT2A受体的结合恢复平衡状态, 从而发挥抗焦虑作用[24], 但其起效时间相对缓慢而且耐受程度不一[25]。此外, 由于抗抑郁药具有抗抑郁和抗焦虑的双重作用, 也被广泛应用于临床抗焦虑治疗, 包括单胺氧化酶抑制剂、可逆性单胺氧化酶A抑制剂、选择性5-HT重摄取抑制剂(SSRI)、5-HT和去甲肾上腺素重摄取抑制剂(SNRIs)、去甲肾上腺素及特异性5-HT能抗抑郁药、三环类和杂环类抗抑郁药和其他抗抑郁药如安非他酮、米氮平等。此外, 抗癫痫药、非典型抗精神病药以及肾上腺素β受体阻滞药等其他药物, 也有在临床抗焦虑治疗中的应用[25]。但是这些药物均存在一定的不良反应, 急需开发不良反应小的新型抗焦虑药物以满足临床需求。SSRI和SNRIs由于不良反应较小, 目前已成为临床用药首选[23, 26]。
抗焦虑药物的研发历史较早, 基于焦虑障碍的发病机制已经建立了大量的动物模型。鉴于抗焦虑药物评价的动物模型数量庞大, 种类繁多, 不合适的动物模型与不完善的试验方案可能导致临床转化困难。本综述结合了近年来国内外焦虑动物模型的研发进展, 归纳了不同类型的焦虑动物模型和药效评价指标, 以期建立起严格规范化的抗焦虑药物的非临床药效学评价体系, 提高临床转化的成功率。
1 焦虑障碍动物模型及评价指标已报道的焦虑动物模型中有些既可以建立焦虑模型, 也可以用来测量焦虑情绪的水平(即作为评价指标), 而有些只能建立焦虑模型, 需要使用上述模型进行焦虑水平的评价。现将其分类综述如下。
1.1 可测量焦虑情绪水平的动物模型 1.1.1 非条件化焦虑模型非条件化焦虑模型基于动物对无明确疼痛或不适的压力或刺激的自然或自发反应[27]。这些模型也可以用来测量焦虑情绪的水平, 因此也可以称之为“实验(test)”。根据动物的行为方式, 可以分为行为性实验、社会行为实验、恐惧行为实验和其他行为实验4类。
1.1.1.1 行为性实验这一类模型基于啮齿动物天性中对新环境的探究习性和回避空旷、敞开的明亮空间的习性冲突建立, 也称为趋近-回避冲突模型[14], 典型行为学实验用仪器如图 1所示。
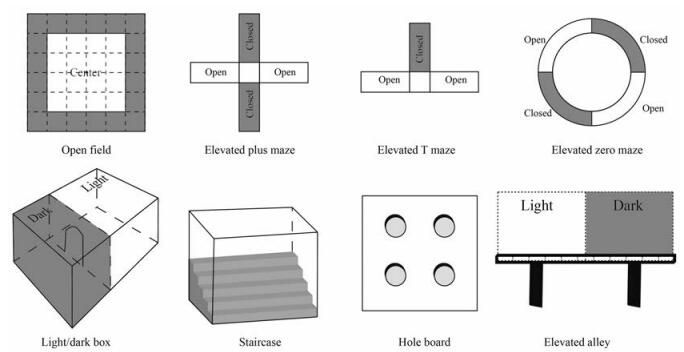
|
Figure 1 Typical ethological tests of unconditioned anxiety models |
由Hall在1934年首次建立, 是动物心理学中最常用的实验之一, 通过动物与群体的分离和对陌生空旷环境的恐惧冲突造成焦虑行为[28]。旷场饮水实验是旷场实验的变体, 通过动物对新异环境的恐惧和对中央区的饮水或进食等动机形成冲突状态[29]。小鼠常用28 cm×28 cm至55 cm×55 cm的正方形敞箱(底部划分为面积相等的若干方格)[30]; 大鼠使用正方形(100 cm×100 cm×50 cm[31], 底部划分为面积相等的若干方格) 或圆形敞箱(直径80 cm, 高30 cm, 中央区为直径35 cm的圆圈)[29]。敞箱上方照明或使用透明底下方照明, 也可使用红光照明[28]。旷场饮水实验在箱中央倒置悬挂一水瓶, 瓶嘴离地面10 cm[29]。动物按设计给药一定时间后置于中央区, 令其在敞箱中自由活动一定时间(通常为5~10 min), 由顶部摄像机捕捉动物的活动, 统计动物总活动次数、进入中央区的次数和停留时间, 抗焦虑药物在不改变总运动和探索行为的前提下增加动物在中央区的活动和停留时间。对旷场饮水实验, 前3天大鼠限制饮水, 每天仅15∶00~16∶00给予饮水1 h, 同样给药后置于中央区, 自由活动5~10 min观察动物开始饮水的潜伏期、饮水时间、靠近水瓶的次数、站立数、排便和排尿次数等指标, 低焦虑水平的动物具有较长的中央区域的饮水时间。
1.1.1.1.2 高架十字迷宫实验高架十字迷宫实验是最常用的焦虑动物模型[32], 由于开臂和外界相通, 对动物来说具有新奇性的同时又具有一定威胁性, 因此高焦虑水平的动物会退缩到闭臂中, 低焦虑水平动物则在开臂停留更多的时间, 对开臂的探究次数也增多[19]。该模型对抗焦虑药和致焦虑药均敏感, 但仪器差异、实验过程和动物品系均可能影响结果的重现性[33]。装置由两个开臂和两个闭臂呈十字交叉状组成。大鼠迷宫开闭臂均长50 cm, 宽10 cm, 闭臂高30~40 cm, 交叉区域形成长宽均为10 cm的中间平台, 装置离地面50 cm[29, 34]。小鼠迷宫开闭臂均长30 cm, 宽5 cm, 闭臂高15.25 cm, 中央平台长宽均为5 cm, 装置离地面40 cm[34]。实验开始前, 动物按设计给药一定时间后在敞口动物盒内任其自由活动5 min, 立即置于高架十字迷宫的中央平台处, 头朝固定的某一开臂, 用摄像头记录5 min动物的活动轨迹。分别统计各组动物进入开臂、闭臂的次数和停留时间, 以及进入闭臂的潜伏期。同时计算进入开臂次数和时间占总入臂次数和时间的百分比, 进行统计分析。高焦虑水平的动物在开臂停留的次数和时间显著低于低焦虑水平的动物。
1.1.1.1.3 高架T迷宫实验T迷宫由高架十字迷宫改进而来[29, 35]。大鼠迷宫三臂各长50 cm, 宽12 cm, 离地50 cm。闭臂高40 cm, 与两个开臂垂直, 开臂两侧设有1 cm高的边缘防止跌落。小鼠迷宫结构相似, 臂长30 cm, 宽5 cm, 闭臂高15 cm, 开臂高1 cm, 离地38.5 cm[29, 35]。T迷宫可以通过不同实验程序分别评价抗焦虑和抗惊恐药物。回避反应实验(avoidance) 用于评价抗焦虑药物: 大鼠给药后一定时间放入迷宫闭臂, 面朝开臂, 记录其从放入迷宫到四足全部进入开臂的时间, 作为潜伏期基线; 取出该动物, 间隔30 s再次放入闭臂, 记录其四足全部进入开臂的时间为回避反应潜伏期1, 再次取出该动物并间隔30 s放入, 记录其四足全部进入开臂的时间为回避反应潜伏期2。小鼠实验与大鼠类似, 但放入检测的次数增加到5次, 即记录5个回避反应潜伏期[29, 35]。逃避反应实验(escape) 用于评价抗惊恐药物: 动物给药后一定时间放入开臂面朝固定的某一闭臂, 记录其从放入迷宫到四足全部进入闭臂的时间为逃避反应潜伏期。对比组间动物反应潜伏期, 抗焦虑药物可以缩短回避反应的潜伏期, 抗惊恐药物可以延长逃避反应潜伏期[29]。
1.1.1.1.4 圆形迷宫/O迷宫实验O迷宫是在高架十字迷宫基础上的改进, 由一个环形区域构成, 四等分交替分为开臂和闭臂, 以避免动物停留于中心区既不属于开臂也不属于闭臂的现象[36]。大鼠O迷宫为黑色硬质塑料制成的内直径105 cm的圆环迷宫, 跑道宽10 cm, 等分为四份, 闭臂两侧设有高27~40 cm的侧壁, 开臂两侧高1 cm, 防止动物掉落[29]。小鼠O迷宫与大鼠O迷宫类似, 内直径30 cm, 跑道宽5 cm[37]。实验方法和评价指标同高架十字迷宫实验, 但动物放置于O迷宫的开闭臂交界处, 头朝固定的某一开臂。
1.1.1.1.5 明暗箱实验由Crawley[38]利用动物对明亮地方具有天然的厌恶和好奇倾向建立。明暗箱尺寸为44 cm×21 cm×21 cm, 暗箱占1/3, 顶部加盖避光, 明箱占2/3, 顶部亮光照明。两箱之间的隔板底部有一个12 cm×5 cm或7.5 cm×7.5 cm的门洞供动物穿过[29, 30]。动物给药后一段时间, 在敞口动物盒中自由探究10 min后将其立即置于明箱中央, 背对洞口, 记录5~10 min内动物的活动行为[29]。统计动物进入暗箱的潜伏期, 穿箱次数, 在明暗箱的滞留时间, 进入明箱次数和时间占总次数和停留时间的百分比。高焦虑水平的动物的潜伏期、进入明箱次数和时间显著低于低焦虑水平的动物。
1.1.1.1.6 爬梯实验[29]基于啮齿类动物进入新异环境时通常感到紧张不安, 表现为警觉和活动增加建立。实验使用有机玻璃箱, 长45 cm、宽10 cm, 一端高12.5 cm、另一端高25 cm, 箱内有5级高2.5 cm、宽10 cm的相同楼梯, 保证动物在楼梯内都有相同的站立条件。实验时环境安静、光线恒定, 将小鼠置于箱的底部, 使其背朝楼梯, 记录3 min内小鼠在楼梯上站立数(两前肢完全脱离地面计为一次) 和攀爬上阶梯的级数(四肢都停留在阶梯上才算为一级, 忽略下阶梯的级数)。以动物的爬梯数作为评价动物探究行为或活动性的指标, 而站立数则作为动物焦虑状态的参数。抗焦虑药物在不减少爬梯数的同时使站立数减少。
1.1.1.1.7 孔板实验该实验由Boissier等[39]于1962年首次建立, 动物的反复钻头行为反映了动物的新奇感与逃避的冲突行为。小鼠实验箱为40 cm×40 cm×27 cm的敞箱, 盒底均匀分布有4个直径为3.0 cm的圆孔, 每个孔内壁光滑, 孔中心距离邻近的两个壁的距离为10 cm; 大鼠实验箱为66 cm×56 cm×47 cm, 圆孔直径为3.8 cm[29]。实验时将给药后的动物单独放置于实验箱孔板中央, 记录5 min内的活动行为, 包括钻头次数和时间(以动物把头部伸入孔中直到双肩低于板平面时为一次; 在一个圆孔探究一次后, 不离开该圆孔而继续探究该孔的次数不计入, 离开该孔后重新回来探究, 算作另一次) 和自主活动(动物在实验箱内水平活动的时间)。抗焦虑药物在不影响动物自主活动的同时, 增加钻头次数和时间[29, 40]。
1.1.1.1.8 高架小径实验(Suok实验)[41]由Kalueff等[41]在2005年基于经典的趋近-回避理论建立, 动物在高架平衡木上活动同时受到高度(同时被保持平衡加强) 和新环境的威胁, 表现出对压力敏感的自发探究活动和平衡能力的变化。小鼠使用长2~3 m, 直径2~3 cm, 离地20 cm的光滑铝管或铝棒, 正中20 cm区域为中央区; 大鼠使用240 cm×5 cm×1 cm的铝制“小径”或直径5 cm的裹有海绵的金属/塑料棒, 离地20 cm, 正中30 cm区域为中央区。常规Suok实验在普通照明条件下进行; 明暗Suok实验在暗室中进行, 在一半装置上方50 cm处悬挂4~6个45~60 W灯泡。动物在给药一定时间后至于中央区自由活动5~10 min, 由摄像机捕捉动物的行为。记录动物的水平探索(离开中央区, 跨越分区, 移动距离和时间, 不动时间等)、垂直探索(直立, 靠墙行为)、定向探索(钻头, 侧视)、风险评价行为(伸展姿势) 和植物性神经反应(排便潜伏期, 粪便数量, 排尿点)。在常规Suok实验中, 焦虑动物的探索活动减少, 在明暗Suok实验中, 焦虑动物进入明亮区域的时间和在明亮区域内移动的距离均减少。
1.1.1.2 社会行为实验社会行为模型基于动物的社会活动行为建立[14]。天敌暴露、社会隔离和母爱剥夺模型也属于社会行为模型, 但因不能评价焦虑水平, 将在“1.2仅建立焦虑反应的模型”中进行介绍。
1.1.1.2.1 群居接触实验[29]本方法为1970年代末期File和Hyde[42]建立, 基于孤养大鼠在陌生的环境相互表现出渴望接触的动机, 但又对陌生环境和强光条件产生恐惧形成的矛盾冲突状态, 表现为正常的主动接触行为受到抑制。一般采用雄性大鼠单笼饲养7日以上, 实验时按体重随机编成成对小组(体重一般相差不超过15 g), 给药后放回原笼。动物彼此不熟悉条件下, 将配对两只大鼠对角同时放入60 cm×60 cm×35 cm的敝箱。分别测定10 min内配对大鼠在强光(350流明左右) 和弱光(30流明左右) 下的主动接触累积时间(s), 主动接触包括: 嗅、舔、追尾、抓、咬、踢、打等行为动作, 而被动的依靠则不计入在内。实验后将大鼠单个放在箱内, 使之在自然光的条件下每天熟悉实验箱10 min, 连续2天。接下来进行强光和弱光熟悉实验, 观察时间和指标与第一阶段相同。未经药物处理的大鼠, 其主动接触时间在弱光熟悉多于强光不熟悉, 而强光熟悉与弱光不熟悉则介于两者之间。不同类型的抗焦虑药物在此模型上的表现不完全相同。如: BDZ类药物增加强光或不熟悉环境下大鼠的主动接触时间, 而在弱光熟悉条件下的作用极小; 巴比妥类药物则在4种条件下都使主动接触增多。
1.1.1.2.2 分离诱导超声波实验啮齿类动物可以发出并探测超声波用于交流, 其频率与动物的情绪相关[43]。幼年大鼠出生后前14天内, 在与母亲、同巢幼崽或巢穴分离时会发出超声波, 该反应在幼崽出生6~12天内最强[29], 可作为焦虑模型用于抗焦虑药物评价[44]。实验使用出生后9~11天的幼鼠, 保持室温25 ± 1 ℃。实验前与母鼠正常合养, 实验当天, 幼鼠腹腔给药后放回原笼, 按设计在一定时间后依次取出幼鼠, 放入隔音箱内的20 cm×20 cm×17 cm有机玻璃箱或铺有滤纸的500 mL烧杯中并关闭隔音箱, 记录5 min内幼鼠发出20~60 kHz之间超声波的发声次数, 超声记录结束后记录动物的直肠温度[29, 44]。抗焦虑药物在不影响动物直肠温度的前提下减少动物的发声次数[29, 44]。
1.1.1.2.3 期待性焦虑实验基于实验动物在应激下体温升高的现象建立, 该现象也在人类存在[45]。当群居小鼠被从笼中依次取出时, 最后一只小鼠出现直肠温度升高的现象, 是动物对反感事件的期待性焦虑造成, 可以被提前给予的抗焦虑药物抑制[29, 46]。雄性小鼠在实验环境中适应饲养至少7天以后随机分组, 每笼18~20只, 按设计给药一定时间后, 逐一取出小鼠测温。只记录前3只和最后3只的体温。探头伸入的长度和停留的时间保持一致[29, 46]。计算后3只和前3只动物的体温平均值之差作为体温的升高值。空白对照的升高值一般为1.1~1.3 ℃。实验结果用多因素方差分析和Tukey's test[29, 45, 46]。
1.1.1.3 恐惧行为实验 1.1.1.3.1 僵住行为实验基于啮齿类动物在遭受厌恶刺激时会产生僵住的防御性行为建立[29]。实验使用动物操作箱, 底部金属栅栏, 带有电击控制器[29, 47]。雄性大鼠给药后适当时间单独放入操作箱内任其自由探究2 min。然后给予0.5 mA、0.5 s电击, 2~2.5 min后再次电击, 进行观察, 记录动物的僵住时间、小范围探究活动时间(仅躯体和前肢活动)、活动时间(后肢活动、理毛、站立) 和站立次数[29, 47]。
1.1.1.3.2 听觉惊跳反应实验突然的声音刺激会引起哺乳动物的惊吓反应[29]。惊跳反应系统包括小笼(大鼠8 cm×8 cm×16 cm[29], 可以限制其活动但不致束缚)、扬声器和压力感受器, 置于隔音箱中。动物置于小笼内适应50分贝(dB) 白噪声5 min, 实验噪声为98或124 dB, 持续20 ms, 并测定动物200 ms内压力变化, 各噪声随机重复12次, 间隔20~40 s (同样随机), 给药后再次以上述程序随机测定[29]。每次刺激后200 ms内最大重量变化为惊恐峰值, 每个刺激的12个峰值取均值。动物给药前作为对照, 结果以给药后的均值占给药前均值的百分比表示[29]。
1.1.1.4 其他行为模型 1.1.1.4.1 新奇抑制摄食实验1988年由Bodnoff等[48]基于动物的吞噬行为建立, 禁食动物在新环境里会产生类似焦虑的冲突反应[14, 29]。大鼠使用76 cm×76 cm×46 cm[29]至100 cm×100 cm×40 cm[49]的敞箱, 底部铺有一层锯末(每只动物更换), 中央区摆有30个同样大小的食丸或一定重量的食物, 中央区有强光照明[49]。小鼠使用较小的敞箱(如50 cm×50 cm×20 cm) 和较少的食物[29, 50]。使用雄性动物, 测试前给药一至多次, 实验前动物禁食48 h后头朝外放入敞箱并开始计时, 直到动物开始咀嚼食物而不是摆弄食物, 记为摄食的潜伏期[49], 记录5~10 min内动物的摄食量[49]。以摄食潜伏期和摄食量判断药物的抗焦虑作用, 抗焦虑药物使动物的摄食潜伏期缩短, 摄食量增加[49]。
1.1.1.4.2 咬木塞实验本模型基于啮齿动物的啃咬习性, 由Pollard和Howard[51]于1991年首次报道。该方法对丁螺环酮类药物敏感, 因此有独到的价值[29, 46, 51]。实验使用底部带金属丝网的不锈钢笼具, 大小为17 cm×18 cm×24 cm; 11号软木塞, 重2~3 g[29, 51]。实验使用雄性大鼠, 每天上午单独与一个软木塞放入笼具训练30 min, 每周训练5天, 训练30次至软木塞丢失量(精确至0.01 g) 稳定后开始给药实验, 记录给药前数日的丢失量和给药后的实验日丢失量[29, 51], 以给药前数日的丢失量均值为基线, 与给药后的实验日丢失量比较进行计算[29, 51]。
1.1.2 条件化焦虑模型条件化焦虑模型考察动物对条件化(且往往是疼痛, 例如电击) 刺激的焦虑行为反应[27]。典型的条件化模型使用的仪器如下图 2所示。
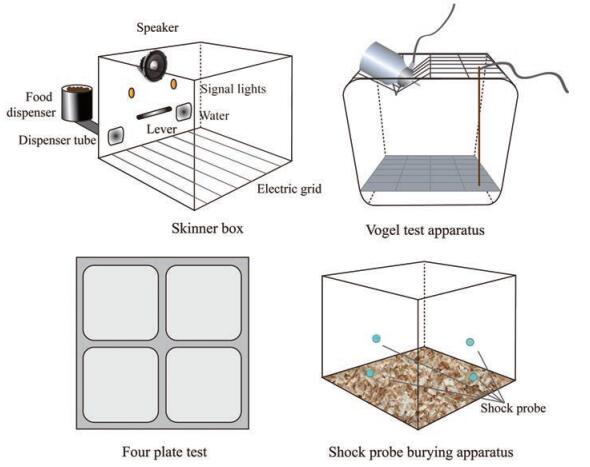
|
Figure 2 Typical apparatus for conditioned response models |
操作条件冲突实验指包含学习/惩罚反应的焦虑动物模型[52], 通常使用斯金纳箱, 也称条件操作箱(图 2)[53], 尺寸一般为30 cm×22 cm×27 cm, 放在隔音箱中, 箱中有通风和摄像头。底部为与电刺激器相连的不锈钢栅栏, 上方照明, 一侧装有1只扬声器和2个刺激灯, 其下方5 cm处各有1个不锈钢水平压杆用于动物获得食丸[29]。
1.1.2.1.1 Geller-Seifter冲突实验[29]由Geller和Seifter[54]建立, 通过给饥饿大鼠食物奖赏的同时给予电击刺激, 使大鼠处于矛盾冲突状态。实验使用连接微机的斯金纳箱, 选用健康雄性大鼠, 体重250~300 g。首先, 设置程序训练大鼠, 经典Geller-Seifter程序由变动间期(variable interval, VI) 和固定比率(fixed ratio, FR) 两部分组成。先对大鼠进行VI-2 min训练, 每日训练大鼠至平均每2 min的间隔获得一次食丸; 之后变为FRl, 即在VI内的每个15 min内给予3 min的声刺激。大约再过7个训练间期(7天), 在声刺激同时给予电击(电击强度为0.6~0.85 mA), 即在声音出现时每次压杆产生一次强化和一次电击。程序可缩写为“组合VI-2 min (食) + FR1 (食+电击)”, FR1称为冲突部分。分别记录FR和Ⅵ期动物压杆数。抗焦虑药物增加FR期压杆次数, 而不影响Ⅵ期反应; Ⅵ期压杆反应次数的降低可能与药物的镇静作用有关。在此基础上调整时间和刺激等条件, 发展出Davidson-Cook、Pollard-Howard和Kennett-Pittaway-Blackburn等训练程序, 可参见相关文献[29], 本文不一一详述。
1.1.2.1.2 安全信号撤除实验[29]此实验基于在经过训练、与安全信号建立了条件反射的大鼠, 在安全信号消失后会产生焦虑的原理建立。实验分训练和实验两个阶段。训练阶段大鼠禁食24 h, 每天训练18 min, 约12天内学会从FR1到FR8的压杆强化操作(参见1.1.2.1.1和文献[29]), 期间保持右灯亮(安全信号), 压右杆给予食丸, 压左杆无反应。12天后在第4 min和第11 min分别加入4 min的电击惩罚期, 期间左灯亮(惩罚信号), 压右杆给予食物强化同时按50%的随机比率给予不超过9次的电击, 并逐渐增加强度至每只大鼠产生类似的反应抑制(0.5~1.5 mA), 记录大鼠获得的食丸数和电击数。大约20个训练间期后所有大鼠都表现出稳定的非惩罚和惩罚反应速率, 此时开始药物实验。实验间期共11 min, 1段(4 min) 和3段(3 min) 为FR8非惩罚期, 右灯亮(安全信号); 2段(4 min) 左右灯均关闭(安全信号撤除), 室灯亮, 按FRl给予强化但不加电击, 记录各段动物的压杆强化数。抗焦虑药在不增加1、3段强化数的剂量下增加2段的强化数。
1.1.2.1.3 戊四氮鉴别刺激实验五甲烯四氮唑, 即戊四氮(pentylenetetrazol, PTZ) 是一种GABA受体拮抗剂和致焦虑剂, 广泛应用于动物焦虑模型的建立。本模型通过固定比率食物强化程序使动物对PTZ和某个特定的条件(如正确压杆或钻洞) 建立条件反射, 并不断强化, 形成PTZ辨别, 抗焦虑药物可以使动物PTZ判别正确率下降[46, 55]。实验装置为斯金纳箱或钻洞触鼻训练箱[46, 55]。雄性大鼠单笼饲养, 禁食至体重下降20%并保持控制食物使体重维持在这一水平, 开始进行压杆奖赏实验, 给予戊四氮20 mg·kg-1后, 动物压A杆有食丸奖赏, B杆不给奖赏; 注射生理盐水则反之。每天进行一次5 min训练, 随机给予戊四氮或生理盐水, 但连续给同一刺激不超过2次; 最终使动物能够完成连续8次的正确辨认(所注射的是生理盐水或是戊四氮), 进入测试阶段。给药后每2天进入训练箱1次, 当天提前1 h给予受试药物或溶剂对照, 之后腹腔注射戊四氮或生理盐水, 观察动物的压杆行为[46, 55]。记录测试阶段动物压杆的正确和错误行为次数, 给予抗焦虑药物的动物压错杆才记为正确行为, 连续4次正确行为可以认为受试药物具有抗焦虑活性。每只动物统计是否体现抗焦虑活性, 得出百分比并用χ2检验比较组间差异[46, 55]。
1.1.2.2 Vogel饮水冲突实验[29]由Vogel等[56]于1971年建立的非操作条件冲突实验, 主要利用禁水动物饮水时受到电击的恐惧形成矛盾状态, 抗焦虑药物会使惩罚期舔水次数增多。实验箱为45 cm×24 cm×21 cm的有机玻璃箱, 底部为不锈钢栅栏, 顶部为不锈钢网盖, 插入绝缘的带有不锈钢嘴的水瓶, 水瓶和底部栅栏一起通过导线与刺激-记录仪相连。实验分两阶段进行。第一阶段为训练期, 动物禁水24 h后被单独置于操作箱, 直到发现瓶嘴并开始舔水, 计数器自动记录其在3 min内的舔水次数, 对舔水少于300次的动物予以淘汰; 第二阶段为惩罚期, 将未被淘汰的动物继续禁水24 h后给药, 再次单独置于操作箱, 动物舔水20次起仪器自动开始计时并给予一次电击(舔水与电击次数之比为20∶1), 电击强度一般为0.2~0.5 mA, 持续2 s, 但动物可通过脱离瓶嘴来解除电击。记录3 min动物的舔水次数和电击次数。也可以通过多次饮水电击造成焦虑模型。
1.1.2.3 电击探头埋藏实验也称为条件性防御掩埋模型, 基于动物对恐惧刺激产生的防御反应建立, 该反应不需要训练, 经历一次电击即可出现[29]。一些神经松弛剂也表现出阳性效果, 但抗焦虑药物仅在低电流时有效, 神经松弛剂在电流较高(如10 mA) 时仍有效[46]。实验使用40 cm×40 cm×30 cm有机玻璃盒, 底部均匀覆盖5 cm厚垫料。四壁安装有4个电击探头(长6.5 cm, 直径0.5 cm), 均高于垫料2 cm, 电流设为1~2 mA, 盒上方连接摄像头用于观察[29, 57]。实验前, 每天将大鼠5~6只为一组放入实验盒适应30 min, 共适应4天。实验当日给药后适当时间, 大鼠单独放入实验箱中央, 背对电击探头, 待动物第一次接触探头被电击后开始计时15 min, 探头保持充电[29, 57]。记录大鼠被电击后15 min内掩埋动作的持续时间、电击的总次数、动物的不动时间(定义为大鼠除了呼吸外身体完全不动) 和电击反应行为评分。评分标准为: 1分=只有头或前爪退缩, 2分=全身退缩, 包括/不包括缓慢远离探头, 3分=全身退缩及立即远离探头, 包括/不包括跳跃, 4分=全身退缩和跳跃(四爪离地) 并立即逃向实验箱对侧[29, 57]。
1.1.2.4 小鼠四板实验[29]四板实验以被动回避为基础, 小鼠渴望探究, 但又因害怕足部电击而使探究活动受到抑制, 抗焦虑剂可缓解或解除这种抑制状态, 使小鼠电击次数增多。实验使用25 cm×18 cm×16 cm的长方形箱, 底部有4块8 cm×11 cm的金属板, 各板间均有4 mm宽的间隙, 均与电刺激器相连, 电流强度为0.2~0.8 mA, 处于对角线的2块板同极, 使小鼠每当跨越上下或左右金属板时受到一次电击。给药后一定时间将小鼠置于板上, 让其探究15 s后打开电刺激器。当小鼠受到电刺激时产生明显的逃避反应, 通常穿过2块到3块板便会停下, 计为1次。如小鼠继续移动, 3 min内不予电击; 如小鼠不停移动则予以淘汰。记录10 min内每分钟的电击数。
1.1.2.5 应激诱导超声波啮齿动物在面对厌恶事件, 如电击、与同窝幼仔分离、固定尾部和冷板等时发出超声波, 这一反应不会被止痛类药物抑制, 可以用于抗焦虑药物的评价[58, 59]。与分离发声实验不同, 电击等应激条件下的超声发声实验属于条件化焦虑模型[58]。实验使用连接有超声测量仪器的隔音箱。使用200 g左右的青年雄性Wistar大鼠, 适应环境饲养7天以上。在训练期, 每只大鼠每天单独放置于隔音箱中接受电击或天敌暴露、社交失败、声音惊吓和慢性温和应激等刺激[59, 60], 经过一段时间的训练(如电击5天), 最后一次应激后立即记录超声波5 min。连续两天发出超过150 s超声波的动物为造模成功, 可用于后续的药效评价[58]。统计动物发出超声波的时长(s) 和平均发声水平(以测试期间的超声信号平均值表示), 抗焦虑药物能够剂量依赖地减少超声波时长和平均发声水平[58, 59]。
1.1.2.6 其他条件性焦虑实验其他条件性焦虑模型包括条件恐惧实验和条件味觉厌恶等。条件恐惧实验基于巴普罗夫的条件反射建立, 如条件性情绪反应[61], 将较弱刺激通过训练与厌恶刺激建立条件反射, 在没有刺激的情况下测量动物的行为, 以评价其焦虑或恐惧的强度[62]; 恐惧增强惊跳实验因不测量对焦虑或恐惧的抑制状态[62], 而是考察对象对训练场景的惊跳反射变化, 目前在PTSD研究中较为常用[63]。条件性味觉厌恶是味觉刺激与不适内脏刺激导致的厌恶情绪之间的条件反应[64], 抗焦虑药物可以对抗通过训练建立起的条件厌恶反应[65]。这两类实验目前在焦虑药物的临床前评价中应用较少, 本文不再详述。
1.2 仅建立焦虑反应的模型此类型模型只建立焦虑反应, 焦虑水平可通过“1.1可测量焦虑情绪水平的动物模型”中的方法进行评价。
1.2.1 应激焦虑模型应激是焦虑相关障碍的诱发因素, 也是目前造成抑郁等各种精神障碍的主要因素之一[66]。通过各种应激条件刺激动物可以模拟人类在应激下的焦虑反应, 相关模型包括不同的压力源(包括躯体应激和社会心理应激)、不同的应激时间(单次或慢性多次应激)、单一压力源多次应激或不同压力源多次应激等[66]。
1.2.1.1 躯体应激躯体应激通过对机体结构和/或功能完整性的破坏而刺激中枢神经产生焦虑反应[67]。强迫游泳等无法逃避的应激条件更适用于造成抑郁模型, 不在此详述。
1.2.1.1.1 足部电击使用具有电击控制器不锈钢栅栏的实验箱, 可参考僵住实验等实验的电击条件, 如大鼠电击0.5 mA、0.5 s[29]。
1.2.1.1.2 束缚/固定应激大鼠可使用适当大小的矿泉水瓶, 小鼠则可以使用50 mL离心管, 并在鼠头位置开洞制成通气良好的塑料束缚管, 将动物置于束缚管中, 尽量避免生理性压迫和疼痛的发生, 大鼠每次束缚时间一般为每天120~180 min, 小鼠则可延长至8 h。固定应激使用胶带将动物四肢用胶带固定, 头部用金属环限制活动[52]。急性应激可在1~2天内造成焦虑模型, 慢性模型则需要7~21天[52, 68]。
1.2.1.1.3 低温诱导应激[52]体温变化会激活机体的温度调节中心, 并随后激活HPA轴从而诱发应激反应。将动物放于15~18 ℃的冷水中15~30 min, 或在4 ℃环境中放置15~30 min, 可进行急性单次应激或慢性应激(7~14天)。
1.2.1.1.4 噪音应激噪音作为环境中的压力源可以导致睡眠障碍、焦虑、抑郁等精神障碍以及高血压、心律不齐等一系列不良反应[52, 69]。将15 W扬声器置于动物笼具上方30 cm处, 连接0~26 kHz白噪音生成器[52], 给予动物100 dB或以上的噪音。单次刺激4 h可造成急性应激, 每日4 h刺激, 持续14天可以造成慢性应激[52]。
1.2.1.1.5 慢性温和不可预期应激慢性温和不可预期应激, 又称慢性温和应激、慢性不可预期应激或慢性可变应激[66], 慢性应激反应和不可预测性增加的不确定性可以造成动物的焦虑和抑郁样反应, 引发皮质酮分泌、HPA轴功能异常和氧化应激等一系列反应[17]。实验使用雄性大鼠孤养, 每日随机选取一种刺激, 连续两天内刺激方法不重复, 包括整晚光照、禁食、笼具倾斜、低温、强迫游泳、束缚、高架、振动等, 持续3~4周[17, 66]。
1.2.1.1.6 皮质酮诱导的焦虑模型动物躯体应激后激活HPA轴, 刺激糖皮质激素等激素分泌并诱导动物的焦虑行为[70]。通过注射啮齿类动物最主要的糖皮质激素——皮质酮, 同样可以影响杏仁核神经元并诱导焦虑行为。雄性Wistar大鼠单次注射10 mg·kg-1皮质酮12天可造成急性焦虑模型[71]; 雄性大鼠每天束缚4 h后皮下注射皮质酮30 mg·kg-1持续21天[72]可造成慢性焦虑和抑郁样模型[73]; 雄性CL级中缅树鼩(130~150 g) 皮下注射皮质酮(27 mg·kg-1), 持续21天也可造成慢性焦虑模型[74]。
1.2.1.2 心理应激心理应激模型基于动物存在与人类相似的情绪、心理冲突等反应, 通过施加一些心理应激因素建立[67]。
1.2.1.2.1 天敌暴露基于啮齿类动物在遇到天敌时的四处逃窜、动作僵硬、蹲伏、不自主排泄等焦虑行为而建立[75]。将大鼠与猫同时放入有阻挡的铁丝笼中, 每次时间持续45 min, 大鼠可通过视觉、嗅觉、听觉体验到天敌的存在但不会受到直接攻击。同时每天让猫仅进食30 g小鼠1只, 使处于饥饿状态, 以维持其攻击性[75]。
1.2.1.2.2 社会隔离啮齿类动物的社会隔离可以诱导动物的神经化学和神经内分泌功能变化和抑郁/焦虑样行为, 建立焦虑和抑郁模型[76]。该模型在群居的大小鼠雌雄动物上均可成功建立、但不适于大仓鼠等独居动物[77]。早期社会隔离模型一般采取离乳大鼠(3周左右) 单笼饲养至成年[78]; 成年社会隔离模型则采取单笼饲养4~10周造模[76, 77, 79]。
1.2.1.2.3 昼夜节律变化[52]昼夜节律由松果体分泌褪黑素调节, 光照节律变化同时涉及躯体和心理两个方面, 啮齿动物接受不可预期光照变化后表现出急性应激反应, 可通过昼夜颠倒光照, 或在正常的昼夜光照循环中增加数个黑暗时段建立。但由于动物能够适应长期的节律改变, 该应激只适用于急性模型。
1.2.1.2.4 不确定性空瓶饮水应激空瓶饮水刺激模型是一种慢性心理应激模型, 通过2周左右应激可以诱导动物的焦虑反应和肾上腺素、去甲肾上腺素及皮质酮的升高[3, 19, 80]。大鼠或小鼠均对此应激敏感。应激动物单笼饲养, 先进行7天饮水训练, 每天早晚各10 min定时给水, 两次饮水间隔12 h, 其余时间撤去水瓶。训练后开始2周应激, 每天的饮水时间段内, 随机选取1~2个时间段给予空瓶刺激, 共饮水12次, 空瓶16次[68, 81]。
1.2.1.2.5 慢性社会挫败应激基于雄性动物之间的社会从属关系建立, 通过长期暴露于处于主导的“居留者”动物造成应激, 动物表现出社交回避、焦虑、抑郁、多动等多种行为学变化和持续的HPA轴激活效应[82, 83]。实验采取“居留者-入侵者”模式建立, 入侵者体重小于居留者, 事先筛选去除攻击性不足(5 min内无攻击行为) 或过强(导致入侵者躯体损伤) 的居留动物。小鼠模型使用7~8周C57BL/6J雄性小鼠作为入侵者, 使用退役雄性CD-1种鼠单笼饲养作为居留者, 将C57BL/6J小鼠放入CD-1小鼠饲养箱中进行直接或隔网接触5~10 min, 每天接触一次, 共接触10天[83]。大鼠模型可采用雄性Long-Evans或Lister Hooded大鼠作为居留者, 雄性Wistar或SD大鼠作为入侵者, 隔网接触时间延长至每天1 h, 共接触5周[84, 85]。
1.2.1.3 发育模型 1.2.1.3.1 产后应激啮齿动物产后早期的应激经历会导致其终生应激反应, 也会造成成年动物HPA轴的过度活化, 与人类的童年创伤导致成年后的焦虑、抑郁等精神障碍相似[66]。幼仔从出生后早期(3~4天) 与母亲分离一段时间可造成急性应激, 可通过超声波(1.1.1.2.2) 进行评价; 出生后2~9天仅给带仔母鼠极少垫料和纸巾, 可以造成母鼠对幼仔护理的不稳定和碎片化的慢性模型[66]。
1.2.1.3.2 产前应激孕期应激造成子代HPA轴功能和行为的异常, 包括童年和成年期易怒, 睡眠和饮食障碍及较高水平的情绪问题[66]。通过对动物整个孕期进行慢性温和应激[86], 或在孕期最后一周每日对动物进行束缚或电击1~3次可以建立产前应激模型。孕期感染造成的固有免疫激活模型也同样可以在子代造成焦虑样行为[66]。
1.2.2 药物诱导的焦虑模型药物诱导的焦虑模型基于临床发现的致焦虑药物建立, 通常用于焦虑的神经生物学研究, 也被用于抗焦虑药物的评价[22]。
1.2.2.1 1-(3-氯苯基) 哌嗪单盐酸盐(间氯苯哌嗪, meta-chlorophenylpiperazine, mCPP) 诱导的焦虑模型mCPP最早在临床上发现可致焦虑, 并可以导致动物脑内5-HT系统的变化[22], 研究表明mCPP是5-HT受体激动剂, 对5-HT1B和5-HT2C等均有激动作用[87]。通过雄性大鼠或小鼠适应饲养后按2 mg·kg-1皮下注射mCPP建立模型, 30 min后使用明暗箱测试其焦虑行为[46, 88]。
1.2.2.2 其他药物诱导的焦虑模型除了上述药物以外, 以往的研究表明肾上腺素能药物(如肾上腺素、去甲肾上腺素、育亨宾等)、拟胆碱药(如槟榔碱)[22]、GABA受体激动剂[89]、胆囊收缩素、二氧化碳、乳酸钠、咖啡因和氟马西尼等[22]可以诱导焦虑模型的建立, 成瘾药物的戒断也同样可以造成动物的焦虑模型, 但这些模型均多用于药物作用机制的研究, 并不常见于药效学评价, 因此不在此详述。
1.2.2.3 药物诱导的惊厥模型[46]由于苯二氮卓类抗焦虑药物通过增强抑制性神经递质GABA和甘氨酸发挥抗焦虑作用, 通过阻断GABA能或者甘氨酸能神经传递诱导的动物惊厥模型也可以用于抗焦虑药物的筛选。常用的诱导惊厥的药物包括士的宁、印防己毒素、戊四氮、异烟肼和育亨宾等, 通常以动物出现惊厥的时间(潜伏期)、第一次达到V级发作的潜伏期、发作例数、一定时间内的死亡数和时间等作为评价指标。
1.2.3 遗传动物模型在探究焦虑障碍的病因、神经生物学和新药研发方面, 遗传动物模型是一种独特而全面的工具[90]。目前已建立了多种焦虑或焦虑样转基因动物和基因敲除动物, 用于对药物的药效评价及作用机制研究。已经报道的焦虑动物遗传模型主要基于5-HT系统、GABA系统、HPA轴等与发病机制密切相关的基因建立。鉴于焦虑与抑郁在发病机制中的相关性, 这些转基因动物模型往往也可以应用于抑郁研究。
1.2.3.1 单胺神经递质系统相关遗传动物模型单胺类神经递质如5-HT、去甲肾上腺素(norepinephrine, NE) 和多巴胺等对中枢神经系统的调节起重要作用, 并与焦虑等情绪障碍的发生有密切关系。已经建立了一系列与5-HT分泌、转运和受体相关的动物模型, 包括5-HT受体(5-HT1A、5-HT1B、5-HT2C和5-HT5A) 5-HT转运体(SERT) 的空突变、敲除和杂合子动物, 一般用于SSRI等药物的作用机制研究[90]。其中5-HT1A敲除小鼠具有良好的表型, 是目前研究最广泛的焦虑相关敲除动物之一[91], SERT敲除大鼠[92]与小鼠[91]同样表现出焦虑样行为。值得注意的是, 同一基因不同遗传背景的动物可能表现出不同的焦虑水平和对抗焦虑药物的反应, 如C57BL6的5-HT1A敲除小鼠在旷场实验和EPM实验中的焦虑反应强于Swiss Webster和129 sv品系的敲除小鼠, Swiss Webster的5-HT1A敲除小鼠对地西泮不敏感[93]。在NE系统也建立了类似的转基因动物模型, 儿茶酚-O-甲基转移酶敲除小鼠表现出典型的雌雄差异, 仅雌性敲除小鼠在明暗箱实验中表现出焦虑样行为的增加; α2-肾上腺素能受体敲除小鼠中, Adra2a亚型敲除小鼠表现出对盐水注射的焦虑升高行为[91]。
1.2.3.2 GABA能相关基因小鼠模型GABA是中枢神经系统的抑制性神经递质, GABA能网络在焦虑症的发病机制和临床治疗中都发挥着重要作用[94]。GABA A受体亚单位GABAAγ2、GABAAα1和GABAAα2的敲除小鼠在BDZs的作用机制研究中发挥了重要作用[94]。参与GABA合成的谷氨酸脱羧酶GAD65的无效突变小鼠则出现杏仁核和海马体的过度兴奋以及焦虑样行为[95]。
1.2.3.3 HPA轴相关基因动物模型HPA轴主要通过激素水平调节动物在应激状态下的焦虑样行为[96], 促肾上腺皮质激素释放激素(corticotropin-releasing hormone, CRH) 在其中起重要作用, 因此相关转基因动物也可以用于建立焦虑动物模型。CRH受体2敲除小鼠表现出焦虑样行为[94], CRH结合蛋白(CRH-BP) 基因缺失的小鼠焦虑行为增多[91], 过表达CRH小鼠表现出焦虑样行为和运动功能障碍[97]。盐皮质激素受体敲除小鼠[98]与糖皮质激素受体过表达小鼠[99]也表现出焦虑行为的增强, 但一般均用于机制研究, 而不作为药效评价的模型使用。
1.2.3.4 其他基因动物模型除了以上与焦虑障碍发病机制相关的遗传动物模型以外, NPY敲除动物在惊跳实验中表现出焦虑反应的增强[100], 可作为NPY相关的焦虑动物模型。脑神经营养因子BDNF的Val66Met突变小鼠BDNFMet/Met表现出不能被氟西汀缓解的焦虑样行为[101]。SERT和BDNFMet/Met双转的雄性小鼠也表现出焦虑样行为的增加[102]。肾素-血管紧张素-醛固酮系统的遗传动物模型也有焦虑样行为的报道, 小鼠ren-2转基因大鼠TGR (mREN2) 27脑中血管紧张素Ⅱ升高, 焦虑行为增加[103], 表达血管紧张素原反义RNA的转基因大鼠TGR (ASrAOGEN) 680也表现出显著高于野生型大鼠的焦虑行为, 可能与血管紧张素原的低水平引发的5-HT系统功能紊乱相关[104]。
1.3 非人灵长类动物焦虑模型非人灵长类动物与人类系统发育相近, 且对诱发人类焦虑的条件产生相似的生理和行为反应, 这是啮齿类动物模型所不能比拟的。其中狨猴(Callithrix jacchus) 由于体型小、易圈养, 且不属濒危动物, 常用于非人灵长类动物焦虑模型的研究[105]。与啮齿类动物模型相似, 非人灵长类动物模型也包括条件化焦虑模型如冲突模型[105], 非条件化焦虑模型如旷场实验[106]、明暗箱[107]等行为性模型, 非自愿社会隔离、群居接触、人类威胁、天敌对抗等社会行为模型以及PTZ等药物诱导的焦虑模型等[105], 目前已经建立了超过30种非人灵长类焦虑模型, 但由于实验成本和操作等问题, 其应用仍受到一定限制[105]。
2 规范化抗焦虑药物非临床研究需要注意的问题 2.1 实验动物和品系的选择大鼠和小鼠是临床前焦虑研究中最常用的模型动物[90]。在药效学评价实验设计中, 首先应尽量同时考察药物在大小鼠的抗焦虑作用, 对于存在物种敏感差异的模型则仅选用敏感物种, 如大鼠对社会学行为较为敏感, 因此群居接触实验一般优先使用大鼠[29]。其次, 应考虑在同一物种内, 不同品系的动物对焦虑模型的敏感程度: 不同品系的大鼠和小鼠对同一模型的敏感度均存在一定差异; 如C57BL/6小鼠在慢性温和应激中表现出焦虑和抑郁样行为, 而ICR小鼠仅表现出抑郁样行为[108]; Wistar大鼠在群居接触实验中较SD大鼠更为敏感[109]。在基因敲除动物中, 不同品系动物的焦虑程度和对药物的敏感度也同样存在差异(详见1.2.3.1单胺神经递质系统相关遗传动物模型)。因此在抗焦虑药物非临床药效学评价的实验设计中, 首先应选择焦虑敏感的动物品系; 其次为增加动物遗传背景的复杂性, 优先选用远交系动物; 在此基础上, 应同时覆盖大小鼠, 并在条件允许下进行多品系比较, 以期获得更全面的药效学评价结果。
2.2 动物性别差异目前大多数动物模型都以雄性动物为主, 一般是出于简化实验条件的目的, 避免雌性动物激素周期等对行为反应的干扰[110]。但是, 焦虑行为中的性别差异是一个公认且被广泛报道的现象: 内分泌系统参与焦虑障碍的发病机制, 女性焦虑障碍的发病率显著高于男性, 并且经常在激素波动时, 包括青春期、经前、怀孕或产后以及更年期过渡时期加剧或加重[5]。因此, 仅使用雄性动物往往不能反映药物真正的药效学作用。近年来的研究表明, 基于行为学的焦虑模型在雌性动物上同样适用: 与雄性动物相比, 雌性动物在高架十字迷宫[110]、孔板实验[111]和旷场实验[112]中表现出更低的焦虑水平, 但在Vogel饮水冲突实验和天敌暴露等威胁中焦虑水平较高[112], 且受到发情周期、生殖周期和性腺激素等因素的影响[110]; 而在遗传动物模型中, 雌性动物往往表现出更高的焦虑水平, 例如雌性SERT KO大鼠对于焦虑和抑郁相关疾病的易感性高于雄性, 与临床结果一致[92]。因此在此类模型中, 将雌性动物和雄性动物分别统计可能是较好的研究方式。
对基于社会行为的焦虑模型, 涉及社会等级和从属关系的模型一般只在雄性动物中建立, 雌性动物之间很难建立起等级从属关系[19, 112], 因此在慢性社会挫败应激和拥挤等模型中只使用雄性动物; 与之相反, 雌性动物对社会隔离模型(孤养) 较雄鼠更为敏感[112]。此外, 已经基于雌性动物的生理机制建立了一些焦虑模型, 例如使用黄体酮和电击探头埋藏共同建立的雌性大鼠经前综合征焦虑模型[113], 药物诱导的大鼠围绝经期动物模型[114]等。但是, 在雌性动物上很难模拟人类女性产生情绪障碍的心理社会因素, 目前尚没有建立起公认的标准化雌性动物的焦虑模型。鉴于女性焦虑障碍的高发病率以及相应模型和药物的缺乏, 亟待进一步开展女性焦虑障碍模型的研究。
2.3 需要排除的作用在对药物进行抗焦虑作用的非临床药效学评价时, 应注意到其他药理作用对抗焦虑作用的干扰, 例如药物的镇静、催眠和肌松作用以及木僵效应等均可能使动物在开放区域的活动减少, 药物的镇痛作用可以使其对电击等刺激更加耐受, 此外, 药物对学习记忆的影响和抗精神分裂症效应等作用均可能干扰对其抗焦虑药效的评价。因此在抗焦虑药物的药效学评价中, 需要设计相应的实验以排除以上作用。自主活动实验、睡眠时间、阈下睡眠时间和脑电图等实验可以考察药物潜在的镇静-催眠作用[115]。对肌力的潜在作用可以通过转棒实验、牵引力实验、斜坡/攀网实验和攀登测试[116, 117]等考察。可能的镇痛作用可以通过扭体实验、福尔马林实验、热板实验、电刺激等考察[118, 119]; 对学习记忆的影响可以通过避暗实验、跳台实验等考察[29]; 抗精神分裂症作用可以通过木僵作用和小鼠隔离打架实验评价[120, 121]。药物在抗焦虑的剂量对上述作用无显著影响, 才能表明其抗焦虑作用。
2.4 给药方式的规范性在非临床药效学评价中, 除了模型选择和设计的规范性外, 还需要考虑动物给药的规范性。对待测药物, 应考察不同给药方式的作用。虽然在临床前研究中经常使用腹腔注射给药, 但考虑到后期的临床转化与应用, 应尽量考察口服给药的药效。此外, 抗焦虑药物的动物实验研究往往以单次给药为主, 但临床前研究中应包含长期给药方案, 一方面避免遗漏慢性有效的药物如抗抑郁药物SSRI等[122], 另一方面则需要考虑长期用药造成的药物耐受性。
2.5 实验实施的规范性由于抗焦虑药物药效学评价模型中广泛涉及动物的行为学指标, 因此实验操作的规范性直接决定了结果评价的准确性与一致性。
2.5.1 动物的提前适应一般而言, 动物在操作间内应适应两天以上。对一些实验仪器, 例如听觉惊跳反应, 动物需要提前适应仪器。但对旷场等基于动物对新奇环境探究行为的实验则要保持实验设施的新奇性, 仅对实验环境进行适应。在动物进行环境适应的同时, 实验人员应每日手握动物接触一段时间使动物适应操作。
2.5.2 实验条件与实验人员的规范性在实验测试中, 每只动物进入仪器前应使用75%乙醇擦拭仪器以去除上一只动物在仪器中遗留气味的影响。在需要使用垫料的实验如电击探头埋藏实验等中, 每只动物应更换新的垫料。在行为学仪器和操作人员之间设置帘子避免人员的干扰和光线变化对软件识别等的影响。实验人员在操作中应避免使用香水和有气味的化妆品和其他物品。实验人员应保持稳定, 避免在实验中更换人员, 避免无关人员在操作期间穿行。考虑昼夜节律的影响, 啮齿类动物在下午活动较少, 而较多地处于睡眠状态, 因此行为学检测一般在上午8:00~12:00之间进行。此外, 在条件允许下应采用盲法设计, 行为学测试人员对分组信息不知情。
2.5.3 实验操作的规范性动物放入仪器位置和动物头的方向需一致, 一般背向操作人, 面向开臂、旷场中心等造成焦虑冲突的位置, T迷宫则按设计而定; 实验人员的给药、放置等操作应轻柔快速且稳定, 尽量避免造成疼痛不适和冲击。
2.6 动物分组的规范性鉴于动物个体差异的影响和行为学指标的特点, 每组同性别动物应不少于15只, 在雌雄兼用的实验中应做到性别平衡。待测药物在药效学评价设计中应至少设置3个剂量组, 动物分组应按体重随机分布。
3 选择规范化研发模型的建议目前对焦虑障碍及其发病机制的研究表明, 焦虑障碍是环境和遗传因素共同作用的结果, 涉及神经和内分泌等多个系统共同的作用。临床研究表明, 不同类别焦虑障碍存在不同的神经生物学基础, 很难为特定的焦虑障碍指定特定的动物模型, 单个模型往往只能反映焦虑的某一个方面或焦虑障碍的某一类型。以往各方面研究均表明, 单一焦虑模型不足以全面评价药物抗焦虑的作用, 更为适合的评价方式是选择一组模型对应一类焦虑障碍[27]。因此, 研究者开发了大量的焦虑动物模型, 例如群居接触实验反映了类似社交恐惧症的症状, 而高架十字迷宫则反映了类似恐高症的症状[27]。药物评价研究表明, 不同焦虑模型常常表现出对于不同药物的敏感度差异, 例如条件操作冲突模型对BDZs和抗抑郁药物较敏感而对丁螺环酮敏感度较低, 恐惧增强惊跳和防御掩埋实验对于5HT1A和BDZs同样敏感, 而超声波对目前的各种抗焦虑药物都表现出较好的敏感性[123]。
但是, 大量的焦虑模型为药效评价人员在选择模型上造成了困难, 例如在本综述中列举了超过40种研究者经常使用的焦虑模型(图 3)。在抗焦虑药物非临床药效学评价的研究中, 应涵盖已有模型的不同类别, 例如尽量同时涵盖非条件模型和条件化模型。在非条件模型中, 应同时包含探究行为模型和社会行为模型; 在应激模型中, 同时包括急性和慢性应激。在此基础上, 应选择一些对不同药物均具有较好敏感性的模型, 从而尽可能对药物的抗焦虑作用进行全面评价, 同时, 应该设计排除其他精神神经作用的实验, 具体的推荐模型参见表 1。

|
Figure 3 Models used in non-clinical pharmacodynamics evaluation of anxiety disorder |
| Table 1 Recommendations for the pre-clinical animal model selection of anxiolytics assessment |
近年来, 我国焦虑障碍治疗药物的临床研究主要针对中药复方制剂和帕罗西汀、坦度螺酮等已上市药物开展。目前国内抗焦虑药物的临床前研究, 一方面基于传统中医药中的复方制剂, 如逍遥散等[124], 一方面集中于对天然产物及结构类似物的研究, 如对黄酮类单体化合物研究表明, 一系列黄酮、黄酮醇与二氢黄酮均在动物模型上表现出抗焦虑作用, 且在结构上有一定的相关性, 其作用机制与GABA受体和5-HT神经递质通路相关[125]; 荜拨明碱、甜菜碱和小檗碱等生物碱类成分[126]以及菲类、黄酮类和苯丙素类等小分子酚[127]也都有临床前抗焦虑作用的报道; 基于沉香化学成分沉香呋喃及其衍生物, 中国医学科学院药物研究所尹大力研究员课题组开发了抗焦虑障碍的1.1类新药布格呋喃, 其在动物模型上抗焦虑作用效果与地西泮相当, 较丁螺环酮强, 在中枢神经系统的其他作用较弱。毒理研究结果显示布格呋喃毒性低, 无依赖性和耐受性, Ⅰ期临床试验结果表明其不良反应均为轻中度, 耐受性良好[128], Ⅱa期临床试验也已完成, 获得了Ⅲ期临床批件, 其作用机制尚在研究中[129, 130]。另一方面, 由于焦虑与抑郁在发病机制上的相关性, 以及抗抑郁药物抗抑郁和抗焦虑的双重作用, 以快速起效抗抑郁-焦虑的靶标为研究策略, 军事医学科学院毒物药物研究所李云峰研究员开发了2个1.1类抗抑郁化学新药盐酸羟哌吡酮(YL-0919) 和盐酸阿姆西汀(071031B), 以及1.1类抗焦虑-抑郁、抗PTSD候选新药YL-IPA08等, 提示了抗焦虑药物研发的新思路[131]。
5 小结焦虑障碍是常见的成人精神障碍, 当下新冠肺炎疫情造成了广泛的紧张与焦虑情绪, 使其得到广泛的关注。目前对焦虑障碍的发病机制已经有了较为深入的认识, 基于其发病机制建立了一系列相关的动物模型。鉴于焦虑动物模型的数量庞大, 涉及行为学指标, 部分实验操作复杂, 对其进行规范化一方面可以提高模型的成功率、有效性和可重复性, 另一方面可以增加药物进入临床试验的成功率。规范化的抗焦虑药非临床效学评价体系对抑郁等情绪障碍的临床前动物实验研究也有很好的参考价值。
作者贡献: 兰嘉琦完成了论文的撰写; 赵春阳协助完成了本论文的文献收集; 吴镭、冯新红和王庆利提供了论文写作思路的建议并对论文进行了校对; 彭英为本论文进行了修改和指导。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Association AP. Diagnostic and statistical manual of mental disorders[J]. BMC Med, 2013, 17: 133-137. |
| [2] |
Bandelow B, Baldwin D, Abelli M, et al. Biological markers for anxiety disorders, OCD and PTSD-a consensus statement. Part Ⅰ: neuroimaging and genetics[J]. World J Biol Psychiatry, 2016, 17: 1-45. DOI:10.3109/15622975.2016.1131961 |
| [3] |
Shao F, Lin W, Wang W, et al. The effect of emotional stress on the primary humoral immunity of rats[J]. J Psychopharmacol, 2003, 17: 179-183. DOI:10.1177/0269881103017002005 |
| [4] |
Baxter A, Scott K, Vos T, et al. Global prevalence of anxiety disorders: a systematic review and meta-regression[J]. Psychol Med, 2013, 43: 897-910. DOI:10.1017/S003329171200147X |
| [5] |
Hantsoo L, Epperson CN. Anxiety disorders among women: a female lifespan approach[J]. Focus (Am Psychiatr Publ), 2017, 15: 162-172. |
| [6] |
Huang YQ, Wang Y, Wang H, et al. Prevalence of mental disorders in China: a cross-sectional epidemiological study[J]. Lancet Psychiatry, 2019, 6: 211-224. DOI:10.1016/S2215-0366(18)30511-X |
| [7] |
Linden W, Vodermaier A, MacKenzie R, et al. Anxiety and depression after cancer diagnosis: prevalence rates by cancer type, gender, and age[J]. J Affect Disord, 2012, 141: 343-351. DOI:10.1016/j.jad.2012.03.025 |
| [8] |
McWilliams LA, Cox BJ, Enns MW. Mood and anxiety disorders associated with chronic pain: an examination in a nationally representative sample[J]. Pain, 2003, 106: 127-133. DOI:10.1016/S0304-3959(03)00301-4 |
| [9] |
Broen MP, Narayen NE, Kuijf ML, et al. Prevalence of anxiety in Parkinson's disease: a systematic review and meta-analysis[J]. Mov Disord, 2016, 31: 1125-1133. DOI:10.1002/mds.26643 |
| [10] |
Barker-Collo SL. Depression and anxiety 3 months post stroke: prevalence and correlates[J]. Arch Clin Neuropsychol, 2007, 22: 519-531. DOI:10.1016/j.acn.2007.03.002 |
| [11] |
Shimada-Sugimoto M, Otowa T, Hettema JM. Genetics of anxiety disorders: genetic epidemiological and molecular studies in humans[J]. Psychiatry Clin Neurosci, 2015, 69: 388-401. DOI:10.1111/pcn.12291 |
| [12] |
Chen ZB, Zhang B, Min LX, et al. Research progress on the pathogenesis of anxiety[J]. Tianjin J Tradit Chin Med (天津中医药), 2018, 35: 316-320. |
| [13] |
Schienle A, Hettema J, Caceda R, et al. Neurobiology and genetics of generalized anxiety disorder[J]. Psychiatr Ann, 2011, 41: 113-123. DOI:10.3928/00485713-20110203-10 |
| [14] |
Calhoon G, Tye K. Resolving the neural circuits of anxiety[J]. Nat Neurosci, 2015, 18: 1394-1404. DOI:10.1038/nn.4101 |
| [15] |
Fischer S, Ehlert U. Hypothalamic-pituitary-thyroid (HPT) axis functioning in anxiety disorders. A systematic review[J]. Depress Anxiety, 2018, 35: 98-110. DOI:10.1002/da.22692 |
| [16] |
Maeng LY, Milad MR. Sex differences in anxiety disorders: interactions between fear, stress, and gonadal hormones[J]. Horm Behav, 2015, 76: 106-117. DOI:10.1016/j.yhbeh.2015.04.002 |
| [17] |
Gawali NB, Bulani VD, Gursahani MS, et al. Agmatine attenuates chronic unpredictable mild stress-induced anxiety, depression-like behaviours and cognitive impairment by modulating nitrergic signalling pathway[J]. Brain Res, 2017, 1663: 66-77. DOI:10.1016/j.brainres.2017.03.004 |
| [18] |
Sharma S, Powers A, Bradley B, et al. Gene×environment determinants of stress- and anxiety-related disorders[J]. Annu Rev Psychol, 2016, 67: 239-261. DOI:10.1146/annurev-psych-122414-033408 |
| [19] |
Qi XL, Lin WJ. Methods and strategies of anxiety and depression animal models study[J]. Adv Psychol Sci (心理科学进展), 2005, 13: 327-332. |
| [20] |
Fava GA, Sonino N, Morphy MA. Psychosomatic view of endocrine disorders[J]. Psychother Psychosom, 1993, 59: 20-33. DOI:10.1159/000288641 |
| [21] |
Hogle JM, Kaye JT, Curtin JJ. Nicotine withdrawal increases threat-induced anxiety but not fear: neuroadaptation in human addiction[J]. Biol Psychiatry, 2010, 68: 719-725. DOI:10.1016/j.biopsych.2010.06.003 |
| [22] |
Uhde TW, Tancer ME, Gurguis GN. Chemical models of anxiety: evidence for diagnostic and neurotransmitter specificity[J]. Int Rev Psychiatry, 1990, 2: 367-384. DOI:10.3109/09540269009026607 |
| [23] |
Katzman MA, Bleau P, Blier P, et al. Canadian clinical practice guidelines for the management of anxiety, posttraumatic stress and obsessive-compulsive disorders[J]. BMC Psychiatry, 2014, 14: S1. DOI:10.1186/1471-244X-14-S1-S1 |
| [24] |
Zhang HY, Li YZ. Tandospirone, an emergingdrugs for the treatment of general anxiety disorders[J]. Clin Med J (临床药物治疗杂志), 2005, 3: 53-57. |
| [25] |
Su H, Jiang KD, Xu YF. 5-Serotonin and norepinephrine reuptake inhibitor is first line drug for anxiety disorder[J]. Chin J New Drugs Clin Rem (中国新药与临床杂志), 2010, 29: 264-269. |
| [26] |
Wu WY. Guidelines for the Prevention and Treatment of Anxiety Disorders (焦虑障碍防治指南)[M]. Beijing: People's Medical Publishing House, 2010.
|
| [27] |
Bourin M. Animal models for screening anxiolytic-like drugs: a perspective[J]. Dialogues Clin Neurosci, 2015, 17: 295-303. DOI:10.31887/DCNS.2015.17.3/mbourin |
| [28] |
Prut L, Belzung C. The open field as a paradigm to measure the effects of drugs on anxiety-like behaviors: a review[J]. Eur J Pharmacol, 2003, 463: 3-33. DOI:10.1016/S0014-2999(03)01272-X |
| [29] |
Wei W, Wu XM, Li YJ. Experimental Methodology of Pharmacology (药理学实验方法学)[M]. Beijing: People's Medical Publishing House, 2010.
|
| [30] |
Bailey KR, Crawley JN. Chapter 5. Anxiety-related behaviors in mice[M]//Jerry J Buccafusco. Methods of Behavior Analysis in Neuroscience. Boca Raton: 2CRC Press/Taylor & Francis, 2009.
|
| [31] |
Fromm L, Heath DL, Vink R, et al. Magnesium attenuates post-traumatic depression/anxiety following diffuse traumatic brain injury in rats[J]. J Am Coll Nutr, 2004, 23: 529S-533S. DOI:10.1080/07315724.2004.10719396 |
| [32] |
Salum C, Roque-da-Silva AC, Morato S. Conflict as a determinant of rat behavior in three types of elevated plus-maze[J]. Behav Processes, 2003, 63: 87-93. DOI:10.1016/S0376-6357(03)00034-2 |
| [33] |
Pellow S, Chopin P, File SE, et al. Validation of open: closed arm entries in an elevated plus-maze as a measure of anxiety in the rat[J]. J Neurosci Methods, 1985, 14: 149-167. DOI:10.1016/0165-0270(85)90031-7 |
| [34] |
Walf AA, Frye CA. The use of the elevated plus maze as an assay of anxiety-related behavior in rodents[J]. Nat Protoc, 2008, 2: 322-328. |
| [35] |
Kumar V, Bhat ZA, Kumar D. Animal models of anxiety: a comprehensive review[J]. J Pharmacol Toxicol Methods, 2013, 68: 175-183. DOI:10.1016/j.vascn.2013.05.003 |
| [36] |
Shepherd JK, Grewal SS, Fletcher A, et al. Behavioural and pharmacological characterisation of the elevated "zero-maze" as an animal model of anxiety[J]. Psychopharmacology (Berl), 1994, 116: 56-64. DOI:10.1007/BF02244871 |
| [37] |
Cook MN, Crounse M, Flaherty L. Anxiety in the elevated zero-maze is augmented in mice after repeated daily exposure[J]. Behav Genet, 2002, 32: 113-118. DOI:10.1023/A:1015249706579 |
| [38] |
Crawley JN. Exploratory behavior models of anxiety in mice[J]. Neurosci Biobehav Rev, 1985, 9: 37-44. DOI:10.1016/0149-7634(85)90030-2 |
| [39] |
Boissier J. La reaction d'exploration chez la souris[J]. Therapie, 1962, 17: 1225-1232. |
| [40] |
File SE, Wardill AG. Validity of head-dipping as a measure of exploration in a modified hole-board[J]. Psychopharmacologia, 1975, 44: 53-59. DOI:10.1007/BF00421184 |
| [41] |
Kalueff AV, Keisala T, Minasyan A, et al. The regular and light-dark Suok tests of anxiety and sensorimotor integration: utility for behavioral characterization in laboratory rodents[J]. Nat Protoc, 2008, 3: 129-136. DOI:10.1038/nprot.2007.516 |
| [42] |
File SE, Hyde J. Can social interaction be used to measure anxiety?[J]. Br J Pharmacol, 1978, 62: 19. DOI:10.1111/j.1476-5381.1978.tb07001.x |
| [43] |
Sánchez C. Stress-induced vocalisation in adult animals. A valid model of anxiety?[J]. Eur J Pharmacol, 2003, 463: 133-143. DOI:10.1016/S0014-2999(03)01277-9 |
| [44] |
Iijima M, Chaki S. Separation-induced ultrasonic vocalization in rat pups: further pharmacological characterization[J]. Pharmacol Biochem Behav, 2006, 82: 652-657. |
| [45] |
Lecci A, Borsini F, Volterra G, et al. Pharmacological validation of a novel animal model of anticipatory anxiety in mice[J]. Psychopharmacology (Berl), 1990, 101: 255-261. DOI:10.1007/BF02244136 |
| [46] |
Zhao YN, Du LJ. Experimental animal models of nervous system[M]//Du LJ, Zhao YN. Laboratory Animal and Experimental Animal Models (实验动物与实验动物模型). Beijing: China Medical Science Press, 2012: 43-115.
|
| [47] |
Han YW, Zhao LZ, Liu QQ, et al. Effect of conditioned fear training on behavioral activity in F344 rats[J]. Chin J Behav Med Sci (中华行为医学与脑科学杂志), 2004, 13: 622-623. |
| [48] |
Bodnoff SR, Suranyi-Cadotte B, Aitken DH, et al. The effects of chronic antidepressant treatment in an animal model of anxiety[J]. Psychopharmacology (Berl), 1988, 95: 298-302. |
| [49] |
Blasco-Serra A, González-Soler EM, Cervera-Ferri A, et al. A standardization of the novelty-suppressed feeding test protocol in rats[J]. Neurosci Lett, 2017, 658: 73-78. DOI:10.1016/j.neulet.2017.08.019 |
| [50] |
Li CF, Chen XM, Chen SM, et al. Extracts from Pericarpium citri improve behaviors and hippocampal BDNF in mice exposed to chronic mild unpredictable stress[J]. China J Exp Tradit Med Form (中国实验方剂学杂志), 2014, 20: 151-154. |
| [51] |
Pollard GT, Howard JL. Cork gnawing in the rat as a screening method for buspirone-like anxiolytics[J]. Drug Dev Res, 1991, 22: 179-187. DOI:10.1002/ddr.430220208 |
| [52] |
Campos AC, Fogaca MV, Aguiar DC, et al. Animal models of anxiety disorders and stress[J]. Braz J Psychiatry, 2013, 35: S101-S111. DOI:10.1590/1516-4446-2013-1139 |
| [53] |
File SE, Lippa AS, Beer B, et al. Animal tests of anxiety[J]. Curr Protoc Neurosci, 2004, Chapter 8: Unit 8.3.
|
| [54] |
Geller I, Seifter J. The effects of meprobamate, barbiturates, D-amphetamine and promazine on experimentally induced conflict in the rat[J]. Psychopharmacologia, 1960, 1: 482-492. DOI:10.1007/BF00429273 |
| [55] |
Spencer DG, Lal H. CGS 9896, a chloro-derivative of the diazepam antagonist CGS 8216, exhibits anxiolytic activity in the pentylenetetrazol-saline discrimination test[J]. Drug Dev Res, 1983, 3: 365-370. DOI:10.1002/ddr.430030409 |
| [56] |
Vogel JR, Beer B, Clody DE. A simple and reliable conflict procedure for testing anti-anxiety agents[J]. Psychopharmacologia, 1971, 21: 1-7. DOI:10.1007/BF00403989 |
| [57] |
Degroot A, Treit D. Dorsal and ventral hippocampal cholinergic systems modulate anxiety in the plus-maze and shock-probe tests[J]. Brain Res, 2002, 949: 60-70. DOI:10.1016/S0006-8993(02)02965-7 |
| [58] |
Vry JD, Benz U, Schreiber R, et al. Shock-induced ultrasonic vocalization in young adult rats: a model for testing putative anti-anxiety drugs[J]. Eur J Pharmacol, 1993, 249: 331-339. DOI:10.1016/0014-2999(93)90530-U |
| [59] |
Jelen P, Soltysik S, Zagrodzka J. 22-kHz Ultrasonic vocalization in rats as an index of anxiety but not fear: behavioral and pharmacological modulation of affective state[J]. Behav Brain Res, 2003, 141: 63-72. DOI:10.1016/S0166-4328(02)00321-2 |
| [60] |
Borta A, Wöhr M, Schwarting RKW. Rat ultrasonic vocalization in aversively motivated situations and the role of individual differences in anxiety-related behavior[J]. Behav Brain Res, 2006, 166: 271-280. DOI:10.1016/j.bbr.2005.08.009 |
| [61] |
Estes WK, Skinner BF. Some quantitative properties of anxiety[J]. J Exp Psychol, 1941, 29: 390. DOI:10.1037/h0062283 |
| [62] |
Davis M. Animal models of anxiety based on classical conditioning: the conditioned emotional response (CER) and the fear-potentiated startle effect[J]. Pharmacol Ther, 1990, 47: 147-165. DOI:10.1016/0163-7258(90)90084-F |
| [63] |
Dong XW, Wang CY, Wng CL, et al. The progress of startle paradigm in the clinical studies of PTSD: hyperarousal and fear inhibition[J]. Adv Psychol Sci (心理科学进展), 2013, 21: 965-974. DOI:10.3724/SP.J.1042.2013.00965 |
| [64] |
Geng DD, Bai WZ, Ma J, et al. c-fos expression in the parabrachial nucleus following differential conditioning taste aversion in rats[J]. Acta Psychol Sin (心理学报), 2006, 38: 442-447. |
| [65] |
Ervin G, Soroko F, Cooper B. Buspirone antagonizes the expression of conditioned taste aversion in rats[J]. Drug Dev Res, 1987, 11: 87-95. DOI:10.1002/ddr.430110203 |
| [66] |
Lezak KR, Missig G, Carlezon WA. Behavioral methods to study anxiety in rodents[J]. Dialogues Clin Neurosci, 2017, 19: 181-191. DOI:10.31887/DCNS.2017.19.2/wcarlezon |
| [67] |
Gao WT, Yang C, Wang HY, et al. Physiological basis of the stress models and their progressin comparative study[J]. Prog Modern Biomed (现代生物医学进展), 2014, 14: 4160-4163. |
| [68] |
Zhu MH, Jiang N, Zhou WX. Establishment and comparison of anxiety models by uncertain empty water bottle stimulation and restraint stress in mice[J]. Chin J Pharmacol Toxicol (中国药理学与毒理学杂志), 2019, 33: 102-108. |
| [69] |
Beutel ME, Jünger C, Klein EM, et al. Noise annoyance is associated with depression and anxiety in the general population-the contribution of aircraft noise[J]. PLoS One, 2016, 11: e0155357. DOI:10.1371/journal.pone.0155357 |
| [70] |
Tafet GE, Nemeroff CB. Pharmacological treatment of anxiety disorders: the role of the HPA axis[J]. Front Psychiatry, 2020, 11: 443. |
| [71] |
Mitra R, Sapolsky RM. Acute corticosterone treatment is sufficient to induce anxiety and amygdaloid dendritic hypertrophy[J]. Proc Natl Acad Sci U S A, 2008, 105: 5573-5578. DOI:10.1073/pnas.0705615105 |
| [72] |
Zhao HQ, Han YS, Liu Z, et al. Changes of control of monoamine neurotransmitters and expression of neurotrophic factors in brain regions of rat modals of anxious depression[J]. Acta Lab Anim Sci Sin (中国实验动物学报), 2017, 25: 373-379. |
| [73] |
Gregus A, Wintink AJ, Davis AC, et al. Effect of repeated corticosterone injections and restraint stress on anxiety and depression-like behavior in male rats[J]. Behav Brain Res, 2005, 156: 105-114. DOI:10.1016/j.bbr.2004.05.013 |
| [74] |
Wu MY, Qing ZH, Yang Q, et al. Study on model of tree shrew induced by chronic corticosterone injection in anxious depression[J]. Chin Pharmacol Bull (中国药理学通报), 2018, 34: 141-144. |
| [75] |
Yang C, Feng GK. Review on modeling methods of anxious animal model[J]. J Guangzhou Univ Tradit Chin Med (广州中医药大学学报), 2015, 32: 1135-1138. |
| [76] |
Evans J, Sun Y, Mcgregor A, et al. Allopregnanolone regulates neurogenesis and depressive/anxiety-like behaviour in a social isolation rodent model of chronic stress[J]. Neuropharmacology, 2012, 63: 1315-1326. DOI:10.1016/j.neuropharm.2012.08.012 |
| [77] |
Liu YJ, Li LF, Bao WD, et al. Effects of chronic social isolation on behavior and physiology in female rats[J]. J Shaanxi Norm Univ: Nat Sci Ed (陕西师范大学学报(自然科学版)), 2016, 44: 71-77. |
| [78] |
Weiss IC, Pryce CR, Jongenrelo AL, et al. Effect of social isolation on stress-related behavioural and neuroendocrine state in the rat[J]. Behav Brain Res, 2004, 152: 279-295. DOI:10.1016/j.bbr.2003.10.015 |
| [79] |
Matsumoto K, Puia G, Dong E, et al. GABAA receptor neurotransmission dysfunction in a mouse model of social isolation-induced stress: possible insights into a non-serotonergic mechanism of action of SSRIs in mood and anxiety disorders[J]. Stress, 2007, 10: 3-12. DOI:10.1080/10253890701200997 |
| [80] |
Lin WJ, Wang WW, Shao F. New animal model of emotional stress: behavioral, neuroendocrine and immunological consequences[J]. Chin Sci Bull, 2003, 48: 1565-1568. DOI:10.1007/BF03183962 |
| [81] |
Zhang HQ, Han YS, Du Q, et al. Research of different methods of stress-induced anxiety-like behavior in rats at different time points[J]. Chin J Comp Med (中国比较医学杂志), 2017, 27: 22-26. |
| [82] |
Venzala E, Garcia-Garcia A, Elizalde N, et al. Chronic social defeat stress model: behavioral features, antidepressant action, and interaction with biological risk factors[J]. Psychopharmacology (Berl), 2012, 224: 313-325. DOI:10.1007/s00213-012-2754-5 |
| [83] |
Golden S, Covington H, Berton O, et al. Corrigendum: a standardized protocol for repeated social defeat stress in mice[J]. Nat Protoc, 2011, 6: 1183-1191. DOI:10.1038/nprot.2011.361 |
| [84] |
Kieran N, Ou XM, Iyo AH. Chronic social defeat downregulates the 5-HT1A receptor but not Freud-1 or NUDR in the rat prefrontal cortex[J]. Neurosci Lett, 2010, 469: 380-384. DOI:10.1016/j.neulet.2009.12.032 |
| [85] |
Rygula R, Abumaria N, Flügge G, et al. Anhedonia and motivational deficits in rats: impact of chronic social stress[J]. Behav Brain Res, 2005, 162: 127-134. DOI:10.1016/j.bbr.2005.03.009 |
| [86] |
Zhang YR, Wang RZ, Chen R, et al. Changes of Wnt/β-catenin signaling pathway in the hippocampus caused by prenatal stress induce depression- and anxiety-like behaviors in rats[J]. J South Med Univ (南方医科大学学报), 2019, 39: 102-106. |
| [87] |
Dryden S, Wang Q, Frankish HM, et al. Differential effects of the 5-HT1B2C receptor agonist mCPP and the 5-HT1A agonist flesinoxan on hypothalamic neuropeptide Y in the rat: evidence that NPY may mediate serotonin's effects on food intake[J]. Peptides, 1996, 17: 943-949. DOI:10.1016/0196-9781(96)00142-8 |
| [88] |
Tan DJ, Takenaga T, Otomo S. m-Chlorophenylpiperazine-induced anxiety model in light-dark box in ddy mice-a new economic and simple method for screening anxiolytics[J]. Acta Pharm Sin (药学学报), 2000, 35: 580-582. |
| [89] |
Yeung M, Lu L, Hughes AM, et al. FG7142, yohimbine, and βCCE produce anxiogenic-like effects in the elevated plus-maze but do not affect brainstem activated hippocampal theta[J]. Neuropharmacology, 2013, 75: 47-52. DOI:10.1016/j.neuropharm.2013.06.027 |
| [90] |
Jacobson LH, Cryan JF. Genetic approaches to modeling anxiety in animals[M]//Stein MB, Steckler T. Behavioral Neurobiology of Anxiety and Its Treatment. Berlin, Heidelberg: Springer Berlin Heidelberg, 2010: 161-201.
|
| [91] |
Finn DA, Rutledge-Gorman MT, Crabbe JC. Genetic animal models of anxiety[J]. Neurogenetics, 2003, 4: 109-135. DOI:10.1007/s10048-003-0143-2 |
| [92] |
Olivier J, Van Der Hart M, Van Swelm R, et al. A study in male and female 5-HT transporter knockout rats: an animal model for anxiety and depression disorders[J]. Neuroscience, 2008, 152: 573-584. DOI:10.1016/j.neuroscience.2007.12.032 |
| [93] |
Toth M. 5-HT1A receptor knockout mouse as a genetic model of anxiety[J]. Eur J Pharmacol, 2003, 463: 177-184. DOI:10.1016/S0014-2999(03)01280-9 |
| [94] |
Savage K, Firth J, Stough C, et al. GABA-modulating phytomedicines for anxiety: a systematic review of preclinical and clinical evidence[J]. Phytother Res, 2018, 32: 3-18. DOI:10.1002/ptr.5940 |
| [95] |
Müller I, Çalışkan G, Stork O. The GAD65 knock out mouse-a model for GABAergic processes in fear- and stress-induced psychopathology[J]. Genes Brain Behav, 2015, 14: 37-45. DOI:10.1111/gbb.12188 |
| [96] |
Watson S, Mackin P. HPA axis function in mood disorders[J]. Psychiatry, 2006, 5: 166-170. DOI:10.1383/psyt.2006.5.5.166 |
| [97] |
Van Gaalen MM, Stenzel-Poore MP, Holsboer F, et al. Effects of transgenic overproduction of CRH on anxiety-like behaviour[J]. Eur J Neurosci, 2002, 15: 2007-2015. DOI:10.1046/j.1460-9568.2002.02040.x |
| [98] |
Gass P, Reichardt HM, Strekalova T, et al. Mice with targeted mutations of glucocorticoid and mineralocorticoid receptors: models for depression and anxiety?[J]. Physiol Behav, 2001, 73: 811-825. DOI:10.1016/S0031-9384(01)00518-2 |
| [99] |
Wei Q, Fentress HM, Hoversten MT, et al. Early-life forebrain glucocorticoid receptor overexpression increases anxiety behavior and cocaine sensitization[J]. Biol Psychiatry, 2012, 71: 224-231. DOI:10.1016/j.biopsych.2011.07.009 |
| [100] |
Lin S, Boey D, Herzog H. NPY and Y receptors: lessons from transgenic and knockout models[J]. Neuropeptides, 2004, 38: 189-200. DOI:10.1016/j.npep.2004.05.005 |
| [101] |
Chen ZY, Jing D, Bath KG, et al. Genetic variant BDNF (Val66Met) polymorphism alters anxiety-related behavior[J]. Science, 2006, 314: 140-143. DOI:10.1126/science.1129663 |
| [102] |
Ren-Patterson RF, Cochran LW, Holmes A, et al. Gender-dependent modulation of brain monoamines and anxiety-like behaviors in mice with genetic serotonin transporter and BDNF deficiencies[J]. Cell Mol Neurobiol, 2006, 26: 753-778. DOI:10.1007/s10571-006-9048-6 |
| [103] |
Wilson W, Voigt P, Bader M, et al. Behaviour of the transgenic (mREN2) 27 rat[J]. Brain Res, 1996, 729: 1-9. |
| [104] |
Voigt JP, Hörtnagl H, Rex A, et al. Brain angiotensin and anxiety-related behavior: the transgenic rat TGR(ASrAOGEN)680[J]. Brain Res, 2005, 1046: 145-156. DOI:10.1016/j.brainres.2005.03.048 |
| [105] |
Barros M, Tomaz C. Non-human primate models for investigating fear and anxiety[J]. Neurosci Biobehav Rev, 2002, 26: 187-201. DOI:10.1016/S0149-7634(01)00064-1 |
| [106] |
Cagni P, Komorowski M, Melo GC, et al. Diazepam-induced decrease in anxiety-like behaviors of marmoset monkeys exposed to a novel open-field[J]. Pharmacol Biochem Behav, 2012, 100: 518-521. DOI:10.1016/j.pbb.2011.10.020 |
| [107] |
Wang Y, Fang Q, Gong N. A modified light-dark box test for the common marmoset[J]. Neurosci Bull, 2014, 30: 394-400. DOI:10.1007/s12264-013-1426-8 |
| [108] |
Jung YH, Hong SI, Ma SX, et al. Strain differences in the chronic mild stress animal model of depression and anxiety in mice[J]. Biomol Ther, 2014, 22: 453. DOI:10.4062/biomolther.2014.058 |
| [109] |
Rex A, Voigt JP, Gustedt C, et al. Anxiolytic-like profile in wistar, but not sprague-dawley rats in the social interaction test[J]. Psychopharmacology (Berl), 2004, 177: 23-34. DOI:10.1007/s00213-004-1914-7 |
| [110] |
Marcondes FK, Miguel KJ, Melo LL, et al. Estrous cycle influences the response of female rats in the elevated plus-maze test[J]. Physiol Behav, 2001, 74: 435-440. DOI:10.1016/S0031-9384(01)00593-5 |
| [111] |
File SE, Wardill AG. The reliability of the hole-board apparatus[J]. Psychopharmacologia, 1975, 44: 47-51. DOI:10.1007/BF00421183 |
| [112] |
Palanza P. Animal models of anxiety and depression: how are females different?[J]. Neurosci Biobehav Rev, 2001, 25: 219-233. DOI:10.1016/S0149-7634(01)00010-0 |
| [113] |
Gallo MA, Smith SS. Progesterone withdrawal decreases latency to and increases duration of electrified prod burial: a possible rat model of PMS anxiety[J]. Pharmacol Biochem Behav, 1993, 46: 897-904. |
| [114] |
Reis F, Pestana-Oliveira N, Leite CM, et al. Hormonal changes and increased anxiety-like behavior in a perimenopause-animal model induced by 4-vinylcyclohexene diepoxide (VCD) in female rats[J]. Psychoneuroendocrinology, 2014, 49: 130-140. DOI:10.1016/j.psyneuen.2014.06.019 |
| [115] |
dela Peña IJI, Kim HJ, Botanas CJ, et al. The psychopharmacological activities of Vietnamese ginseng in mice: characterization of its psychomotor, sedative-hypnotic, antistress, anxiolytic, and cognitive effects[J]. J Ginseng Res, 2017, 41: 201-208. DOI:10.1016/j.jgr.2016.03.005 |
| [116] |
Adeyemi OO, Yemitan OK, Taiwo AE. Neurosedative and muscle-relaxant activities of ethyl acetate extract of Baphia nitida AFZEL[J]. J Ethnopharmacol, 2006, 106: 312-316. DOI:10.1016/j.jep.2005.11.035 |
| [117] |
Hosseinzadeh H, Nassiri Asl M. Anticonvulsant, sedative and muscle relaxant effects of carbenoxolone in mice[J]. BMC Pharmacol, 2003, 3: 3. DOI:10.1186/1471-2210-3-3 |
| [118] |
Farouk L, Laroubi A, Aboufatima R, et al. Evaluation of the analgesic effect of alkaloid extract of Peganum harmala L.: possible mechanisms involved[J]. J Ethnopharmacol, 2008, 115: 449-454. DOI:10.1016/j.jep.2007.10.014 |
| [119] |
Naef M, Curatolo M, Petersen-Felix S, et al. The analgesic effect of oral delta-9-tetrahydrocannabinol (THC), morphine, and a THC-morphine combination in healthy subjects under experimental pain conditions[J]. Pain, 2003, 105: 79-88. DOI:10.1016/S0304-3959(03)00163-5 |
| [120] |
Ferrari F, Giuliani D. Behavioural assessment in rats of the antipsychotic potential of the potent dopamine D2 receptor antagonist, (-)eticlopride[J]. Pharmacol Res, 1995, 31: 261-267. |
| [121] |
Sanberg PR, Bunsey MD, Giordano M, et al. The catalepsy test: its ups and downs[J]. Behav Neurosci, 1988, 102: 748-759. DOI:10.1037/0735-7044.102.5.748 |
| [122] |
Huang JZ, Wang ZC. Experimental methods and pharmacological evaluation of anxiety animal models[J]. Shanghai Arch Psychiatry (上海精神医学), 2003, 15: 106-109. |
| [123] |
Treit D, Engin E, McEown K. Animal models of anxiety and anxiolytic drug action[M]//Stein MB, Steckler T. Behavioral Neurobiology of Anxiety and Its Treatment. Berlin, Heidelberg: Springer Berlin Heidelberg, 2010: 121-160.
|
| [124] |
Zhou JY, Zhou SW, Tang JL. Research progress on anti-anxiety effect of Chinese herbal compound preparations[J]. China Pharm (中国药房), 2010, 21: 1044-1047. |
| [125] |
Lv YW, Guo JY, Liu Y, et al. Advanced in studies on anxiolytic effects of natural flavonoids[J]. China J Chin Mater Med (中国中药杂志), 2016, 41: 38-44. |
| [126] |
Zhang YY, Wang JM, Cui Y, et al. Research progress of anxiolytic and antidepressant bioactive ingredients of Chinese medicine alkaloids and the pharmacological effect of Coptidis Rhizoma alkaloids[J]. China J Tradit Chin Med Pharma (中华中医药杂志), 2015, 30: 1184-1187. |
| [127] |
Wang XH, Zhang CX, Li GY, et al. Review on anxiolytic effect of natural small-molecule phenols[J]. China J Chin Mater Med (中国中药杂志), 2017, 42: 1557-1565. |
| [128] |
Qin WX, Guo ZZ, Jie HB, et al. Tolerance and safety of buagafuran in Chinese healthy volunteers[J]. Chin J New Drugs (中国新药杂志), 2011, 20: 110-114. |
| [129] |
Chen X, Jiang J, Yang F, et al. Pharmacokinetic and pharmacodynamic studies on anxiolytic drug buagafuran[J]. Med J Peking Union Med Coll Hosp (协和医学杂志), 2013, 4: 5-10. |
| [130] |
Zhang Y, Wang W, Zhang J. Effects of novel anxiolytic 4-butyl-alpha-agarofuran on levels of monoamine neurotransmitters in rats[J]. Eur J Pharmacol, 2004, 504: 39-44. DOI:10.1016/j.ejphar.2004.09.051 |
| [131] |
Li YF. Rapid onset antidepressant-anxiety target strategy and new drug research[J]. Chin J Pharmacol Toxicol (中国药理学与毒理学杂志), 2017, 31: 473-474. |
 2021, Vol. 56
2021, Vol. 56


