2. 中国药科大学中药学院, 江苏 南京 211198
2. School of Traditional Chinese Pharmacy, China Pharmaceutical University, Nanjing 211198, China
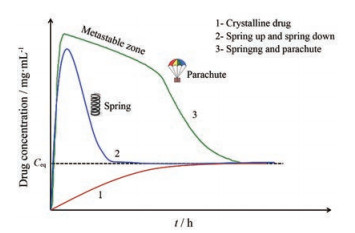
目前约75%新药候选药物属于生物药剂学分类系统(biopharmaceutical classification system, BCS) II或IV药物[1, 2], 低溶解性和低溶出速率已经成为限制制剂产品开发的重要因素。将晶态药物无定形化后, 无定形态呈长程无序的分子排列, 理论上将表现出较高的表观溶解度及溶出速率[3, 4]。然而, 无定形处于热力学不稳定态, 具有较高的表面吉布斯自由能和熵, 同时在过饱和度的热力学驱动力下, 溶出期间易发生析晶导致其溶出逐渐接近晶体药物的溶出水平[5, 6]。一般来说, 对于快速结晶的药物, 如无定形阿托伐他汀钙[7]和多烯紫杉醇[8], 溶出开始时无定形态迅速达到峰值浓度, 而后在几分钟至1 h内又迅速降低至晶体的溶出水平(即spring up和spring down溶出模型); 而对于慢速结晶药物, 如无定形他达拉非[9]和厄贝沙坦[10], 通常在一段时间内表现出较高的表观溶解度, 随后缓慢降低至晶态药物的溶出水平(即spring和parachute溶出模型)。研究发现, 这种缓慢降低的溶出过程遵循奥斯特瓦尔德的阶段定律(Ostwald's law of stages), 即无定形药物倾向于先形成亚稳相, 而后向其稳相发生转变[11, 12] (图 1)。然而, 与上述两种溶出模型不同, 一些小分子无定形药物在溶出过程中却表现出显著低于晶体药物的异常溶出行为, 并伴随凝胶化现象的发生。研究发现, 无定形盐酸鲁拉西酮在37 ℃溶出过程中, 会出现聚集成团、黏附在桨轴上的凝胶化现象, 这导致无定形态的溶出显著低于晶体[13]。通过熔融冷却法制得的无定形吲哚美辛在37 ℃的介质中进行溶出实验时, 无定形粉末形成凝胶状并黏附于搅拌桨及杯壁上, 导致无定形态的溶出度显著低于晶体[14, 15]。Hamaura等[16]报道, 头孢泊肟酯的R型异构体在pH < 1.2的强酸环境中也会形成凝胶[17]。
|
Figure 1 Several common dissolution behaviors of amorphous drugs. The crystalline (stable) form has low solubility (1); the amorphous phase shows peak solubility (spring up) but quickly drops (within minutes to an hour) to the low solubility of the crystalline form (spring down) (2); highly soluble drug forms are maintained for a long enough time (usually hours) in the metastable zone (3). Ceq: Equilibrium concentration |
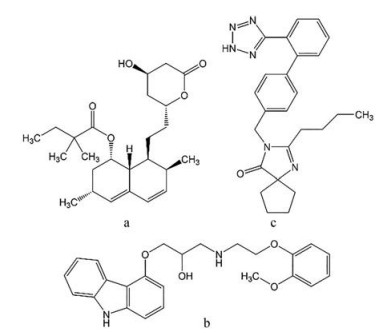
无定形药物在溶出/生理环境中的凝胶化将显著降低其溶出及体内生物利用度, 严重限制了一些无定形药物的应用。目前, 大分子物质(泊洛沙姆、羟丙甲纤维素和蛋白质等) 的凝胶形成及机制研究已被广泛报道[18, 19], 而小分子物质的凝胶形成机制研究较少。本研究中, 作者选择了3种BCS II类模型药物, 降血脂药物辛伐他汀(simvastatin, SIM)、降血压药物卡维地洛(carvedilol, CAR) 和降血压药物厄贝沙坦(irbesartan, IRB) (结构见图 2), 通过熔融冷却法制备三者的无定形态, 对其溶出过程中的溶出行为及凝胶化现象进行深入研究, 以探索二者之间内在联系, 并阐明凝胶形成的内在机制, 以补充有机小分子物质凝胶化形成及机制研究的理论基础, 同时为凝胶化药物的制剂开发提供研究基础和指导。
|
Figure 2 Chemical structures of simvastatin (SIM) (a), carvedilol (CAR) (b), and irbesartan (IRB) (c) |
试药与试剂 辛伐他汀(纯度99.0%, 浙江华海药业有限公司); 卡维地洛(纯度99.0%, 湖北鸿鑫瑞宇精细化工有限公司); 厄贝沙坦(纯度99.0%, 修正药业集团柳河药业有限公司); 乙酸铵、三乙胺(分析纯, 国药集团化学试剂有限公司); 磷酸二氢钾(分析纯, 上海凌峰化学试剂有限公司); 甲醇、乙腈(色谱纯, 上海安谱科学仪器有限公司); 盐酸、冰醋酸、磷酸(分析纯, 南京化学试剂股份有限公司); Milli-Q水(色谱纯, 实验室Milli-Q水净化系统自制)。
主要仪器 箱式电阻炉(SX2-16-10, 武汉格莱莫检测设备有限公司); 溶出仪(RC-806, 天津天大天发科技有限公司); 熔点测定仪(YRT-3, 广东天大有限公司); 偏光显微镜(Eclipse Ci-POL, 日本尼康公司); X-射线衍射仪(X′TRA, 瑞士ARL公司); 差示扫描热分析仪(Pyris 1, 美国Perkinelmer有限公司); 红外光谱仪(Nicolet Impact 410, 赛默飞世尔科技公司); 扫描电子显微镜(Hitachi S-3400N, 日本日立公司); 高效液相色谱仪(LC-2010AHT, 日本Shimadzu公司)。
无定形药物的制备 分别称取SIM、CAR和IRB的晶体约500 mg, 均匀分散在不同的铝箔盘表面, 依次放置于温度为140 ℃、120 ℃和180 ℃的箱式电阻炉中加热熔融, 约20 s后取出, 加入液氮迅速冷却, 得到固体产物。将所得产物刮出, 在低湿环境下(约35% RH) 过80目筛(粒径约180 μm) 后, 置含有无水氯化钙的干燥器中低温保存, 备用。
物理化学表征偏光显微镜(polarizing microscope, PLM) 分别取适量SIM、CAR、IRB的晶体和熔融冷却产物粉末, 置于载玻片上, 滴加液体石蜡, 将粉末充分分散开, 于10×10倍的PLM下观察。
熔点测定 取适量SIM、CAR和IRB的晶体和熔融冷却产物, 置于毛细管中, 放入熔点测定仪中进行测定, 初始温度为25 ℃, 升温速率为1.0 ℃·min-1, 观察样品在升温过程的现象。
X-射线粉末衍射(X-ray powder diffraction, XRPD) 分别取SIM、CAR、IRB的晶体和熔融冷却产物粉末约200 mg, 采用X-射线衍射仪Cu-Kα靶进行测定, 扫描速度为10°·min-1, 扫描范围为5~40° 2θ, 步长为0.02°, 波长为1.540 6 Å, 管压为40 kV, 管流为40 mA。采用Origin 8.0软件分析数据。
差示扫描量热法(differential scanning calorimetry, DSC) 分别取SIM、CAR、IRB的晶体和熔融冷却产物粉末约3~5 mg放于铝坩埚内, 采用DSC热分析仪进行测定, 在20~250 ℃内以10 ℃·min-1进行升温。采用NETZSCH-Proteus 4.2热分析软件处理数据。
傅里叶变换红外光谱(Fourier transform infrared spectroscopy, FT-IR) 分别将适量SIM、CAR、IRB的晶体和熔融冷却产物粉末与KBr压成薄片, 用红外光谱仪测定, 于4 000~400 cm-1内进行扫描。采用Nicolet Omnic 8.0红外光谱处理软件处理数据。
无定形凝胶化的影响因素考察温度对无定形凝胶化的影响 分别称取约500 mg无定形SIM、CAR及IRB粉末置于10 mL不同温度(SIM: 8、15、25、37 ℃; CAR: 15、25、30、37 ℃; IRB: 37、45、50、55 ℃) 的纯水中, 用玻璃棒沿着同一方向匀速搅拌, 直至粉末与水溶液充分接触, 观察无定形粉末在不同温度下的凝胶化现象。
pH值对无定形凝胶化的影响 称取约500 mg无定形CAR粉末置于25 ℃、10 mL不同pH值(0.25、0.5、1、2) 的盐酸溶液中, 用玻璃棒沿着同一方向匀速搅拌, 直至粉末与盐酸溶液充分接触, 观察无定形CAR在不同pH值下的凝胶化现象; 称取约500 mg无定形IRB粉末置于45 ℃、10 mL不同pH值(0.25、0.5、1、2) 的盐酸溶液中, 同法操作, 观察IRB无定形在不同pH值下的凝胶化现象。
扫描电子显微镜(scanning electron microscope, SEM) 取无定形SIM、CAR和IRB凝胶适量, 均匀地分散于黏有黑色双面胶的载玻片上(厚度约为15~20 nm), 在真空条件下将试样表面喷金处理后, 置于扫描电镜下观察样品外观形态, 实验中激发电压设置为20 kV。
溶出实验 将SIM晶体、SIM无定形、CAR晶体、CAR无定形、IRB晶体和IRB无定形按照《中国药典》2015版四部0931第三法(小杯法) 装置进行实验, 释放介质为200 mL纯化水, 转速为50 r·min-1, SIM晶体及其无定形、CAR晶体及其无定形的介质温度均为37 ℃, IRB晶体及其无定形的介质温度为50 ℃。称取上述样品约200 mg投入介质中, 分别于0.5、1、2、4、7、10和24 h取溶液3 mL, 经0.22 μm滤膜过滤, 取续滤液作为供试品溶液进行高效液相色谱(high performance liquid chromatography, HPLC) 分析, 同时补充相同温度的介质3 mL。每组平行测定3份。此外, 平行进行另一组实验, 分别于0.5、1、2、4、10和24 h时在溶出杯同一相对位置处取出部分样品, 通过PLM及XRPD研究无定形样品在溶出期间的析晶行为。
SIM的HPLC分析方法 采用Ultimate XB-C18色谱柱(150 mm×4.6 mm, 5 μm), 柱温为30 ℃, 以甲醇-0.02 mol·L-1乙酸铵(冰醋酸调节pH至4.0) (85∶15) 为流动相, 总流速为1.0 mL·min-1, 检测波长为243 nm, 灵敏度0.05 AUFS (absorbance unit full scale), 进样体积20 μL[20]。在该色谱条件下, SIM的保留时间约为5.8 min, 色谱峰与溶剂峰分离良好, 专属性良好。
CAR的HPLC分析方法 采用Kromasil C18色谱柱(150 mm×4.6 mm, 5 μm), 柱温为30 ℃, 以乙腈-0.02 mol·L-1磷酸二氢钾(用磷酸调节pH至3.5) (45∶55) 为流动相, 总流速为1.0 mL·min-1, 检测波长为241 nm, 灵敏度0.05 AUFS, 进样体积20 μL[21]。在该色谱条件下, CAR的保留时间约为7.0 min, 色谱峰与溶剂峰分离良好, 专属性良好。
IRB的HPLC分析方法 采用Ultimate Lp-C18色谱柱(250 mm×4.6 mm, 5 μm), 柱温为35 ℃, 以乙腈-磷酸溶液(取85%磷酸5.5 mL, 加水至950 mL, 以三乙胺调节pH至3.2) (35∶65) 为流动相, 总流速为1.0 mL·min-1, 检测波长为245 nm, 灵敏度0.05 AUFS, 进样体积10 μL[22]。在该色谱条件下, CAR的保留时间约为12.3 min, 色谱峰与溶剂峰分离良好, 专属性良好。
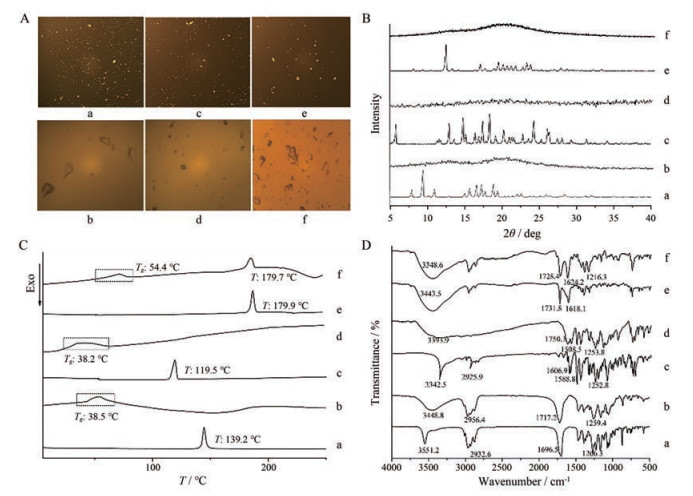
结果与讨论 1 物理化学表征 1.1 PLM结果SIM、CAR、IRB晶体及其熔融冷却产物的PLM结果如图 3A所示, SIM、CAR和IRB晶体在PLM下均呈现出明暗交替的双折射现象; 三者的熔融冷却产物均呈现不规则片状, 无双折射现象, 表明均形成了无定形态。
|
Figure 3 Polarizing microscope (PLM) photographs (10×10) (A), X-ray powder diffraction (XRPD) patterns (B), differential scanning calorimetry (DSC) thermograms (C) and Fourier transform infrared spectroscopy (FT-IR) spectra (D) of crystalline SIM (a) and its melt cooling product (b), crystalline CAR (c) and its melt cooling product (d), crystalline IRB (e) and its melt cooling product (f) |
通过熔点测定仪观察, SIM晶体在138.5~139.5 ℃发生熔融, 其熔融冷却产物在32~40 ℃转变为透明玻璃状, 此阶段即为玻璃化转变过程; CAR晶体的熔点为117.5~119.0 ℃, 其熔融冷却产物在30~38.5 ℃转变为透明玻璃状, 发生玻璃化转变; IRB晶体的熔点为179.5~180.5 ℃, 其熔融冷却产物在50~55.5 ℃转变为透明玻璃状, 随着温度进一步升高, 可以观察到白色固体物质的析出(析晶), 至180 ℃左右完全熔融为液态。
无定形药物在熔点测定的升温过程中, 可以观察到玻璃态向过冷液态的转变, 此时的温度为玻璃化转变温度(glass transition temperature, Tg), 随着温度的继续升高, 过冷液态的无定形可能会发生析晶, 最后在晶体熔点附近熔融为液态。
1.3 XRPD分析SIM、CAR、IRB晶体及其熔融冷却产物的XRPD检测结果如图 3B所示, SIM晶体在7.83°、9.35°、10.92°、16.52°、17.23°、17.68°和19.38° 2θ处有明显的晶体衍射峰, 与文献报道一致[20]; CAR晶体在5.80°、12.96°、14.82°、16.45°、17.41°、18.43°、19.23°、22.86°、24.35°、26.16°和26.38° 2θ处有明显的晶体衍射峰, 与文献报道一致[23]; IRB晶体在12.40°、16.90°、19.37°、19.94°、20.48°、21.06°、21.63°、22.58°、23.11°和23.58° 2θ处具有明显的晶体衍射峰, 与文献报道一致[24]。SIM、CAR和IRB三者熔融冷却产物的XRPD图谱中均未出现晶体的衍射峰, 而是呈现弥散状, 表明SIM、CAR及IRB通过熔融冷却过程均形成了无定形态。
1.4 DSC分析无定形药物出现玻璃化转变时会在DSC图谱中呈现“阶梯状”的热容变化, 此时的温度称为Tg[25]。SIM、CAR、IRB晶体及其熔融冷却产物的DSC结果如图 3C所示, SIM晶体在139.2 ℃处有单一且尖锐的吸热熔融峰, 其熔融冷却产物在38.5 ℃处出现玻璃化转变, 表明SIM熔融冷却产物是不同于SIM晶体的无定形态, 与文献报道一致[20]; CAR晶体在119.5 ℃处有单一且尖锐的吸热熔融峰, 其熔融冷却产物在38.2 ℃出现玻璃化转变, 表明CAR熔融冷却产物是不同于CAR晶体的无定形态, 与文献报道一致[26]; IRB晶体在179.9 ℃处有单一且尖锐的吸热熔融峰, 其熔融冷却产物在54.4 ℃处发生玻璃化转变, 在179.7 ℃熔融为液态, 表明IRB熔融冷却产物是不同于IRB晶体的无定形态。各样品的DSC结果与熔点测定仪测定结果相近。
1.5 FT-IR分析SIM、CAR、IRB晶体及其熔融冷却产物的FT-IR图谱如图 3D所示, SIM晶体的νO-H峰出现在3 551.2 cm-1, νC-H峰在2 932.6 cm-1, 酯基中的νC=O峰出现在1 696.5 cm-1, νC-O峰在1 266.3 cm-1, 与文献报道一致[27, 28]。与SIM晶体相比, 其无定形态的峰发生了一定程度的位移, 例如νO-H峰和νC-H峰分别移至3 448.8和2 956.4 cm-1, 酯基中的νC=O峰、νC-O峰分别移至1 717.2和1 259.4 cm-1, 且峰形均较宽, 这可能是由于无定形化后原晶体的晶格排列被破坏, 分子构象进行重排所致[29]。
CAR晶体在3 342.5 cm-1有一尖锐的窄峰, 为νN-H峰。νC-H峰出现在2 925.9 cm-1、1 606.9 cm-1和1 588.8 cm-1分别为芳香环、脂肪链上βN-H峰, 1 252.8 cm-1处为βO-H与νC-O的重叠峰[30]。CAR无定形的νN-H峰由3 342.5 cm-1蓝移至3 393.9 cm-1, 且峰形变宽, 其余峰的峰形和峰位也有变化, 与文献中所述一致[26]。
IRB晶体中仲胺νN-H的伸缩振动峰位于3 443.5 cm-1, 内酰胺中νC=O的伸缩振动在1 731.8 cm-1, 1 618.1 cm-1推断为νC=N的伸缩振动峰[24]。IRB无定形仲胺νN-H的伸缩振动由3 443.5 cm-1蓝移至3 448.6cm-1处, 内酰胺中νC=O的伸缩振动移至1 728.4 cm-1, 峰形变宽, νC=N的伸缩振动移至1 624.2 cm-1。
综上分析, 根据PLM、XRPD、DSC及FT-IR等表征结果可知, 熔融冷却法能够成功制备出SIM、CAR、IRB 3种药物的无定形态, 后续实验将对所制备的无定形SIM、CAR和IRB的凝胶化进行研究。
2 凝胶形成的影响因素考察及微观形态表征 2.1 温度对无定形凝胶化的影响SIM无定形、CAR无定形和IRB无定形在不同温度条件下的凝胶化现象如图 4所示。在相同的搅拌情况下, SIM无定形粉末在8 ℃的水中呈现混悬液状, 未出现凝胶化现象, 但随着温度慢慢升高至15 ℃, 可以观察到混悬液中的粉末慢慢聚集在一起, 形成有黏性的凝胶团块。且温度越高, 形成凝胶的速度越快, SIM无定形凝胶的黏性越强。

|
Figure 4 Gelation phenomena of amorphous SIM, CAR and IRB at different temperatures |
CAR无定形粉末在15 ℃的水中呈现混悬液状, 未形成凝胶团块。25 ℃时, 无定形粉末开始聚集形成絮状物。当温度继续升高至30 ℃及37 ℃时, CAR无定形粉末均能聚集成团, 形成明显的白色凝胶团块, 且温度越高, 越容易形成。与SIM无定形凝胶相比, CAR无定形凝胶的黏性较弱, 硬度较强。
IRB无定形粉末在37 ℃的水中呈现混悬液状, 未形成凝胶团块。当温度升至45 ℃时, 无定形粉末在介质表面形成一层膜, 能聚集形成絮状物, 但未形成明显凝胶团块。而在50 ℃及55 ℃的介质中, IRB无定形粉末均能聚集成团, 形成微黄色的凝胶团块, 且温度越高, 凝胶越容易形成。IRB无定形凝胶与CAR无定形凝胶的性质较为类似, 其黏性及延展性弱于SIM无定形凝胶。
综上分析, 温度会影响无定形药物的凝胶化, 温度越高, 无定形粉末越容易聚集形成凝胶, 且黏性越强。无定形药物形成凝胶时存在临界凝胶温度(Tgel), 当溶液温度高于Tgel时, 无定形才会出现凝胶化现象。SIM无定形凝胶的Tgel为8~15 ℃, CAR无定形凝胶的Tgel为25~30 ℃, IRB无定形凝胶的Tgel为45~50 ℃。
2.2 pH值对无定形凝胶化的影响除温度外, 本研究还采用了单因素考察, 在无定形药物未形成凝胶的温度(低于Tgel) 条件下, 考察pH值对无定形凝胶的影响。结果发现, 在不同pH值的盐酸溶液中, SIM无定形不能形成凝胶, 呈混悬液状; CAR和IRB无定形凝胶的形成与否及其程度随着pH值的改变发生明显变化。因此, 本研究进一步考察了pH值对CAR和IRB无定形凝胶形成的影响。
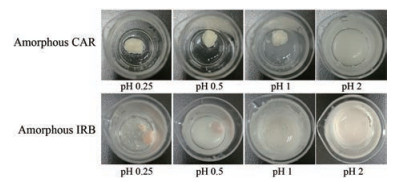
CAR和IRB无定形在不同pH值条件下的凝胶化现象如图 5所示。在相同的搅拌情况下, CAR无定形在pH 0.25、0.5和1的盐酸溶液中均能够聚集成白色凝胶团块, 但随着介质pH值的增加, 形成凝胶的能力减弱。当介质pH 2时, CAR无定形粉末呈白色混悬液状, 在室温静置后, 有明显的分层现象, 但无凝胶化现象。与在25 ℃纯水中形成的凝胶相比, CAR无定形在酸性条件下形成的团块很快变硬变脆, 且黏性减弱。
|
Figure 5 Gelation phenomena of amorphous CAR and IRB in HCl solution with various pH values |
在相同的搅拌情况下, IRB无定形在pH 0.25和0.5的盐酸溶液中聚集成凝胶团块。其中, 在pH 0.25的盐酸溶液中, 淡黄色粉末聚集成淡黄色的凝胶团块; 在pH 0.5的盐酸溶液中, 部分形成淡黄色的凝胶团块。而在pH 1的溶液中, 粉末聚集形成絮状物, 堆积在底部, 呈现白色浑浊状, 但是未能形成凝胶团块; 在pH 2的盐酸溶液为白色混悬液, 无凝胶化现象。与CAR无定形在酸性介质中形成凝胶的性质类似, IRB无定形在强酸溶液中形成的凝胶团块很快就变硬变脆, 且黏性较弱。
综上分析, 在温度低于Tgel的酸性条件下, 无定形也会出现凝胶化现象, 由此说明温度不是介导凝胶形成的唯一因素, pH值也会影响无定形凝胶化, 且pH越低, 越容易形成凝胶。无定形在酸性介质中存在临界凝胶pH值(pHgel), 当低于pHgel时出现凝胶化现象, 无定形CAR在pH < 1时形成凝胶, 无定形IRB在pH < 0.25时形成凝胶。
2.3 无定形凝胶微观形态的表征为观察无定形凝胶的微观形态, 分别对SIM、CAR、IRB无定形在水中形成的凝胶以及CAR、IRB无定形在盐酸溶液中形成的凝胶进行SEM表征分析。3种无定形凝胶的SEM图有明显的区别, SIM无定形水凝胶的微观形态由纤维交互缠结的三维网络结构组成(图 6a); CAR无定形水凝胶呈短片状层层堆积在一起, 能够看到明显的空隙, 有明显的交联(图 6b); IRB无定形水凝胶呈现为片状, 有明显的交联, 片状层层堆积形成阶梯状(图 6c)。CAR无定形在酸性条件下形成的凝胶, 能够看到许多细小的孔隙, 形成类似“蜂窝煤”状的结构(图 6d); IRB无定形在酸性条件下形成的凝胶, 由纤维相互交联堆积在一起形成网状结构(图 6e)。两者在酸性条件下形成的凝胶形态均与相同温度下水中形成的凝胶形态有较大差异。

|
Figure 6 Scanning electron microscope (SEM) images of amorphous SIM gel in water at 37 ℃ (a), amorphous CAR gel in water at 37 ℃ (b), amorphous IRB gel in water at 55 ℃ (c), CAR amorphous gel in HCl solution (25 ℃, pH 0.25) (d), IRB amorphous gel in HCl solution (45 ℃, pH 0.25) (e) |
SIM晶体和SIM无定形、CAR晶体和CAR无定形、IRB晶体和IRB无定形的溶出结果分别如图 7A~C所示, SIM晶体、CAR晶体和IRB晶体在整个溶出过程中粉末均分散在介质中, 不会聚集成团; 而SIM无定形、CAR无定形和IRB无定形均出现了凝胶化现象, 粉末聚集成团, 黏附在桨轴上, 形成白色凝胶团块。三者共同的特征为无定形态药物的溶出显著低于其晶态药物。
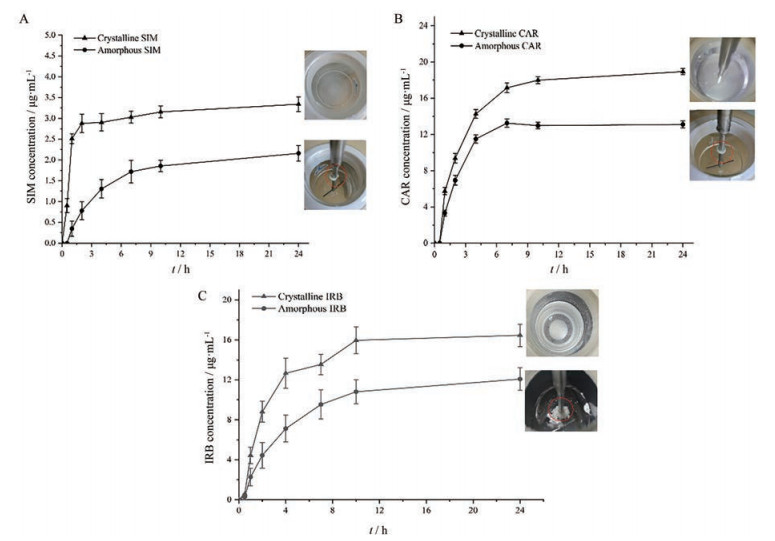
|
Figure 7 Supersaturated dissolution profiles and photographs of SIM (A), CAR (B) and IRB (C) in their crystalline (▲) and amorphous(●) states in water at 37, 37 and 50 ℃, respectively (n = 3, x ± s) |
SIM无定形、CAR无定形和IRB无定形在凝胶化过程中的析晶行为分别如图 8A~C所示。采用PLM观察, SIM无定形在2 h内大部分保持无定形态, 随着溶出进行, 无定形粉末析晶的程度增加, 24 h后几乎全部析晶; CAR无定形和IRB无定形的析晶行为均与之类似。结果表明, 无定形样品在凝胶化初期大多数保持为无定形态, 但随着时间延长, 析晶程度显著增加。
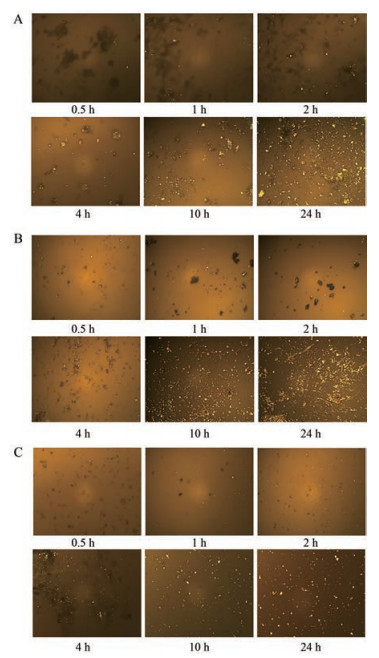
|
Figure 8 PLM photographs (10×10) of the collected solid materials at various time points during dissolution of amorphous SIM in water at 37 ℃ (A), amorphous CAR in water at 37 ℃ (B) and amorphous IRB in water at 50 ℃ (C) |
将SIM、CAR、IRB晶体和无定形溶出实验进行至4 h时取出的样品进行XRPD分析, 如图 9所示。SIM无定形凝胶部分处于无定形态, 结晶度较弱, 在9.34°、10.90°、16.54°、17.21°、17.68°、19.38°和22.54° 2θ处出现晶体衍射峰, 与SIM晶体一致[20]; CAR无定形凝胶部分处于无定形态, 结晶度较弱, 在12.93°、14.83°、17.44°、18.41°、20.28°、24.31°和26.16° 2θ处出现晶体衍射峰, 与CAR晶体一致[23]; IRB无定形凝胶部分处于无定形态, 结晶度较弱, 在12.40°、16.90°、19.96°、20.48°、21.62°、22.58°和23.10° 2θ处出现晶体的特征衍射峰, 与IRB晶体一致[24]。XRPD结果表明, SIM、CAR和IRB无定形在溶出实验发生凝胶化的过程中, 伴随着析晶的产生。
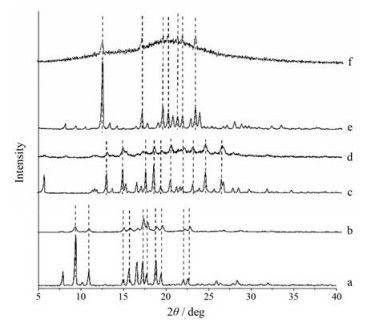
|
Figure 9 X-ray powder diffraction (XRPD) patterns of crystalline SIM (a), amorphous SIM gel (b), crystalline CAR (c), amorphous CAR gel (d), crystalline IRB (e), and amorphous IRB (f) |
根据溶出实验结果可知, SIM无定形态在整个溶出期间的溶出显著低于其晶态, PLM结果显示SIM无定形在2 h内多数以无定形态存在, 由此说明SIM无定形较低的溶出速率不是由于析晶造成的。进一步分析可知, 在溶出过程中, SIM无定形接触溶出介质后粉末聚集成凝胶团块, 使得介质无法渗透进入无定形内部, 且团块内部溶解的药物分子无法向本体溶液扩散, 从而阻碍了药物的溶出。CAR无定形和IRB无定形在溶出过程中也出现了同样的凝胶化现象, 从而导致在整个溶出期间无定形态的溶出显著低于其晶态, 未能改善晶体的溶出。
4 无定形凝胶的机制分析 4.1 过冷液态与无定形凝胶化过冷液态和玻璃态是无定形物质存在的两种形态, 两者之间发生转变的温度称为玻璃化转变温度。玻璃态具有一定的硬脆性, 而过冷液态保留液体热力学性质, 具有一定的流动性、延展性和黏性, 其黏度一般在10-3~1012 Pa·s[15]。
Hancock等[31]研究发现, 水是一种有效的增塑剂, 能够显著降低无定形药物的Tg。无定形SIM、CAR和IRB粉末与一定温度的水溶液接触, 在水的塑化作用下, 其Tg降低, 当降至介质温度时, 无定形药物将进入黏度较高的过冷液态。最先与水接触的药物粉末最早进入过冷液态, 进而迅速形成黏性的膜状物质, 逐渐发生聚集, 并包裹未与水接触的药物粉末, 形成黏性团块。随着水分逐渐渗入聚集团块的内部, 被包裹的无定形粉末也将进入过冷液态。与此同时, 药物分子进行重排自组装成三维网络结构(图 6), 吸附的水分散布于网络结构中, 形成具有一定黏性和延展性的凝胶。而SIM、CAR和IRB晶体药物在与水接触的过程中, 不会发生玻璃化转变而进入过冷液态, 故无凝胶化现象。因此, 无定形药物进入高黏度的过冷液态是其凝胶化的驱动力, 高温和水的塑化作用都会加速无定形进入过冷液态, 进而促进凝胶化。
4.2 Tgel与水对无定形药物的润湿性具有凝胶化性质的无定形药物在水溶液中存在Tgel, 当介质温度高于Tgel时, 无定形会出现凝胶化现象。本研究中的3种模型药物, SIM无定形凝胶的Tgel为8~15 ℃, CAR无定形凝胶的Tgel为25~30 ℃, IRB无定形凝胶的Tgel为45~50 ℃。由DSC结果可知, SIM无定形和CAR无定形的Tg均在38 ℃左右, 但是二者的Tgel差异较大, 由此推断, 无定形药物Tg的大小不会直接影响凝胶化的难易程度。
后续实验过程中发现, 水对SIM无定形粉末的润湿性很好, 一旦与水接触, SIM无定形粉末很容易浸湿, 吸附一定量水分后, 其Tg降低, 当降至介质温度时, 无定形粉末在液面自发聚集形成一层“膜”, 像链条一样聚集在一起, 不需要搅拌, 即可形成白色透明状凝胶。15 ℃时, SIM无定形在水中就会出现凝胶化现象。与之相比, CAR无定形粉末投入25 ℃水中后, 水对其润湿性较差, 无定形粉末吸附水分的能力较弱, 粉末漂浮在液面未形成凝胶。当水的温度升高至30 ℃, 吸附少量水分的CAR无定形的Tg降低至介质温度时, 先接触液面的CAR无定形粉末在液面上聚集形成一层“膜”, 将其余粉末包裹在一起, 形成聚集体, 水分慢慢渗入聚集体中心, 形成白色有黏性的凝胶团块。
水的塑化作用, 可以加速无定形进入过冷液态, 但是由于水对无定形药物的润湿性及药物自身特性的差异, 导致水对其塑化作用的程度不同, 进而其在水中形成凝胶的临界温度的不同。因此, 温度是影响无定形凝胶化的重要因素, 水对无定形药物的润湿性及药物吸附水分的能力也会影响凝胶化。
4.3 pHgel与无定形药物酸性条件下的质子化在温度低于Tgel的酸性介质中, SIM无定形不会出现凝胶化现象, 而CAR和IRB无定形则会出现凝胶化现象。CAR无定形在25 ℃水溶液中未出现凝胶化现象, 但是在25 ℃、pH 0.25~1的盐酸溶液中则出现凝胶化现象。同样, IRB无定形在45 ℃水溶液中未出现凝胶化现象, 但是在45 ℃、pH 0.25~0.5的盐酸溶液中则会出现凝胶化现象。由此可以说明, 温度不是影响无定形药物凝胶化的唯一因素, 同时药物结构可能也会对凝胶化产生影响。
分析本研究中3种药物的化学结构发现, 无定形CAR结构中具有吡咯基团和仲胺基团, 无定形IRB结构中具有咪唑环、叔胺基团和四氮唑基团。上述特殊基团均为含N结构, 而无定形SIM结构中没有相关含N基团。在强酸条件下, 上述含N基团易发生不同程度的质子化, 形成N+-H结构, 从而增加了药物分子与溶剂的水合作用, 促进了药物分子的溶解, 加速了溶解-聚集平衡的形成, 这是凝胶形成的前提[32]。与此同时, 质子化的药物, 可能会通过分子间作用力发生自组装, 经过缠绕聚集包裹溶剂, 最终形成凝胶体系。而结构中不含N的无定形SIM药物分子, 在强酸条件下, 不会发生质子化, 进而不会发生后续的自组装形成凝胶。因此, 推测药物分子中易发生质子化的含N结构, 可能是酸性条件下触发分子自组装, 发生凝胶化的重要原因之一。
关于药物质子化触发的凝胶化, 已有研究证实, 如无定形盐酸鲁拉西酮(LH), 其结构中含有的N+-H键触发了酸性条件下凝胶的形成[13]。此外, 根据文献报道, 无定形利托那韦[33]和无定形头孢泊肟酯[16]在酸性条件中出现的凝胶化现象, 可能也是受到了药物结构中类似含N基团质子化的触发。
结论本研究采用熔融冷却法制备得到SIM、CAR和IRB 3种药物的无定形态。SIM、CAR及IRB无定形, 与水或盐酸溶液接触时, 均会出现聚集成团的凝胶化现象, 导致了显著低于晶体的异常溶出行为。温度和pH值是影响凝胶化的重要因素, 无定形药物在特定的温度和pH值下开始发生凝胶化, 无定形SIM、CAR与IRB的Tgel分别为8~15 ℃、25~30 ℃和45~50 ℃, 无定形CAR与IRB的pHgel分别为1和0.25。小分子无定形药物向过冷液态的转变是其凝胶化重要驱动力, 药物分子在酸性介质中质子化导致的自组装也是凝胶形成的触发因素之一。因此, 小分子无定形药物在溶出时表现出的显著低于晶体的异常溶出行为, 是药物在综合因素驱动下发生凝胶化的结果。本研究对小分子无定形药物在制剂研发中出现的凝胶化现象进行了深入研究, 阐明了无定形药物的异常溶出行为与凝胶化之间的关系, 为凝胶化的解决和利用提供了理论基础。
作者贡献: 任俊杰和衡伟利负责实验操作、结果分析及文章的撰写和修改; 周生研负责实验操作、资料整理; 高缘和张建军是本研究的构思者, 负责对实验设计、数据分析、文章撰写和修改进行指导。
利益冲突: 本文的研究内容不存在任何利益冲突。
| [1] |
Pinnamaneni S, Das NG, Das S. Formulation approaches for orally administered poorly soluble drugs[J]. Die Pharm, 2002, 57: 291-300. |
| [2] |
Perrut M, Jung J, Leboeuf F. Enhancement of dissolution rate of poorly-soluble active ingredients by supercritical fluid processes. Part I: Micronization of neat particles[J]. Int J Pharm, 2005, 288: 3-10. DOI:10.1016/j.ijpharm.2004.09.007 |
| [3] |
Yao J, Shi NQ, Wang XL. The development of co-amorphous drug systems[J]. Acta Pharm Sin (药学学报), 2013, 48: 648-654. |
| [4] |
Hao TY, Wei YF, Qian S, et al. Advances in strategies of improving solubility and permeability of taxanes[J]. Acta Pharm Sin (药学学报), 2018, 53: 54-61. |
| [5] |
Yu L. Amorphous pharmaceutical solids: preparation, characterization and stabilization[J]. Adv Drug Deliv Rev, 2001, 48: 27-42. DOI:10.1016/S0169-409X(01)00098-9 |
| [6] |
Murdande SB, Pikal MJ, Shanker RM, et al. Solubility advantage of amorphous pharmaceuticals: I. A thermodynamic analysis[J]. J Pharm Sci, 2010, 99: 1254-1264. DOI:10.1002/jps.21903 |
| [7] |
Kim J, Kim M, Park HJ, et al. Physicochemical properties and oral bioavailability of amorphous atorvastatin hemi-calcium using spray-drying and SAS process[J]. Int J Pharm, 2008, 359: 211-219. DOI:10.1016/j.ijpharm.2008.04.006 |
| [8] |
Wei Y, Zhou S, Hao T, et al. Further enhanced dissolution and oral bioavailability of docetaxel by coamorphization with a natural P-gp inhibitor myricetin[J]. Eur J Pharm Sci, 2019, 129: 21-30. DOI:10.1016/j.ejps.2018.12.016 |
| [9] |
Wei Y, Ling Y, Su M, et al. Characterization and stability of amorphous tadalafil and four crystalline polymorphs[J]. Chem Pharm Bull, 2018, 66: 1114-1121. DOI:10.1248/cpb.c18-00450 |
| [10] |
Chawla G, Bansal AK. A comparative assessment of solubility advantage from glassy and crystalline forms of a water-insoluble drug[J]. Eur J Pharm Sci, 2007, 32: 45-57. DOI:10.1016/j.ejps.2007.05.111 |
| [11] |
Burley JC, Duer MJ, Stein RS, et al. Enforcing Ostwald's rule of stages: isolation of paracetamol forms Ⅲ and Ⅱ[J]. Eur J Pharm Sci, 2007, 31: 271-276. DOI:10.1016/j.ejps.2007.04.002 |
| [12] |
Guzman H, Tawa M, Zhang Z, et al. Combined use of crystalline salt forms and precipitation inhibitors to improve oral absorption of celecoxib from solid oral formulations[J]. J Pharm Sci, 2007, 96: 2686-2702. DOI:10.1002/jps.20906 |
| [13] |
Qian S, Wang S, Li Z, et al. Charge-assisted bond N(+)H mediates the gelation of amorphous lurasidone hydrochloride during dissolution[J]. Int J Pharm, 2017, 518: 335-341. DOI:10.1016/j.ijpharm.2016.12.059 |
| [14] |
Hancock BC, Zografi G. The relationship between the glass transition temperature and the water content of amorphous pharmaceutical solids[J]. Pharm Res, 1994, 11: 471-477. DOI:10.1023/A:1018941810744 |
| [15] |
Andronis V, Zografi G. Molecular mobility of supercooled amorphous indomethacin, determined by dynamic mechanical analysis[J]. Pharm Res, 1997, 14: 410-414. DOI:10.1023/A:1012026911459 |
| [16] |
Hamaura T, Kusai A, Nishimura K. Gel formation of cefpodoxime proxetil[J]. Stp Pharm Sci, 1995, 5: 324-331. |
| [17] |
Kakumanu VK, Arora VK, Bansal AK. Investigation of factors responsible for low oral bioavailability of cefpodoxime proxetil[J]. Int J Pharm, 2006, 317: 155-160. DOI:10.1016/j.ijpharm.2006.03.004 |
| [18] |
Hirrien M, Chevillard C, Desbrieres J, et al. Thermogelation of methylcelluloses: new evidence for understanding the gelation mechanism[J]. Polymer, 1998, 39: 6251-6259. DOI:10.1016/S0032-3861(98)00142-6 |
| [19] |
Nagarkar S, Nicolai T, Chassenieux C, et al. Structure and gelation mechanism of silk hydrogels[J]. Phys Chem Chem Phys, 2010, 12: 3834-3844. DOI:10.1039/b916319k |
| [20] |
Cheng J, Guo HH, Zhang JJ, et al. Physical and chemical properties of co-amorphous simvastatin-gliclazide[J]. J China Pharma Univ (中国药科大学学报), 2015, 46: 301-308. |
| [21] |
Hao J. Study on Co-amorphous Carvedilol (共无定形卡维地洛的研究)[D]. Nanjing: China Pharmaceutical University (中国药科大学), 2014.
|
| [22] |
Wei XB, Wang MY, Lu TT. Determination of irbesartan by HPLC[J]. Chin J Biochem Pharm (中国生化药物杂志), 2015, 35: 141-143. |
| [23] |
Beyer P, Reinholz E. Thermodynamically stable modification of 1-(4-carbazolyl-oxy-3-[2-(2-methoxy phenoxy)-ethylamino]-2-propanole, process for its preparation and pharmaceutical compositions containing it. EP, 0893440A1[P]. 1999.
|
| [24] |
Bocskei Z, Simon K, Rao R, et al. Irbesartan crystal form B[J]. Acta Crystallogr, 1998, 54: 808-810. |
| [25] |
Hancock BC, Zografi G. Characteristics and significance of the amorphous state in pharmaceutical systems[J]. J Pharm Sci, 1997, 86: 1-12. DOI:10.1021/js9601896 |
| [26] |
Pokharkar VB, Mandpe L, Padamwar MN, et al. Development, characterization and stabilization of amorphous form of a low Tg drug[J]. Powder Technol, 2006, 167: 20-25. DOI:10.1016/j.powtec.2006.05.012 |
| [27] |
Ambike AA, Mahadik KR, Paradkar A. Spray-dried amorphous solid dispersions of simvastatin, a low Tg drug: in vitro and in vivo evaluations[J]. Pharm Res, 2005, 22: 990-998. DOI:10.1007/s11095-005-4594-z |
| [28] |
Zhang F, Aaltonen J, Tian F, et al. Influence of particle size and preparation methods on the physical and chemical stability of amorphous simvastatin[J]. Eur J Pharm Biopharm, 2009, 71: 64-70. DOI:10.1016/j.ejpb.2008.07.010 |
| [29] |
Lobmann K, Strachan CJ, Grohganz H, et al. Co-amorphous simvastatin and glipizide combinations show improved physical stability without evidence of intermolecular interactions[J]. Eur J Pharm Biopharm, 2012, 81: 159-169. DOI:10.1016/j.ejpb.2012.02.004 |
| [30] |
Wen X, Tan F, Jing Z, et al. Preparation and study the 1:2 inclusion complex of carvedilol with beta-cyclodextrin[J]. J Pharm Biomed Anal, 2004, 34: 517-523. DOI:10.1016/S0731-7085(03)00576-4 |
| [31] |
Hancock BC, Zografi G. The relationship between the glass transition temperature and the water content of amorphous pharmaceutical solids[J]. Pharm Res, 1994, 11: 471-477. DOI:10.1023/A:1018941810744 |
| [32] |
Estroff LA, Hamilton AD. Water gelation by small organic molecules[J]. Chem Rev, 2004, 104: 1201-1218. DOI:10.1021/cr0302049 |
| [33] |
Law D, Krill SL, Schmitt EA, et al. Physicochemical considerations in the preparation of amorphous ritonavir-poly(ethylene glycol) 8000 solid dispersions[J]. J Pharm Sci, 2001, 90: 1015-1025. DOI:10.1002/jps.1054 |
 2021, Vol. 56
2021, Vol. 56


