2. 中国科学院大学, 北京 100049;
3. 西北民族大学化学化工学院, 甘肃 兰州 730030;
4. 兰州佛慈制药股份有限公司, 甘肃 兰州 730046;
5. 甘肃岷县当归研究院, 甘肃 定西 748400;
6. 甘肃省药品检验研究院, 甘肃 兰州 730000
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. School of Chemical Engineering, Northwest Minzu University, Lanzhou 730030, China;
4. Lanzhou Foci Pharmaceutical CO., LTD, Lanzhou 730046, China;
5. Minxian Institute of Angelica sinensis of Gansu Province, Dingxi 748400, China;
6. Gansu Institute for Drug Control, Lanzhou 730000, China
当归[Angelica sinensis (Oliv.) Diels] 主产于甘肃东南部, 在青海、云南、四川、陕西等地也有栽培, 具有补血、和血、调经止痛、润肠滑肠等药理作用[1, 2]。种植区域扩大、药材产量增加以及安全用药需要致使当归药材质量控制亟待加强[3, 4]。当归药材的质控方法采用阿魏酸、藁本内酯等指标成分已进行过大量研究[5-11], 现代药理研究表明当归的主要药效标志物为藁本内酯, 且其挥发油90%以上化学成分为藁本内酯[12-20], 因此藁本内酯的含量对于当归药材质量优劣的评价至关重要[21-23], 但其化学结构存在多个双键构成的高度不饱和共轭体系, 决定其稳定性较差, 在提取、分离、纯化和贮存过程中极易发生氧化、聚合等降解反应[13, 14, 24, 25], 导致藁本内酯的对照品可靠性至今尚未解决, 因此定量测定当归药材中的藁本内酯含量存在诸多不确定性。
本文通过化学转化法建立间接测定当归药材中藁本内酯的检测技术, 最大限度避免由于藁本内酯的不稳定而影响其药材含量测定的准确性。鉴于90%以上的商品当归药材供应产自甘肃和青海两省, 本研究大量采集甘肃和青海的原产地药材标本和市场商品化药材样本, 采用化学转化法测定其藁本内酯的准确含量, 通过多样本的藁本内酯含量数据分析, 为中国药典提升当归药材定量检测质量标准提供科学依据。
材料与方法仪器与试剂 Agilent 1200高效液相色谱仪(安捷伦公司, 美国), 包括G1315D二极管阵列检测器(DAD), G1354A四元泵, G1328B手动进样器(20 μL定量环), G1316A柱温箱; 数控超声清洗机(KQ-500DB型, 昆山市超声仪器有限公司); Sartorius BSA224S-CW电子分析天平(Sartorius, 德国); 甲醇(色谱纯, 山东禹王和天下新材料有限公司); 环丙胺(分析纯, 上海萨恩化学技术有限公司); 藁本内酯对照品(81944-09-4, 98.0%, 成都普瑞法科技有限公司); 环丙藁本对照品[mp: 116~118 ℃, [α] = 0 (c 0.5, CH3OH), 无色或白色棱柱状结晶, 由中国科学院兰州化学物理研究所西北特色植物资源化学重点实验室合成, 通过1D、2D NMR、HE-ESI-MS、X-ray等多种现代波谱技术鉴定为目标化合物, 并按照国家药品标准物质制备指导原则制备, 采用有关杂质(正丁环丙内酰胺) 的含量差减法标定对照品的纯度为99.4%, 批号: LICP20200102]。
材料 原产地当归药材样本(68份) 于2019年11、12月分别采自甘肃省和青海省的不同种植基地, 采挖后洗净泥沙, 阴凉干燥处自然放置至干待用。商品当归样本于2020年6月采自岷县当归城(45份) 和渭源县会川药材市场(10份), 1.5年储存期当归样本于2019年5、6月采购自岷县当归城(10份) 和渭源县会川药材市场(5份), 采购后于实验室自然放置干燥, 水分检测达到中国药典(2015版) 要求, 经西北民族大学罗兴平教授鉴定为Angelica sinensis (Oliv.) Diels的干燥根。
色谱条件 色谱柱: Elite SinoChrom ODS-BP (250 mm×4.6 mm, 5 μm); 柱温为25 ℃, 流速为1.0 mL·min-1; 流动相: 甲醇-超纯水(65∶35), 等度洗脱; 进样量: 20 μL (N = 10 864.57, R = 3.08)。
对照品溶液的制备 精密称量环丙藁本对照品0.050 01 g, 色谱甲醇定容于50 mL量瓶中, 于5 ℃冰箱冷藏放置, 用时取出, 放置至室温正常使用; 藁本内酯对照品现配现用。
供试品溶液的制备 取当归药材适量, 粉碎并过四号药典筛, 精密称定药材粉末0.5 g, 置于25 mL带塞单口圆底烧瓶中, 加入一定量环丙胺和甲醇, 电磁搅拌(转速2 400 r·min-1) 提取/反应适当时间, 将以上圆底烧瓶超声适当时间, 提取/反应产物再继续电磁搅拌提取/反应适当时间后停止搅拌, 反应物真空抽滤, 药渣以甲醇洗涤3次, 每次10 mL, 合并滤液并定容至50 mL量瓶中作为供试品溶液。
反应机制 环丙胺的氨基与藁本内酯的内酯环羰基官能团发生分子间亲核取代反应, 生成酰胺过渡态, 同时环戊烯基侧链的烯醇结构发生异构化形成酮羰基, 酰胺键的氮原子同时与异构化的酮羰基发生分子内亲核取代, 最终通过两次亲核反应形成五元环内酰胺稳定结构[13, 21]。因此, 该技术采用化学转化方法将不稳定的藁本内酯转化为等摩尔化学结构稳定的环丙藁本, 通过测定环丙藁本的量间接计算当归药材中的藁本内酯的含量(反应机制见图 1)。
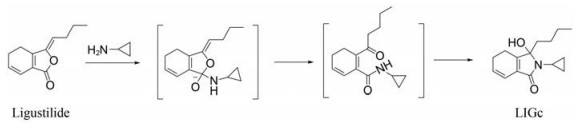
|
Figure 1 Principle of indirectly determination of ligustilide (LIG) in Angelica sinensis (Oliv.) Diels through the chemical transformational method |
检测波长 目标化合物(环丙藁本和藁本内酯) DAD检测波长的确定: 环丙藁本对照品溶液(110.0 μg·mL-1) 和藁本内酯对照品溶液(80.0 μg·mL-1) 进行HPLC-DAD全波长扫描检测。
方法学验证线性关系考察 取环丙藁本对照品储备液, 依次倍比稀释共计9份不同浓度对照品溶液, 按HPLC-DAD色谱条件进样测定, 记录各溶液环丙藁本峰面积。分别以浓度为横坐标, 以峰面积为纵坐标进行线性回归, 计算线性回归方程和相关系数。
精密度 精密吸取环丙藁本标准溶液, 连续进样6次, 以环丙藁本峰面积计算RSD值。
稳定性 将反应完毕的供试品溶液, 每间隔2 h进样测定一次环丙藁本的HPLC色谱图, 直至10 h, 计算藁本内酯的含量及RSD值。
重复性 精密称取同一产地当归药材粉末6份进行平行实验, 按“供试品溶液的制备”项下方法制备供试品溶液, 以HPLC-DAD色谱条件测定藁本内酯的含量, 计算RSD值。
加样回收率 依据《中国药典》 (2020版) 中质量标准分析方法验证指导原则, 设计供试品溶液中环丙藁本含量的80%、100%、120%浓度各3组, 加入环丙藁本对照品, 进行加样回收率实验, 并测定环丙藁本的峰面积, 计算回收率。
当归药材中藁本内酯的含量计算基于检测原理及方法学研究基础之上, 当归药材中藁本内酯的准确含量W按以下公式(式1) 计算得到:
| $ \begin{array}{l} W(\% ) = \frac{{{C_{{\rm{LIGc}}}} \times V \times {{10}^{ - 6}} \times {M_{{\rm{rLIG}}}}}}{{{M_{r{\rm{LIGc}}}} \times m}} \times 100\% \\ \;\;\;\;\;\;\;\;\; = 7.695 \times {10^{ - 5}} \times \frac{{{C_{{\rm{LIGc}}}} \times V}}{m}(\% ) \end{array} $ | (1) |
其中CLIGc为供试品溶液中环丙藁本的浓度, 单位为μg·mL-1, 其值根据供试品溶液232 nm检测下环丙藁本色谱峰面积ALIGc, 按标准曲线计算得到CLIGc; Mr LIG为藁本内酯的摩尔质量, 其值为190.2 g·moL-1; Mr LIGc为环丙藁本的摩尔质量, 其值为247.16 g·moL-1; m为待测当归药材粉末的称重质量; V为供试液定容体积。
当归药材中藁本内酯的化学转化反应条件优化 根据化学反应动力学和热力学理论, 化学反应的速率和产率主要取决于反应温度、反应浓度、反应时间等关键因素。在预试的基础上, 称取过四号药典筛当归药材粉末0.500 0 g, 固定体系总体积为5 mL, 设计三个反应进程, 初次搅拌提取/反应, 超声提取/反应和再次搅拌提取/反应, 针对该反应进行单因素影响实验和多因素综合影响实验的筛选优化。
单因素影响研究方法: ①反应温度。恒温水浴控制反应温度分别为15、17.5、20、22.5、25、27.5、30、32.5、35、37.5、40、42.5和45 ℃, 加入环丙胺3.75 mL及甲醇1.25 mL, 初次搅拌45 min, 超声5 min, 并再次搅拌45 min; ②反应物投料比。固定最佳反应温度, 分别加入环丙胺0.65、1.30、1.60、1.80、2.00、2.20、2.40、2.60、2.80、3.00、3.20、3.40、3.60、3.75、4.55和5.00 mL, 其余用甲醇补足, 初次搅拌45 min, 超声5 min, 并再次搅拌45 min; ③反应时间。在最佳反应温度、反应物投料比下, 按照固定其中两个时间, 优化第3个时间条件的方式, 设计18次转化反应(表 1), 考察反应时间对化学转化率的影响。
| Table 1 Optimization of chemical reaction time conditions for indirect determination of ligustilide content in Angelica sinensis |
多因素影响研究方法: 参考单因素实验结果, 设置三因素三水平, 采用Design-Expert设计软件Box-Behnken模型, 进一步优化最佳化学转化条件, 效应面实验条件设置见表 2。
| Table 2 Optimization of transform conditions by Box-Behnken design for the indirect determination of ligustilide content in Angelica sinensis |
反应过程监控及最佳化学转化条件验证 化学转化优化完毕的条件下, 取藁本内酯对照品43.1 mg和方法学研究用当归粉末0.500 0 g制备供试液, 检测化学转化反应的完全程度; 以方法学研究用当归粉末平行6组进行测定, 并与单因素、多因素测定结果比较, 验证该条件是否为最佳化学转化条件。
藁本内酯对照品的重新标定及两种测定方法比较 准确称取藁本内酯对照品8.35 mg加入5 mm核磁管中, 并加入均三甲氧基苯内标(WR = 99%) 12.5 mg, 用CDCl3 0.6 mL溶解, 测定混合物的1H NMR, 按公式(2) 对藁本内酯纯度重新标定(藁本内酯化学性质的不稳定, 参照文献中1H NMR的标定方法进行[26])。
| $ W_{\mathrm{S}}(\%)=\frac{\frac{A_{\mathrm{S}}}{n_{\mathrm{S}}} \times M_{\mathrm{S}} \times m_{\mathrm{S}}}{\frac{A_{\mathrm{R}}}{n_{\mathrm{R}}} \times M_{\mathrm{S}} \times m_{\mathrm{S}}} \times W_{\mathrm{R}}(\%) $ | (2) |
AS: 藁本内酯分子中δ 6.2 (2dt, J = 4.0, 12.0 Hz, H-6, 1H) 质子信号积分面积; nS: 选定藁本内酯积分信号代表的质子数; MS: 藁本内酯相对分子质量; AR: 内标均三甲氧基苯分子中δ 6.03 (s, H-2, 4, 6, 3H) 的质子信号积分面积; nR: 内标均三甲氧基苯被积分信号峰包含的质子数; MR: 内标均三甲氧基苯相对分子质量; mS: 称取的藁本内酯对照品质量; mR: 称取的内标均三甲氧基苯质量; WR%: 内标均三甲氧基苯的质量分数(99%); WS%: 藁本内酯对照品的真实纯度。
随机选择一组当归原产地样本, 以超声波辅助法(500 W, 100 MHz, 20 ℃, 30 min) 平行6组进行药材中藁本内酯的直接提取, 通过重新标定的藁本内酯对照品进行含量计算, 并以化学转化法对该样本平行6组进行含量测定。
化学转化法间接测定当归药材中藁本内酯含量的应用 按优化及验证的化学转化检测条件, 对68份甘肃和青海省内原产地当年采集的当归药材样本、55份商品化当归药材样本(当年药材) 及21份商品化当归药材样本(1.5年及以上储藏期) 进行藁本内酯的含量测定, 进行显著性差异分析并作讨论。
结果 1 色谱条件优化选择最大紫外吸收波长330和232 nm分别作为藁本内酯、环丙藁本的定量检测波长; 当归甲醇提取物及供试品溶液HPLC-DAD检测结果见图 2A (tRLIG = 18.1 min, tRLIGc = 10.7 min), c为232 nm下当归甲醇提取液色谱图, tR = 10.7 min无色谱峰, 以232 nm作为环丙藁本的定量检测波长不受提取物中其他杂质干扰; e为232 nm下供试品溶液色谱图, DAD峰纯度检测环丙藁本色谱峰为单一化合物; f为330 nm下供试品溶液色谱图, 无藁本内酯色谱峰, 结合图 2B对供试品溶液中藁本内酯及环丙藁本色谱峰峰面积的检测结果, 表明藁本内酯已反应完全且生成的环丙藁本没有转化为其他物质。
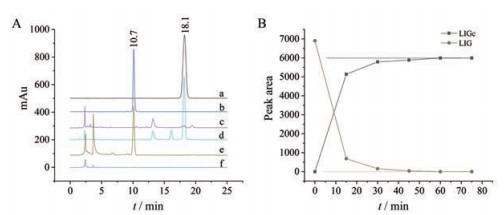
|
Figure 2 Typical HPLC chromatogram (A) and chromatographic peak areas in DAD detector of analytes (B). a: LIG reference substance chromatogram at 330 nm; b: LIGc reference substance chromatogram at 232 nm; c: The chromatogram of the AS extract before LIG reaction at 232 nm; d: The chromatogram of the AS extract before LIG reaction at 330 nm; e: The chromatogram of the AS extract chromatogram (LIGc) after LIG reaction at 232 nm; f: The chromatogram of the AS extract chromatogram (LIGc) after LIG reaction at 330 nm |
以环丙藁本对照品溶液浓度(X) 为自变量, 色谱峰峰面积(Y) 为因变量进行线性回归和拟合, 得线性回归方程为Y = 31.807X + 74.987, R = 0.999 9。环丙藁本浓度在15.625~1 000 μg·mL-1内, 其浓度与峰面积具有良好的线性关系。
2.2 精密度环丙藁本峰面积的RSD = 0.803%, 表明环丙藁本测定方法和仪器精密度良好, 符合中国药典(2020版) 含量测定方法学要求。
2.3 稳定性供试品溶液稳定性RSD = 0.995%, 表明供试品溶液在10 h内稳定。
2.4 重复性藁本内酯测定含量为1.556% ± 0.080%, RSD = 0.549%, 该测定方法重复性良好。
2.5 加样回收率80%、100%、120%浓度下加样回收率平均值分别为100.83%、98.94%和101.94%, RSD (%) 分别为0.998 6%、0.994 2%和0.997 8%, 加样回收率满足药典方法学要求的95%~105%之间, RSD小于3%, 表明方法准确度良好。
3 当归药材中藁本内酯的化学转化反应条件优化 3.1 单因素温度对藁本内酯化学转化的影响结果见图 3A, 温度较低时, 化学反应速度较慢且提取效率较低; 温度较高时, 加速了藁本内酯的氧化降解等转化。30 ℃下所测藁本内酯含量最高, 选择30 ℃作为最佳反应温度, 研究其他因素对藁本内酯化学转化产率的影响。
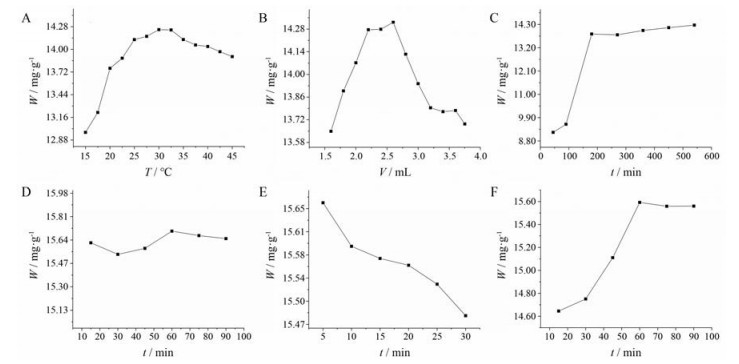
|
图 3 Optimization of chemical transformational conditions for indirect determination of ligustilide content in Angelica sinensis. A: The effect of react temperature on the conversional rate; B: The effect of the addition amount of cyprolamine on the conversional rate; C: The effect of stirring time on the conversional rate; D: The effect of initial stirring time on the conversional rate; E: The effect of ultrasound time on the conversional rate; F: The effect of the stirring time again on the conversional rate |
环丙胺试剂加入量对化学转化的影响结果见图 3B, 投入环丙胺2.6 mL时, 所测藁本内酯含量最高。选择环丙胺的投料量为2.6 mL, 同时加入甲醇2.4 mL, 继续研究反应时间对于藁本内酯化学转化率的影响。反应时间对化学转化的影响结果见图 3C~F。单纯持续搅拌, 藁本内酯含量测定值最高为1.420%, 对应反应时间为9 h (图 3C); 延长初次搅拌反应时间后含量测定结果增幅较小, 表明药材粉末表面游离的藁本内酯化学转化迅速趋于完全(图 3D); 延长超声时间, 藁本内酯的转化率有降低现象, 超声对反应物的稳定性有一定影响, 时间不宜过长(图 3E); 再次搅拌时间超过60 min时, 藁本内酯含量趋于恒定, 化学转化反应已完全(图 3F)。
3.2 多因素Design-Expert Box-Behnken模型17次实验下, ANOVA二项式多影响因素的综合拟合得多元相关方程: W = 1.56 + 5.25 × A × 10-3 + 0.033 × B + 0.034 × C - 0.020 × AB + 5.0 × 10-4 × AC - 0.012 × BC - 0.047 × A2 - 0.045 × B2 - 0.038× C2。
拟合方程模型的F为27.59, 概率P为0.000 1, 模型具有极显著统计学相关关系; 模型相关系数为0.972 6, 拟合方程中自变量与因变量之间具有显著的相关关系; 模型的变异系数为0.92%, 模型精度较好; 失拟项F为3.68, 概率P为0.120 4, 失拟项不显著, 回归方程拟合较好。数值优化/方法项下给出的最佳转化反应条件: 反应温度31 ℃、反应时间60 min、加入2.4 mL环丙胺及2.6 mL甲醇。
综上所述, 供试品溶液的具体制备方法为: 取当归药材适量, 粉碎机粉碎并过四号药典筛, 精密称定药材粉末0.5 g, 置于25 mL带塞单口圆底烧瓶中, 加入环丙胺2.4 mL及甲醇2.6 mL, 31 ℃下电磁搅拌(转速2 400 r·min-1) 提取/反应15 min, 再将圆底烧瓶置于超声提取器中超声5 min (100 MHz、20 ℃), 提取/反应产物继续在31 ℃下电磁搅拌提取/反应60 min后停止搅拌, 反应物砂芯漏斗真空抽滤, 药渣以甲醇洗涤3次, 每次10 mL, 合并甲醇溶液, 定容至50 mL量瓶中。
3.3 反应过程监控及最佳化学转化条件验证藁本内酯对照品反应完毕供试液HPLC检测表明, 反应后330 nm下tR = 18.1 min色谱峰完全消失, 反应后232 nm下增加tR = 10.7 min环丙藁本色谱峰; 方法学研究用当归粉末反应完毕供试液HPLC检测结果见图 2B, 反应60 min时藁本内酯色谱峰完全消失, 且反应时间延长至75 min时环丙藁本色谱峰面积无变化; 藁本内酯百分含量测定结果为1.572 ± 0.007 (%), RSD = 0.462 %, 该测定结果皆高于单因素、多因素优化中单次实验的测定结果。综合上述结果, 表明该最佳检测条件可信度高, 方法重复性良好, 藁本内酯的测定结果无限接近于真实值。
3.4 商品藁本内酯对照品准确含量的标定(NMR方法和化学转化法)1H NMR中AS = 1.23, AR = 3, 根据式(2) 计算得WS = 91.99%, 与标示量98%有显著差异; HPLC检测“反应过程监控”项下对照品反应完毕供试液, 计算得对照品纯度为91.76%。
3.5 两种方法(直接法和间接法)测定当归药材中藁本内酯含量直接提取法测定藁本内酯含量为1.300% ± 0.038%; 化学转化法测定藁本内酯含量为1.350% ± 0.014% (P > 0.05, 无显著性差异)。
4 化学转化法间接测定当归药材中藁本内酯含量的应用按“多因素”项下供试品溶液具体制备方法, 对68组甘肃和青海省内原产地当年所采当归药材样本进行藁本内酯的含量测定, 各产地内样本中藁本内酯的含量统计作图分析结果见图 4A, 平均含量为1.407% ± 0.384%, 最低含量为0.779% ± 0.006%, 最高含量为2.584% ± 0.003%; 对55份商品化当归药材样本进行藁本内酯的含量测定, 其含量统计结果见图 4A, 平均含量为1.475% ± 0.467%, 最低含量为0.713% ± 0.031%, 最高含量为2.377% ± 0.009%。商品当归和原产地当归样本的藁本内酯含量采用箱线图统计, 结果见图 4B,55组商品化当归药材样本的藁本内酯含量中位数为1.435%, 与原产地当归药材进行单因素显著性差异分析(P > 0.05), 两者差异性不显著。
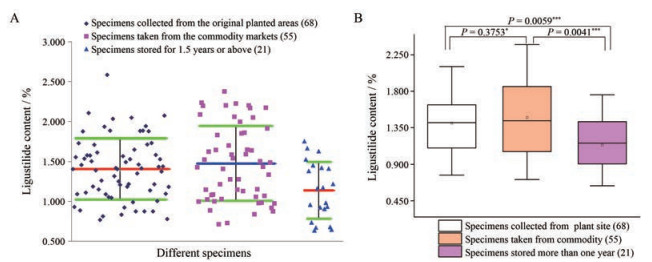
|
Figure 4 Statistical results of chemical transformational indirect method for determination of ligustilide content in Angelica sinensis specimens. A: Statistical results of scatter plot among different specimens; B: Statistical results of boxplot among different specimens |
对21份商品化当归药材样本(1.5年及以上储藏期)进行藁本内酯的含量测定, 平均含量为1.138% ± 0.356%, 最低含量为0.636% ± 0.005%, 最高含量为1.756% ± 0.008%, 统计作图分析结果见图 4A。对三组当归样本中藁本内酯含量测定结果采用箱线图统计分析, 当归原产地样本(P < 0.01) 和商品化当年当归样本(P < 0.01) 的含量测定结果与1.5年及以上储藏期的当归样本藁本内酯含量存在极显著差异。
讨论《中国药典》 (2020版) 关于当归药材的质量标准及国际标准中的定量检测指标仍采用阿魏酸和挥发油总量, 但中药材应以药效标志物作为最佳质量控制指标, 藁本内酯作为当归药材的药效标志物早已在学术和产业领域达成共识, 建立藁本内酯的定量检测技术符合国内、国际对当归药材质量控制的客观需求。
化学转化法的准确度取决于藁本内酯提取率及转化率, 本研究借助提取和固定反应同时进行的思想, 先固定药材粉末表面大量的藁本内酯, 再利用空化作用将细胞内固化的藁本内酯提取至体系中并反应完全, 保证了方法的准确性。此外, 扩大反应的原料化合物比例达九百多倍, 将检测周期控制在2.5~ 3.0 h以内, 实现了快速且准确地进行质量检测。
本文检测了144份当归样本(68份原产地样本、55份商品化样本和21份储存时间达1.5年及以上的样本), 结果表明, 藁本内酯的平均含量为1.417 ± 0.427 (%), 最高含量达到2.584 ± 0.003 (%), 最低含量为0.636 ± 0.006 (%), 80.74%的样本藁本内酯含量高于1.0%。若按香港中药材标准0.6%的含量限度规定, 则本研究采用的当归样本全部合格; 若按样本量5%的不合格率设定检测限, 则藁本内酯的含量限度应不低于0.779%; 若按样本量的10%不合格率设定检测限, 则藁本内酯的含量限度应不低于0.877%。研究数据显示当归药材储存1.5年以上, 藁本内酯含量将显著下降, 将有大量药材不合格, 综合考虑药材产地和商品有效消耗周期的特殊性, 以及产品初加工和现代农业集约化发展趋势, 药材的储存期限不能强制低于1.5年。本研究建议中国药典有关当归药材的质量标准可以参照香港中药材标准[4, 21], 以藁本内酯的含量为定量检测指标, 其含量限度以不低于0.6%为宜。
作者贡献: 伍鹏程、赵盼负责实验研究、数据分析、图谱绘制及文稿撰写, 魏小宁、刘鹏伟、王云洁负责当归样本采集, 罗兴平、郝泉负责样本鉴定和对照品标定, 蔺瑞丽、倪琳、宋平顺负责方法学设计和计量验证, 通讯作者柳军玺负责项目总体设计、规划以及稿件修改。
利益冲突: 本文作者声明该论文没有涉及任何利益冲突。
| [1] |
Chinese Flora Editorial Committee of Chinese Academy of Sciences. Flora of China (中国植物志)[M]. Beijing: Science Press, 1992: 41-42.
|
| [2] |
State Pharmacopoeia Committee. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[M]. Beijing: China Medical Science Press, 2015: 202-203.
|
| [3] |
Yan H, Zhang XB, Zhu SD, et al. Production regionalization study of Chinese Angelica based on MaxEnt model[J]. China J Tradit Mater Med (中国中药杂志), 2016, 41: 3139-3147. |
| [4] |
Wang YJ, Yan H, Huang SL, et al. Establishment of HPLC fingerprint and stoichiometry of Angelica sinensis[J]. Chin Tradit Pat Med (中成药), 2020, 42: 514-519. |
| [5] |
Lin LZ, He XG, Lian LZ, et al. Liquid chromatographic-electrospray mass spectrometric study of the phthalides of Angelica sinensis and chemical changes of Z-ligustilide[J]. J Chromatogr A, 1998, 810: 71-79. DOI:10.1016/S0021-9673(98)00201-5 |
| [6] |
Lu GH, Chan K, Liang YZ, et al. Development of high-performance liquid chromatographic fingerprints for distinguishing Chinese Angelica from related Umbelliferae herbs[J]. J Chromatogr A, 2005, 1073: 383-392. DOI:10.1016/j.chroma.2004.11.080 |
| [7] |
Yi LZ, Liang YZ, Wu H, et al. The analysis of Radix Angelicae Sinensis (Danggui)[J]. J Chromatogr A, 2009, 1216: 1991-2001. DOI:10.1016/j.chroma.2008.07.033 |
| [8] |
Nino G, Yang YP, Franz KH, et al. Angelica sinensis (Oliv.) Diels: influence of value chain on quality criteria and marker compounds ferulic acid and Z-ligustilide[J]. Medicines, 2017, 4: 1-14. DOI:10.3390/medicines4010001 |
| [9] |
Hou J, Guo HR, Du T, et al. Quality study of new varieties of Angelicae sinensis in different storage periods based on index compounds and near-infrared spectroscopy[J]. J Chin Med Mater (中药材), 2020, 43: 564-568. |
| [10] |
Chen J, Zhang Y, Wang HL, et al. Fingerprint and multi-components content determination of standard decoction of Angelicae sinensis Radix[J]. Chin Tradit Herb Drugs (中草药), 2019, 50: 4538-4546. |
| [11] |
Xu XQ, Chen Bo, Zhang XB, et al. Determination and evaluation of multicomponent content of Angelica sinensis in the main production areas of Gansu by UPLC[J]. Nat Prod Res Dev (天然产物研究与开发), 2020, 32: 1014-1022. |
| [12] |
Yan ML, Ding GY, Cong LF, et al. Rapid evaluation of vasodilation efficacy of Angelica sinensis by near infrared spectroscopy based on quality markers[J]. Chin Tradit Her Drug (中草药), 2019, 50: 4538-4546. |
| [13] |
Zhang YX, Zhang YM, Han YM, et al. Pharmacokinetics, tissue distribution, and safety evaluation of a ligustilide derivative (LIGc)[J]. J Pharm Biomed Anal, 2020, 182: 113140. DOI:10.1016/j.jpba.2020.113140 |
| [14] |
Yan R, Ko NL, Li SL, et al. Pharmacokinetics and metabolism of ligustilide, a major bioactive component in Rhizoma Chuanxiong, in the rat[J]. Drug Metab Dispos, 2008, 36: 400-408. DOI:10.1124/dmd.107.017707 |
| [15] |
Alejandra L, Mayela DA, Jose LV, et al. Phthalides: distribution in nature, chemical reactivity, synthesis, and biological activity[J]. Prog Chem Org Nat Prod, 2017, 104: 127-245. |
| [16] |
Zuo AH, Wang L, Xiao HH. Research progress studies on pharmacology and pharmacokinetics of ligustilide[J]. China J Chin Mater Med (中国中药杂志), 2012, 37: 13-16. |
| [17] |
Zhang LB, Lv JL, Chen H, et al. Research progress of structures and pharmacological activities of phthalides from Angelica sinensis[J]. China J Chin Mater Med (中国中药杂志), 2016, 41: 167-176. |
| [18] |
Zhao KJ, Dong TX, Tu PF, et al. Molecular genetic and chemical assessment of Radix Angelica (Danggui) in China[J]. J Agric Food Chem, 2003, 51: 2576-2583. DOI:10.1021/jf026178h |
| [19] |
Zhang XG, Li XR, Wang QL, et al. Study on effects of endophytes on growth and production of Z-Ligustilide and ferulic acid in Angelica sinensis[J]. Braz J Bot, 2016, 39: 417-426. DOI:10.1007/s40415-015-0245-8 |
| [20] |
Yan ML, Cong LF, Zhang ZY, et al. Rapid evaluation of anti-inflammatory efficacy of Angelica sinensis (Oliv.) Diels by near infrared spectroscopy based on quality markers[J]. J Instrum Anal (分析测试学报), 2020, 39: 1320-1326. |
| [21] |
International Organization for Standardization. Traditional Chinese Medicine-Angelica sinensis Root[M]. Switzerland: ISO copyright office, 2019: 1-13.
|
| [22] |
Yang WZ, Zhang YB, Wu WY, et al. Approaches to establish Q-markers for the quality standards of traditional Chinese medicines[J]. Acta Pharm Sin B, 2017, 7: 439-446. DOI:10.1016/j.apsb.2017.04.012 |
| [23] |
Yang WZ, Qiao X, Li K, et al. Identification and differentiation of Panax ginseng, Panax quinquefolium, and Panax notoginseng by monitoring multiple diagnostic chemical markers[J]. Acta Pharm Sin (药学学报), 2016, 51: 568-575. |
| [24] |
Beck JJ, Stermitz FR. Addition of methyl thioglycolate and benzylamine to (Z)-ligustilide, a bioactive unsaturated lactone constituent of several herbal medicines. An improved synthesis of (Z)-ligustilide[J]. J Nat Prod, 1995, 58: 1047-1055. DOI:10.1021/np50121a009 |
| [25] |
Zuo AH, Cheng MC, Zhuo RJ, et al. Structure elucidation of degradation products of Z-ligustilide by UPLC-QTOF-MS and NMR spectroscopy[J]. Acta Pharm Sin (药学学报), 2013, 48: 911-916. |
| [26] |
Pauli GF, Chen SN, Simmler C, et al. Importance of purity evaluation and the potential of quantitative 1H NMR as a purity assay[J]. J Med Chem, 2014, 57: 9220-9231. DOI:10.1021/jm500734a |
 2021, Vol. 56
2021, Vol. 56


