2. 南京中医药大学附属中西医结合医院, 江苏 南京 210028;
3. 江苏省中医药研究院, 中药组分与微生态研究中心, 江苏 南京 210028
2. Affiliated Hospital of Integrated Traditional Chinese and Western Medicine, Nanjing University of Chinese Medicine, Nanjing 210028, China;
3. Multi-component of Traditional Chinese Medicine and Microecology Research Center, Jiangsu Provincial Academy of Chinese Medicine, Nanjing 210028, China
肿瘤转移是肿瘤患者预后不良最终导致死亡的重要原因[1], 其中肺转移是多种恶性肿瘤最常见以及患者死亡率较高的器官转移[2], 且目前缺少有效的治疗手段。近年来的研究发现, 肿瘤在发生转移时, 会分泌一种微小囊泡——外泌体(exosomes, Exo), 促进肿瘤的转移[3]。Exo的直径在30~150 nm, 内含蛋白质、脂质和核酸等不同成分, 可作为细胞间通讯的关键参与者, 从而传递信息[4, 5]。Exo促进肿瘤转移的机制可能与炎症因子的浸润密切相关。Peinado等[6]发现小鼠尾静脉注射黑色素瘤细胞系B16-F10细胞分泌的Exo后, 肺组织中相关因子热休克蛋白、S100钙结合蛋白A8 (S100 calcium-binding protein A8, S100A8) 和S100钙结合蛋白A9 (s100 calcium-binding protein A9, S100A9) 蛋白表达升高。有学者表明, 肿瘤细胞分泌的Exo, 含有双链DNA, 可以激活细胞内DNA传感器黑素瘤缺乏因子2 (absent in melanoma 2, AIM2), 触发炎症反应[7]。环磷酸鸟苷-腺苷酸合成酶(cyclic guanosine monophosphate-adenosine monophosphate synthase, cGAS) 作为DNA感受器, 同样可以识别Exo中双链DNA[8], 进而产生2'-3' cGAMP。2'-3' cGAMP可激活干扰素基因刺激因子(stimulator of interferon gene, STING), 使STING构象改变进而招募TANK结合激酶1 (TANK-binding kinase 1, TBK1) 使其磷酸化, 接着磷酸化干扰素调节因子3 (interferon regulatory factor 3, IRF3) 并移位至细胞核中, 产生Ⅰ型干扰素(interferon, IFN) 和趋化因子, 触发炎症反应。因此, 针对炎症的研究是治疗肿瘤转移的新策略和方法。
淫羊藿(Epimedii Folium) 作为传统的补肾补虚中药, 在民间沿用已有千年历史, 具有补肾阳、强筋骨和祛风湿等传统功效, 在治疗肺部肿瘤中应用频率较高。而淫羊藿素(icaritin, ICT, 图 1) 是淫羊藿中的有效活性成分, 属异戊烯基黄酮类化合物, 也是淫羊藿活性成分淫羊藿苷体内代谢的主要产物, 具有抗炎和抗肿瘤转移的作用, 但其抗肿瘤转移的机制尚不明确。

|
Figure 1 Chemical structure of icaritin (ICT) |
本研究通过构建Exo诱导的黑色素瘤体内外转移模型, 考察了ICT对肿瘤肺转移的作用, 旨在证明ICT能够抑制Exo介导的肿瘤转移。通过ELISA检测转移肺组织中炎症因子S100A8/A9、血清淀粉样蛋白A (serum amyloid A, SAA) 和白细胞介素6 (interleukin-6, IL-6) 的表达, 计算机模拟ICT与STING结合, 并用Western blotting和免疫组化实验考察了cGAS/STING通路中关键蛋白的表达, 初步探索了ICT抑制Exo介导的黑色素瘤肺转移的机制, 为中药淫羊藿用于临床防治肿瘤转移提供重要指导。
材料与方法细胞株 小鼠恶性黑色素瘤B16BL6细胞, 购于和园生物有限公司。B16BL6细胞培养于含10%胎牛血清(fetal bovine serum, FBS) 和1%的青-链霉素的DMEM完全培养基, 37 ℃、5% CO2培养箱中培养。
实验动物 SPF级C57BL/6雄性小鼠, 由南京中医药大学动物实验中心提供, 合格证号: SCXK (苏) 2018-0007。鼠龄为4~5周, 体重为18~22 g, 动物实验获得南京中医药大学伦理委员会的同意。
药物与试剂 ICT (纯度≥ 98%, 批号: 118525-40-9, 上海源叶生物科技有限公司); 高糖DMEM培养基、胰蛋白酶(上海源培生物科技股份有限公司); FBS (以色列BI公司); 二甲亚砜(DMSO, 美国Sigma公司); BCA检测试剂盒、蛋白Marker (Thermo Fisher Scientific公司); 蛋白酶抑制剂(北京鼎国昌盛生物技术有限公司); 磷酸酶抑制剂(江苏凯基生物科技发展有限公司); 肿瘤易感基因101 (tumor susceptibility gene 101, TSG101) (14497-1-AP, Proteintech公司); phospho-STING (p-STING, Ser366) (Ab-AF7416, Affinity公司); STING (D2P2F, Cell Signaling Technology); CD9 (ab92726)、p-NAK/TBK1 (phospho S172, ab109272)、NAK/TBK1 (ab40676) (Abcam公司); Goat anti-rabbit IgG (H & L)-HRP (BS13278, Bioworld technology公司)。
仪器 超净工作台(苏州安泰空气技术有限公司); TDZ5-WS台式低速离心机(湖南星科科技有限公司); TOMY-SX500高压蒸汽灭菌器(日本TOMY公司); HERA Cell 150i CO2培养箱(美国Thermo Fisher Scientific公司); Thermo MULTISKAN GO酶标仪(赛默飞科技有限公司); 凝胶成像系统(美国Bio-Rad公司)。
Exo的提取、表征及蛋白浓度测定
Exo的提取 收集处于对数生长期的B16BL6细胞上清液, 采用梯度-超速离心的方法提取Exo, 4 ℃条件下300 ×g离心10 min, 2 000 ×g离心15 min和12 000 ×g离心30 min, 去除细胞及细胞碎片, 上清用0.22 μm的无菌过滤膜过滤除菌, 4 ℃下100 000 ×g离心70 min, 收集沉淀, PBS洗涤, 最后用200 μL PBS重悬。
Exo的表征 取Exo 10 μL, 加入纯水稀释至1 mL, 用马尔文激光粒径仪测定Exo的平均粒径、多分散系数(PDI) 及zeta电位。将载有Formvar支持膜的铜网置于蜡板上, 在膜上滴加1滴Exo的PBS重悬液。红外灯下照射5 min, 滴加1滴1%磷钨酸, 室温下风干10 min, 置于透射电镜下观察Exo的外观形态。
Western blotting检测外泌体特异性蛋白 取Exo样品, 加入5×蛋白样品上样缓冲液, 于100 ℃干式混匀器中加热10 min变性。取蛋白样品(20 μg总蛋白量) 进行电泳、转膜、洗涤封闭, 分别结合一抗(CD9和TSG101稀释倍数均为1∶1 000) 于4 ℃过夜, 洗涤, 室温下结合二抗(二抗的稀释倍数为1∶20 000) 孵育2 h后, 洗涤, ECL发光法检测蛋白条带。
Exo的总蛋白浓度测定 采用BCA法测定Exo的总蛋白浓度。取10 μL Exo, 加入高效RIPA裂解液15 μL, 共计25 μL, 涡旋混匀, 作为待测样品。取BCA试剂盒, 按试剂A∶试剂B = 50∶1, 制备工作液。在96孔板中分别加入各个稀释浓度的蛋白质标准品(25~2 000 μg·mL-1) 和待测样品各25 μL, 然后每孔加入200 μL工作液, 振荡器上震荡1 min, 37 ℃孵育30 min, 采用全波长酶标仪测定各孔562 nm处吸光度值。根据标准曲线计算Exo的总蛋白浓度。
划痕实验考察ICT对Exo诱导的B16BL6细胞迁移的影响 当B16BL6细胞融合度为80%~90%时, 用胰蛋白酶消化并重悬至单个细胞, 以每孔3×105个细胞接种于6孔板, 于37 ℃、5%的CO2环境下培养至细胞贴壁长成单层细胞。10 μL枪头沿着6孔板直径在细胞培养板上垂直划痕, PBS轻轻冲洗3次后, 拍照记录(0 h)。实验组设置空白对照组、Exo组、ICT剂量组(5、10和20 μmol·L-1), Exo组与ICT组均给予10 μg·mL-1 Exo。继续培养24 h后, 于倒置显微镜下拍照, 并计算划痕愈合度, 分析细胞迁移情况。
| $ 迁移率\left( \% \right)=\frac{初始划痕面积-24\text{ h}后划痕面积}{初始划痕面积} \ \times 100 \% $ |
ICT对Exo诱导的B16BL6细胞小鼠体内实验性转移的影响 建立小鼠黑色素瘤肺转移实验性模型。取对数生长期的B16BL6, 消化后离心, 重悬于PBS中, 调整细胞密度为每毫升5×105个, 每只C57BL/6小鼠尾静脉接种200 μL细胞悬液。小鼠接种肿瘤细胞后, 按体重随机分为模型组、Exo组、Exo + ICT (10 mg·kg-1) 组、Exo + ICT (20 mg·kg-1) 组。隔天Exo组和Exo + ICT组小鼠尾静脉Exo处理, 每只鼠20 μg, 隔天1次, 一共进行10次。同时给药组腹腔注射给予ICT (10和20 mg·kg-1), 隔天给药。21天后小鼠摘眼球取血, 处死小鼠, 剥离小鼠肺组织, 拍照并称重, 记录转移肺结节数目并对肺组织进行H & E染色来分析肺转移。
ICT对Exo诱导的体内转移肺组织炎症因子的影响 取出肺组织, 加入蛋白裂解液匀浆, 反复冻融4~5次, 12 000 r·min-1离心10 min, 取上清, BCA测定蛋白浓度。按照ELISA试剂盒的操作方法(标准品的稀释、加样温育、加检测抗体、洗板、加酶温育、洗板、显色、终止及测定) 检测肺组织中炎症因子S100A8/A9、SAA和IL-6因子的释放。采用免疫荧光法考察纤连蛋白fibronectin的表达, 取4%多聚甲醛固定的肺组织, 蔗糖脱水、OCT包埋、冰冻切片、封闭、孵一抗、二抗、DAPI复染、荧光淬灭封片液封片, 荧光显微镜观察拍摄。
分子对接 下载化合物的*mol格式文件, 用Chem Office软件将化合物结构保存为*mol2格式, 经加氢、赋予力场后, 保存为SD格式, 备用。STING蛋白结构下载于PDB数据库, PDB ID为4F5FD。蛋白经加氢、准备、赋予力场后, 定义其原配体的位置为活性位点, 球状半径设为9。采用Discovery studio 3.5平台的Cdocker模块进行对接。
免疫组化检测p-STING、fibronectin在肺组织中的表达 肺组织浸入4%多聚甲醛溶液中固定, 固定的肺组织经脱水、石蜡包埋、切片、脱蜡, 将切片浸入0.01 mol·L-1柠檬酸盐缓冲液(pH 6.0), 微波炉加热修复抗原; PBS清洗, 3% BSA的PBS溶液封闭, 然后滴加一抗, 4 ℃过夜; PBS清洗, 滴加二抗, 室温孵育1.5 h; DAB室温显色; 蒸馏水洗涤; 苏木素轻度复染、脱水、透明、封片; 最后镜检并采集图像。
Western blotting检测p-STING、STING、p-TBK1和TBK1在肺组织中的表达 取50 mg的肺组织, 加预冷的蛋白裂解液冰上研磨, -80 ℃冻融过夜, 然后4 ℃条件下, 12 000 r·min-1离心10 min, 收集上清。利用BCA法测定样品蛋白浓度。取适量肺上清, 加入5×蛋白样品上样缓冲液, 于干式混匀器中100 ℃蛋白加热变性10 min。配胶、上样、SDS-PAGE电泳后转膜, TBST缓冲液配制的5%脱脂奶粉封闭, 一抗孵育, 4 ℃过夜, 加入二抗, 室温孵育2 h, 最后化学发光曝光显影。
统计学分析 应用GraphPad 8.0软件进行统计分析。所有实验均独立重复3次, 计量资料以x ± s表示, 各组分别与对照组进行单因素方差分析。
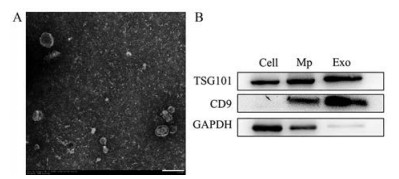
结果 1 Exo的表征从对数生长期的小鼠黑色素瘤B16BL6细胞上清液中提取Exo, 马尔文粒径仪检测粒径和电位, 结果表明, 所提取的Exo平均粒径约为(149.33 ± 2.68) nm, 分散均匀, 多分散系数为(0.192 ± 0.02), zeta电位为(-32.22 ± 0.50) mV, 呈负电荷。电镜下显示: Exo形态均匀, 具有茶托样的双层膜结构, 大小约在100 nm左右(图 2A)。BCA法检测Exo的蛋白含量, 标准曲线为y = 0.796 5x + 0.009 4, 计算含量为(838.66 ± 62.14)μg·mL-1。Western blotting实验结果表明, 所提取的外泌体能够表达TSG101和CD9外泌体标记性蛋白(图 2B), 以B16BL6细胞的裂解物及B16BL6细胞衍生的微囊泡作为对照。
|
Figure 2 Preparation and characterization of exosomes (Exo). A: Morphology of Exo detected by transmission electron. Scale bar: 200 nm; B: Expressions of tumor susceptibility gene 101 (TSG101), CD9, and glyceraldehyde-3-phosphate dehydrogenase (GAPDH) in Exo from B16BL6 cell line, using lysed B16BL6 cells (cell) and B16BL6 cell-derived microvesicles (Mp) as controls |
通过划痕法考察不同浓度的ICT (5、10和20 μmol·L-1) 抑制Exo (10 μg·mL-1) 诱导的黑色素瘤B16BL6水平迁移能力(图 3)。结果发现, Exo (10 μg·mL-1) 刺激24 h后, 能够明显诱导细胞迁移; 而给予ICT后, 随着ICT浓度的提高, 细胞划痕的愈合程度呈递减趋势。图 3是以0和24 h两个时间点为例, 发现24 h时, 对照组的划痕区域的黑色素瘤细胞发生明显迁移, 而Exo组较对照组发生更明显的迁移(P < 0.01); 而随着ICT药物浓度的增加, 划痕区域细胞迁移的数目呈降低趋势, ICT浓度为20 μmol·L-1时, 对B16BL6细胞的迁移抑制率高达90%以上(P < 0.001), 几乎完全抑制B16BL6细胞的水平迁移。

|
Figure 3 Effect of different concentrations of ICT on Exo-induced migration of B16BL6 cells. ##P < 0.05 vs blank group; **P < 0.01, ***P < 0.001 vs Exo group |
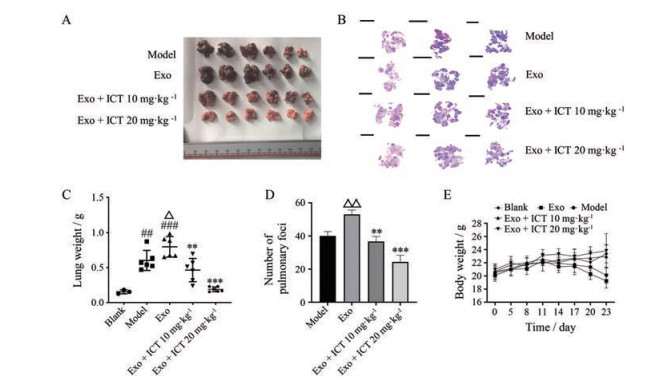
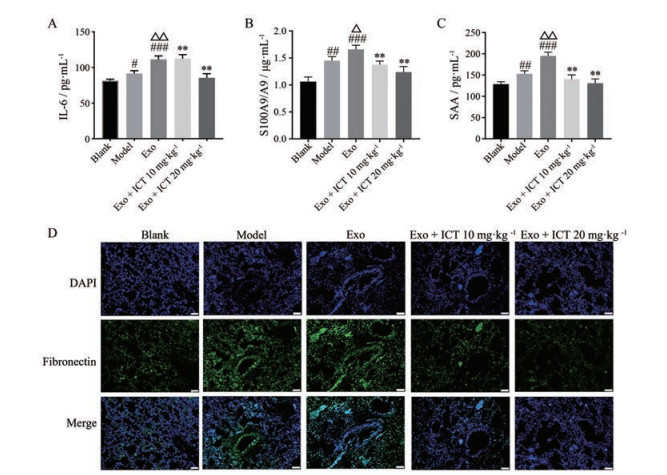
为了考察ICT对Exo诱导的B16BL6黑色素瘤体内转移情况, 本研究构建了黑色素瘤实验性肺转移模型。尾静脉接种B16BL6细胞, 同时给予Exo以及10和20 mg·kg-1 ICT, 21天后将小鼠处死, 取出肺脏, 进行拍照、称量肺重以及H & E染色。图 4结果显示, Exo组与模型组相比, 肺部肿瘤转移结节数明显增多(图 4A、B、D), 肺质量异常增加(图 4C), 体重异常降低(图 4E), 表明Exo能够促进B16BL6的肺转移; 而腹腔注射给予ICT能有效减少肺转移结节数目, 并降低肺重, 逆转体重异常降低, 抑制肿瘤的肺转移。ELISA实验结果如图 5所示, ICT抗小鼠黑色素瘤肺转移的作用可能与抑制炎症因子的表达有关。肺组织中, Exo组的IL-6、SAA和S100A8/9的含量与模型组相比较存在显著性差异, 而ICT (20 mg·kg-1) 组明显抑制了促炎细胞因子SAA、S100A8/A9和IL-6的释放(图 5A~C)。同时免疫荧光结果显示, Exo组的纤连蛋白(fibronectin) 的表达增多, ICT能够抑制fibronectin的表达(图 5D)。
|
Figure 4 Effect of ICT on Exo-induced B16BL6 cell lung metastasis in vivo. A: The lung size; B: H & E stain histological analysis of lung, scale bar: 5 mm; C: The lung weight; D: The number of pulmonary foci; E: The body weight. n = 3, x ± s. ##P < 0.01, ###P < 0.001 vs blank group; △P < 0.05, △△P < 0.01 vs model group; **P < 0.01, ***P < 0.001 vs Exo group |
|
Figure 5 Inflammatory factors effect of ICT on Exo-induced B16BL6 cell lung metastasis in the lung. A-C: ELISA was used to detect the content of interleukin 6 (IL-6, A), S100 calcium-binding protein A8/A9 complex (S100A8/9, B), and serum amyloid A (SAA, C) in the lung of each group; D: Immunofluorescence method was used to detect the content of fibronectin in the lung. Scale bar: 50 μm. n = 3, x ± s. #P < 0.05, ##P < 0.01, ###P < 0.001 vs blank group; △P < 0.05, △△P < 0.01 vs model group; **P < 0.01 vs Exo group |
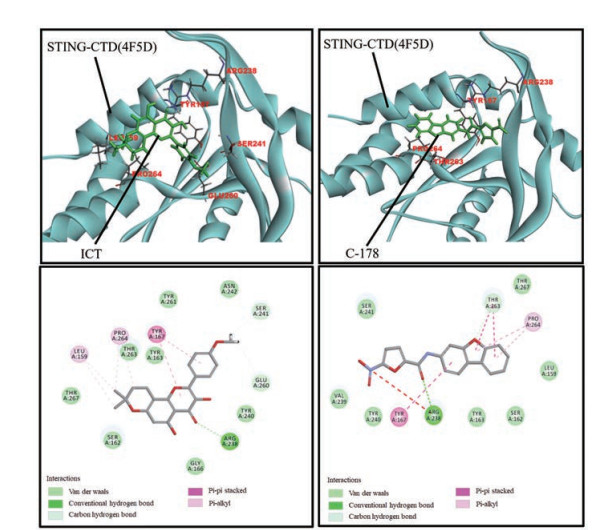
由于STING通路的激活与炎症因子的释放相关, 故运用分子模拟CDocker对ICT与STING的对接能力进行分析。研究报道C-178是STING小分子抑制剂[9], 因此将C-178作为阳性参照。分子对接结果表明: C-178分子能够与STING蛋白的氨基酸残基238位精氨酸(Arg238) 和253位苏氨酸(Thr263) 分别形成分子间氢键, 还与氨基酸残基167位酪氨酸(Tyr167)、Thr263和264位脯氨酸(Pro264) 分别形成共轭作用力。ICT能够与STING蛋白的氨基酸残基Arg238、241位丝氨酸(Ser241)、260位谷氨酸(Glu260) 形成分子间氢键, 还与Tyr167形成共轭作用力, 与氨基酸残基159位亮氨酸(Leu159)、Pro264形成疏水作用力(图 6)。
|
Figure 6 Docking pattern of ICT-STING and C-178-STING |
ICT和C-178与STING的对接有共同的氨基酸残基Arg238、Tyr167和Pro264, 且结合模式有一定的相近性。ICT和C-178与STING的相互作用的能量打分接近, 分别为32.57和30.123。综合对接能量打分和对接模式分析, 淫羊藿素结构稳定, 能够与STING-CTD活性位点相结合。
5 ICT抑制Exo诱导的B16BL6体内转移的机制初探为了进一步考察ICT抑制Exo诱导的B16BL6体内转移的机制, 基于分子对接结果的同时, 本研究通过免疫组化考察ICT对Exo介导的转移肺组织中p-STING和fibronectin的表达, Western blotting实验考察了ICT对Exo介导的转移肺组织中p-STING、STING、p-TBK1和TBK1的表达影响。结果如图 7所示, Exo组小鼠肺组织中, fibronectin和p-STING的表达较模型组增多; 与Exo组相比, ICT组小鼠肺组织中fibronectin和p-STING的表达下降(图 7A); 由图 7B可知, Western blotting实验表明, Exo组小鼠肺组织中p-STING、STING、p-TBK1和TBK1蛋白表达升高; 而ICT组, 尤其是高剂量组, 蛋白表达下降。
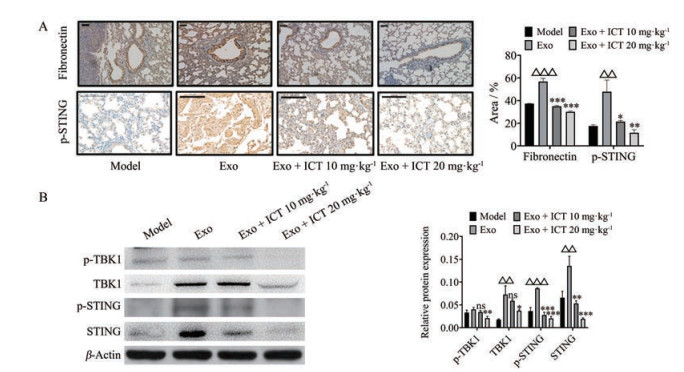
|
Figure 7 Effect of ICT on Exo-induced B16BL6 cell lung metastasis-related proteins of lung. A: Immunohistochemical method was used to detect the content of fibronectin (scale bar: 50 μm), p-STING (scale bar: 100 μm) in the lung of black mice; B: Western blotting method was used to detect the changes of p-TBK1, TBK1, p-STING, and STING protein contents in the lungs of black mice. n = 3, x ± s. △△P < 0.01, △△△P < 0.001 vs model; nsP > 0.05, *P < 0.05, **P < 0.01, ***P < 0.001 vs Exo group |
原位肿瘤与转移灶之间的对话是促进肿瘤发生转移的重要因素。原位肿瘤持续释放趋化因子和胞外囊泡等加剧肿瘤转移的发生, 其中外泌体被发现是原位肿瘤和继发转移灶之间的桥梁, 在肿瘤细胞转移过程中起了决定性的作用。因此, 本研究采用Exo作为诱导剂, 建立体内外转移模型。研究认为, 肿瘤细胞衍生的Exo加剧肿瘤细胞和局部组织的炎症是其促进肿瘤转移的重要机制。结果发现, 通过ELISA检测转移组织中炎症因子的表达, Exo的诱导可促使S100A8/S100A9、IL-6和SAA炎症相关因子的表达升高, 加重B16BL6的肺转移。IL-6是调节细胞增殖与分化的一种多效细胞因子, 具有多种控制稳态功能如免疫应答、急性期反应及造血功能。有研究表明, IL-6能够通过激活STAT3的激活, 从而促进SAA的释放[10]。而SAA是一种主要由肝脏合成的高度保守的急性期蛋白, 能够刺激自身的转录以及促炎性S100A8和S100A9蛋白的转录, 增强了肿瘤细胞对纤连蛋白的黏附, 并促进肿瘤细胞的迁移和侵袭[11]。免疫荧光实验证明, Exo组纤连蛋白表达同样增多。炎症相关的S100A8和S100A9是S100家族的钙结合蛋白, 研究表明高表达S100A8/A9能诱导黑色素瘤细胞发生转移[12]。综上所述, 研究Exo介导的肿瘤转移能够探寻有效的治疗转移的药物。
文献[13]报道, ICT对多种肿瘤如前列腺癌、肾癌、胃癌、肺癌及骨肉瘤等均有不同程度的抑制作用, 但其具体的机制尚不明确。B16BL6黑色素瘤实验性转移模型是目前常用的转移动物模型, 本研究发现, ICT可以显著抑制Exo诱导的B16BL6细胞水平迁移, 并可以显著抑制由Exo诱导的肿瘤肺转移。另外, ICT能够降低S100A8/A9和IL-6等炎症因子的表达。
研究表明, DNA是肿瘤细胞衍生的Exo荷载并传递的重要内容物, 恶性肿瘤细胞的染色体不稳定, 易产生断裂的双链DNA, 可由Exo携带进入受体细胞。而这种遗传不稳定性可激活模式识别受体信号cGAS-STING信号, 促进肿瘤的发生发展和转移[14]。此外, IL-6的表达与STING通路的激活也有关, 在STING缺失的小鼠中, IL-6表达受到抑制[15]。那么, ICT抑制炎症因子的表达是否与STING相关呢?本研究首先利用分子模拟CDocker对ICT与STING的对接能力进行分析, 发现ICT与STING蛋白的活性位点CTD结合。然后, 对小鼠体内实验性转移模型中转移肺进行免疫组化和Western blotting实验, 发现ICT能够抑制p-STING、STING、TBK1和p-TBK1的表达。
STING通路在肿瘤转移中扮演了重要的角色。STING的高表达, 一方面可以招募免疫抑制细胞如Treg细胞, 帮助肿瘤细胞逃避免疫; 另一方面可激活吲哚胺2, 3-双加氧酶(indoleamine 2, 3-dioxygenase, IDO), 促进肿瘤的增长转移。因而, STING的抑制剂的开发得到了广泛关注, 然而目前针对STING的报道较少, 主要有C-178、C-176、H-151和astin C[14]。ICT能够抑制STING的表达, 有作为STING的抑制剂开发的前景, 但是具体机制和应用有待于进一步研究。
作者贡献: 陈彦负责实验设计和文章审核等工作; 屠书梅和刘玉萍参与实验并进行数据分析, 负责完成文章撰写及文章修改等工作。
利益冲突: 所有作者声明不存在利益冲突。
| [1] |
Steeg PS. Targeting metastasis[J]. Nat Rev Cancer, 2016, 16: 201-218. DOI:10.1038/nrc.2016.25 |
| [2] |
Zhang H, Yu Y, Zhou L, et al. Circulating tumor microparticles promote lung metastasis by reprogramming inflammatory and mechanical niches via a macrophage-dependent pathway[J]. Cancer Immunol Res, 2018, 6: 1046-1056. DOI:10.1158/2326-6066.CIR-17-0574 |
| [3] |
Li K, Chen Y, Li A, et al. Exosomes play roles in sequential processes of tumor metastasis[J]. Int J Cancer, 2019, 144: 1486-1495. DOI:10.1002/ijc.31774 |
| [4] |
Record M, Carayon K, Poirot M, et al. Exosomes as new vesicular lipid transporters involved in cell-cell communication and various pathophysiologies[J]. Biochim Biophys Acta, 2014, 1841: 108-120. DOI:10.1016/j.bbalip.2013.10.004 |
| [5] |
Alenquer M, Amorim MJ. Exosome biogenesis, regulation, and function in viral infection[J]. Viruses, 2015, 7: 5066-5083. DOI:10.3390/v7092862 |
| [6] |
Peinado H, Aleckovic M, Lavotshkin S, et al. Melanoma exosomes educate bone marrow progenitor cells toward a pro-metastatic phenotype through MET[J]. Nat Med, 2012, 18: 883-891. DOI:10.1038/nm.2753 |
| [7] |
Lian Q, Xu J, Yan S, et al. Chemotherapy-induced intestinal inflammatory responses are mediated by exosome secretion of double-strand DNA via AIM2 inflammasome activation[J]. Cell Res, 2017, 27: 784-800. DOI:10.1038/cr.2017.54 |
| [8] |
Sharma A, Johnson A. Exosome DNA: critical regulator of tumor immunity and a diagnostic biomarker[J]. J Cell Physiol, 2020, 235: 1921-1932. DOI:10.1002/jcp.29153 |
| [9] |
Haag SM, Gulen MF, Reymond L, et al. Targeting STING with covalent small-molecule inhibitors[J]. Nature, 2018, 559: 269-273. DOI:10.1038/s41586-018-0287-8 |
| [10] |
Lee JW, Stone ML, Porrett PM, et al. Hepatocytes direct the formation of a pro-metastatic niche in the liver[J]. Nature, 2019, 567: 249-252. DOI:10.1038/s41586-019-1004-y |
| [11] |
Hansen MT, Forst B, Cremers N, et al. A link between inflammation and metastasis: serum amyloid A1 and A3 induce metastasis, and are targets of metastasis-inducing S100A4[J]. Oncogene, 2015, 34: 424-435. DOI:10.1038/onc.2013.568 |
| [12] |
Hiratsuka S, Watanabe A, Aburatani H, et al. Tumour-mediated upregulation of chemoattractants and recruitment of myeloid cells predetermines lung metastasis[J]. Nat Cell Biol, 2006, 8: 1369-1375. DOI:10.1038/ncb1507 |
| [13] |
Tan HL, Chan KG, Pusparajah P, et al. Anti-cancer properties of the naturally occurring aphrodisiacs: icariin and its derivatives[J]. Front Pharmacol, 2016, 7: 191. |
| [14] |
Tu SM, Liu YP, Chen Y. Research progress of cGAS-STING in tumor metastasis[J]. Acta Pharm Sin (药学学报), 2020, 55: 398-406. |
| [15] |
Abdullah A, Zhang M, Frugier T, et al. STING-mediated type-Ⅰ interferons contribute to the neuroinflammatory process and detrimental effects following traumatic brain injury[J]. J Neuroinflammation, 2018, 15: 323. DOI:10.1186/s12974-018-1354-7 |
 2021, Vol. 56
2021, Vol. 56


