2. 中药复方安徽省重点实验室, 安徽 合肥 230012;
3. 中国药科大学药学院, 江苏 南京 210009
2. Anhui Province Key Laboratory of Chinese Medicinal Formula, Hefei 230012, China;
3. School of Pharmacy, China Pharmaceutical University, Nanjing 210009, China
AT2受体是血管紧张素Ⅱ (angiotensin Ⅱ, Ang Ⅱ) 受体的其中一个亚型, 属于G蛋白偶联受体(G protein-coupled receptors, GPCRs) 家族成员之一。AT2受体在胎儿组织中高水平表达, 随着年龄的增长, 组织中AT2受体含量逐渐降低, 并在心力衰竭、心肌梗死、血管损伤、伤口愈合等病理损伤中出现明显的上调[1-3]。研究发现, AT2受体的活化可以抵消由AT1受体(血管紧张素Ⅱ受体的另一种亚型) 的激活所引起的生理效应, 如激动AT2受体可以抑制由AT1受体激活引起的血压升高[4]。因此, 早期研究针对AT2受体在肾素-血管紧张素系统(renin-angiotensin-system, RAS) 中的作用以及潜在信号通路中的作用展开了探讨。大量研究证实, AT2受体可介导RAS中的多种细胞内信号的转导, 产生抗增殖、抗纤维化、抗肿瘤细胞增生、抗血栓、促进细胞凋亡和分化等作用[5-7]。
近期研究发现, 激动AT2受体可以引起大鼠十二指肠黏膜的碱性成分分泌增多, 增强十二指肠黏膜抵御胃酸的能力; 拮抗AT2受体可以阻断神经元兴奋性, 继而产生缓解疼痛的作用[8, 9]。因此, AT2受体被认为是具有潜力的药物靶标。从早期对内源性配体Ang Ⅱ进行结构修饰, 得到一系列肽类AT2受体激动剂和拮抗剂; 到后来以非肽类、非选择性AT2受体激动剂L-162313为先导化合物, 得到的一系列非肽类AT2受体激动剂和拮抗剂, 针对作用于AT2受体化合物的研究从未止步。
本文对AT2受体的结构特点、介导的生理效应、细胞信号转导的分子机制以及作用于AT2受体的化合物的研究进展进行总结, 并对现有研究中存在的问题和经验进行分析讨论, 为后期深入研究提供参考。
1 AT2受体蛋白的研究进展 1.1 AT2受体蛋白的结构AT2受体与AT1受体仅有34%的基因序列同源性, 在基因结构、特性、蛋白质序列、组织表达、信号和调控等方面与AT1受体均有差异[10, 11]。人类AT2受体基因位于染色体Xq22-Xq23上(AT1受体基因位于3q21-3q25), 编码受体基因的位置导致了其在表达和功能上的性别差异[12, 13]。AT2受体蛋白是由一个7TM束(跨膜螺旋Ⅰ-Ⅶ) 和一个细胞内两亲性螺旋Ⅷ组成的膜蛋白。与AT1受体及其他肽结合的GPCRs类似(图 1[14]), AT2受体的细胞外环2 (ECL2) 处具有一个β-发夹构象和两个二硫键: ①连接受体蛋白的N端和细胞外环3 (ECL3) 的二硫键, 氨基酸残基为N端: Cys35; ECL3: Cys30; ②连接ECL2和螺旋Ⅲ的二硫键, 氨基酸残基为螺旋Ⅲ: Cys117; ECL2: Cys195[14-16]。研究表明, 任何一个二硫键被还原均可改变AT2受体与配体分子的亲和力, 也就是说, AT2受体蛋白中的二硫键对配体与受体之间的亲和力起着关键作用[15]。
|
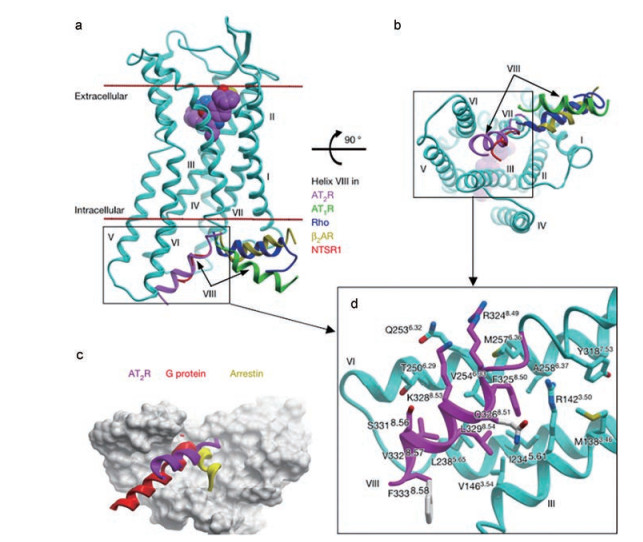
Figure 1 Helix Ⅷ blocks the putative G protein/β-arrestin-binding site of AT2R |
Zhang等[14]认为, AT2受体蛋白的螺旋Ⅷ处于一个非经典的位置, 这种非经典位置阻断了AT2受体对G蛋白或β-抑制蛋白(β-arrestin) 的招募, 继而使得AT2受体具有与AT1受体不同的信号转导机制。Connolly等[17]认为螺旋Ⅷ所处的非典型位置可能在受体与下游效应器耦合的能力中发挥作用, 继而阻碍了受体与下游信号调节因子G蛋白或β-抑制蛋白的结合, 使得AT2受体具有与AT1受体不同的信号通路。研究发现, AT2受体螺旋Ⅷ朝向细胞内环1 (AT1受体的螺旋Ⅷ则与细胞内环1平行), 使得螺旋Ⅷ与细胞内环1形成一种相互作用, 这种相互作用阻断了细胞内环1与下游效应器的结合, 使得下游信号调节因子G蛋白或β-抑制蛋白未能参与AT2受体的激活[17]。此结果表明AT2受体的细胞内环1和螺旋Ⅷ之间的相互作用控制着受体的激活。
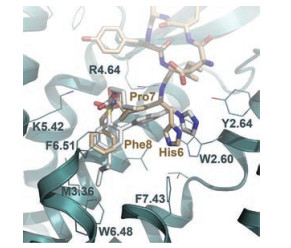
1.3 AT2受体蛋白的活性位点对于非肽类小分子配体, AT2受体的活性口袋的中心位于由K5.42、R4.64以及Y7.43残基围成的空腔, 主要通过氢键、疏水、盐桥以及范德华力与配体形成相互作用, 与结合位点有关的氨基酸残基为: F2.53、F7.43、F6.51、L2.57、W2.60、W6.48、Y2.65、Y2.64、P7.36、I7.39、L3.22、M3.66、V3.32。Ang Ⅱ (Asp1-Arg2-Val3-Tyr4-Ile5-His6-Pro7-Phe8) 与AT2受体靶蛋白的结合模型表明[18]: Ang Ⅱ深嵌入整个受体蛋白的跨膜区(transmembrane domain, TMD), His6位于由AT2受体靶蛋白的Y2.64、W2.60、L3.32和F7.43组成的空腔中; Phe8则位于由TM3和TM5-TM7组成的疏水区, 且Ang Ⅱ的C末端能够与R4.64和K5.42残基形成离子相互作用; Ang Ⅱ的C末端采用了一种延长的构象位于受体蛋白中, 且C末端三肽(His6-Pro7-Phe8) 与非肽类配体的结构覆盖, 即处于相同大小的活性口袋(图 2[18])。
|
Figure 2 Binding mode of the endogenous agonist, Ang Ⅱ (beige) and non-peptide ligand (light gray) on the modeled active-like conformation of the AT2R |
综上, 目前达成一致的观点是: 由W2.60、K5.42、R4.64、M3.36、F7.43以及ECL2的R182残基组成的活性口袋与AT2受体的活性关系密切; 由TM3和TM7在靶蛋白的N末端处形成的活性口袋, 与配体对AT2受体的选择性有关。即受体蛋白在TM3和TM7形成的口袋中: AT1受体含有Y7.43残基, 能够与TM3的V3.32残基形成氢键(使得TM3和TM7形成一种相互作用); 而AT2受体含有F7.43残基(缺少氢键供体), 该残基不能与TM3的V3.32残基形成氢键(TM3不能与TM7形成相互作用), 继而产生选择性差异。
2 作用于AT2受体的激动剂研究进展现有的AT2受体激动剂主要包括拟肽类AT2受体激动剂和小分子AT2受体激动剂。
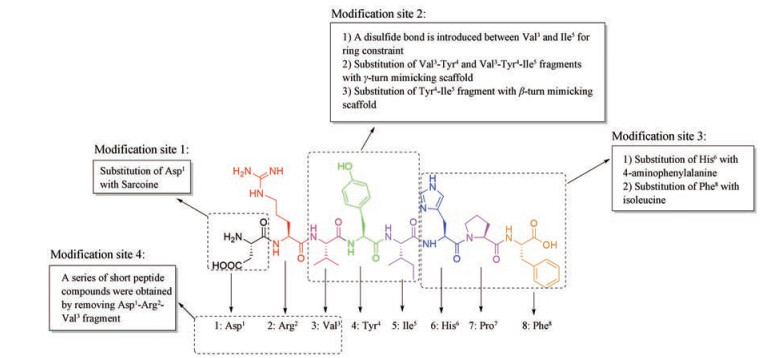
2.1 拟肽类AT2受体激动剂研究进展Ang Ⅱ的氨基酸序列为: Asp1-Arg2-Val3-Tyr4-Ile5-His6-Pro7-Phe8, 与AT2受体结合时处于一种延长的构象。Ang Ⅱ与AT1受体和AT2受体的亲和力分别为0.31和0.63 mol·L-1, 对AT2受体几乎无选择性[19, 20]。因此, 早期作用于AT2受体化合物的设计主要围绕Ang Ⅱ (图 3) 的氨基酸序列, 对某个氨基酸残基或其中的某个片段进行修饰与改造, 以提高化合物对AT2受体的选择性。
|
Figure 3 Modification sites and structure of Ang Ⅱ |
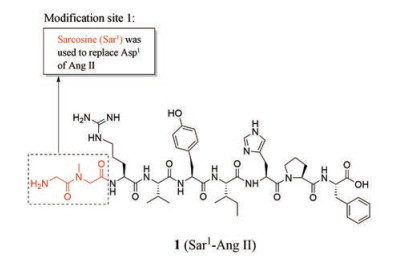
参考早期作用于AT1受体化合物的研究思路, 研究围绕Ang Ⅱ的氨基酸残基对AT2受体的亲和力的影响, 发现Asp1不是Ang Ⅱ及其类似物与AT2受体结合的必需基团[21-23]。于是有人开始尝试用肌氨酸(Sar) 来替代Ang Ⅱ的Asp1, 并保留与AT2受体的亲和力中起着关键作用的Arg2残基, 得到了化合物1 (Sar1-Ang Ⅱ, 图 4)。结果表明, 这种修饰不仅保留了对AT2受体一定的激动效应, 提高了代谢稳定性, 而且增强了配体与AT1受体和AT2受体的亲和力, 但该化合物对AT2受体仍不具有选择性[24]。
|
Figure 4 The modified site of Ang Ⅱ and the structure of compound 1 |
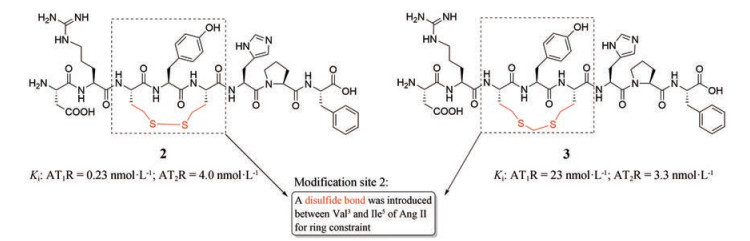
为提高Ang Ⅱ及其类似物对AT2受体的选择性, 人们除了对Ang Ⅱ进行线性修饰(如化合物1) 外, 还尝试了对Ang Ⅱ进行环约束(用二硫键连接Val3和Ile5), 继而得到一系列大环二硫类Ang Ⅱ类似物。13元环系的二硫化合物2 (c[Hcy3, 5]Ang Ⅱ, 图 5) 是一种强效的AT1受体激动剂, 具有一定的血管收缩活性, 但对AT2受体的选择性很低(Ki: AT1R = 0.23 nmol·L-1; AT2R = 4.0 nmol·L-1)[25-27]。
|
Figure 5 The modified site of Ang Ⅱ and the structures of compounds 2 and 3 |
在化合物2的两个硫原子之间引入亚甲基, 得到了14元亚甲基二硫醚单环化的拟肽类化合物3 (图 5)。该化合物降低了对AT1受体的亲和力, 并且对AT2受体的亲和力几乎没影响(Ki: AT1R = 23 nmol·L-1; AT2R = 3.3 nmol·L-1)[28]。
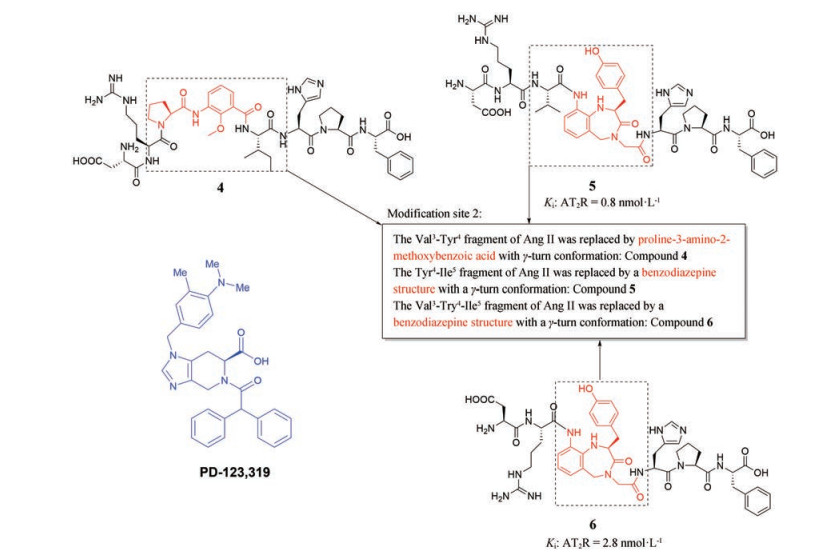
2.1.3 用γ转角模拟结构取代Val3-Tyr4-Ile5片段得到的化合物研究表明, 脯氨酸-3-氨基-2-甲氧基苯甲酸是一种根据构象分析设计得到的γ转角模拟结构[29]。用该结构取代Ang Ⅱ的Val3-Tyr4片段可得到一种高效的拟肽类AT2受体激动剂, 如化合物4 (图 6)。化合物4可以诱导NG108-15细胞的突起生长, 且在选择性AT2受体拮抗剂PD-123319 (图 6) 的存在下, 这种生长受到抑制[29]。
|
Figure 6 The modified site of Ang Ⅱ and structures of compounds 4-6, PD-123319 |
进一步研究发现, 去除Ang Ⅱ的Val3残基使得Arg2残基和Tyr4残基间的距离变短, 导致配体失去了对AT2受体的激动活性, 说明Arg2残基在空间上相对于TYR4残基的位置对配体的活性至关重要; 用γ转角模拟结构取代Ang Ⅱ的Ile5-His6片段, 对于提高配体对AT2受体的选择性和活性是无效的。于是, 尝试用具有γ转角构象的苯二氮䓬结构取代Ang Ⅱ的Tyr4-Ile5片段, 得到了化合物5 (图 6); 继而又取代Ang Ⅱ的Val3-Tyr4-Ile5片段, 得到了化合物6 (图 6)。与Ang Ⅱ类似, 化合物5、6均可通过MEK/p42/p44mapk和一氧化氮/鸟苷酸环化酶/cGMP信号通路来介导轴突生长[30]。
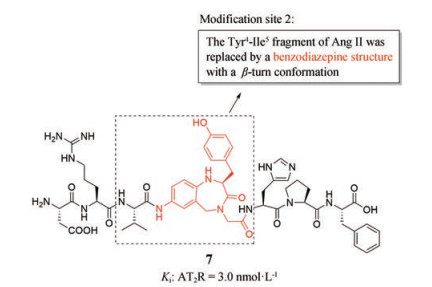
2.1.4 用β转角模拟结构取代Tyr4-Ile5片段得到的化合物前期研究表明, 用构象限制的结构(基于γ转角构象的结构) 取代Ang Ⅱ的Tyr4-Ile5片段得到了具有选择性的拟肽激动剂。于是, 人们尝试用具有β转角构象的苯二氮䓬结构取代Ang Ⅱ的Tyr4-Ile5片段, 得到了化合物7 (图 7)。研究发现, 化合物7可以诱导NG108-15细胞的突起生长, 因此可作为拟肽类选择性AT2受体激动剂[30]。综上表明, 这种构象限制的拟肽类化合物(含γ转角模拟结构和β转角模拟结构) 可提高配体对AT2受体的选择性, 同时保留对AT2受体的激动活性。
|
Figure 7 The modified site of Ang Ⅱ and the structure of compound 7 |
研究发现, 用4-氨基-苯丙氨酸(4-NH2-Phe) 取代Ang Ⅱ的His6得到化合物8 (4-NH2-Phe6-Ang Ⅱ, 图 8)。而且, 在G蛋白稳定激动剂鸟苷5'-O- (3-硫代三磷酸) (GTPγS) 存在时, 肝脏中化合物8与AT2受体的结合亲和力降低, 即说明化合物8是一个高选择性的拟肽类AT2受体激动剂[31, 32]。

|
Figure 8 The modified site of Ang Ⅱ and structures of compounds 8 and 9 |
同时, 用酪氨酸(Try) 取代Ang Ⅱ的His6得到了化合物9 (Tyr6-Ang Ⅱ, 图 8)。研究发现, 化合物9不仅对AT2受体具有较好的激动活性, 还具有一定的选择性, 并可诱导AT2受体过度表达的PC12细胞突起生长, 抑制MCF-7乳腺癌细胞增殖及小鼠胰腺导管癌(PDAC) 的移植瘤生长[32-34]。
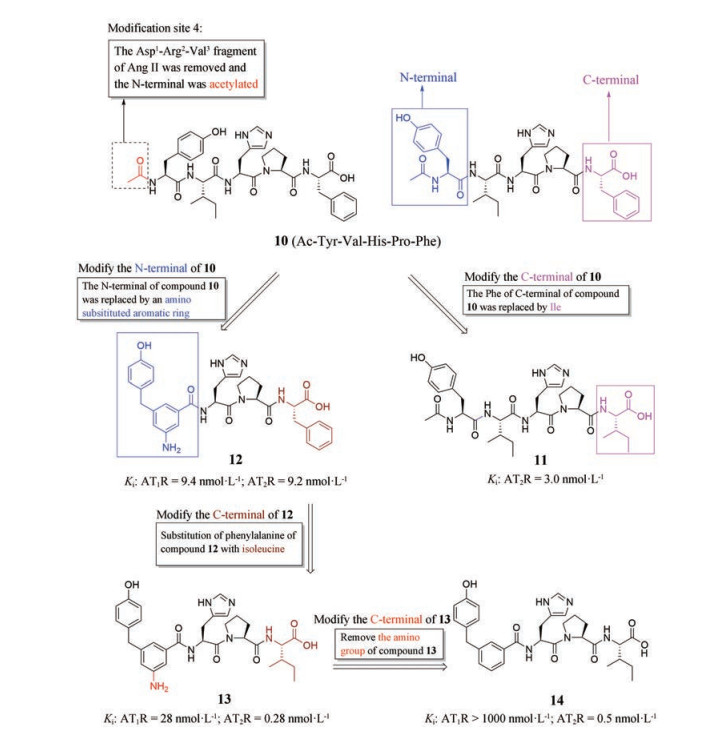
2.1.6 去除Asp1-Arg2-Val3片段得到的短肽化合物1991年, Gasparo等[35]报道, 乙酰化五肽Ac-Tyr-Val-His-Pro-Phe和Ac-Tyr-Val-His-Pro-Ile均表现出较高的AT2受体亲和力和选择性。为了检测这些缺乏Asp1-Arg2-Val3片段的乙酰化五肽是否真的能够激活AT2受体, Guimond等[36]合成了化合物10 (Ac-Tyr-Val-His-Pro-Phe, 图 9)。化合物10能够激活AT2受体, 但对AT2受体的选择性并不高, 即缺乏Asp1-Arg2-Val3片段的乙酰化五肽可以激活AT2受体, 但对AT2受体不具有选择性。因此, 为提高化合物对AT2受体的选择性, 人们开始尝试分别对化合物10的C端(苯丙氨酸) 以及N端(乙酰化酪氨酸) 进行修饰改造。
|
Figure 9 The modified site of Ang Ⅱ and structures of compounds 10-14 |
化合物10的C端修饰: 用异亮氨酸(Ile) 取代化合物10的C端苯丙氨酸(Phe) 得到了化合物11 (图 9), 在保留其激动活性的基础上, 提高了对AT2受体的选择性(Ki: AT2R = 3.0 nmol·L-1)[37]。
化合物10的N端修饰: 用氨基取代的芳环结构取代化合物10的N端(乙酰化酪氨酸), 得到了化合物12 (图 9), 对AT2受体无选择性(Ki: AT1R = 9.4 nmol·L-1; AT2R = 9.2 nmol·L-1)。为进一步提高化合物12对AT2受体的亲和力, 保留化合物12的N端结构, 用异亮氨酸(Ile) 取代C端的苯丙氨酸(Phe) 得到了化合物13 (图 9), 提高了对AT2受体的选择性(Ki: AT1R = 28 nmol·L-1; AT2R = 0.28 nmol·L-1)。同时, 也再次证明了作用于AT2受体的短肽化合物的C端含有亲脂性侧链时, 可提高配体对AT2受体的亲和力。在此研究的基础上, 为获得具有更高选择性的AT2受体激动剂, 人们删除化合物13的N端苯环上的氨基, 得到了化合物14 (图 9), 作为高选择性的短肽AT2受体激动剂[37]。
综上, 通过对现有的作用于AT2受体的拟肽类化合物的总结, 发现: ① Ang Ⅱ中的Asp1不是与受体结合所必需的; ② Arg2的氨基酸残基胍基基团与N末端在空间上影响Ang Ⅱ类似物与受体的结合; ③ Val3-Tyr4-Ile5区域的γ-转角构型和β-转角构型有助于Ang Ⅱ类似物与受体的结合, 但不同γ-转角和β-转角结构取代的化合物对受体亲和力不同, 作用也不相同; ④取代His6的基团包含咪唑环、4-氨基或4-羟基苯基均能提高化合物对AT2受体的选择性; ⑤ 7位的芳香氨基酸残基与8位的疏水性氨基酸残基之间的作用也可提高化合物对AT2受体的选择性; ⑥ C端以Ile取代Phe8后得到的化合物对AT2受体的亲和力增高数倍。
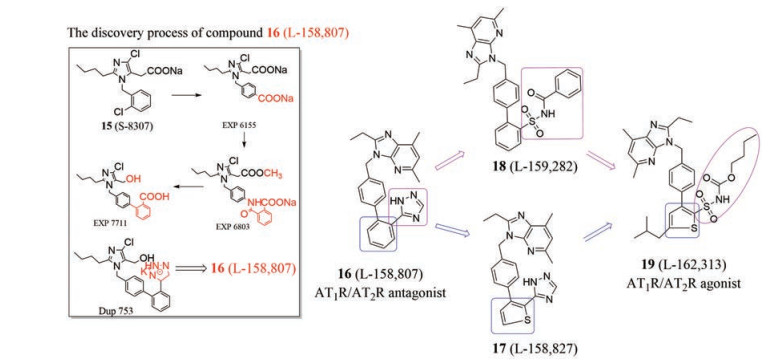
2.2 小分子AT2受体激动剂研究进展 2.2.1 非选择性小分子AT2受体激动剂化合物16 (L-158, 807, 图 10) 是以化合物15 (S-8307: 选择性Ang Ⅱ受体拮抗剂, 但拮抗活性很弱, 图 10) 为先导化合物, 进行结构修饰(S-8307→EXP6155→EXP6803→EXP7711→DUP753→L-158, 807) 得到的AT1/AT2受体双重拮抗剂[38]。化合物16虽然对AT1、AT2受体产生了较高的拮抗活性, 但不具备对AT2受体的选择性。以提高化合物对AT2受体的选择性为目的, 对化合物16进行结构修饰: 将苯环换为噻吩环(化合物17, L-158827, 图 10); 或将与苯环连接的1, 2, 4-三氮唑换为磺酰胺片段(化合物18, L-159282, 图 10), 但都没有达到理想的激动活性和选择性。于是利用化合物17的苯联噻吩骨架和化合物18的磺酰胺片段, 并保留苄基咪唑并吡啶环, 得到了化合物19 (L-162313, 图 10)[39, 40]。体内试验表明, 静脉注射化合物19可使小鼠的平均动脉压增加, 且该升压作用可以被AT1受体拮抗剂氯沙坦阻断; 化合物19对大鼠十二指肠黏膜的碱性分泌增加的作用可以被选择性AT2受体拮抗剂PD-123319抵消, 因此确定化合物19为AT1受体和AT2受体的非选择性小分子激动剂[41]。
|
Figure 10 The discovery process of compound 16 and structures of compounds 16-19 |
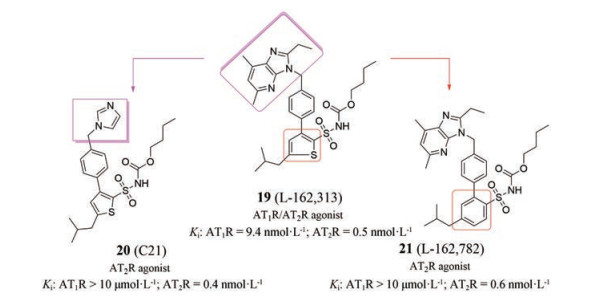
为提高化合物19对AT2受体的选择性, Wan等[42]在化合物19的基础上, 通过活性筛选并借鉴前期课题组的经验, 将咪唑并吡啶替换为苄基咪唑, 得到了第一个具有较高选择性的小分子AT2受体激动剂: 化合物20 (C21, 图 11)。研究表明, C21可以诱导细胞轴突生长、调节MAPK信号通路、增加大鼠十二指肠黏膜的碱性分泌, 降低自发性高血压大鼠(SHR) 的平均动脉压[43-45]。目前, C21正处于临床Ⅱ期试验, 主要用于肺和其他器官纤维化的疾病治疗。人们进一步将化合物19的噻吩环替换为苯环, 得到了化合物21 (L-162782, 图 11)。该化合物具有与化合物20相当的激动活性和AT2受体选择性(Ki: AT1R > 10 umol·L-1; AT2R = 0.6 nmol·L-1)。
|
Figure 11 Structures of compounds 19-21 |
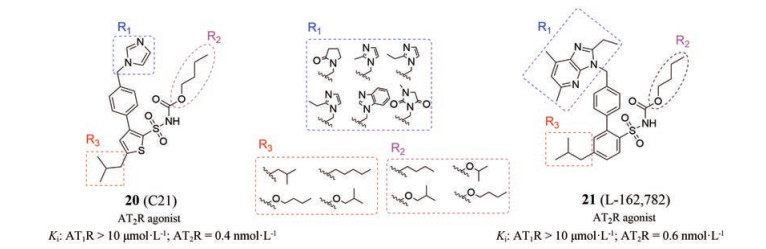
近年, 针对小分子AT2受体激动剂的研究, 主要围绕对C21和L-16278 2进行结构修饰开展[46]。现有的构效关系表明: ①磺酰胺基为配体拥有对AT2受体选择性的必需基团; ②苄基咪唑和咪唑并吡啶可以采用相似大小的含氮碱性基团代替, 可使配体保持一定的选择性; ③联苯和苯联噻吩对活性和选择性几乎没影响, 可能由于此结构只起到骨架支撑的作用。因此, C21和L-162782的R1、R2、R3部位成为此系列化合物结构修饰的关注点(如图 12, 列举了部分基团), 以获得更理想的选择性AT2受体激动剂。
|
Figure 12 The modified site of compounds 20 and 21 and structures of R1, R2, R3 |
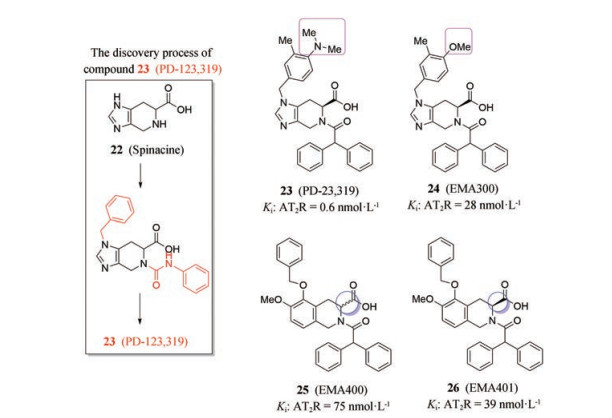
化合物22 (spinacine, 图 13) 是在对Ang Ⅱ的组氨酸(His6, Ang Ⅱ的功能活性片段Tyr4-Ile5-His6-Pro7-Phe8中的重要氨基酸) 改造中得到的醛环化衍生物, 是非肽类Ang Ⅱ受体拮抗剂, 并且对AT2受体具有一定选择性[47]。于是, 以化合物22为先导化合物, 结合4, 5, 6, 7-四氢-3H-咪唑[4, 5-c]吡啶-6-羧酸(化合物22) 衍生物的构效关系, 通过人工合成得到了化合物23 (PD-123319, 图 13), 作为高效高选择性的AT2受体拮抗剂[48]。PD-123319能够拮抗由激活AT2受体导致的细胞功能障碍、细胞生长停滞和凋亡, 在中枢神经系统中, 还具有神经保护功能[49, 50]。目前, PD-123319常作为工具药用于小分子AT2受体拮抗剂的研究。
|
Figure 13 The discovery process of compound 23 and structures of compounds 22-26 |
在此研究的基础上, 将PD-123319的二甲基氨基用甲氧基取代, 得到了化合物24 (EMA300, 图 13), 提高了对AT2受体的选择性和拮抗活性。PD-123319的类似物: 化合物25 (EMA400, 图 13) 和化合物26 (EMA401, 图 13) 的亲和力较高, EMA401的受体结合亲和力与PD-123319相当, 并在治疗神经病理性疼痛中具有一定的止痛作用[51, 52]。目前, 第一代选择性AT2受体拮抗剂临床主要用于神经病理性疼痛的治疗, 其中EMA401正处于临床Ⅱ期试验, 用于带状疱疹神经痛的治疗[53]。
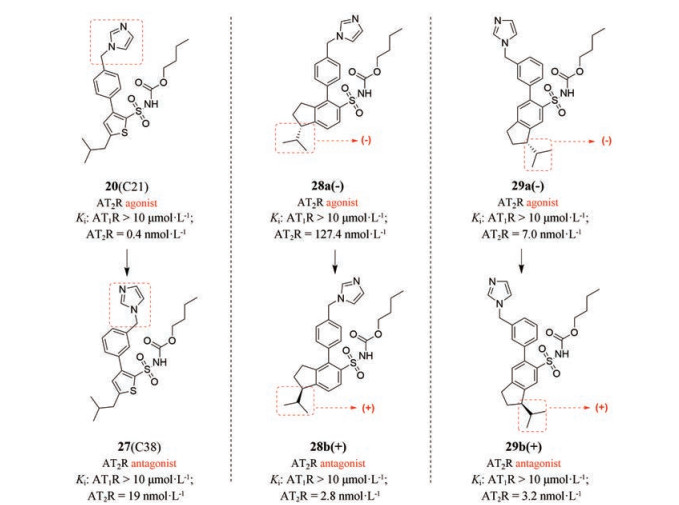
3.2 第二代AT2受体拮抗剂在对AT2受体激动剂C21及其类似物的结构进行修饰的同时, 人们发现结构的微小改变, 可使得活性发生翻转[54]。如图所示, 化合物20 (C21, 图 14) 和化合物27 (C38, 图 14) 由于苄基咪唑的位置由对位转到间位, 即可使化合物的活性由激动转变为拮抗[55]。为进一步探究结构的微小改变对配体活性的影响, Wallinder等[56-58]合成了具有吲哚骨架的作用于AT2受体的化合物, 以评估异丁基侧链在空间中的取向对AT2受体的亲和力和活性产生的影响。在所合成的4对异丁基构象限制的对映异构体中, 化合物28a(-)和化合物28b(+), 化合物29a(-)和化合物29b(+)均实现了活性的翻转[59]。如图 14所示, 左旋体化合物28a(-)为激动剂, 右旋体化合物28b(+)则为拮抗剂; 左旋体化合物29a(-)为激动剂, 右旋体化合物29b(+)则为拮抗剂。因此, 近年对选择性AT2受体拮抗剂的结构修饰, 主要以现有选择性AT2受体激动剂为先导化合物, 通过对其结构进行微小改变, 获得具有选择性的作用于AT2受体的拮抗剂, 但结构的微小改变使得活性翻转的机制仍不明确, 构效关系仍未阐明。
|
Figure 14 Structures of compounds 20, 27, 28a(-), 28b(+), 29a(-), 29b(+) |
AT2受体与许多疾病的发生关系逐渐得到重视, 是临床治疗心血管疾病、纤维化、炎症、肿瘤学和神经元疾病的生物医学研究中关注度较高的潜在药物靶标, 选择性AT2受体激动剂或拮抗剂的研究可能为这些疾病的药物开发提供新的方向。
目前, AT2受体的功能及其在相关疾病的作用已逐渐清晰, 大量的AT2受体的激动剂和拮抗剂被报道。但除小分子AT2受体激动剂C21正处于临床Ⅱ期试验, 可能用于治疗肺和其他器官的纤维化疾病; AT2受体拮抗剂EMA401正处于治疗周围神经性疼痛的Ⅱ期临床试验以外, 还没有其他AT2受体激动剂或拮抗剂进入临床研究。而且, 作用于AT2受体的配体分子的构效关系仍不十分清楚。由于AT2受体在胎儿组织中高水平表达, 成人组织中含量很低; 在病理条件下表达水平显著提高, 并且具有组织和细胞特异性。有研究者提出[60], 需要设计具有更高组织和细胞选择性和特异性的化合物, 来改善药物在疾病器官中的生物分布, 以提高疗效。可以设计以线粒体靶向抗氧化肽SS-31 (D-Arg-dimethylTyr-Lys-Phe-NH2) 作为碱性磷酸酶(alkaline phosphatase, APA) 诱导的AT2受体在病变肾脏中表达的前体药物, 来选择性地将AT2受体激动剂或拮抗剂输送到病变组织和细胞中。
针对当前的研究现状, 建议可从以下3个方面推进作用于AT2受体化合物的研发: ①利用现有活性化合物的结构进一步确认AT2受体蛋白与配体分子的关键活性位点, 为化合物的设计提供理论指导; ②以C21和PD-123319为先导化合物, 运用计算机辅助药物设计方法, 发现具有新型骨架的化合物。并通过进一步的结构优化获得能够选择性作用于AT2受体的配体分子, 以丰富化合物库, 为完善构效关系提供基础; ③由于AT2受体在G蛋白偶联受体中的信号转导机制还未完全阐明, 深入研究配体与受体靶蛋白的相互作用机制将有助于明确AT2受体的作用, 并为作用于AT2受体新化合物的进一步药理研究提供指导。
作者贡献: 张艳春和张祖志负责论文的撰写; 王丹慧和徐梅月参与论文图片及结构的绘制; 张艳春和徐进宜负责论文的规划、指导及审阅。
利益冲突: 所有作者均声明本论文与其他人或机构无任何利益冲突。
| [1] |
Lenkei Z, Palkovits M, Corvol P, et al. Expression of angiotensin type-1(AT1) and type-2(AT2) receptor mRNAs in the adult rat brain: a functional neuroanatomical review[J]. Front Neuroendocrinol, 1997, 18: 383-439. DOI:10.1006/frne.1997.0155 |
| [2] |
Kambayashi Y, Bardhan S, Takahashi K, et al. Molecular cloning of a novel angiotensin Ⅱ receptor isoform involved in phosphotyrosine phosphatase inhibition[J]. J Biol Chem, 1993, 268: 24543-24546. DOI:10.1016/S0021-9258(19)74499-8 |
| [3] |
Carey RM. Update on the role of the AT2 receptor[J]. Curr Opin Nephrol Hypertens, 2005, 14: 67-71. DOI:10.1097/00041552-200501000-00011 |
| [4] |
Hein L, Barsh GS, Pratt RE, et al. Behavioral and cardiovascular effects of disrupting the angiotensin Ⅱ type-2 receptor in mice[J]. Nature, 1995, 377: 744-747. DOI:10.1038/377744a0 |
| [5] |
Tsutsumi K, Zorad S, Saavedra JM. The AT2 subtype of the angiotensin Ⅱ receptors has differential sensitivity to dithiothreitol in specific brain nuclei of young rats[J]. Eur J Pharmacol, 1992, 226: 169-173. DOI:10.1016/0922-4106(92)90179-Y |
| [6] |
Karnik SS, Unal H, Kemp JR, et al. Angiotensin receptors: interpreters of pathophysiological angiotensinergic stimuli[J]. Pharmacol Rev, 2015, 67: 754-819. DOI:10.1124/pr.114.010454 |
| [7] |
Kaschina E, Unger T. Angiotensin AT1/AT2 receptors: regulation, signalling and function[J]. Blood Press, 2003, 12: 70-88. DOI:10.1080/08037050310001057 |
| [8] |
Danser J, Anand P. The angiotensin Ⅱ type 2 receptor for pain control[J]. Cell, 2014, 157: 1504-1506. DOI:10.1016/j.cell.2014.05.030 |
| [9] |
Johansson B, Holm M, Ewert S, et al. Angiotensin Ⅱ type 2 receptor-mediated duodenal mucosal alkaline secretion in the rat[J]. Am J Physiol Gastrointest Liver Physiol, 2001, 280: G1254-G1260. DOI:10.1152/ajpgi.2001.280.6.G1254 |
| [10] |
Mukoyama M, Nakajima M, Horiuchi M, et al. Expression cloning of type 2 angiotensin Ⅱ receptor reveals a unique class of seven-transmembrane receptors[J]. J Biol Chem, 1993, 268: 24539-24542. DOI:10.1016/S0021-9258(19)74498-6 |
| [11] |
Bienvenu T, Poirier K, Van Esch H, et al. Rare polymorphic variants of the AGTR2 gene in boys with non-specific mental retardation[J]. J Med Genet, 2003, 40: 357-359. DOI:10.1136/jmg.40.5.357 |
| [12] |
Schmieder RE, Erdmann J, Delles C, et al. Effect of the angiotensin Ⅱ type 2-receptor gene (+1675 G/A) on left ventricular structure in humans[J]. J Am Coll Cardiol, 2001, 37: 175-182. DOI:10.1016/S0735-1097(00)01063-9 |
| [13] |
Ott C, Titze SI, Schwarz TK, et al. High sodium intake modulates left ventricular mass in patients with G expression of +1675 G/A angiotensin Ⅱ receptor type 2 gene[J]. J Hypertens, 2007, 25: 1627-1632. DOI:10.1097/HJH.0b013e3281cd40f5 |
| [14] |
Zhang H, Han GW, Batyuk A, et al. Structural basis for selectivity and diversity in angiotensin Ⅱ receptors[J]. Nature, 2017, 544: 327-332. DOI:10.1038/nature22035 |
| [15] |
Speth RC, Rowe BP, Grove KL, et al. Sulfhydryl reducing agents distinguish two subtypes of angiotensin Ⅱ receptors in the rat brain[J]. Brain Res, 1991, 548: 1-8. DOI:10.1016/0006-8993(91)91098-L |
| [16] |
Feng YH, Saad Y, Karnik SS. Reversible inactivation of AT(2) angiotensin Ⅱ receptor from cysteine-disulfide bond exchange[J]. FEBS Lett, 2000, 484: 133-138. DOI:10.1016/S0014-5793(00)02141-4 |
| [17] |
Connolly A, Holleran BJ, Simard E, et al. Interplay between intracellular loop 1 and helix Ⅷ of the angiotensin Ⅱ type 2 receptor controls its activation[J]. Biochem Pharmacol, 2019, 168: 330-338. DOI:10.1016/j.bcp.2019.07.018 |
| [18] |
Sallander J, Wallinder C, Hallberga A, et al. Structural determinants of subtype selectivity and functional activity of angiotensin Ⅱ receptors[J]. Bioorg Med Chem Lett, 2016, 26: 1355-1359. DOI:10.1016/j.bmcl.2015.10.084 |
| [19] |
Hallberg M, Sävmarker J, Hallberg A. Angiotensin peptides as AT2 receptor agonists[J]. Curr Protein Pept Sci, 2017, 18: 809-818. |
| [20] |
Hodges JC, Hamby JM, Blankley CJ. Angiotensin Ⅱ receptor binding inhibitors[J]. Drugs Future, 1992, 17: 575-593. |
| [21] |
Regoli D, Rioux F, Park WK, et al. Role of the N-terminal amino acid for the biological activities of angiotensin and inhibitory analogues[J]. Can J Physiol Pharmacol, 1974, 52: 39-49. DOI:10.1139/y74-006 |
| [22] |
Miura S, Karnik SS. Angiotensin Ⅱ type 1 and type 2 receptors bind angiotensin Ⅱ through different types of epitope recognition[J]. J Hypertens, 1999, 17: 397-404. DOI:10.1097/00004872-199917030-00013 |
| [23] |
Liu Q, Xu JY, Yao HQ, et al. Advances in research on structure-activity relationship of selective angiotensinⅡ AT2 receptor agonists[J]. Prog Pharm Sin (药学进展), 2011, 35: 145-153. |
| [24] |
Bosnyak S, Jones ES, Christopoulos A, et al. Relative affinity of angiotensin peptides and novel ligands at AT1 and AT2 receptors[J]. Clin Sci (Lond), 2011, 121: 297-303. DOI:10.1042/CS20110036 |
| [25] |
Spear KL, Brown MS, Reinhard EJ, et al. Conformational restriction of angiotensin Ⅱ: cyclic analogues having high potency[J]. J Med Chem, 1990, 33: 1935-1940. DOI:10.1021/jm00169a019 |
| [26] |
Lindman S, Lindeberg G, Frdberg PA, et al. Effect of 3-5 monocyclizations of angiotensin Ⅱ and 4-aminoPhe6-Ang Ⅱ on AT2 receptor affinity[J]. Bioorg Med Chem, 2003, 11: 2947-2954. DOI:10.1016/S0968-0896(03)00212-8 |
| [27] |
Spear KL, Brown MS, Reinhard EJ, et al. Conformational restriction of angiotensin Ⅱ: cyclic analogues having high potency[J]. J Med Chem, 1990, 33: 1935-1940. DOI:10.1021/jm00169a019 |
| [28] |
Johannesson P, Lindeberg G, Johansson A, et al. Vinyl sulfide cyclized analogues of angiotensin Ⅱ with high affinity and full agonist activity at the AT(1) receptor[J]. J Med Chem, 2002, 45: 1767-1777. DOI:10.1021/jm011063a |
| [29] |
Jedhe GS, Kotmale AS, Rajamohanan PR, et al. Angiotensin Ⅱ analogs comprised of Pro-Amb (γ-turn scaffold) as angiotensin Ⅱ type 2(AT2) receptor agonists[J]. Chem Commun (Camb), 2016, 52: 1645-1648. DOI:10.1039/C5CC09687A |
| [30] |
Rosenström U, Sköld C, Plouffe B, et al. New selective AT2 receptor ligands encompassing a gamma-turn mimetic replacing the amino acid residues 4-5 of angiotensin Ⅱ act as agonists[J]. J Med Chem, 2005, 48: 4009-4024. DOI:10.1021/jm0491492 |
| [31] |
Whitebread S, Mele M, Kamber B, et al. Preliminary biochemical characterization of two angiotensin Ⅱ receptor subtypes[J]. Biochem Biophys Res Commun, 1989, 163: 284-291. DOI:10.1016/0006-291X(89)92133-5 |
| [32] |
Speth RC, Kim KH. Discrimination of two angiotensin Ⅱ receptor subtypes with a selective agonist analogue of angiotensin Ⅱ, p-aminophenylalanine6 angiotensin Ⅱ[J]. Biochem Biophys Res Commun, 1990, 169: 997-1006. DOI:10.1016/0006-291X(90)91993-3 |
| [33] |
Magnani F, Pappas CG, Crook T, et al. Electronic sculpting of ligand-GPCR subtype selectivity: the case of angiotensin Ⅱ[J]. ACS Chem Biol, 2014, 9: 1420-1425. DOI:10.1021/cb500063y |
| [34] |
Ishiguro S, Yoshimura K, Tsunedomi R, et al. Involvement of angiotensin Ⅱ type 2 receptor (AT2R) signaling in human pancreatic ductal adenocarcinoma (PDAC): a novel AT2R agonist effectively attenuates growth of PDAC grafts in mice[J]. Cancer Biol Ther, 2015, 16: 307-316. DOI:10.1080/15384047.2014.1002357 |
| [35] |
De Gasparo M, Whitebread S, Kamber B, et al. Effect of covalent dimer conjugates of angiotensin Ⅱ on receptor affinity and activity in vitro[J]. J Recept Res, 1991, 11: 247-257. DOI:10.3109/10799899109066404 |
| [36] |
Guimond MO, Hallberg M, Gallo-Payet N, et al. Saralasin and sarile are AT2 receptor agonists[J]. ACS Med Chem Lett, 2014, 5: 1129-1132. DOI:10.1021/ml500278g |
| [37] |
Georgsson J, Rosenstrom U, Wallinder C, et al. Short pseudopeptides containing turn scaffolds with high AT2 receptor affinity[J]. Bioorg Med Chem, 2006, 14: 5963-5972. DOI:10.1016/j.bmc.2006.05.019 |
| [38] |
Timmermans PB, Carini DJ, Chiu AT, et al. The discovery of a new class of highly specific nonpeptide angiotensin Ⅱ receptor antagonists[J]. Am J Hypertens, 1991, 4: 275S-281S. DOI:10.1093/ajh/4.4.275S |
| [39] |
Alterman M. Development of selective non-peptide angiotensin Ⅱ type 2 receptor agonsists[J]. J Renin Angiotensin Aldosterone Syst, 2010, 11: 57-66. DOI:10.1177/1470320309347790 |
| [40] |
Kivlighn SD, Huckle WR, Zingaro GJ, et al. Discovery of L-162, 313:a nonpeptide that mimics the biological actions of angiotensin Ⅱ[J]. Am J Physiol, 1995, 268: R820-R823. |
| [41] |
Wan Y, Wallinder C, Johansson B, et al. First reported nonpeptide AT1 receptor agonist (L-162, 313) acts as an AT2 receptor agonist in vivo[J]. J Med Chem, 2004, 47: 1536-1546. DOI:10.1021/jm031031i |
| [42] |
Wan Y, Wallinder C, Plouffe B, et al. Design, synthesis, and biological evaluation of the first selective nonpeptide AT2 receptor agonist[J]. J Med Chem, 2004, 47: 5995-6008. DOI:10.1021/jm049715t |
| [43] |
Isaksson R, Casselbrant A, Elebring E, et al. Direct stimulation of angiotensin Ⅱ type 2 receptor reduces nitric oxide production in lipopolysaccharide treated mouse macrophages[J]. Eur J Pharmacol, 2020, 868: 172855. DOI:10.1016/j.ejphar.2019.172855 |
| [44] |
Veron JB, Joshi A, Wallinder C, et al. Synthesis and evaluation of isoleucine derived angiotensin Ⅱ AT2 receptor ligands[J]. Bioorg Med Chem Lett, 2014, 24: 476-479. DOI:10.1016/j.bmcl.2013.12.040 |
| [45] |
Mahalingam AK, Wan Y, Murugaiah AM, et al. Selective angiotensin Ⅱ AT2 receptor agonists with reduced CYP 450 inhibition[J]. Bioorg Med Chem, 2010, 18: 4570-4590. DOI:10.1016/j.bmc.2010.03.064 |
| [46] |
Murugaiah AM, Wallinder C, Mahalingam AK, et al. Selective angiotensin Ⅱ AT2 receptor agonists devoid of the imidazole ring system[J]. Bioorg Med Chem, 2007, 15: 7166-7183. DOI:10.1016/j.bmc.2007.07.026 |
| [47] |
Chiu AT, Duncia JV, Mccall DE, et al. Nonpeptide angiotensin Ⅱ receptor antagonists. Ⅲ. Structure-function studies[J]. J Pharmacol Exp Ther, 1989, 250: 867-874. |
| [48] |
Blankley CJ, Hodges JC, Klutchko SR, et al. Synthesis and structure-activity relationships of a novel series of non-peptide angiotensin Ⅱ receptor binding inhibitors specific for the AT2 subtype[J]. J Med Chem, 1991, 34: 3248-3260. DOI:10.1021/jm00115a014 |
| [49] |
Murugaiah AM, Wallinder C, Mahalingam AK, et al. Selective angiotensin Ⅱ AT2 receptor agonists devoid of the imidazole ring system[J]. Bioorg Med Chem, 2007, 15: 7166-7183. DOI:10.1016/j.bmc.2007.07.026 |
| [50] |
Asada H, Horita S, Hirata K, et al. Crystal structure of the human angiotensin Ⅱ type 2 receptor bound to an angiotensin Ⅱ analog[J]. Nat Struct Mol Biol, 2018, 25: 570-576. DOI:10.1038/s41594-018-0079-8 |
| [51] |
Wakchaure PB, Bremberg U, Wannberg J, et al. Synthesis of enantiopure angiotensin Ⅱ type 2 receptor[AT2R] antagonist EMA401[J]. Tetrahedron, 2015, 71: 6881-6887. DOI:10.1016/j.tet.2015.07.018 |
| [52] |
Wexler RR, Greenlee WJ, Irvin JD, et al. Nonpeptide angiotensin Ⅱ receptor antagonists: the next generation in antihypertensive therapy[J]. J Med Chem, 1996, 39: 625-656. DOI:10.1021/jm9504722 |
| [53] |
Tsuda M. Microglia-mediated regulation of neuropathic pain: molecular and cellular mechanisms[J]. Biol Pharm Bull, 2019, 42: 1959-1968. DOI:10.1248/bpb.b19-00715 |
| [54] |
Wallinder C, Sköld C, Botros M, et al. Interconversion of functional activity by minor structural alterations in nonpeptide AT2 receptor ligands[J]. ACS Med Chem Lett, 2014, 6: 178-182. |
| [55] |
Murugalah AM, Wu X, Wallinder C, et al. From the first selective non-peptide AT2 receptor agonist to structurally related antagonists[J]. J Med Chem, 2012, 55: 2265-2278. DOI:10.1021/jm2015099 |
| [56] |
Liu J, Liu Q, Yang X, et al. Design, synthesis, and biological evaluation of 1, 2, 4-triazole bearing 5-substituted biphenyl-2-sulfonamide derivatives as potential antihypertensive candidates[J]. Bioorg Med Chem, 2013, 21: 7742-7751. DOI:10.1016/j.bmc.2013.10.017 |
| [57] |
Wallinder C, Botros M, Rosenström U, et al. Selective angiotensin Ⅱ AT2 receptor agonists: benzamide structure-activity relationships[J]. Bioorg Med Chem, 2008, 16: 6841-6849. DOI:10.1016/j.bmc.2008.05.066 |
| [58] |
Murugaiah AM, Wu X, Wallinder C, et al. From the first selective non-peptide AT2 receptor agonist to structurally related antagonists[J]. J Med Chem, 2012, 55: 2265-2278. DOI:10.1021/jm2015099 |
| [59] |
Wallinder C, Christian S, Sundholm S, et al. High affinity rigidified AT2 receptor ligands with indane scaffolds[J]. MedChemComm, 2019, 10: 2146-2160. DOI:10.1039/C9MD00402E |
| [60] |
Juillerat-Jeanneret L. The other angiotensin ii receptor: AT2R as a therapeutic target[J]. J Med Chem, 2020, 63: 1978-1995. DOI:10.1021/acs.jmedchem.9b01780 |
 2021, Vol. 56
2021, Vol. 56


