2. 集美大学食品与生物工程学院, 福建 厦门 361021
2. College of Food and Biological Engineering, Jimei University, Xiamen 361021, China
淋巴瘤是一种起源于淋巴造血系统的恶性肿瘤, 主要分为霍奇金淋巴瘤和非霍奇金淋巴瘤, 其中非霍奇金淋巴瘤约占淋巴瘤的发病率90%, 根据淋巴细胞的起源不同非霍奇金淋巴瘤又可以分为B细胞、T细胞和自然杀伤(natural killer, NK) 细胞淋巴瘤。淋巴瘤是全世界发病率增速最快的恶性肿瘤之一, 具有不易察觉、发病率高和死亡快的特点。根据世界卫生组织国际癌症研究机构发布的GLOBOCAN 2018年全球癌症统计报告[1], 2018年全球新增癌症病例中淋巴瘤占3.2%, 在全球癌症死亡病例中淋巴瘤占2.9%。我国淋巴瘤的死亡率每年增加4.5%, 且随着年龄增长呈上升趋势[2]。淋巴瘤已成为我国乃至全世界不容忽视的公共卫生议题。
在淋巴瘤的治疗方面, 传统的放、化疗手段仍然占据着主导地位, 但毒副作用大, 不利于患者的身体健康和康复。近几年来, 靶向治疗和免疫治疗的应用也显示出了一定疗效[3, 4], 但靶向治疗易产生耐药性[5, 6], 免疫治疗可能会存在起效的持续性短和免疫排斥等问题[7]。JAK/STATs (Janus protein tyrosine kinase, JAK/ signal transducers and activators of transcription, STATs) 信号转导通路在多种淋巴瘤中普遍存在异常激活及突变[8-10], 这表明阻断JAK/STATs信号通路可能是淋巴瘤治疗中的一个重要策略。目前已研发出很多JAK激酶的抑制剂, 如已被美国食品药品监督管理局(U.S. Food and Drug Administration, FDA) 批准上市的鲁索利替尼和托法替尼, 均对一些淋巴瘤肿瘤有较好抑制作用[11-13]。然而大多数JAK抑制剂的选择性不佳, 适应症广而不良反应明显[14]。STATs家族蛋白在淋巴瘤中高度活跃, 利用STATs抑制剂治疗淋巴瘤具有广泛的研究和应用前景。然而目前尚未有上市的STATs抑制剂, 因此本文着重讲述STATs蛋白在淋巴瘤中的异常激活及STATs抑制剂在淋巴瘤中的应用研究。
1 STAT家族蛋白的结构和功能JAK/STATs信号通路可以结合细胞内多种细胞因子受体并启动相关基因转录, 从而实现对细胞增殖、分化、凋亡以及炎症发生的调控。JAK/STATs信号通路主要由酪氨酸激酶相关受体、Janus蛋白质酪氨酸激酶JAK、信号转导和转录激活蛋白STAT组成。
STATs蛋白在细胞中负责细胞因子信号转导并传递到细胞核中启动转录。STATs蛋白家族有7个成员: STAT1、STAT2、STAT3、STAT4、STAT5a、STAT5b以及STAT6。STATs蛋白包含有6个结构域(图 1): 保守的N端结构域、超螺旋结构域、脱氧核糖核酸(deoxyribonucleic acid, DNA) 结合域、高度保守的连接结构域、SH2结构域(Src homology domain) 和C端反式激活结构域。其中DNA结合域负责与特定靶基因序列结合; SH2结构域负责STATs蛋白的二聚化; C端反式激活结构域上则含有大量磷酸化位点, 激活STATs, 促进靶基因的转录。

|
Figure 1 Protein domains of signal transducers and activators of transcription (STATs). DNA: Deoxyribonucleic acid; SH2 domain: Src homology domain |
STATs蛋白的激活方式有磷酸化、二聚化、棕榈酰化[15, 16]等。胞外的很多细胞因子和生长因子如一些白细胞介素(interleukin, IL)、干扰素、生长激素、表皮生长因子等通过与相应的酪氨酸激酶相关受体结合来激活JAK/STATs信号通路, 与受体偶联的JAK激酶相互靠近并相互进行酪氨酸磷酸化, 随后招募STATs蛋白使其发生磷酸化激活。STAT1的Y701、STAT2的Y690、STAT3的Y705、STAT4的Y693、STAT5a的Y694、STAT5b的Y699、STAT6的Y641是其关键的激活位点。磷酸化的STATs蛋白形成同源或异源二聚体入核与DNA结合促进下游靶基因的表达(图 2), 包括细胞的增殖、存活、血管生成和侵袭有关的基因等[17], 如编码IL、表皮细胞生长因子、细胞周期蛋白、与癌症发生有关的蛋白的基因和凋亡抑制基因, 进而调控细胞的生命活动。最新的研究表明, STAT3的棕榈酰化-去棕榈酰化循环能促进STAT3的磷酸化激活和促进其入核转录[16]。
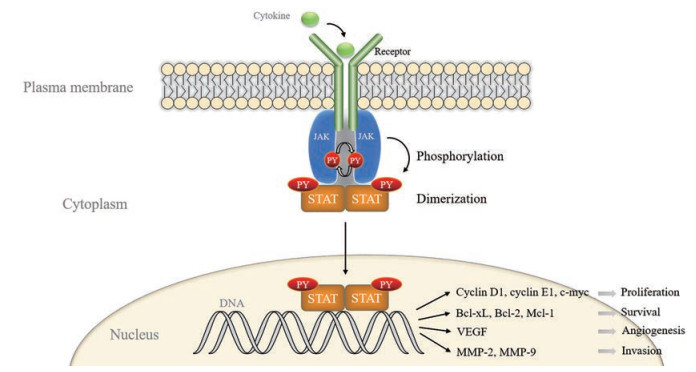
|
Figure 2 JAK/STAT signaling pathway. JAK: Janus protein tyrosine kinase; PY: Phosphorylated tyrosine residue; Bcl-xL: B cell lymphoma 2-like 1; Bcl-2: B-cell lymphoma-2; Mcl-1: Myeloid cell leukemia-1; VEGF: Vascular endothelial growth factor; MMP: Matrix metalloproteinase |
研究表明, STATs家族蛋白的异常激活与突变广泛存在于多种淋巴瘤中, 如外周T细胞淋巴瘤[18]、弥漫性大B细胞淋巴瘤[19]、原发性渗出性淋巴瘤[20]、皮肤T细胞淋巴瘤[21]、伯基特淋巴瘤[22]、脾缘带淋巴瘤和套细胞淋巴瘤[23]等。在171个外周T细胞淋巴瘤和结外NK/T细胞淋巴瘤患者中检测的188个基因中, STAT3的突变占15%, 其中52% (13/25) 为已知位于SH2结构域中的热点激活突变(D661Y、G618R、S614R、Y640F和N647I)[10, 24]; STAT5b的N642H是常见的致癌突变, 并具有抗去磷酸化能力。统计数据显示, 60%的T细胞疾病患者都携带N642H突变, 包括T细胞急性淋巴细胞白血病和单形上皮样肠T细胞淋巴瘤[25]; 在细胞因子的刺激下, STAT6在原发性淋巴癌细胞中发生组成性激活, 在细胞核和细胞质之间穿梭[20, 26], 在经典霍奇金淋巴癌中也检测出了STAT6-N417Y的高频突变[8]。
3 STATs抑制剂的筛选策略淋巴瘤中普遍存在STATs的异常激活与突变, 提示研发STAT的抑制剂是治疗淋巴癌的一个重要研究方向。选择合适的筛选策略、研发具有高度特异性的STATs抑制剂具有十分重要的意义。STATs蛋白活性的抑制主要有几个方面: 降低STATs蛋白的磷酸化水平、抑制临床点突变的激活、阻止STATs的二聚化(SH2结构域) 以及阻断STATs与DNA的结合[27]。因此, 针对STATs蛋白的抑制剂设计和筛选策略主要包含以下5类: ① 核苷酸类抑制剂, 竞争结合STATs的DNA结合域, 从而削弱STATs下游靶基因的转录; ② 肽类及拟肽类抑制剂, 竞争结合STATs的SH2结构域, 阻断STATs与细胞因子受体的结合; ③ 人工合成的小分子化合物类抑制剂; ④ 具有抑制活性的天然产物类抑制剂; ⑤ 利用蛋白质水解靶向嵌合体技术(proteolysis targeting chimeras, PROTAC) 技术设计STATs的降解剂(图 3)。
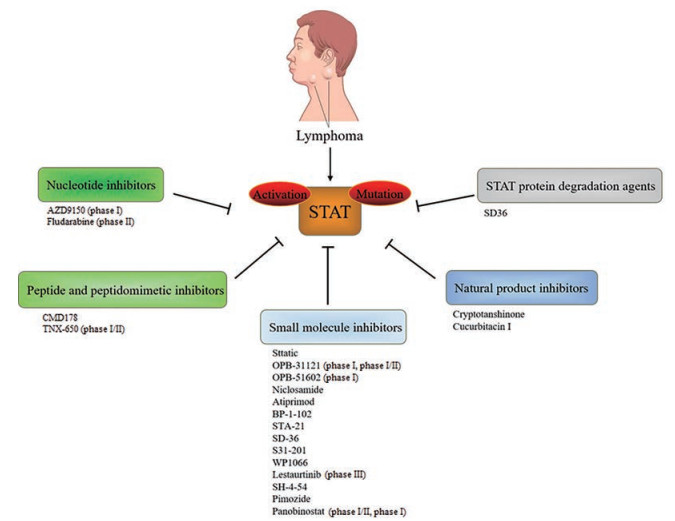
|
Figure 3 Classification of STATs inhibitors |
STATs抑制剂的开发因其生物利用度、体内药效和选择性难以提高的问题一直是癌症治疗的一大难题, 所以至今仍未有上市的STATs抑制剂药物。近年来研究者从多方面入手开发了具有相对较高的特异性和体内药效的STATs抑制剂[28] (表 1[29-51]), 从多个方面抑制癌症中STATs蛋白的活性, 其中许多药物在临床上具有较好的应用, 有望成为治疗淋巴瘤患者的新型药物。
| Table 1 The clinical application of STATs inhibitors in lymphomas. NK: Natural killer; IL-2: Interleukin-2 |
在STATs家族蛋白成员中STAT3有着最为重要的生理功能, 在细胞的增殖、炎症和肿瘤发生等生命活动都有很重要作用, 在肿瘤的发生与发展中也最经常发生激活和突变。由于STATs家族成员的SH2结构域有很高的结构同源性, 以至于难以提高STAT3抑制剂的特异性。另外, STAT3蛋白的单体也具有转录活性[52], 故抑制二聚化只能起到抑制STAT3一部分活性的作用, 靶向STAT3的抑制剂的临床效应受到局限。
商品化的Sttatic是一种非肽类的STAT3小分子抑制剂, 能与STAT3的SH2结构域结合从而抑制其激活、二聚化和核易位, 且不受STAT3激活状态的影响[53]。Liu等[29]的研究表明, Sttatic能够抑制两株鼻型NK/T细胞淋巴瘤细胞(人NK细胞白血病细胞和人NK细胞淋巴瘤悬浮细胞) 的STAT3-Y640F的活性, 从而诱导细胞凋亡。正在进行临床试验的小分子抑制剂OPB-31121和OPB-51602通过特异性地结合STAT3的SH2结构域进而影响STAT3的核易位。OPB-31121对于治疗Burkitt淋巴瘤特别有效, 韩国和香港已进行临床Ⅰ期试验, Ⅰ/Ⅱ期试验在日本进行[30]; OPB-51602可以抑制STAT3的酪氨酸和丝氨酸磷酸化, 在一项多中心剂量递增Ⅰ期研究[31]中, OPB-51602在多名淋巴癌患者中单次和多次给药后迅速吸收, 但剂量难以达到给定值, 因此该药用于血液恶性肿瘤的进一步临床研究已经终止。近年来还有许多正在被研发用于治疗淋巴瘤的小分子抑制剂类药物, 例如氯硝硫胺[32, 54]、阿替莫德[33]、BP-1-102[34]、STA-21[35]、SD-36[37]、S31-201[38]和WP1066[41]等。STAT3的反义寡核苷酸类抑制剂AZD9150通过抑制STAT3基因的表达, 在治疗难度大的淋巴瘤和非小细胞肺癌患者中显示出低剂量的单药抗肿瘤活性[42], 目前AZD9150联合德瓦鲁单抗对于治疗复发或难治性的弥漫性大B细胞淋巴瘤已完成临床Ⅰ期研究。
天然产物类抑制剂用于治疗淋巴瘤也是近年热点。隐丹参酮是一种特异性抑制STAT3的天然产物, 是从丹参酮中分离出来的单体, 能抑制STAT3 Y705的磷酸化和核易位。研究表明[43], 经过隐丹参酮处理后的Burkitt淋巴瘤细胞对药物变得非常敏感, 谷胱甘肽过氧化物酶1和超氧化物歧化酶2表达下调, 活化氧水平增加, 提高了肿瘤细胞对化疗药物的敏感性和细胞凋亡。葫芦素是从葫芦科植物中提取的JAK2/STAT3的天然选择性抑制剂。葫芦素Ⅰ用于治疗对阿霉素耐药的淋巴瘤患者, 通过STAT3的去磷酸化, 增强了肿瘤坏死因子α介导的细胞生长抑制, 提高了细胞对药物的敏感性[44]。
近期研究成果表明, Zhou等[36]率先利用PROTAC技术, 将与STAT3的SH2结构域具有高结合亲和力的拟肽化合物进行优化并合成了小分子配体SI-109, 其二氟甲基磷酸部分与STAT3多个氨基酸残基形成广泛的氢键, 并利用一个连接子连接上E3泛素连接酶的底物受体cereblon蛋白, 合成出对磷酸化STAT3具有很好降解特异性的化合物SD-36, 在白血病和淋巴瘤细胞系中显示出很强的生长抑制活性[37]。STAT3的PROTAC降解剂在临床上的应用值得期待。
4.2 靶向STAT5的抑制剂在淋巴瘤的发生与发展中, STAT5是仅次于STAT3的过度激活的STAT蛋白。STAT5有STAT5a和STAT5b两个亚型, 相似度高于90%, 在多种类型的癌症中高度活跃[55]。来他替尼是一个微生物来源的吲哚并咔唑类化合物K-252a的类似物, 对于多种淋巴细胞白血病具有治疗效果, 现已完成临床Ⅲ期试验。Diaz等[45]研究表明, 来他替尼显著抑制STAT3和STAT5的磷酸化, 使下游Bcl-xL (B cell lymphoma 2-like 1) 表达下调, 通过调节JAK2/STAT5信号通路来诱导霍奇金淋巴瘤细胞生长抑制和凋亡激活。Price-Troska等[46]设计了22种抑制IL-2和IL-2Rα (interleukin 2 receptor α) 结合的肽化合物, 其中CMD178能够持续地通过抑制IL-2/soluble IL-2Rα (sIL-2Rα) 信号通路来降低STAT5的表达, 从而达到B细胞非霍奇金淋巴瘤的良好预后。SH-4-54是一种高效STAT3/STAT5小分子双重抑制剂, 可以通过结合STAT的SH2结构域来抑制其转录活性, 从而抑制细胞增殖和诱导细胞凋亡。在Swerev等[47]的研究中, 联合STAT3/STAT5抑制剂SH-4-54与地西他滨靶向JAK-STATs通路, 在所有浓度组合下联合指数几乎均小于1, 在人霍奇金淋巴瘤细胞L428中显示出很好的协同效应。另外还有一种小分子抑制剂匹莫齐特, 通过抑制STAT5的酪氨酸磷酸化来特异性地抑制STAT5, 而不影响STAT1或STAT3的磷酸化[56]。匹莫齐特是被FDA批准的一种具有可控性不良反应的抗精神病药物。Simpson等[48]的研究表明, 在外周T细胞淋巴瘤细胞中, 匹莫齐特能抑制STAT5的激活, 通过肿瘤坏死因子相关凋亡诱导配体(TNF-related apoptosis-inducing ligand, TRAIL) 及其受体(TRAIL-receptor 1) 依赖的外源性凋亡途径导致凋亡细胞死亡, 在Kit225和HuT102细胞中的半抑制浓度(half maximal inhibitory concentration, IC50) 值分别为15和11 μmol·L-1。
4.3 靶向STAT6的抑制剂STAT6在淋巴瘤细胞中也常出现组成性的激活和突变。TNX-650是一种抗IL-13的单抗, 能降低霍奇金淋巴瘤肿瘤组织中的磷酸化STAT6和IL-13Rα1的水平。一项TNX-650治疗难治性霍奇金淋巴瘤的安全性和有效性研究已完成临床Ⅰ/Ⅱ期的研究, 为以后的临床研究提供早期疗效预测指标(NCT00441818)。帕比司他是一种乙酰基转移酶抑制剂, 在复发/难治性霍奇金淋巴瘤患者的治疗中已显示出很好的临床疗效[50]。近期研究表明[49], 帕比司他和依维莫司联合能抑制STAT5和STAT6的活性, 帕比司他通过调节caspase途径来抑制STAT5和STAT6的磷酸化, 从而诱导细胞死亡, 依维莫司抑制哺乳动物雷帕霉素靶蛋白的功能, 增强了帕比司他抑制细胞增殖的活性。目前帕比司他对于治疗复发难治性淋巴瘤的治疗有很多的临床应用, 如帕比司他和依维莫司联合治疗复发难治性淋巴瘤已完成临床Ⅰ/Ⅱ期试验; 帕比司他联合硼替佐米治疗复发和/或难治性外套细胞淋巴瘤已完成临床Ⅰ期研究; 帕比司他治疗复发性或难治性霍奇金或非霍奇金淋巴瘤已完成临床Ⅰ期研究等。
4.4 靶向STAT1的抑制剂STAT1可以诱导caspase家族成员的表达[57], 在很多细胞中是一种抑癌因子, 能抑制细胞增殖。然而, STAT1在淋巴瘤中能异常激活, 促进癌症的发生与发展[58, 59]。氟达拉滨对STAT1有较高特异性, 在血管平滑肌细胞中能够特异性地抑制STAT1的激活, 而且对其他STAT蛋白的表达和激活没有显著影响[60]。在Epstein-Barr病毒感染的Burkitt淋巴瘤株中, STAT1呈现组成性激活以及Tyr701和Ser727位点的磷酸化, 氟达拉滨处理后能诱导淋巴瘤细胞的凋亡[51]。氟达拉滨在淋巴瘤的治疗有很多的临床应用。氟达拉滨联合利妥昔单抗治疗边缘区非霍奇金淋巴瘤的临床Ⅱ期试验目前已经完成, 其对于患者的治疗非常有效, 随访3.1年的总生存率为87.4%[61]。硼替佐米联合氟达拉滨和阿糖胞苷治疗外套细胞淋巴瘤的疗效和安全性的临床Ⅱ期试验也正在进行中。
5 总结与展望JAK/STATs信号通路在各种淋巴瘤中普遍存在激活和突变, JAK/STATs的异常表达促进淋巴瘤的发生与发展。STATs抑制剂的研发成为治疗淋巴瘤的一个重要策略。然而现今仍未有上市的STATs抑制剂, 主要因为STATs蛋白的抑制剂普遍存在脱靶的缺点, 使得在治疗淋巴瘤的临床试验中会出现药物疗效不高和药物剂量难以提高的现象。因此, 采取先进的药物筛选策略, 提高选择特异性, 降低临床毒副作用将是未来STATs抑制剂设计和筛选的重中之重。利用现有的有效抑制剂作为先导化合物, 根据不同STAT蛋白与DNA的不同结合方式、蛋白结构的差异或是参与的信号通路的不同来合成更具有靶向性的抑制剂具有较好发展前景。另外, 随着肿瘤免疫疗法的快速发展, 靶向STATs抑制剂与免疫检查点抑制剂或嵌合抗原受体(chimeric antigen receptor, CAR) T细胞疗法的联合使用可能对于淋巴瘤治疗的安全性和有效性具有一定程度的提高。其中STAT1抑制剂氟达拉滨联合CD20单抗利妥昔单抗对于边缘区非霍奇金淋巴瘤的临床治疗, 以及STAT3抑制剂AZD9150联合德瓦鲁单抗治疗复发或难治性的弥漫性大B细胞淋巴瘤的临床治疗已初见成效。可以预期, 将有越来越多的STATs抑制剂用于治疗淋巴瘤的临床研究和辅助治疗, 实现淋巴瘤的个性化诊疗。
作者贡献: 邓绮虹完成了文献收集及论文初稿撰写; 李莉是文章的构思者并进行修改和定稿; 邓贤明提供了指导意见; 王峥对文章的图表整理提供了帮助。
利益冲突: 所有作者均声明没有利益冲突。
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68: 394-424. DOI:10.3322/caac.21492 |
| [2] |
Liu W, Liu J, Song Y, et al. Mortality of lymphoma and myeloma in China, 2004-2017:an observational study[J]. J Hematol Oncol, 2019, 12: 22. DOI:10.1186/s13045-019-0706-9 |
| [3] |
Ansell SM, Lesokhin AM, Borrello I, et al. PD-1 blockade with nivolumab in relapsed or refractory Hodgkin's lymphoma[J]. N Engl J Med, 2015, 372: 311-319. DOI:10.1056/NEJMoa1411087 |
| [4] |
Ying Z, Huang XF, Xiang X, et al. A safe and potent anti-CD19 CAR T cell therapy[J]. Nat Med, 2019, 25: 947-953. DOI:10.1038/s41591-019-0421-7 |
| [5] |
Kim JH, Kim WS, Park C. Interleukin-6 mediates resistance to PI3K-pathway-targeted therapy in lymphoma[J]. BMC Cancer, 2019, 19: 936. DOI:10.1186/s12885-019-6057-7 |
| [6] |
Song Z, Wang M, Zhang A. Alectinib: a novel second generation anaplastic lymphoma kinase (ALK) inhibitor for overcoming clinically-acquired resistance[J]. Acta Pharm Sin B, 2015, 5: 34-37. DOI:10.1016/j.apsb.2014.12.007 |
| [7] |
Brudno JN, Kochenderfer JN. Chimeric antigen receptor T-cell therapies for lymphoma[J]. Nat Rev Clin Oncol, 2018, 15: 31-46. DOI:10.1038/nrclinonc.2017.128 |
| [8] |
Tiacci E, Ladewig E, Schiavoni G, et al. Pervasive mutations of JAK-STAT pathway genes in classical Hodgkin lymphoma[J]. Blood, 2018, 131: 2454-2465. DOI:10.1182/blood-2017-11-814913 |
| [9] |
Mata E, Diaz-Lopez A, Martin-Moreno AM, et al. Analysis of the mutational landscape of classic Hodgkin lymphoma identifies disease heterogeneity and potential therapeutic targets[J]. Oncotarget, 2017, 8: 111386-111395. DOI:10.18632/oncotarget.22799 |
| [10] |
Song TL, Nairismagi ML, Laurensia Y, et al. Oncogenic activation of the STAT3 pathway drives PD-L1 expression in natural killer/T-cell lymphoma[J]. Blood, 2018, 132: 1146-1158. |
| [11] |
Ando S, Kawada JI, Watanabe T, et al. Tofacitinib induces G1 cell-cycle arrest and inhibits tumor growth in Epstein-Barr virus-associated T and natural killer cell lymphoma cells[J]. Oncotarget, 2016, 7: 76793-76805. DOI:10.18632/oncotarget.12529 |
| [12] |
Kim SJ, Yoon DH, Kang HJ, et al. Ruxolitinib shows activity against Hodgkin lymphoma but not primary mediastinal large B-cell lymphoma[J]. BMC Cancer, 2019, 19: 1080. DOI:10.1186/s12885-019-6303-z |
| [13] |
Lee S, Shah T, Yin C, et al. Ruxolitinib significantly enhances in vitro apoptosis in Hodgkin lymphoma and primary mediastinal B-cell lymphoma and survival in a lymphoma xenograft murine model[J]. Oncotarget, 2018, 9: 9776-9788. DOI:10.18632/oncotarget.24267 |
| [14] |
Yin Y, Zhang TT, Zhang DY. Research progress of JAK-3 kinase and its inhibitors[J]. Acta Pharm Sin (药学学报), 2016, 51: 1520-1529. |
| [15] |
Niu J, Sun Y, Chen B, et al. Fatty acids and cancer-amplified ZDHHC19 promote STAT3 activation through S-palmitoylation[J]. Nature, 2019, 573: 139-143. DOI:10.1038/s41586-019-1511-x |
| [16] |
Zhang MM, Zhou LX, Xu YJ, et al. A STAT3 palmitoylation cycle promotes TH17 differentiation and colitis[J]. Nature, 2020, 586: 434-439. DOI:10.1038/s41586-020-2799-2 |
| [17] |
Alvarez JV, Frank DA. Genome-wide analysis of STAT target genes-elucidating the mechanism of STAT-mediated oncogenesis[J]. Cancer Biol Ther, 2004, 3: 1045-1050. DOI:10.4161/cbt.3.11.1172 |
| [18] |
Maurer B, Nivarthi H, Wingelhofer B, et al. High activation of STAT5A drives peripheral T-cell lymphoma and leukemia[J]. Haematologica, 2020, 105: 435-447. DOI:10.3324/haematol.2019.216986 |
| [19] |
Rui L, Drennan AC, Ceribelli M, et al. Epigenetic gene regulation by Janus kinase 1 in diffuse large B-cell lymphoma[J]. Proc Natl Acad Sci U S A, 2016, 113: E7260-E7267. DOI:10.1073/pnas.1610970113 |
| [20] |
Wang C, Zhu C, Wei F, et al. Constitutive activation of interleukin-13/STAT6 contributes to Kaposi's sarcoma-associated herpesvirus-related primary effusion lymphoma cell proliferation and survival[J]. J Virol, 2015, 89: 10416-10426. DOI:10.1128/JVI.01525-15 |
| [21] |
Bastidas Torres AN, Cats D, Mei H, et al. Genomic analysis reveals recurrent deletion of JAK-STAT signaling inhibitors HNRNPK and SOCS1 in mycosis fungoides[J]. Genes Chromosomes Cancer, 2018, 57: 653-664. DOI:10.1002/gcc.22679 |
| [22] |
Lee S, Day NS, Miles RR, et al. Comparative genomic expression signatures of signal transduction pathways and targets in paediatric Burkitt lymphoma: a Children's Oncology Group report[J]. Br J Haematol, 2017, 177: 601-611. DOI:10.1111/bjh.14604 |
| [23] |
Meyer AN, Gallo LH, Ko J, et al. Oncogenic mutations in IKKβ function through global changes induced by K63-linked ubiquitination and result in autocrine stimulation[J]. PLoS One, 2018, 13: e0206014. DOI:10.1371/journal.pone.0206014 |
| [24] |
An B, Zhu S, Li T, et al. A dual TLR7/TLR9 inhibitor HJ901 inhibits ABC-DLBCL expressing the MyD88 L265P mutation[J]. Front Cell Dev Biol, 2020, 8: 262. DOI:10.3389/fcell.2020.00262 |
| [25] |
de Araujo ED, Erdogan F, Neubauer HA, et al. Structural and functional consequences of the STAT5B(N642H) driver mutation[J]. Nat Commun, 2019, 10: 2517. DOI:10.1038/s41467-019-10422-7 |
| [26] |
Miloudi H, Leroy K, Jardin F, et al. STAT6 is a cargo of exportin 1:biological relevance in primary mediastinal B-cell lymphoma[J]. Cell Signal, 2018, 46: 76-82. DOI:10.1016/j.cellsig.2018.02.016 |
| [27] |
O'Shea JJ, Schwartz DM, Villarino AV, et al. The JAK-STAT pathway: impact on human disease and therapeutic intervention[J]. Annu Rev Med, 2015, 66: 311-328. DOI:10.1146/annurev-med-051113-024537 |
| [28] |
Lai PS, Rosa DA, Magdy Ali A, et al. A STAT inhibitor patent review: progress since 2011[J]. Expert Opin Ther Pat, 2015, 25: 1397-1421. DOI:10.1517/13543776.2015.1086749 |
| [29] |
Liu J, Liang L, Li D, et al. JAK3/STAT3 oncogenic pathway and PRDM1 expression stratify clinicopathologic features of extranodal NK/T cell lymphoma, nasal type[J]. Oncol Rep, 2019, 41: 3219-3232. |
| [30] |
Hayakawa F, Sugimoto K, Harada Y, et al. A novel STAT inhibitor, OPB-31121, has a significant antitumor effect on leukemia with STAT-addictive oncokinases[J]. Blood Cancer J, 2013, 3: e166. DOI:10.1038/bcj.2013.63 |
| [31] |
Ogura M, Uchida T, Terui Y, et al. Phase I study of OPB-51602, an oral inhibitor of signal transducer and activator of transcription 3, in patients with relapsed/refractory hematological malignancies[J]. Cancer Sci, 2015, 106: 896-901. DOI:10.1111/cas.12683 |
| [32] |
Xiang D, Yuan Y, Chen L, et al. Niclosamide, an anti-helminthic molecule, downregulates the retroviral oncoprotein Tax and pro-survival Bcl-2 proteins in HTLV-1-transformed T lymphocytes[J]. Biochem Biophys Res Commun, 2015, 464: 221-228. DOI:10.1016/j.bbrc.2015.06.120 |
| [33] |
Wang M, Zhang L, Han X, et al. Atiprimod inhibits the growth of mantle cell lymphoma in vitro and in vivo and induces apoptosis via activating the mitochondrial pathways[J]. Blood, 2007, 109: 5455-5462. DOI:10.1182/blood-2006-12-063958 |
| [34] |
Uchihara Y, Ohe T, Mashino T, et al. N-Acetyl cysteine prevents activities of STAT3 inhibitors, Stattic and BP-1-102 independently of its antioxidant properties[J]. Pharmacol Rep, 2019, 71: 1067-1078. DOI:10.1016/j.pharep.2019.05.021 |
| [35] |
Kaneko N, Kita A, Yamanaka K, et al. Combination of YM155, a survivin suppressant with a STAT3 inhibitor: a new strategy to treat diffuse large B-cell lymphoma[J]. Leuk Res, 2013, 37: 1156-1161. DOI:10.1016/j.leukres.2013.05.010 |
| [36] |
Zhou H, Bai L, Xu R, et al. Structure-based discovery of SD-36 as a potent, selective, and efficacious PROTAC degrader of STAT3 protein[J]. J Med Chem, 2019, 62: 11280-11300. DOI:10.1021/acs.jmedchem.9b01530 |
| [37] |
Bai L, Zhou H, Xu R, et al. A potent and selective small-molecule degrader of STAT3 achieves complete tumor regression in vivo[J]. Cancer Cell, 2019, 36: 498-511.e17. DOI:10.1016/j.ccell.2019.10.002 |
| [38] |
Chang Y, Cui M, Fu X, et al. MiRNA-155 regulates lymphangiogenesis in natural killer/T-cell lymphoma by targeting BRG1[J]. Cancer Biol Ther, 2019, 20: 31-41. DOI:10.1080/15384047.2018.1504721 |
| [39] |
Lu K, Chen N, Zhou XX, et al. The STAT3 inhibitor WP1066 synergizes with vorinostat to induce apoptosis of mantle cell lymphoma cells[J]. Biochem Biophys Res Commun, 2015, 464: 292-298. DOI:10.1016/j.bbrc.2015.06.145 |
| [40] |
Geng L, Li X, Zhou X, et al. WP1066 exhibits antitumor efficacy in nasaltype natural killer/T-cell lymphoma cells through downregulation of the STAT3 signaling pathway[J]. Oncol Rep, 2016, 36: 2868-2874. DOI:10.3892/or.2016.5091 |
| [41] |
Ma C, Horlad H, Pan C, et al. Stat3 inhibitor abrogates the expression of PD-1 ligands on lymphoma cell lines[J]. J Clin Exp Hematop, 2017, 57: 21-25. DOI:10.3960/jslrt.17006 |
| [42] |
Hong D, Kurzrock R, Kim Y, et al. AZD9150, a next-generation antisense oligonucleotide inhibitor of STAT3 with early evidence of clinical activity in lymphoma and lung cancer[J]. Sci Transl Med, 2015, 7: 314r. |
| [43] |
Zeng R, Tang Y, Zhou H, et al. STAT3 mediates multidrug resistance of Burkitt lymphoma cells by promoting antioxidant feedback[J]. Biochem Biophys Res Commun, 2017, 488: 182-188. DOI:10.1016/j.bbrc.2017.05.031 |
| [44] |
Hira SK, Mondal I, Bhattacharya D, et al. Downregulation of STAT3 phosphorylation enhances tumoricidal effect of IL-15-activated dendritic cell against doxorubicin-resistant lymphoma and leukemia via TNF-alpha[J]. Int J Biochem Cell Biol, 2015, 67: 1-13. DOI:10.1016/j.biocel.2015.08.002 |
| [45] |
Diaz T, Navarro A, Ferrer G, et al. Lestaurtinib inhibition of the Jak/STAT signaling pathway in hodgkin lymphoma inhibits proliferation and induces apoptosis[J]. PLoS One, 2011, 6: e18856. DOI:10.1371/journal.pone.0018856 |
| [46] |
Price-Troska T, Yang ZZ, Diller D, et al. Inhibiting IL-2 signaling and the regulatory T-cell pathway using computationally designed peptides[J]. Invest New Drugs, 2019, 37: 9-16. DOI:10.1007/s10637-018-0606-9 |
| [47] |
Swerev TM, Wirth T, Ushmorov A. Activation of oncogenic pathways in classical Hodgkin lymphoma by decitabine: a rationale for combination with small molecular weight inhibitors[J]. Int J Oncol, 2017, 50: 555-566. DOI:10.3892/ijo.2016.3827 |
| [48] |
Simpson HM, Furusawa A, Sadashivaiah K, et al. STAT5 inhibition induces TRAIL/DR4 dependent apoptosis in peripheral T-cell lymphoma[J]. Oncotarget, 2018, 9: 16792-16806. DOI:10.18632/oncotarget.24698 |
| [49] |
Lemoine M, Derenzini E, Buglio D, et al. The pan-deacetylase inhibitor panobinostat induces cell death and synergizes with everolimus in Hodgkin lymphoma cell lines[J]. Blood, 2012, 119: 4017-4025. DOI:10.1182/blood-2011-01-331421 |
| [50] |
Younes A, Ong TC, Ribrag V, et al. Efficacy of panobinostat in phase Ⅱ study in patients with relapsed/refractory Hodgkin lymphoma (HL) after high-dose chemotherapy with autologous stem cell transplant[J]. Blood, 2009, 114: 380-381. |
| [51] |
Fagard R, Mouas H, Dusanter-Fourt I, et al. Resistance to fludarabine-induced apoptosis in Epstein-Barr virus infected B cells[J]. Oncogene, 2002, 21: 4473-4480. DOI:10.1038/sj.onc.1205554 |
| [52] |
Yang J, Stark GR. Roles of unphosphorylated STATs in signaling[J]. Cell Res, 2008, 18: 443-451. DOI:10.1038/cr.2008.41 |
| [53] |
Schust J, Sperl B, Hollis A, et al. Stattic: a small-molecule inhibitor of STAT3 activation and dimerization[J]. Chem Biol, 2006, 13: 1235-1242. DOI:10.1016/j.chembiol.2006.09.018 |
| [54] |
Ren X, Duan L, He Q, et al. Identification of niclosamide as a new small-molecule inhibitor of the STAT3 signaling pathway[J]. ACS Med Chem Lett, 2010, 1: 454-459. DOI:10.1021/ml100146z |
| [55] |
Muller J, Sperl B, Reindl W, et al. Discovery of chromone-based inhibitors of the transcription factor STAT5[J]. Chembiochem, 2008, 9: 723-727. DOI:10.1002/cbic.200700701 |
| [56] |
Nelson EA, Walker SR, Weisberg E, et al. The STAT5 inhibitor pimozide decreases survival of chronic myelogenous leukemia cells resistant to kinase inhibitors[J]. Blood, 2011, 117: 3421-3429. DOI:10.1182/blood-2009-11-255232 |
| [57] |
Licht V, Noack K, Schlott B, et al. Caspase-3 and caspase-6 cleave STAT1 in leukemic cells[J]. Oncotarget, 2014, 5: 2305-2317. DOI:10.18632/oncotarget.1911 |
| [58] |
Prutsch N, Gurnhofer E, Suske T, et al. Dependency on the TYK2/STAT1/MCL1 axis in anaplastic large cell lymphoma[J]. Leukemia, 2019, 33: 696-709. DOI:10.1038/s41375-018-0239-1 |
| [59] |
Henrickson SE, Dolan JG, Forbes LR, et al. Gain-of-function STAT1 mutation with familial lymphadenopathy and Hodgkin lymphoma[J]. Front Pediatr, 2019, 7: 160. DOI:10.3389/fped.2019.00160 |
| [60] |
Torella D, Curcio A, Gasparri C, et al. Fludarabine prevents smooth muscle proliferation in vitro and neointimal hyperplasia in vivo through specific inhibition of STAT-1 activation[J]. Am J Physiol Heart Circ Physiol, 2007, 292: H2935-H2943. DOI:10.1152/ajpheart.00887.2006 |
| [61] |
Brown JR, Friedberg JW, Feng Y, et al. A phase 2 study of concurrent fludarabine and rituximab for the treatment of marginal zone lymphomas[J]. Br J Haematol, 2009, 145: 741-748. DOI:10.1111/j.1365-2141.2009.07677.x |
 2021, Vol. 56
2021, Vol. 56


