2. 中国人民解放军联勤保障部队第九〇〇医院, 福建 福州 350025
2. 900 Hospital of the Joint Logistics Team, Fuzhou 350025, China
肿瘤的光动力疗法(photodynamic therapy, PDT)是利用光、光敏剂和氧分子发挥光动力效应的局部微创疗法[1], 光敏剂将光能转移至周围的氧气(O2), 产生单线态氧(singlet oxygen, 1O2)等活性氧簇(reactive oxygen species, ROS)从而杀伤细胞, 使其凋亡、缺血坏死, 达到无痛无痕的治疗[2, 3], 因而氧气在肿瘤的光动力治疗中起着至关重要的作用。然而, 许多实体瘤中普遍存在的低氧环境[4, 5], 严重削弱了PDT的疗效。
为了解决肿瘤环境乏氧问题, 研究者们采用人工红细胞递送氧气[6, 7]、全氟化碳纳米材料输送氧气[8]及过氧化氢酶降解内源性氧而产氧[9]等方法。然而上述方法存在氧气提前泄露、过氧化氢酶在肿瘤微环境中的催化活性较低等问题, 限制了其应用[10, 11]。文献[12]报道, 相对于直接递送氧气而言, 降低细胞耗氧是改善组织乏氧状态的更好方法。细胞的呼吸耗氧主要与线粒体氧化磷酸化过程相关[13], 因此, 抑制细胞的氧化磷酸化过程便可以降低肿瘤细胞的呼吸氧消耗。与筛选新的化合物相比, 筛选临床已经使用的老药发现其新的用途, 是实现药物快速临床应用的便捷方法[14]。经筛选发现, 临床常用的治疗糖尿病的药物二甲双胍和已经使用超过30年的抗疟药阿托伐醌(atovaquone, ATO)被报道可以分别通过抑制线粒体呼吸链复合物I和复合物Ⅲ, 抑制细胞的氧化磷酸化过程[15]。与二甲双胍相比, ATO能够在更低的浓度、更有效地降低更多肿瘤细胞系的氧消耗率[15], 因此是一种更有潜力的肿瘤细胞氧消耗抑制剂。
Fan等[16]通过聚乳酸-羟基乙酸共聚物-聚乙二醇同时包裹ATO和光敏剂维替泊芬(verteporfin, VER), 通过ATO克服肿瘤组织的乏氧, 增强VER介导的光动力治疗疗效。然而, 其载药量不高, 并且不能精确地调节两种药物的载药量和装载比例, 使用的灵活性受到限制; Xia等[17]使用基质金属蛋白酶2响应降解的明胶, 制备了粒径约437 nm的纳米粒, 该纳米粒同时包裹ATO和负载光敏剂吲哚菁绿的牛血清白蛋白, 通过ATO克服肿瘤乏氧, 增强吲哚菁绿介导的光动力治疗疗效。然而, 该纳米粒的制备过程复杂, 多处不可控。
使用临床获批的药物, 通过非共价相互作用(配位作用、氢键作用、静电相互作用、疏水作用、π-π相互作用及范德华力等)构建的无载体材料的超分子纳米粒(supramolecular nanoparticles, SMN)能够很好地解决上述问题[18]。本研究使用ATO和VER (图 1), 在此基础上加入聚乙烯吡咯烷酮(polyvinylpyrrolidone, PVP)作为稳定剂, 通过超分子相互作用构建超分子纳米粒VER-ATO-SMN。对构建的超分子纳米粒进行处方优化, 并对其形貌、大小、理化性质、体外溶氧情况和单线态氧产生情况等进行表征, 考察VER-ATO-SMN对4T1小鼠乳腺癌细胞的光、暗毒性, 考察药物对荷瘤小鼠肿瘤生长的抑制作用。本研究提出的利用临床批准药物构建超分子纳米粒的策略, 为研发更易临床转化的纳米药物提供实验基础和研究思路。
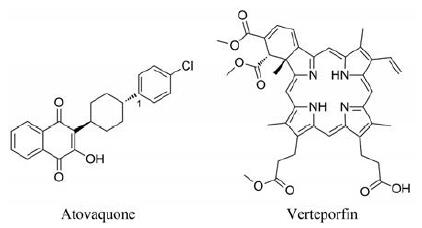
|
Figure 1 Molecular structures of cellular respiration inhibitor atovaquone (ATO) and photosensitizer verteporfin (VER) |
主要仪器 激光粒度仪(奥地利Anton Paar公司); 岛津LC-20A高效液相色谱仪(日本岛津公司); MDL-SD-635 nm激光器(长春新产业光电技术有限公司); 脂质体挤出器(加拿大Avestin公司); Model 680型酶联免疫检测仪(美国Shel-Lab公司); 小动物活体成像系统(Fx Pro, 德国Bruker公司); 流式细胞仪(美国Becton-Dickinson公司); MNT-150原点数显卡尺(上海美耐特实业有限公司); 荧光显微镜(日本Olympus公司)。
药品与试剂 VER (美国USP公司); ATO (美国Sigma-Aldrich公司); 聚乙烯吡咯烷酮-K30 (polyvinylpyrrolidone-K30, PVP-K30)、N, N-二甲基甲酰胺(N, N-dimethyl formamide, DMF)、甲醇、无水乙醇(分析纯)(国药集团化学试剂有限公司); 蛋黄磷脂酰甘油(egg phosphatidylglycerol, EPG)(艾伟拓上海医药科技有限公司); 二肉豆蔻酰磷脂酰胆碱(dimyristoyl phosphatidylcholine, DMPC)(德国Lipoid公司); 二氯甲烷(上海联试化工试剂有限公司); 胎牛血清(fetal bovine serum, FBS)(四季青生物有限公司); 磷酸盐缓冲液(phosphate buffer saline, PBS)、RPMI.1640不完全培养液、Cell Counting Kit-WST-8试剂盒(南京凯基生物技术股份有限公司); 通用型组织固定液(中性, 武汉赛维尔生物科技有限公司); ROS检测试剂盒(上海碧云天生物技术有限公司); Cy5.5 Di Ethylene (南京拜恩特斯生物科技公司)。
实验细胞 小鼠乳腺癌细胞(4T1细胞)购自中国科学院上海细胞库, 在含10%FBS、1%抗生素(链霉素、青霉素)的1640培养基中于37℃、5% CO2条件下培养。
实验动物 雌性BALB/c小鼠(20±2 g, 6~8周龄), 购自上海斯莱克实验动物有限责任公司。动物实验经中国人民解放军联勤保障部队第九〇〇医院动物实验伦理委员会批准, 动物使用许可证号: SYXK (闽)2018-0006。
纳米粒的制备 将一定量的VER、ATO和PVP溶解于500μL DMF中, 边搅拌边匀速滴入5 mL去离子水中, 继续搅拌1 h。将纳米粒溶液转移至截留分子量100 K的超滤管中, 使用0.9%氯化钠注射液为清洗溶液, 超滤5次, 得到VER-ATO-SMN溶液, 稀释至2 mL。4℃保存待用, 全过程避光操作。
纳米粒的表征 取上述制备的纳米粒适量, 加纯水稀释至1 mL, 采用激光纳米粒度仪测定其粒径分布、多分散指数(polymer dispersity index, PDI)及zeta电位。另取适量上述纳米粒溶液, 滴在覆有支持膜的铜网上, 1%磷钨酸负染干燥后, 置于透射电镜(transmission electron microscopy, TEM)下拍照, 观察纳米粒形态。通过高效液相色谱法(high performance liquid chromatography, HPLC)测定纳米粒中两种药物含量。
维替泊芬脂质体的制备 脂质体Visudyne®被FDA批准上市[19], 参考美国专利(US Patent 5707608)制备注射用VER脂质体。采用DMPC和EPG为脂质材料, 脂质体中VER∶EPG∶DMPC=1.05∶3∶5 (w/w/w), 加入二氯甲烷溶解药物后, 旋转蒸发形成一层脂质薄膜, 加入0.9%氯化钠注射液水化, 然后依次通过400、200和100 nm聚碳酸酯膜挤出, 得到VER脂质体(VER-liposome)。
高效液相色谱方法学建立 ①色谱条件色谱柱: Agilent Zorbax SB-C18 column (4.6 mm×250 mm, 5μm); 流动相: 甲醇-磷酸缓冲液(pH 6.80)(70∶30, v/v); 流速: 1 mL·min-1; 柱温: 30℃; 进样量: 10μL; ATO和VER检测波长分别为276和427 nm, 样品进样前过0.22μm滤膜; ②方法专属性考察: 分别取40μg·mL-1的ATO和VER对照品溶液, 按上述色谱条件测定; ③标准曲线和线性关系: 精密称取VER和ATO适量, 用甲醇稀释配成质量浓度为5、10、20、40、60、80和100μg·mL-1的系列对照品溶液, 进样10μL, 以峰面积(A)对其浓度(C, μg·mL-1)进行线性回归; ④精密度和回收率测定: 取配制标准曲线低、中、高3个浓度(5、40、100μg·mL-1)的供试品进行测定, 考察日内、日间精密度及回收率情况; ⑤供试品溶液的配制: 取少量纳米粒溶液, 加入一定体积甲醇使药物和材料完全溶解, 0.22μm滤膜过滤后进样; 取少量脂质体溶液加异丙醇破乳, 超声30 min, 涡旋2 min后过滤进样。
载药量及包封率的测定 将一定量纳米粒溶液冻干后精密称取粉末质量, 然后使用色谱甲醇将其溶解, 通过HPLC测定两种药物含量, 计算载药量(loading capacity, DL)。根据标准曲线分别计算得到两种药物浓度, 并换算为实际药物质量, 计算包封率(encapsulation efficiency, EE)。
| $\mathrm{DL}=\frac{W_{1}}{W_{0}} \times 100 \%$ | (1) |
| $\mathrm{EE}=\frac{W_{1}}{W_{2}} \times 100 \%$ | (2) |
其中, W0为纳米粒总质量, W1为纳米粒中药物质量, W2为实际药物投药量。
纳米粒的处方优化 采用单因素实验, 考察VER和ATO投药重量比、PVP分子质量、PVP用量及DMF与去离子水的体积比, 根据超分子纳米粒的粒径和PDI大小, 筛选最优处方。
纳米粒稳定性的考察 将纳米粒分别静置于PBS和10%FBS的PBS中, 在7天内(0、1、2、3、5和7天)测定其粒径大小和PDI, 重复测定3次。记录数据并绘制曲线图, 观察粒径变化情况。
纳米粒的光稳定性考察 将纳米粒溶液和游离VER (free VER)([VER]=15μg·mL-1)置于6孔板中, 用635 nm激光在0.3 W·cm-2功率密度下照射不同时间(0、5、10、15、30和60 min)后, 在300~800 nm波长内扫描药物的紫外吸收光谱, 通过紫外吸收光谱的变化判断药物的降解速率及产物情况。
纳米粒形成作用力的考察 参考文献[20]方法考察不同浓度(10、20、40、80 mmol·L-1)的Tween 20、曲拉通X-100 (Triton X-100)、十二烷基磺酸钠(sodium dodecyl sulfonate, SDS)、尿素和氯化钠对纳米粒的解离情况, 通过激光纳米粒度仪考察纳米粒的粒径变化, 分析纳米粒中存在的相互作用力。
乏氧和常氧培养条件下细胞暗毒性考察 将4T1细胞为模型细胞, 以5×103个/孔细胞数接种至96孔板中, 细胞贴壁后, 给予不同浓度([VER]=0.5、1、2、3、4、6、8、10、15μmol·L-1)的VER-ATO-SMN溶液100μL, 乏氧组再加入液体石蜡50μL, 孵育24 h。然后每孔加入CCK-8溶液10μL, 4 h后终止培养, 振荡10 min, 用酶标仪在450 nm波长处测定每孔的吸光度值(OD), 计算细胞存活率。
乏氧和常氧培养条件下细胞光毒性考察 将4T1细胞为模型细胞, 以5×103个/孔的密度接种至96孔板中, 细胞贴壁后, 给予PBS以及不同浓度([VER]=0.01、0.02、0.05、0.1、0.2、0.3、0.4μmol·L-1)的VER-ATO-SMN、VER-liposome和free VER, 乏氧组再加入液体石蜡50μL, 孵育6 h后, 用635 nm激光器5 mW·cm-2照射10 min。治疗结束后, 更换含10%FBS的新鲜培养液培养24 h, 然后用CCK-8法测定, 计算细胞的存活率。
细胞摄取 将4T1细胞以8×104个/皿接种于玻璃底培养皿(总直径35 mm, 玻璃直径20 mm)中培养过夜。细胞贴壁后, 使用含2μmol·L-1VER的VER-ATO-SMN和free VER与细胞共孵育2 h/6 h。吸走药液, 用冷的PBS洗3次, 加入1 mL通用型组织固定液(中性)固定30 min, PBS洗3次后于荧光显微镜下观察药物被细胞摄取的情况并拍照记录。
细胞耗氧率的测定 将4T1细胞为模型细胞, 以1×105个/孔细胞数接种于6孔板中, 待细胞贴壁后, 加入样品溶液(PBS、VER-liposome和VER-ATO-SMN, 每孔中对应各药物浓度, VER=5μmol·L-1、ATO=6μmol·L-1)孵育6 h后, 更换为新鲜培养基。将溶氧仪探头插入液面以下、细胞层以上, 加入液体石蜡液封, 避免细胞培养液与外界环境进行气体交换, 构建密闭环境, 记录1 h内细胞的氧消耗量与初始含氧量的比率——氧消耗率(oxygen consumption rate, OCR)的变化情况。计算公式如下:
| $\operatorname{OCR}(\%)=\left(\mathrm{DO}_{0}-\mathrm{DO}_{t}\right) / \mathrm{DO}_{0} \times 100 \%$ | (3) |
其中, DO0表示溶液初始溶解氧测定值, DOt代表测定时刻溶液中的溶解氧测定值。
细胞内ROS的产生 将4T1细胞为模型细胞, 细胞铺板贴壁后, 加入样品溶液(PBS、free VER、VER-liposome和VER-ATO-SMN, 每孔中对应各药物浓度, VER=5μmol·L-1、ATO=6μmol·L-1)孵育6 h后, 使用635 nm激光器5 mW·cm-2照射1 min, 最后使用细胞ROS检测试剂盒[该试剂盒的探针为2, 7-dichlorofluorescin diacetate (DCFH-DA)]考察各组在乏氧培养环境下诱导细胞产生ROS的情况, 并通过激光共聚焦显微镜进行荧光拍照。
小动物活体成像 小鼠皮下接种1×106个4T1细胞, 使用Cy5.5 Di Ethylene (Ex=684 nm, Em=710 nm)作为荧光探针。将疏水的Cy5.5 Di Ethylene加入DMF溶液, 与药物一起滴到水中, 制备得到其标记的纳米粒Cy5.5-VER-ATO-SMN, 通过荧光分光光度计测得Cy5.5的包封率为100%, 其粒径及zeta电位与未修饰的纳米粒几乎相同。因此, 可以通过Cy5.5 DiEthylene的发光情况反应VER-ATO-SMN在模型小鼠体内的分布。在肿瘤体积长至约150 mm3时, 将VER-ATO-SMN经尾静脉注射于小鼠体内(n=3), 在给药后1、2、4、6、9、12和48 h, 分别通过小动物活体成像系统进行观察及拍照。
体内药效学考察 利用雌性BALB/c小鼠皮下肿瘤模型评估VER-ATO-SMN的抗肿瘤活性。使用与VER-ATO-SMN相同的制备方法, 制备不加ATO的VER纳米粒(VER-NP)作为对照, 其粒径及zeta电位与VER-ATO-SMN几乎相同。将1×106个4T1小鼠乳腺癌细胞注射至皮下造模, 将荷瘤小鼠随机分成6组[PBS组、laser (激光)组、VER-ATO-SMN组、VER-liposome PDT组、VER-NP PDT组和VER-ATO-SMN PDT组], 每组6只。在肿瘤体积长至100 mm3左右时, 进行尾静脉注射给药及光照。以VER浓度为准, 每组给药剂量均为8 mg·kg-1, PDT组在给药6 h后用635 nm激光(0.3 W·cm-2)照射10 min, laser组为仅用635 nm激光(0.3 W·cm-2)照射10 min。从第0天起, 每两天测量小鼠体重和肿瘤体积。通过公式计算肿瘤体积(V):
| $V=\left(a \times b^{2}\right) / 2$ | (4) |
其中, a和b分别是肿瘤的长径和短径。
统计学方法 采用IBM SPSS 19.0软件对数据进行单因素方差分析(one-way ANOVA), 实验数据表示为x ± s, 以P < 0.05表示具有显著性差异。
结果与讨论 1 HPLC方法学考察经方法学研究, ATO保留时间约为4.2 min (图 2A), 由于VER为同分异构体(质量比接近1∶1), 因此VER在27.8和36.4 min左右出现双峰(图 2B), 浓度计算时使用两个峰面积之和。两种药物的峰形良好, 溶液中杂质对测定无干扰。VER和ATO的标准曲线方程分别为: A=57 957 C-266 761 (r=0.999 4), A=50 584 C-14 293 (r=0.999 9), 在5~100μg·mL-1内峰面积与浓度线性关系良好。日间、日内精密度良好(RSD < 2.0%), 低、中、高3个浓度平均回收率为102.4%, 表明该测定方法准确、可靠, 满足药物含量测定要求。
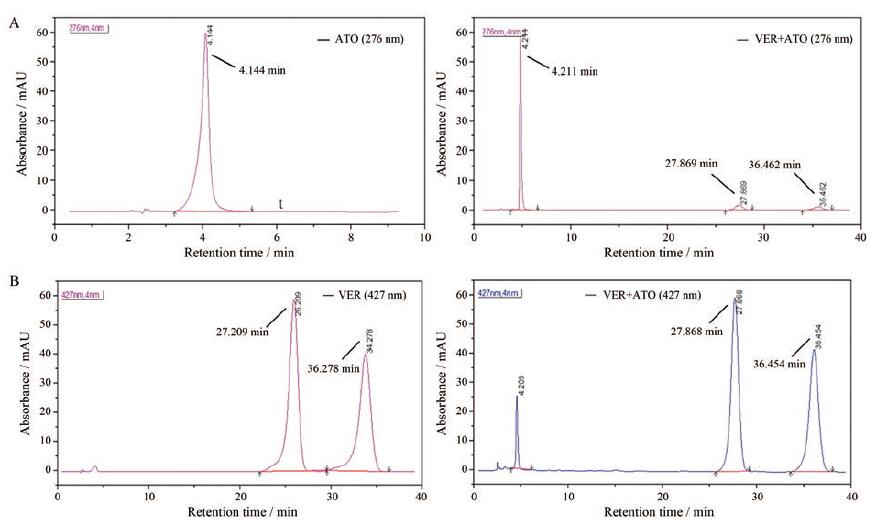
|
Figure 2 Chromatograms of free ATO and ATO in VER-ATO-SMN at 276 nm (A) and free VER and VER in VER-ATO-SMN at 427 nm(B) determined by HPLC method.SMN: Supramolecular nanoparticles |
不同投药比(ATO质量WATO∶VER质量WVER为0.25、0.5、1、2、4、6)制备的纳米粒粒径和药物包封率随着投药比的改变无显著变化, 粒径均在90 nm左右, 两药包封率均在70%左右(图 3A、B)。图 3C的结果显示, 纳米粒中两药物的投药质量比与纳米粒中最终测得的药物比例一致, 且两者具有良好的线性相关(r=0.997, 图 3D), 表明VER-ATO-SMN中两种药物的比例可以通过投药比例进行灵活的调节。文献[16]报道ATO和VER的质量比为1∶1时能够较好地发挥两者的协同作用, 因此本研究选择两药物质量比为1∶1作为最终药物比例。图 3E~G结果表明, DMF体积为500μL、PVP分子质量为30K、PVP用量为100 mg时制备得到的纳米粒的粒径最小。综上所述, 纳米粒的最优制备工艺为: 将VER 2 mg、ATO 2 mg和PVP-K30 100 mg溶解于500μL DMF中, 边搅拌边匀速滴入5 mL去离子水中, 搅拌1 h后超滤5次, 得到终体积为2 mL的VER-ATO-SMN溶液。
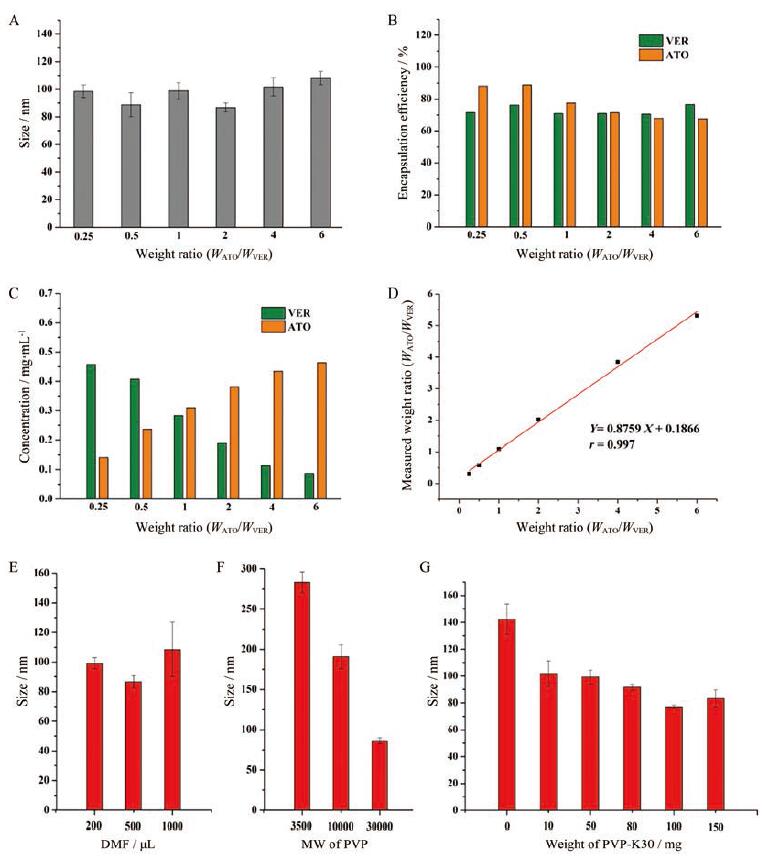
|
Figure 3 The study of formulation optimization.A: Hydrodynamic diameter of different formulations; B: Encapsulation efficiency of different formulations; C: Actual concentration of different formulations; D: The fitting curve of the ratio of drug added and measured.Hydrodynamic diameter of formulations prepared with differentvolume of N, N-dimethyl formamide (DMF)(E), different molecular weight(MW) of polyvinylpyrrolidone (PVP)(F), and different weight of PVP-K30 (G)(n=3, x ± s) |
本研究对最优处方所制纳米粒的理化性质进行了表征, DLS结果表明, 所制备的VER-ATO-SMN水合动力学直径为101.21 nm, PDI为0.232±0.026, 且TEM图像表明其为球形形貌(图 4A), zeta电位为-16.6±0.3 mV(图 4B)。VER-ATO-SMN的这些理化性质更有利于通过高渗透长滞留效应(enhanced permeability and retention effect, EPR)蓄积到肿瘤组织中[21]。紫外测定结果(图 4C)显示, ATO在276 nm处有特征吸收峰, VER在427和690 nm处有特征吸收峰。在VER-ATO-SMN的紫外吸收光谱中观察到ATO和VER分别在276和690 nm处的特性吸收, 表明这两种疏水性药物均被组装在SMN中。通过HPLC测得纳米粒中VER和ATO的质量浓度分别为708.6和775.2μg·mL-1, 载药量分别为44.08%和48.22%, 包封率分别为70.86%和77.52%。图 4D、E结果表明, VER-ATO-SMN在PBS (10 mmol·L-1, pH 7.4)和含10%FBS的PBS中放置7天稳定。并且, 将纳米粒溶液冻干后复溶(图 4F), 其粒径大小基本不变(图 4G), 表明VER-ATO-SMN可以制成冻干粉针剂, 并长期保存。
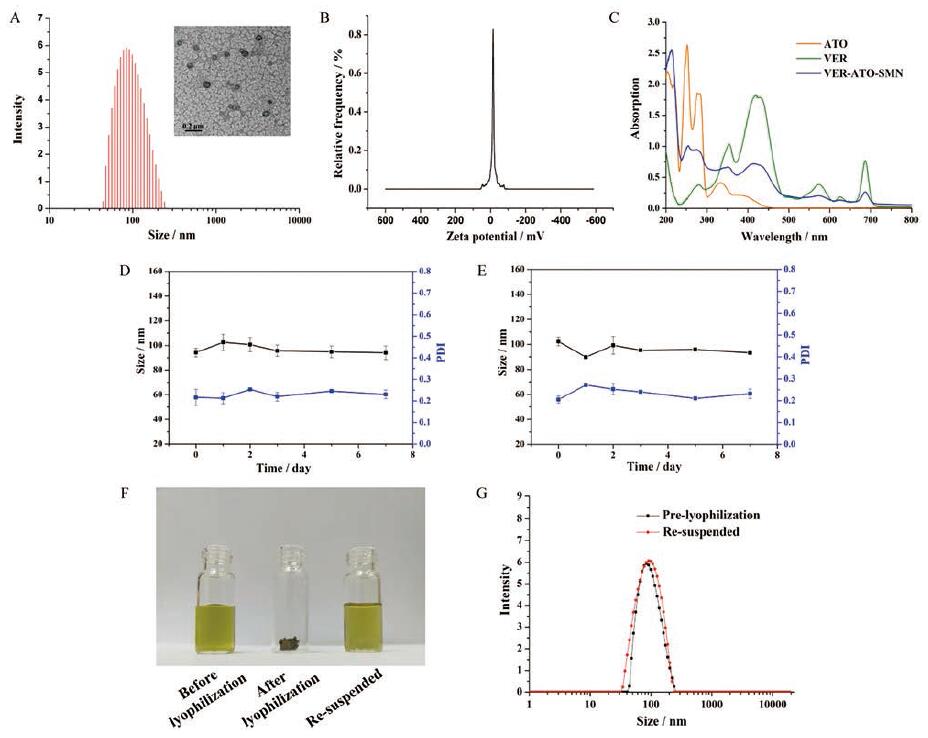
|
Figure 4 Physicochemical characterization of VER-ATO-supramolecular nanoparticles (VER-ATO-SMN).A: Hydrodynamic size distribution, and the representative transmission electron microscopy (TEM) image.Scale bars represent 200 nm; B: Zeta potential; C: UV-Vis absorption spectra of the ATO, VER and VER-ATO-SMN; D: The stability of diluted VER-ATO-SMN in phosphate buffer saline (PBS, pH7.4) for 7 days; E: The stability of diluted VER-ATO-SMN in PBS buffer supplemented with 10%(v/v) fetal bovine serum (FBS) for 7 days.Black lines represent the change of particle size; blue lines represent the change of polymer dispersity index (PDI)(n=3, x ± s); F: The image of VER-ATO-SMN solution before lyophilization, VER-ATO-SMN powder after lyophilization and VER-ATO-SMN resuspended in water; G: The size distribution of VER-ATO-SMN re-suspended in water after lyophilization |
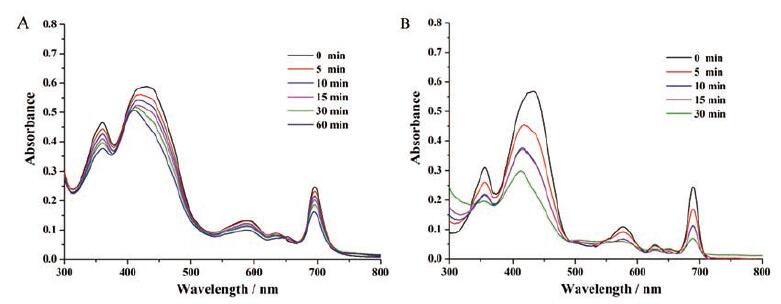
VER-ATO-SMN和free VER随光照时间降解的紫外吸收图谱如图 5所示, 根据表 1中的吸光度, 利用朗伯-比尔定律计算药物降解百分率得出, 经激光照射10 min后, VER-ATO-SMN降解不足10%, 照射60 min后降解20%左右, 表明纳米粒的光稳定性良好; 经激光照射5 min后, free VER即降解22%左右, 照射30 min后降解超过50%, 与VER-ATO-SMN相比稳定性显著降低, 光稳定性较差。从图中看出, 光降解产物中没有出现新的紫外吸收光谱图, 证明光降解产物中没有光敏活性物质, 同时也证明体内实验中使用的光剂量(0.3 W·cm-2、10 min)不会使VER-ATO-SMN大量降解。
|
Figure 5 UV-Vis absorbance spectra of VER-ATO-SMN (A) and free VER (B) irradiated with 635 nm laser within 60 min and 30 min, respectively |
| 表 1 The UV absorbance (427 nm) of VER-ATO-SMN and free VER irradiated with 635 nm laser at different times |
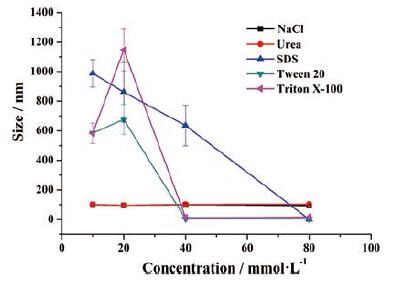
从图 6结果中可以看出, 作为疏水竞争剂, Tween20、Triton X-100和SDS处理组粒径大幅度变化, 均可有效地解离纳米粒, 说明VER-ATO-SMN中存在的主要作用力是疏水相互作用; 而尿素和NaCl处理组干预后粒径无变化, 说明氢键和电荷相互作用并非形成纳米粒组分间的主要相互作用。
|
Figure 6 VER-ATO-SMN dissociation by Tween 20, Triton X-100, sodium dodecyl sulfonate (SDS), urea and NaCl (n=3, x ± s) |
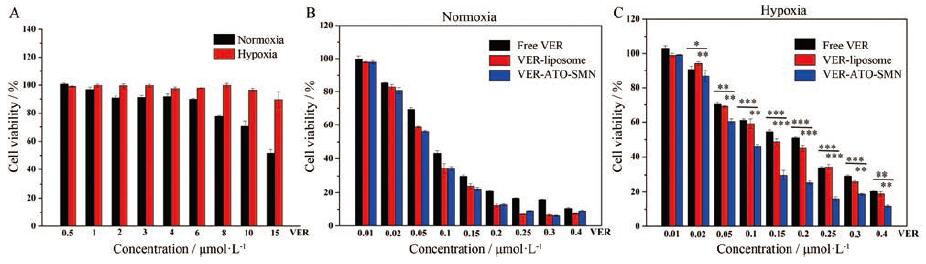
利用CCK-8法考察VER-ATO-SMN在有、无光照情况下对4T1细胞的毒性。图 7A细胞暗毒性结果显示, 在常氧培养条件下, VER-ATO-SMN在VER浓度为6μmol·L-1以下均不影响细胞活力(存活率高于80%)。在乏氧条件下培养, VER在最大给药浓度15μmol·L-1以下未表现出细胞毒性。因此, 选择药物浓度在常氧条件下应该低于6μmol·L-1, 而乏氧条件下应该低于15μmol·L-1, 作为光毒性考察的浓度范围, 在此范围内产生的细胞毒性均为PDT所致, 而无药物本身毒性影响。
|
Figure 7 The viability of 4T1 cells treated with VER-ATO-SMN in various concentrations without irradiation under normoxia and hypoxia(A).The viability of 4T1 cells treated with free VER, VER-liposome and VER-ATO-SMN in various concentrations with 5mW·cm-2 irradiation at 635 nm for 10 min under normoxia (B) and hypoxia (C).n=6, x ± s.*P < 0.05, **P < 0.01, ***P < 0.001 |
光毒性结果显示, 在常氧条件下(图 7B), VER-liposome与VER-ATO-SMN显示出近乎相同的细胞活力, 证明在氧充足的条件下, ATO对于VER的PDT效果几乎无影响, 且光照后ATO未显示额外的细胞毒性, 所产生的细胞毒性效果均来源于VER介导的PDT; free VER细胞存活率较高, 可能是由于细胞对游离药物摄取量少且摄取速度慢所致。在乏氧条件下(图 7C), 给予相同给药浓度及光剂量, VER-ATO-SMN的半数抑制浓度(0.084±0.010μmol·L-1)显著低于VER-liposome的半数抑制浓度(0.137±0.016μmol·L-1)和free VER的半数抑制浓度(0.145±0.019μmol·L-1), 其细胞杀伤能力约为VER-liposome的1.63倍、free VER的1.73倍。
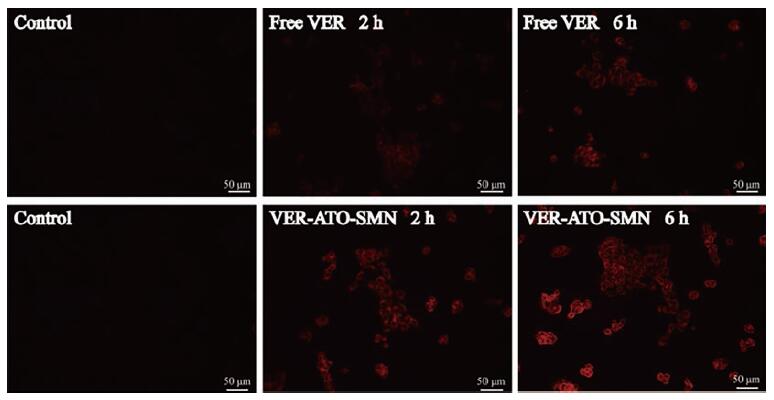
7 机制研究 7.1 细胞摄取光敏剂VER本身可发射荧光, 利用该性质, 通过检测细胞内VER的荧光强度, 判断细胞对于药物的摄取情况。如图 8结果所示, 细胞内的荧光强度与时间呈正相关关系, 证明细胞对药物摄取行为是时间依赖的, 即随着共孵育时间的延长, 药物在胞内的积累量增多。VER-ATO-SMN孵育后, 可以清晰看到细胞中的红色荧光信号, 这表明VER-ATO-SMN可以有效地内化到细胞中。Free VER可以通过被动扩散被内化到细胞中, 用相同浓度的free VER孵育时, 细胞的红色荧光信号并不明显。这表明, 与free VER相比, 细胞能够更有效地摄取VER-ATO-SMN。
|
Figure 8 Fluorescence microscope images of 4T1 cells incubated with free VER and VER-ATO-SMN for 2 and 6 h, respectively.Scale bar=50μm |
体外培养的细胞主要从培养基中摄取O2, 根据细胞从培养基中摄取O2的量可以间接反映细胞的耗氧量。从图 9A可以看出, 相同时间内VER-ATO-SMN处理组细胞的OCR始终低于VER-liposome和PBS处理组, 表明VER-ATO-SMN处理的细胞由于ATO的作用使细胞自身呼吸耗氧量降低, 从外界培养基中摄取O2的量更少。
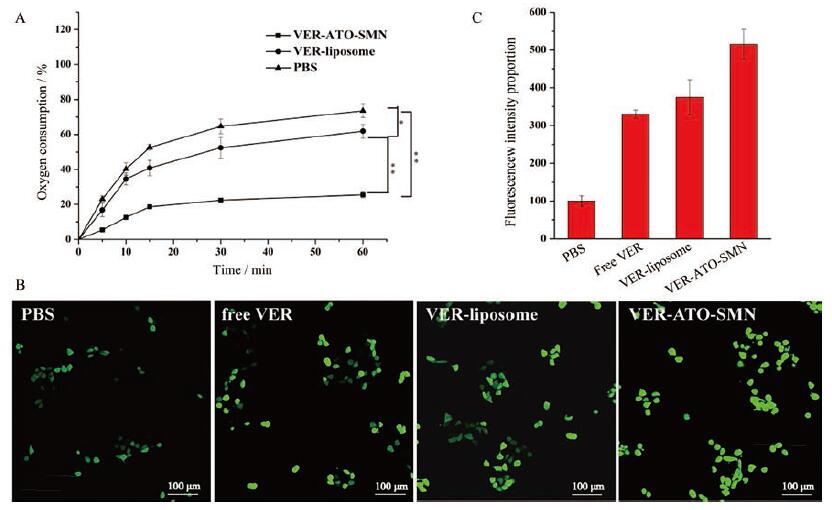
|
Figure 9 Measurement of oxygen consumption rate (OCR, A)(n = 3, x ± s).Reactive oxygen species (ROS) generated in cells treated with PBS, free VER, VER-liposome and VER-ATO-SMN, irradiated with an 635 nm laser (5 mW·cm-2, 1 min each).Green fluorescence under confocal microscopy indicated positive staining for ROS probe 2', 7'-dichlorodihydrofluorescein diacetate (DCFH-DA, Ex=502 nm, Em=5 2 3 nm)(B).Scale bars represent 100μm.Quantitative analysis of ROS production by flow cytometry (C).*P < 0.05, **P < 0.01 |
VER-ATO-SMN处理后细胞内部荧光探针的荧光强度高于free VER和VER-liposome (图 9B、C)。可能的机制是一方面由于细胞对free VER的摄取比VER-ATO-SMN少; 另一方面通过ATO抑制了VER-ATO-SMN组的细胞呼吸氧耗, 其细胞内的O2含量高于其他处理组, 从而有更多的O2接收
8 小动物活体成像皮下接种4T1小鼠乳腺癌细胞的BALB/c荷瘤小鼠用于药物分布和体内药效考察。通过小鼠给药后的活体荧光成像(图 10A)观察, 发现注射后纳米粒能到达并通过EPR效应蓄积在肿瘤部位, 约6 h后药物在肿瘤中累积的荧光强度达到最大值(图 10B)。因此, 了激发的光敏剂传递的能量, 产生更多1O2等ROS。将给予光照的治疗时间点设定为给药后6 h。
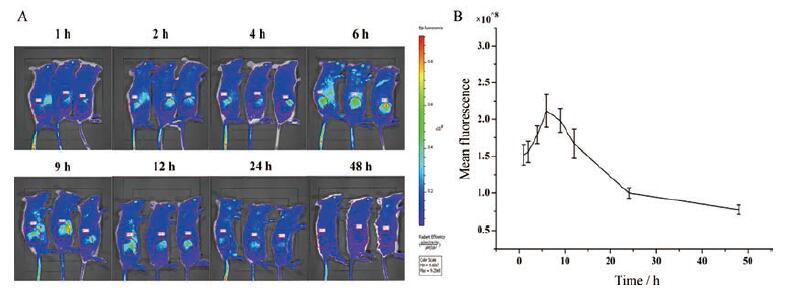
|
Figure 10 In vivo fluorescence images of 4T1 tumor-bearing mice taken at different time points after injection with VER-ATO-SMN (A).Quantitation of the mean fluorescence of tumor sites (B).Tumor sites have been circled in red |
如图 11A所示, 23天内监测到VER-ATO-SMN PDT组肿瘤体积呈现下降趋势, 说明VER-ATO-SMN在体内有较好的抗肿瘤活性。与之相比, PBS组、laser组与VER-ATO-SMN组肿瘤体积增长迅速。VER-liposome PDT组与VER-NP PDT组肿瘤体积增长相对缓慢。各组小鼠的体重没有显著差别(图 11B), 表明各种治疗对小鼠生长无明显毒副作用。为了更直观地反映肿瘤变化趋势, 拍照记录了治疗第0、5、21天的肿瘤生长情况(图 11C), 由于PDT治疗后对表皮有一定损伤, 导致表面皮肤结痂, 治疗结束后该部位的皮肤恢复完好如初。将治疗结束后的小鼠肿瘤组织分离后称量(图 11D), 与对照组相比, VER-ATO-SMN PDT组的肿瘤生长得到明显地抑制, 甚至部分肿瘤完全消融, 该结果与在体肿瘤测量结果一致。
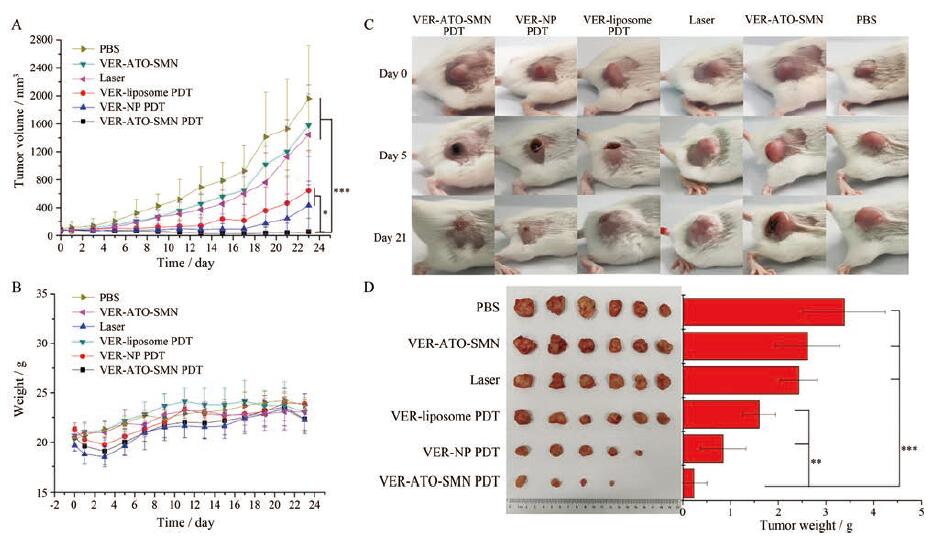
|
Figure 11 VER-ATO-SMN exhibited improved PDT effects in vivo.A: Tumor growth curves following different treatments; B: Body weights shifting in tumor-bearing mice; C: Representative tumor images after different treatments on day 0, 5 and 21;D: Images and weights of the excised tumors after different treatments.n=6, x ± s.*P < 0.05, **P < 0.01, ***P < 0.001 |
本研究以ATO和VER为原料, 成功制备出VER-ATO-SMN, 药物含量高, 能很好地解决目前传统的纳米载体对于药物的装载量低及制备方法复杂等问题。该纳米粒安全性良好, 经细胞摄取后, 释放的ATO作用于细胞线粒体复合物Ⅲ, 切断呼吸链电子传递, 降低细胞耗氧速率, 改善肿瘤细胞缺氧状态。所“节省”的氧气通过光激活的光敏剂的作用生成更多的ROS, 进而对肿瘤细胞产生杀伤作用, 达到增强PDT的效果。此制备方法操作简便, 与游离药物相比, VER-ATO-SMN提高了药物在水中的分散度; 处方筛选后的VER-ATO-SMN形态圆整, 粒径较小, 含药量可调整。在给予635 nm激光治疗时, VER-ATO-SMN对4T1细胞有很强的杀伤作用, 与free VER和VER-liposome相比, VER-ATO-SMN的PDT疗效提高。细胞呼吸耗氧率与细胞ROS生成量的检测验证了该体系在细胞层面上具有抑制细胞呼吸、减少细胞摄取环境中氧的作用, 从而生成更多ROS使肿瘤细胞凋亡或坏死。体内药效学结果显示, 本体系具有显著的肿瘤抑制作用, 甚至达到消融肿瘤的效果, 且无毒副作用, 具有一定安全性。以上表明, VER-ATO-SMN为克服肿瘤的光动力治疗乏氧提供了一种安全有效的方法, 也证明VER-ATO-SMN在抗肿瘤治疗上有一定应用价值, 为后续研究奠定了基础。
作者贡献: 张佳良和宋洪涛提出实验研究的整体思路; 杨雪晗负责主要实验操作、数据处理及文章的撰写; 林娇、张雪婷和徐航负责协助体内药效相关实验的操作及数据采集、分析。
利益冲突: 全体作者声明不存在任何利益冲突。
| [1] |
Awan MA, Tarin SA. Review of photodynamic therapy[J]. Surgeon, 2006, 4: 231-236. DOI:10.1016/S1479-666X(06)80065-X |
| [2] |
Luo L, Liu JB, Yin Z, et al. Biodegradable micelles for two-photon photodynamic therapy in a mouse model of breast cancer[J]. Acta Pharm Sin(药学学报), 2019, 54: 927-936. |
| [3] |
Zhang J, Jiang CS, Longo JPF, et al. An updated overview on the development of new photosensitizers for anticancer photodynamic therapy[J]. Acta Pharm Sin B, 2018, 8: 137-146. DOI:10.1016/j.apsb.2017.09.003 |
| [4] |
Harrison LB, Chadha M, Hill RJ, et al. Impact of tumor hypoxia and anemia on radiation therapy outcomes[J]. Oncologist, 2002, 7: 492-508. DOI:10.1634/theoncologist.7-6-492 |
| [5] |
Meng L, Cheng Y, Tong X, et al. Tumor oxygenation and hypoxia inducible factor-1 functional inhibition via a reactive oxygen species responsive nanoplatform for enhancing radiation therapy and abscopal effects[J]. ACS Nano, 2018, 12: 8308-8322. DOI:10.1021/acsnano.8b03590 |
| [6] |
Luo ZY, Zheng MB, Zhao PF, et al. Self-monitoring artificial red cells with sufficient oxygen supply for enhanced photodynamic therapy[J]. Sci Rep, 2016, 6: 22403-23393. DOI:10.1038/srep22403 |
| [7] |
Tang W, Zhen ZP, Wang MZ, et al. Red blood cell-facilitated photodynamic therapy for cancer treatment[J]. Adv Funct Mater, 2016, 11: 1757-1768. |
| [8] |
Gao M, Liang C, Song XJ, et al. Erythrocyte-membraneenveloped perfluorocarbon as nanoscale artificial red blood cells to relieve tumor hypoxia and enhance cancer radiotherapy[J]. Adv Mater, 2017, 29: 1701429. DOI:10.1002/adma.201701429 |
| [9] |
Wang H, Li J, Wang Y, et al. Nanoparticles-mediated reoxygenation strategy relieve tumor hypoxia for enhanced cancer therapy[J]. J Control Release, 2019, 319: 25-45. |
| [10] |
Nishimura T, Sasaki Y, Akiyoshi K. Biotransporting self-assembled nanofactories using polymer vesicles with molecular permeability for enzyme prodrug cancer therapy[J]. Adv Mater, 2017, 29: 1702406. DOI:10.1002/adma.201702406 |
| [11] |
Sahu A, Kwon I, Tae G. Improving cancer therapy through the nanomaterials-assisted alleviation of hypoxia[J]. Biomaterials, 2020, 228: 119578. DOI:10.1016/j.biomaterials.2019.119578 |
| [12] |
Secomb TW, Hsu R, Ong ET, et al. Analysis of the effects of oxygen supply and demand on hypoxic fraction in tumors[J]. Acta Oncol, 1995, 34: 313-316. DOI:10.3109/02841869509093981 |
| [13] |
Li ML, Shao YJ, Kim JH, et al. Unimolecular photodynamic O2-economizer to overcome hypoxia resistance in phototherapeutics[J]. J Am Chem Soc, 2020, 142: 5380-5388. DOI:10.1021/jacs.0c00734 |
| [14] |
Yang BW, Shi JL. Developing new cancer nanomedicines by repurposing old drugs[J]. Angew Chem Int Ed, 2020. DOI:10.1002/anie.202004317 |
| [15] |
Coates JT, Skwarski M, Higgins GS. Targeting tumour hypoxia: shifting focus from oxygen supply to demand[J]. Br J Radiol, 2019, 92: 20170843. |
| [16] |
Fan YT, Zhou TJ, Cui PF, et al. Modulation of intracellular oxygen pressure by dual-drug nanoparticles to enhance photodynamic therapy[J]. Adv Funct Mater, 2019, 29: 1806708. DOI:10.1002/adfm.201806708 |
| [17] |
Xia D, Xu P, Luo X, et al. Overcoming hypoxia by multistage nanoparticle delivery system to inhibit mitochondrial respiration for photodynamic therapy[J]. Adv Funct Mater, 2019, 29: 1807294. DOI:10.1002/adfm.201807294 |
| [18] |
Qin SY, Zhang AQ, Cheng SX, et al. Drug self-delivery systems for cancer therapy[J]. Biomaterials, 2017, 112: 234-247. DOI:10.1016/j.biomaterials.2016.10.016 |
| [19] |
Wan FJ, Chen BL, Yang LJ, et al. Active loading of verteporfin into cationic liposome for neovasculature and tumor-targeted photodynamic therapy[J]. Acta Pharm Sin(药学学报), 2020, 55: 1680-1690. |
| [20] |
Chung JE, Tan S, Gao SJ, et al. Self-assembled micellar nanocomplexes comprising green tea catechin derivatives and protein drugs for cancer therapy[J]. Nat Nanotechnol, 2014, 9: 907-912. DOI:10.1038/nnano.2014.208 |
| [21] |
Yordanov N, Slavov P. Influence of the diameter and wall thickness of a quartz pipe inserted in the EPR cavity on the signal intensity[J]. Appl Magn Reson, 1996, 10: 351-356. DOI:10.1007/BF03163118 |
 2021, Vol. 56
2021, Vol. 56


