2. 山西振东道地药材开发有限公司, 山西 长治 047100
2. Shanxi Zhendong Genuine Medicinal Materials Development Co., Ltd., Changzhi 047100, China
黄芪为豆科草本植物黄芪属蒙古黄芪Astragalus membranaceus (Fisch.) Bge.var.mongholicus (Bge.)Hsiao或膜荚黄芪Astragalus membranaceus (Fisch.)Bge.的干燥根, 具有补气升阳, 固表止汗, 利水消肿, 生津养血, 行滞通痹, 托毒排脓, 敛疮生肌等传统功效[1]。现代药理学研究表明, 黄芪具有增强机体免疫力、抗病毒、抗心脑损伤、降血糖等多种药理活性[2-4]。黄芪中主要含有皂苷、黄酮、多糖类以及氨基酸类等成分, 其中主要活性成分为皂苷类和黄酮类成分, 皂苷类成分具有抗炎、抗肿瘤等作用, 黄酮类成分具有抗氧化、降血脂等作用[5-7]。2015版《中华人民共和国药典》(以下简称《中国药典》)中以黄酮类成分毛蕊异黄酮葡萄糖苷和皂苷类成分黄芪甲苷(黄芪皂苷Ⅳ)作为黄芪药材及饮片质控指标, 两者分别采用HPLC-UV和HPLC-ELSD作为其含量测定方法, 且采用不同的样品前处理方法[1]。目前, 黄芪中化学成分的文献报道中大多以黄芪皂苷Ⅰ、黄芪皂苷Ⅱ、黄芪甲苷等皂苷类成分和毛蕊异黄酮葡萄糖苷、芒柄花素等黄酮类成分作为指标成分, 用作黄芪药材的质量评价[8-11]。其中, 黄酮类成分含量测定方法主要为HPLC-UV[9, 11, 12], 皂苷类成分主要为HPLC-ELSD[11, 13, 14], 也有少数报道采用LC-MS/MS方法测定黄芪药材中黄酮和皂苷的含量[10, 15]。ELSD作为通用型检测器虽然可以进行弱紫外吸收的皂苷类成分的含量测定, 但灵敏度较低, 不利于皂苷类成分, 特别是低含量成分的准确定量。电雾式检测器(CAD)为近年来出现的一种通用型检测器, 由于检测能力不受被分析的成分结构的限制, 尤其适用于紫外吸收较弱或无紫外吸收的化合物, 且具有较高的灵敏度, 在液相色谱分析中得到了较好的应用, 逐渐被用于中药成分含量测定及其质量研究[16-20]。
中药成分复杂多样, 仅以一、两个成分作为质量评价指标很难反映药材的真实质量, 而多指标含量测定方法更为科学可靠。其中, 一测多评法(quantitative analysis of multi-components with a single marker, QAMS)利用中药有效成分内在函数及比例关系, 以中药中某一种成分为内参物对照品, 从而实现多指标成分的同时测定[21-26], 近年来已经被用于多种中药的质量评价, 而且被《中国药典》收载, 具有重要的指导意义[27]。
本研究建立HPLC-CAD一测多评法同时测定黄芪中6种成分的含量, 其中包括黄芪皂苷Ⅰ、黄芪皂苷Ⅱ、黄芪甲苷3种皂苷类成分和毛蕊异黄酮葡萄糖苷、芒柄花素、7, 2'-二羟基-3', 4'-二甲氧基异黄烷3种黄酮类成分, 以黄芪皂苷Ⅱ作为内参物, 计算黄芪皂苷Ⅰ、黄芪甲苷、毛蕊异黄酮葡萄糖苷、芒柄花素和7, 2'-二羟基-3', 4'-二甲氧基异黄烷与黄芪皂苷Ⅱ的相对校正因子, 从而计算出黄芪皂苷Ⅰ、黄芪甲苷、毛蕊异黄酮葡萄糖苷、芒柄花素和7, 2'-二羟基-3', 4'-二甲氧基异黄烷的含量; 并采用外标法和QAMS同时测定20批黄芪药材中6种成分的含量, 比较其结果以验证QAMS的可行性和准确性, 最终建立黄芪药材中6种成分的一测多评含量测定方法。同时, 比较了不同产地黄芪药材的成分差异, 为黄芪药材的全面质量控制提供新的方法和依据。
材料与方法材料 不同产地的黄芪药材由本实验室自行购买, 经山西医科大学高建平教授鉴定为蒙古黄芪Astragalus membranaceus (Fisch.) Bge.var.mongholicus (Bge.) Hsiao的干燥根, 见表 1。
| 表 1 The source of samples |
仪器与试剂 Thermo U3000高效液相色谱仪(赛默飞世尔科技有限公司, 美国), 包括LPG-3400SD泵、WPS-3000TRS自动进样器、TCC-3200柱温箱、Corona Veo RS电雾式检测器(CAD); Mettler Toledo XSE205DU电子分析天平(Mettler Toledo, 瑞士); 数控超声清洗机(KQ-500DE型, 昆山超声仪器有限公司)。Milli-Q纯水机(Millipore, 美国); 甲酸(190284, LC-MS, 赛默飞世尔科技有限公司); 乙腈(色谱纯, 默克, 美国); 甲醇(色谱纯, 默克, 美国); 其他化学试剂为分析纯
毛蕊异黄酮葡萄糖苷(批号: 111920-201606, 纯度97.6%)、黄芪甲苷(批号: 110781-201717, 纯度96.9%)购自中国食品药品检定研究院; 芒柄花素(批号: 3523, 纯度98.2%)、黄芪皂苷I (批号: 6107, 纯度99.0%)、黄芪皂苷II (批号: 3258, 纯度100.0%)均购自施丹德生物科技有限公司; 7, 2'-二羟基-3', 4'-二甲氧基异黄烷(批号: Y31D10H107318, 纯度98%)购自上海源叶生物科技有限公司。
色谱条件 色谱柱: Agilent SB-C18 (150 mm×4.6 mm, 3.5μm); 柱温为35℃, 流速为1.0 mL·min-1; 流动相: 0.05%甲酸乙腈(A)-0.05%甲酸水(B), 梯度洗脱, 洗脱条件: 0~3 min, 20% A; 3~8 min, 20%→25% A; 8~18 min, 25%→36% A; 18~38 min, 36%→43% A; 进样量: 20μL, CAD漂移管温度50℃, 气体流速50 psi·min-1。
对照品溶液的制备 取黄芪皂苷Ⅰ、黄芪皂苷Ⅱ、黄芪甲苷、毛蕊异黄酮葡萄糖苷、芒柄花素和7, 2'-二羟基-3', 4'-二甲氧基异黄烷各对照品适量, 精密称定, 以80%甲醇配制成每1 mL中含有黄芪皂苷Ⅰ0.450 mg、黄芪皂苷Ⅱ0.048 mg、黄芪甲苷0.016 mg、毛蕊异黄酮葡萄糖苷0.260 mg、芒柄花素0.020 mg和7, 2'-二羟基-3', 4'-二甲氧基异黄烷0.030 mg的混合对照品溶液, 即得。
供试品溶液的制备 精密称取黄芪药材粉末约2 g (过4号筛), 置圆底烧瓶中, 精密加入80%甲醇50 mL, 加热回流2 h, 取出、放冷、补足失重, 滤过, 滤渣以甲醇20 mL淋洗, 收集滤液及淋洗液, 回收溶剂至干, 残渣加80%甲醇溶解, 转移至5 mL量瓶中, 以80%甲醇定容至刻度, 摇匀, 即得。
方法学考察
专属性 取混合对照品溶液、供试品溶液、空白溶液, 分别注入液相色谱仪, 比较色谱图。
精密度 精密吸取混合对照品溶液, 连续进样6次, 以6种成分的峰面积值计算RSD值。
线性关系考察 取黄芪皂苷Ⅰ、黄芪皂苷Ⅱ、黄芪甲苷、毛蕊异黄酮葡萄糖苷、芒柄花素和7, 2'-二羟基-3', 4'-二甲氧基异黄烷各对照品适量, 精密称定, 以80%甲醇配制成每1 mL中含有黄芪皂苷Ⅰ2.250 mg、黄芪皂苷Ⅱ0.240 mg、黄芪甲苷0.080 mg、毛蕊异黄酮葡萄糖苷1.300 mg、芒柄花素0.100 mg和7, 2'-二羟基-3', 4'-二甲氧基异黄烷0.150 mg的混合对照品溶液, 作为储备液。分别精密量取混合对照品储备液0.5、1.0、2.0、4.0、6.0和10 mL分别于10 mL量瓶中, 以80%甲醇定容至刻度, 摇匀, 按HPLC-CAD色谱条件进样测定, 记录各成分峰面积。分别以浓度为横坐标, 以峰面积为纵坐标进行线性回归, 计算线性回归方程和相关系数。
检测限和定量限 取对照品溶液, 用80%甲醇逐步稀释至信噪比约为3和10时的溶液, 计算此时的溶液浓度。
重复性 精密称取黄芪样品6份, 按“供试品溶液的制备”项下方法制备供试品溶液, 按HPLC-CAD色谱条件测定6种成分的含量, 计算RSD。
稳定性 取S16号黄芪药材, 按“供试品溶液的制备”项下方法制备供试品溶液, 分别于0、3、6、9、12、24和48 h后进样分析, 以6种成分的峰面积计算RSD。
加样回收率 取已知含量的黄芪药材约1 g, 精密称定, 共6份, 分别按样品-对照品(1∶1)的比例加入一定量的各对照品, 按“供试品溶液的制备”项下方法制备, 摇匀, 按色谱条件测定各成分的峰面积, 并计算回收率。
数据处理 差异显著性采用ANOVA方差分析检验, 数据统计运算采用SPSS 21.0 for Windows统计软件进行处理。
结果 1 方法学考察 1.1 专属性测得样品色谱图如图 1所示。阴性溶液未出现与对照品及黄芪药材中6种待测成分保留时间相一致的色谱峰, 表明阴性溶液对6种待测成分均无干扰, 结果见图 1。
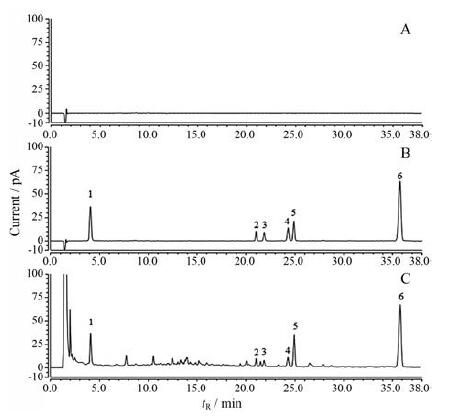
|
Figure 1 The HPLC-CAD chromatograms of blank solvent (A), mixed standard solution (B) and sample solution (C).1:Calycosin-7-glucoside; 2:AstragalosideⅣ; 3:Formononetin; 4:7, 2'-Dihydroxy-3', 4'-dimethoxyisoflavan; 5:Astragaloside Ⅱ; 6:Astragaloside Ⅰ |
黄芪皂苷Ⅰ、黄芪皂苷Ⅱ、黄芪甲苷、毛蕊异黄酮葡萄糖苷、芒柄花素和7, 2'-二羟基-3', 4'-二甲氧基异黄烷峰面积的RSD (n=6)分别为2.55%、1.60%、1.24%、1.33%、2.12%和1.17%, 表明仪器精密度良好。
1.3 线性关系6个成分的线性回归方程及相关系数见表 2。3种皂苷类成分和3种黄酮类成分在CAD检测条件下显示出良好的线性关系。
| 表 2 Linearity, LOD and LOQ data of the 6 analytes in Astragali Radix |
6个成分定量限分别为黄芪皂苷Ⅰ0.04μg、黄芪皂苷Ⅱ0.02μg、黄芪甲苷0.02μg、毛蕊异黄酮葡萄糖苷0.04μg、芒柄花素0.03μg和7, 2'-二羟基-3', 4'-二甲氧基异黄烷0.03μg; 检测限分别为黄芪皂苷Ⅰ0.02μg、黄芪皂苷Ⅱ0.01μg、黄芪甲苷0.01μg、毛蕊异黄酮葡萄糖苷0.02μg、芒柄花素0.01μg和7, 2'-二羟基-3', 4'-二甲氧基异黄烷0.02μg。
1.5 重复性黄芪皂苷Ⅰ、黄芪皂苷Ⅱ、黄芪甲苷、毛蕊异黄酮葡萄糖苷、芒柄花素、7, 2'-二羟基-3', 4'-二甲氧基异黄烷的含量分别为0.068%、0.015%、0.002%、0.028%、0.002%和0.004%, RSD分别为2.38%、2.29%、1.70%、1.51%、2.91%和2.81%, 表明重复性良好。
1.6 稳定性黄芪皂苷Ⅰ、黄芪皂苷Ⅱ、黄芪甲苷、毛蕊异黄酮葡萄糖苷、芒柄花素和7, 2'-二羟基-3', 4'-二甲氧基异黄烷峰面积的RSD分别为1.45%、3.30%、1.72%、3.24%、2.28%和1.91%, 结果表明供试品溶液在48 h内稳定。
1.7 加样回收率6种成分的加样回收率在99.65%~101.81%, 6种成分RSD分别为2.28%、1.34%、3.21%、2.23%、2.41%和1.98%, 具体结果见表 3。
| 表 3 Results of recovery (n=6) |
分别精密吸取混合对照品溶液1.0、2.5、5.0、10.0、20.0和30μL, 依次注入高效液相色谱仪, 记录色谱图。分别计算黄芪皂苷Ⅱ对黄芪皂苷Ⅰ、黄芪甲苷、毛蕊异黄酮葡萄糖苷、芒柄花素及7, 2'-二羟基-3', 4'-二甲氧基异黄烷的相对校正因子, 结果RSD值均 < 2.0%, 表明不同的进样体积对相对校正因子没有显著影响, 具体结果见表 4。
| 表 4 Investigation on relative correction factor. F1: Astragaloside Ⅱ/astragaloside Ⅰ; F2: Astragaloside Ⅱ/astragaloside Ⅳ; F3: Astragaloside Ⅱ/calycosin-7-glucoside; F4: Astragaloside Ⅱ/formononetin; F5: Astragaloside Ⅱ/7, 2'-dihydroxy-3', 4'-dimethoxyisoflavan |
取20批不同产地的黄芪药材, 按供试品溶液制备方法制备供试品溶液, 并按HPLC-CAD色谱条件进行测定, 利用平均相对校正因子计算黄芪药材中黄芪皂苷Ⅰ、黄芪甲苷、毛蕊异黄酮葡萄糖苷、芒柄花素、7, 2'-二羟基-3', 4'-二甲氧基异黄烷的含量, 并与ESM计算得到的结果进行比较, 结果见表 5, 利用SPSS软件对两种含量测定方法测定的结果进行t检验。结果显示两种含量测定方法无显著性差异(P > 0.5)。
| 表 5 Determination results of 6 analytes by ESM and QAMS /mg·g-1 |
基于6种化学成分的含量, 将不同产地20批黄芪药材采用PCA分析, PCA点图显示20批样品可以分为3个不同类别。PCA评分图见图 2A, 进一步将20批样品进行PLS-DA分析, 见图 2B, 结果显示不同产地的黄芪药材化学成分存在差异, 且本实验测定的6种化学成分可以作为不同产地黄芪药材的分类标志物, 但由于样本量不够多, 因此, 具体的质量评价还需继续深入研究。
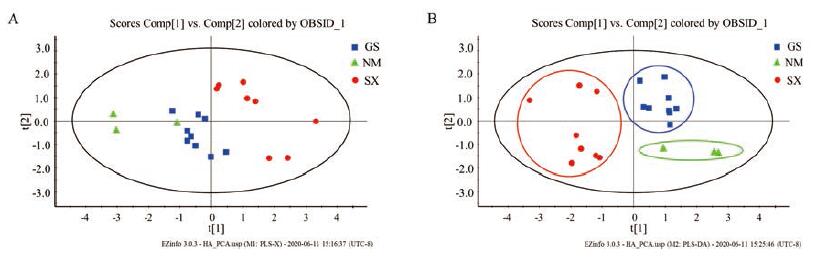
|
Figure 2 The scores plot of PCA and PLS-DA.A: PCA score plot of 20 samples from different regions; B: PLS-DA score plot of 20 samples from different regions.GS: Gansu Province; SX: Shanxi Province; NM: Inner Mongolia Province |
不同产地黄芪3个黄酮和3个皂苷的含量如表 5和图 3所示, 结果显示, 不同产地黄芪药材成分含量存在差异, 来源于同一产地的黄芪药材中不同批次成分含量也存在差异。本实验所定量的6种化学成分、20批样品检测结果显示, 黄芪中黄芪皂苷Ⅰ0.306~0.922 mg·g-1、黄芪皂苷Ⅱ0.053~0.183 mg·g-1、黄芪甲苷0.015~0.092 mg·g-1、毛蕊异黄酮葡萄糖苷0.069~0.823 mg·g-1、芒柄花素0~0.098 mg·g-1和7, 2'-二羟基-3', 4'-二甲氧基异黄烷0.020~0.107 mg·g-1, 6个成分总含量范围0.704~1.534 mg·g-1, 3个黄酮类总含量范围0.376~1.108 mg·g-1, 3个皂苷类总含量范围0.241~0.847 mg·g-1, 其中山西产黄芪中黄芪皂苷Ⅰ、黄芪皂苷Ⅱ、黄芪甲苷、毛蕊异黄酮葡萄糖苷以及7, 2'-二羟基-3', 4'-二甲氧基异黄烷含量高于甘肃和内蒙。三个主要成分中黄芪皂苷Ⅰ、黄芪甲苷(黄芪皂苷Ⅳ)含量均为山西 > 甘肃 > 内蒙, 而毛蕊异黄酮葡萄糖苷含量为山西 > 内蒙 > 甘肃。
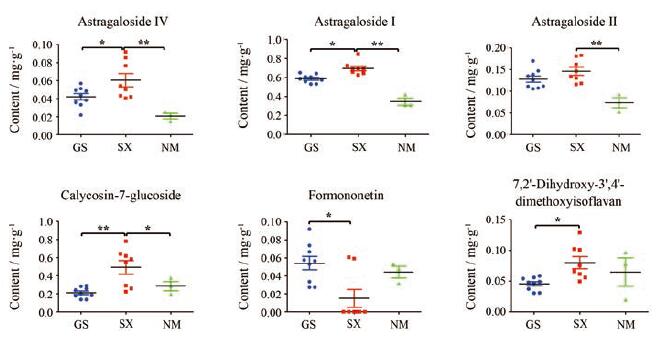
|
Figure 3 Determination assay of 6 analytes in different regions of Astragalus membranaceus.GS: Gansu Province; SX: Shanxi Province; NM: Inner Mongolia Province.n=9 (GS), 8 (SX), 3 (NM), x± s.*P < 0.05, **P < 0.01 |
6个所测成分含量总和、3个所测黄酮成分总和以及3个所测皂苷成分总和对比, 均为山西 > 甘肃 > 内蒙(图 4)。依据《中国药典》中黄芪药材的质控指标分析, 毛蕊异黄酮葡萄糖苷和黄芪甲苷含量均为山西高于甘肃和内蒙。因此, 可以认为此次定量的6个化学成分可在一定程度上作为黄芪药材的质量评价指标。
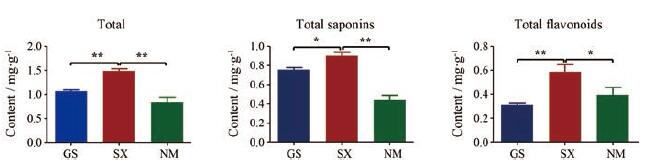
|
Figure 4 Total assay of 6 analytes, three saponins and three flavonoids in different regions of Astragalus membranaceus.GS: Gansu Province; SX: Shanxi Province; NM: Inner Mongolia Province.n=9 (GS), 8 (SX), 3 (NM), x± s.*P < 0.05, **P < 0.01 |
根据本次测定的6个化学成分含量对三个产地的黄芪进行质量评价, 认为山西产黄芪药材含量最高, 然而由于本次采集的药材各地年份不一致, 山西产黄芪药材均为5年生, 而甘肃和内蒙为3~4年, 根据文献报道, 生长年份为4~5年的黄芪黄酮类成分含量最高[28], 且药材的质量应以临床疗效为基础, 因此, 本次实验所定量的6个化学成分可以作为黄芪药材3个主要产地的鉴定指标, 在一定程度上对黄芪药材进行质量评价, 更加系统及完善的质量评价方法还需继续进行研究。
讨论本实验考察了乙腈-水及0.05%甲酸乙腈-0.05%甲酸水溶剂系统对黄芪药材中6种成分的分离情况的影响。结果表明, 0.05%甲酸乙腈-0.05%甲酸水系统, 各峰分离度以及基线较好, 因此确定0.05%甲酸乙腈-0.05%甲酸水作为流动相系统; 同时, 考察了三根不同品牌及型号的色谱柱, 最终发现Agilent ZORBAX SB-C18 (150 mm×4.6 mm, 3.5μm)色谱柱对各峰分离效果优于其余色谱柱, 故选择其用于HPLC-CAD含量测定方法的建立。
黄芪中主要的活性成分为皂苷类和黄酮类成分, 因皂苷类成分具有较弱的末端紫外吸收, 目前大多采用ELSD进行其含量测定, 但其灵敏度较低。与ELSD相比, CAD检测器具有检测灵敏度高的优势, 可提高无紫外吸收或弱紫外吸收化合物的定量的准确性。通过系统的方法学考察, 结果显示所建立HPLC-CAD方法用于黄芪中包括黄酮和皂苷类成分在内的6种成分含量的检测, 灵敏度高、精密性、重复性和稳定性好, 表明该方法稳定、可靠、准确。
中药成分复杂多样, 多成分含量测定已经成为中药质量评价的发展趋势。其中, QAMS以某一个成分作为内参物, 通过计算内参物与其他所测成分间的相对校正因子, 实现“用一个成分进行多成分同时测定”的目的, 大大降低了检测成本, 已广泛得以应用。本实验采用HPLC-CAD一测多评法, 同时测定来自不同产地的20批黄芪药材中的6种成分的含量, 与外标法含量测定结果相比无显著性差异。3个主产地的黄芪药材中, 无论是6个成分总量, 或3个黄酮成分、3个皂苷成分总量, 均显示山西高于甘肃和内蒙。综上, 所建立的HPLC-CAD一测多评法快速、简便、准确, 为黄芪药材的质量控制综合评价提供了更加全面的参考。
作者贡献: 姚静主要进行了本文方法建立、实验数据处理、撰写文章及对编辑部修改意见进行核修等。孙欣光主要进行了本文的选题的设计、实验思路、方法建立、实验数据处理、撰写文章及对编辑部修改意见进行专业的指导等。董蓉、谢建宏和王玉龙对本文的实验思路、方法建立及文章修改提供了宝贵的意见及试验帮助。杨晓宁从选题与设计、方法建立及文章修改提供了指导。
利益冲突: 无任何利益冲突。
| [1] |
Chinese Pharmacopoeia Commission. The Pharmacopoeia of the People's Republic of China(中华人民共和国药典)[S]. 2015ed. PartⅠ. Beijing: China Medical Science Press, 2015: 283-284.
|
| [2] |
Zhang L, Gong AG, Riaz K, et al. A novel combination of four flavonoids derived from Astragali Radix relieves the symptoms of cyclophosphamide-induced anemic rats[J]. FEBS Open Bio, 2017, 7: 318-323. DOI:10.1002/2211-5463.12146 |
| [3] |
Xin B, Ma SJ, Xie J, et al. Influence of different growing years on accumulation of flavonoids and saponins in Astragali Radix[J]. J Chin Med Mater(中药材), 2015, 38: 1366-1369. |
| [4] |
Fu J, Wang ZH, Huang LF, et al. Review of the botanical characteristics, phytochemistry, and pharmacology of Astragalus membranaceus(Huangqi)[J]. Phytother Res, 2014, 28: 1275-1283. DOI:10.1002/ptr.5188 |
| [5] |
Wang ZB, Zhai YD, Ma ZP, et al. Triterpenoids and flavonoids from the leaves of Astragalus membranaceus and their inhibitory effects on nitric oxide production[J]. Chem Biodivers, 2015, 12: 1575-1584. DOI:10.1002/cbdv.201400371 |
| [6] |
Qi YS, Li X, Qin XM, et al. Anti-cancer effect of the flavonoids of Astragalus combined with cisplatin on Lewis lung carcinomabearing mice[J]. Acta Pharm Sin(药学学报), 2020, 55: 930-940. |
| [7] |
Zhou XJ, Sun XB, Gong XX, et al. Astragaloside IV from Astragalus membranaceus ameliorates renal interstitial fibrosis by inhibiting inflammation via TLR4/NF-κB in vivo and in vitro[J]. Int Immunopharmacol, 2017, 42: 18-24. DOI:10.1016/j.intimp.2016.11.006 |
| [8] |
Gao SY, Li K, Xiong YF, et al. Identification of growth years of Hengshan imitative wild culture Astragali Radix and investigation into the accumulation rules of flavonoids and saponins[J]. Acta Pharm Sin(药学学报), 2018, 53: 147-154. |
| [9] |
Qi LW, Yu QT, Li P, et al. Quality evaluation of Radix Astragali through a simultaneous determination of six major active isoflavonoids and four main saponins by high-performance liquid chromatography coupled with diode array and evaporative light scattering detectors[J]. J Chromatogr A, 2006, 1134: 162-169. DOI:10.1016/j.chroma.2006.08.085 |
| [10] |
Li Y, Guo S, Zhu Y, et al. Comparative analysis of twenty-five compounds in different parts of Astragalus membranaceus var. mongholicus and Astragalus membranaceus by UPLC-MS/MS[J]. J Pharm Anal, 2019, 9: 392-399. DOI:10.1016/j.jpha.2019.06.002 |
| [11] |
Zhang CE, Liang LJ, Yu XH, et al. Quality assessment of Astragali Radix from different production areas by simultaneous determination of thirteen major compounds using tandem UV/charged aerosol detector[J]. J Pharm Biomed Anal, 2019, 165: 233-241. DOI:10.1016/j.jpba.2018.12.015 |
| [12] |
Wu T, Annie Bligh SW, Gu LH, et al. Simultaneous determination of six isoflavonoids in commercial Radix Astragali by HPLC-UV[J]. Fitoterapia, 2005, 76: 157-165. DOI:10.1016/j.fitote.2004.11.006 |
| [13] |
Yu QT, Qi LW, Li P, et al. Determination of seventeen main flavonoids and saponins in the medicinal plant Huang-qi(Radix astragali)by HPLC-DAD-ELSD[J]. J Sep Sci, 2007, 30: 1292-1299. DOI:10.1002/jssc.200600422 |
| [14] |
Qi LW, Yu QT, Yi L, et al. Simultaneous determination of 15 marker constituents in various Radix Astragali preparations by solid-phase extraction and high-performance liquid chromatography[J]. J Sep Sci, 2008, 31: 97-106. DOI:10.1002/jssc.200700286 |
| [15] |
Yin G, Cheng X, Tao W, et al. Comparative analysis of multiple representative components in the herb pair Astragali RadixCurcumae Rhizoma and its single herbs by UPLC-QQQ-MS[J]. J Pharm Biomed Anal, 2018, 148: 224-229. DOI:10.1016/j.jpba.2017.09.015 |
| [16] |
Zhang CN, Wang YZ, Sun XG, et al. Chromatographic fingerprint analysis of Toosendan Fructus by HPLC-CAD coupled with chemometrics methods[J]. Acta Pharm Sin(药学学报), 2017, 52: 456-461. |
| [17] |
Dixon RW, Peterson DS. Development and testing of a detection method for liquid chromatography based on aerosol charging[J]. Anal Chem, 2002, 74: 2930-2937. DOI:10.1021/ac011208l |
| [18] |
Novakova L, Lopez SA, Solichova D, et al. Comparison of UV and charged aerosol detection approach in pharmaceutical analysis of statins[J]. Talanta, 2009, 78: 834-839. DOI:10.1016/j.talanta.2008.12.057 |
| [19] |
Eom HY, Park SY, Kim MK, et al. Comparison between evaporative light scattering detection and charged aerosol detection for the analysis of saikosaponins[J]. J Chromatogr A, 2010, 1217: 4347-4354. DOI:10.1016/j.chroma.2010.04.047 |
| [20] |
Cintrón JM, Risley DS. Hydrophilic interaction chromatography with aerosol-based detectors(ELSD, CAD, NQAD)for polar compounds lacking a UV chromophore in an intravenous formulation[J]. J Pharm Biomed Anal, 2013, 78-79: 14-18. DOI:10.1016/j.jpba.2013.01.022 |
| [21] |
Wang ZM, Gao HM, Fu XT, et al. Methodological study on the quality evaluation model of traditional Chinese medicine in "quantitative analysis of multi-components with a single-marker"[J]. China J Chin Mater Med(中国中药杂志), 2006, 31: 1925-1928. |
| [22] |
Wang ZM, Qian ZZ, Zhang QW, et al. A technical guide for the quantitative analysis of multi-components with a single-markemethod[J]. China J Chin Mater Med(中国中药杂志), 2011, 36: 657-658. |
| [23] |
Dong YH, Guo Q, Liu J, et al. Simultaneous determination of seven phenylethanoid glycosides in Cistanches Herba by a single marker using a new calculation of relative correction factor[J]. JSep Sci, 2018, 41: 1913-1922. |
| [24] |
Hou JJ, Wu WY, Da J, et al. Ruggedness and robustness of conversion factors in method of simultaneous determination of multi-components with single reference standard[J]. J Chromatogr A, 2011, 1218: 5618-5627. DOI:10.1016/j.chroma.2011.06.058 |
| [25] |
Wang CQ, Jia XH, Zhu S, et al. A systematic study on the influencing parameters and improvement of quantitative analysis of multi-component with single marker method using notoginseng as research subject[J]. Talanta, 2015, 134: 587-595. DOI:10.1016/j.talanta.2014.11.028 |
| [26] |
Zhang JH, Chen LX, Qiu JN, et al. Simultaneous determination of six chromones in Saposhnikoviae Radix via quantitative analysis of multicomponents by single marker[J]. J Anal Methods Chem, 2020, 2020: 1-13. |
| [27] |
Zhang Y, Xu HR, Li JS, et al. Simultaneous quantitative analyses of eight components in Artemisia capillaris Thunb standard decoction based on a quantitative method of multi-components with a single-marker[J]. Acta Pharm Sin(药学学报), 2019, 54: 1661-1666. |
| [28] |
Zhang R, Cao QW, Li K, et al. Analysis of correlation between commercial traits and chemical characteristics and absolute growth years of Astragali Radix[J]. Chin Tradit Herb Drugs(中草药), 2020, 51: 451-460. |
 2021, Vol. 56
2021, Vol. 56


