2. 中国医学科学院、北京协和医学院药物研究所, 天然药物活性物质与功能国家重点实验室, 北京 100050
2. State Key Laboratory of Bioactive Substance and Function of Natural Medicines, Institute of Materia Medica, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
中药延胡索为罂粟科Papaveraceae紫堇属Corydalis植物延胡索Corydalis yanhusuo W.T.Wang的干燥块茎, 其味辛、苦, 性温, 归肝、脾经, 具有活血散瘀, 理气止痛的功效[1, 2]。现代药理研究表明延胡索及其不同醋制炮制品具有显著的镇痛、镇静作用, 以及对冠心病、心律失常、心肌缺血、肿瘤、胃溃疡等多种疾病有较好的临床效果[3, 4], 但相关研究主要集中在含量较高的原小檗碱类成分及其镇痛活性方面, 在其他临床应用的药效物质仍不明确。为了充分挖掘延胡索其他新型的活性成分, 本课题组对醋制延胡索的水提取物的化学成分进行了系统研究, 从中发现了一系列新型生物碱类化合物[5-7], 部分化合物具有选择性抑制羧酸酯酶2(hCE2)活性或具有抑制PD-1/PD-L1结合的功能。本论文在前期研究基础上, 继续挖掘醋制延胡索生物活性成分, 从醋制延胡索水煎液的乙酸乙酯萃取部位分离鉴定了1个新C-4~C-7'位连接的苄基异喹啉类二聚体生物碱[(±)-bicoryanhunine B (1)]。采用均相时间分辨荧光技术(HTRF, homogeneous time-resolved fluorescence)测定化合物阻止PD-1/PD-L1相互作用的能力, 结果表明, (±)-bicoryanhunine B能抑制PD-1/PD-L1的结合, IC50为7.80±0.49μmol·L-1; 此外, 采用Griess法考察化合物抑制LPS诱导小鼠巨噬细胞RAW 264.7释放NO能力, 结果表明, (±)-bicoryanhunine B可显著抑制LPS诱导小鼠巨噬细胞RAW 264.7释放NO, IC50值为4.83±2.21μmol·L-1, 强于阳性对照药吲哚美辛(IC50为15.0±0.3μmol·L-1)。
结果与讨论 1 结构鉴定化合物1为淡黄色粉末, 碘化铋钾反应显阳性。IR光谱显示存在羟基(3 386 cm-1)和芳香环(1 684, 1 601 cm-1)官能团; (+)-HR-ESI-MS给出准分子离子峰m/z 703.300 2[M-CF3COO-]+(Calcd.for C42H43O8N2+, 703.301 4), 此外, (+)-HR-ESI-MS还给出了双电荷准分子离子峰m/z 352.153 8[M-CF3COO-+H]2+, 结合1H NMR和13C NMR数据确定其分子式为C42H43O8N2, 不饱和度为23。1H NMR谱中显示7个芳香质子信号、7个甲氧基质子信号和2个甲基质子信号。13C NMR谱中共显示42个碳信号, 其中29个芳香碳信号、7个甲氧基碳信号、4个次甲基碳信号和2个甲基碳信号。通过对比化合物1和bicoryanhunine A的1H NMR和13C NMR数据[6], 两者均含有7-取代脱氢紫堇鳞茎碱结构片段, 主要差别在于阿朴菲生物碱片段的1'、4'与5'位。与bicoryanhunine A相比, 化合物1的1H NMR谱中少了4'与5'位相互耦合的芳香氢信号, 多了两组相邻亚甲基氢信号δH2.96 (1H, m, H-4'a), δH3.33 (1H, m, H-4'b)和δH3.21 (2H, m, H-5'); 13C NMR谱中少了两个双键碳信号, 多了两个亚甲基碳信号(δC24.7, C-4'和δC49.2, C-5'), 推测化合物1中4'与5'位为两个相邻的亚甲基。此外, 化合物1的13C NMR谱中少了1'位的羰基碳信号, 多了一个连氧芳香碳信号(δC143.8, C-1')和一个甲氧基碳信号(δC59.5, 1'-OMe), 推测化合物1中1'位为连甲氧基的芳环碳, 由此推测化合物1中存在7'位取代的二去氢海罂粟碱片段。综上所述, 化合物1为由脱氢紫堇鳞茎碱和二去氢海罂粟碱通过C-4-C-7'连接的二聚体生物碱。HMBC谱中, N-Me氢与C-5'和C-6'a相关, H-3'与C-1'、C-4'和C-1'b相关, 1'-OMe氢与C-1'相关, H-8'与C-7'相关, H-1与C-4相关(图 1), 以及(+)-HR-ESI-MS/MS二级质谱中的碎片离子峰[m/z 350.138 6(Calcd.for C21H20NO4+, 350.138 7), m/z 353.160 9 (Calcd.for C21H23NO4+, 353.162 2)]证实了上述推测(图 2)。由于在HPLC纯化过程中使用了三氟醋酸, 最后得到的是化合物1的三氟醋酸盐。由此确定了化合物1的平面结构, 如图 1所示。
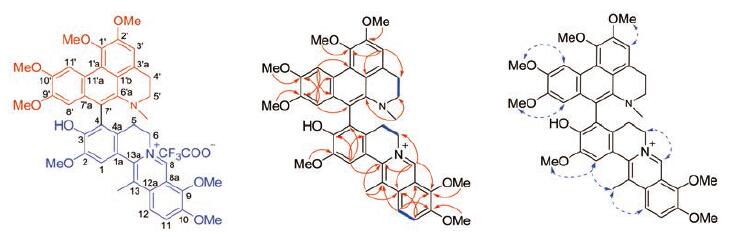
|
Figure 1 The structure (left), COSY (middle, blue bold lines), key HMBC (middle, red arrows), and Key NOESY (right, blue double arrows) correlations of compound 1 |
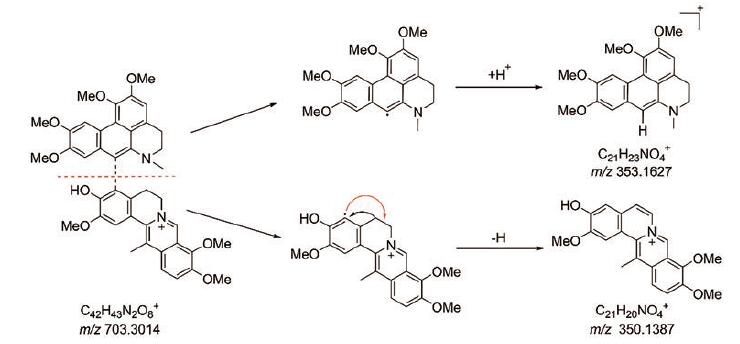
|
Figure 2 The proposed fragmentation pathway of compound 1 |
化合物1旋光值为0, 且ECD光谱中无明显的Cotton效应, 这与bicoryanhunine A消旋体现象一致, 同时采用量子化学计算的方法, 对比化合物1和bicoryanhunine A旋转轴旋转不同角度构象的能量变化(图 3), 化合物1由于N-Me的存在, 旋转能垒高于bicoryanhunine A, 由此推测化合物1也是因轴手性引起的外消旋体混合物, 并通过手性HPLC-HR-MS分析(chiralpak IBN-3手性柱, Me CN-H2O-TFA, 30∶70∶0.1, tR=59.2 min和63.4 min), 可观测到两个不完全基线分离的色谱峰, 进一步证实了上述推断。但通过较系统的手性HPLC条件摸索, 尝试多种不同手性填料色谱柱, 在HPLC-UV制备过程中, 对映体仍无法得到有效的分离。因此, 化合物1两个外消旋体的立体构型还有待于进一步确定。
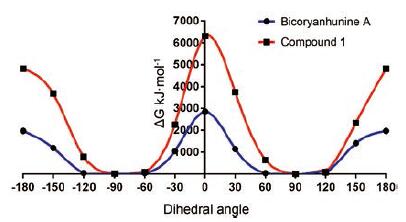
|
Figure 3 Calculated relative molecular energy scan of bicoryan‐hunine A and compound 1 |
综上所述, 确定化合物1为一个新的外消旋体苄基异喹啉二聚体生物碱, 命名为(±)-bicoryanhunine B。
2 化合物活性检测采用HTRF技术测定化合物阻止PD-1/PD-L1相互作用的能力, 结果显示, (±)-bicoryanhunine B可抑制PD-1/PD-L1结合, IC50为7.80±0.49μmol·L-1, 表明(±)-bicoryanhunine B可作为小分子PD-1/PD-L1免疫抑制剂候选化合物做进一步研究; 此外, 采用Griess法考察化合物抑制LPS诱导小鼠巨噬细胞RAW 264.7释放NO能力, 结果显示, (±)-bicoryanhunine B可显著抑制LPS诱导小鼠巨噬细胞RAW 264.7释放NO, IC50值为4.83±2.21μmol·L-1, 强于阳性对照药吲哚美辛(IC50为15.0±0.3μmol·L-1), 表明(±)-bicoryanhunine B具有较强的潜在抗炎活性。
实验部分JASCOJ-810紫外可见分光光度仪、JASCO P-2000旋光测定仪、JASCOJ-810 CD测定仪(JASCO); Nicolet impact 5700型傅里叶变换红外光谱仪(Thermofisher Scientific); Inova 600核磁共振仪(Varian); 质谱仪(Agilent 1100 series LC/MSD-Trap-SL型); 100~200目硅胶(青岛胜海化工厂); Sephadex LH-20 (Amersham Pharmacia); 中压液相色谱仪(Büchi Gradient Former B-687, Rp C18, 43~60μm, Pharmacia); 制备液相色谱仪(创新通恒LC3000高效液相色谱仪); 分析纯试剂(北京化工厂); 色谱纯试剂(乙腈、甲醇为美国Fisher公司生产)。
醋制延胡索药材于2015年购自浙江磐安药材市场, 经中国中医科学院许海玉研究员鉴定为延胡索Corydalis yanhusuo W.T.Wang的干燥块茎。
1 提取与分离醋制延胡索干燥块茎50 kg粉碎, 蒸馏水浸泡超声提取3次, 每次40 min, 水提后药渣用95%乙醇浸泡超声提取3次, 每次40 min。水提取液直接用大孔吸附树脂柱分离, 用水、50%乙醇、95%乙醇依次洗脱, 洗脱液减压浓缩; 95%乙醇提取液浓缩至无醇, 加蒸馏水2 L, 用等体积乙酸乙酯萃取5次, 得乙酸乙酯相和水相。经减压回收有机溶剂后得乙酸乙酯部位YH-E (250.3 g)。YH-E进行硅胶柱色谱分离, 用二氯甲烷-甲醇体系梯度洗脱(200∶1, 150∶1, 100∶1, 50∶1, 25∶1, 10∶1), 流分经TLC检测合并, 最后得A~I组分。组分H (6.9 g)进行分离, 经Sephadex LH-20柱色谱, 石油醚-二氯甲烷-甲醇(5∶5∶1)等度洗脱, 洗脱液经薄层色谱检测, 合并相同组分, 回收溶剂得到H1~H6组分。组分H3(3 g)经反相中压柱色谱, 甲醇-水(5∶95~95∶5)梯度洗脱, 洗脱液经薄层色谱检测, 合并相同组分, 回收溶剂得到H3-1~H3-6组分。组分H3-4经反相半制备HPLC纯化(Rp C18, 51%甲醇-水, 0.1%TFA, 280 nm)得到化合物1 (0.9 mg)。
2 结构鉴定化合物1 淡黄色粉末(MeOH)。[α]D200.0 (c 0.09, MeOH); UV (MeOH)λmax/nm (logε): 202 (0.504), 263(0.790), 284 (0.561), 337 (0.393);IR (KBr)υmax: 3 386, 2 925, 2 853, 1 684, 1 601, 1 205, 1 134, 1 039 cm-1; 1H NMR和13C NMR数据见表 1; (+)-HR-ESI-MS m/z: 703.300 2[M-CF3COO-]+, m/z 352.153 8, [M-CF3COO-+H]2+(Calcd.for C42H43O8N2703.301 4)。
| 表 1 NMR data of compound 1. 1H NMR (600 MHz), 13C NMR (150 MHz) in DMSO-d6 |
采用PD-1/PD-L1 HTRF试剂盒对化合物1抑制PD-1/PD-L1结合活性测定[8, 9]。Tag1-PD-L1 4μL (终浓度5 nmol·L-1)和Tag2-PD1 4μL (终浓度50 nmol·L-1)加入到384孔板中, 取不同浓度化合物1 2μL (终浓度分别为10、5、2.5、1μmol·L-1), 封膜后室温预孵15 min, 用Detection Buffer将anti-Tag1-Eu K稀释到1.83 nmol·L-1, anti-Tag2-XL665稀释到66.7 nmol·L-1。取同体积anti-Tag1-Eu K和anti-Tag2-XL665混合, 384孔板每孔加入10μL抗体混合液。封膜室温孵育, 分别用酶标仪检测2 h的665 nm及620 nm的吸光度值, 根据665 nm/620 nm的值计算每个化合物对PD-1/PD-L1结合的抑制率。
3.2 抑制LPS诱导小鼠巨噬细胞RAW 264.7释放NO活性测定采用Griess法考察化合物抑制LPS诱导小鼠巨噬细胞RAW 264.7释放NO能力[10, 11]。取生长状态良好且处于对数生长期的细胞, 将浓度为每孔1×105个细胞的小鼠巨噬细胞接种于96孔板内, 在37℃、5% CO2培养箱中常规培养24 h。将培养24 h后的细胞板弃去培养基, 加入含有不同药物浓度和2μg·mL-1的LPS的培养基, 每组设3个平行孔, 同时设空白组(只加培养基) 1组, LPS组(加只含LPS培养基) 1组, 平行3个复孔, 于37℃培养24 h。24 h后, 取培养基上清, 加入Griess试剂[0.1% N-萘乙二胺盐酸盐(50μL); 1%对氨基苯磺酰胺的H3PO4溶液(5%, 50μL), 测定540 nm处的吸光度。用浓度分别为1、5、10、50μmol·L-1的NaNO2绘制标准曲线, 根据NaNO2标准曲线计算细胞培养上清液中NO2-的浓度以及对NO释放的抑制率。
作者贡献: 林生负责提出研究选题和设计研究方案; 夏桂阳、肖标兵负责实施研究过程和采集整理数据; 王玲燕、方冬杰负责调研整理文献; 夏桂阳、夏欢负责设计论文框架、起草论文、修订论文; 林生负责获取研究经费、技术或材料支持、指导性支持。
利益冲突: 本研究不存在研究者及与公开研究成果有关的利益冲突。
| [1] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China(中华人民共和国药典)[S]. Part 1. Beijing: China Medical Science Press, 2020: 145.
|
| [2] |
Han YQ, Xu J, Gong SX, et al. Chemical constituents and mechanism of Corydalis Rhizoma based on HPLC-QTOF/MS and G protein-coupled receptor analysis[J]. Acta Pharm Sin(药学学报), 2016, 51: 1302-1308. |
| [3] |
Yang XB, Liu YZ, Yang XW, et al. Study on chemical constituents from Corydalis Rhizoma in Pan'an[J]. Chin Tradit Herb Drugs(中草药), 2013, 44: 2200-2207. |
| [4] |
He K, Gao JL, Zhao GS. Advances in studies on chemistry, pharmacology, and quality control of Corydalis yanhusuo[J]. Chin Tradit Herb Drugs(中草药), 2007, 38: 1909-1912. |
| [5] |
Wang LY, Qiu BL, Xia H, et al. Yanhusanines A-F, Isoquinolinederived alkaloid enantiomers from Corydalis yanhusuo and their biological activity[J]. J Nat Prod, 2020, 83: 489-496. DOI:10.1021/acs.jnatprod.9b01155 |
| [6] |
Xiao BB, Xia GY, Wang LY, et al. (±)-Bicoryanhunine A, dimeric benzylisoquinoline alkaloid atropo-enantiomers from Corydalis yanhusuo[J]. Tetrahedron Lett, 2020, 61: 151890. DOI:10.1016/j.tetlet.2020.151890 |
| [7] |
Qiu BL, Wang LY, Xia GY, et al. Study on structural conversion of dihydrochelerythrine in different solvents[J]. China J Chin Mater Med(中国中药杂志), 2018, 43: 3315-3321. |
| [8] |
Basu S, Yang J, Xu B, et al. Design, synthesis, evaluation, and structural studies of C2-symmetric small molecule inhibitors of programmed cell death-1/programmed death-ligand 1 proteinprotein interaction[J]. J Med Chem, 2019, 62: 7250-7263. DOI:10.1021/acs.jmedchem.9b00795 |
| [9] |
Degorce F, Card A, Soh S, et al. HTRF: a technology tailored for drug discovery-a review of theoretical aspects and recent applications[J]. Curr Chem Genom, 2009, 3: 22-32. DOI:10.2174/1875397300903010022 |
| [10] |
Wu YQ, Huang YF, Luo D, et al. A new oleanane type triterpenoid from Viburnum taitoense Hayata[J]. Acta Pharm Sin(药学学报), 2019, 54: 1260-1264. |
| [11] |
Xia GY, Sun DJ, Ma JH, et al. (+)/(-)-Phaeocaulin A-D, four pairs of new enantiomeric germacranetype sesquiterpenes from Curcuma phaeocaulis as natural nitric oxide inhibitors[J]. Sci Rep, 2017, 7: 43576. DOI:10.1038/srep43576 |
 2021, Vol. 56
2021, Vol. 56


