2. 地产中药功效物质研究与利用山西省重点实验室, 山西 太原 030006;
3. 山西大学计算机与信息技术学院, 山西 太原 030006
2. Shanxi Key Laboratory of Active Constituents Research and Utilization of TCM, Taiyuan 030006, China;
3. School of Computer and Information Technology, Shanxi University, Taiyuan 030006, China
逍遥散是《太平惠民合剂局方》中的经典方剂, 由柴胡、当归、茯苓、白芍、炒白术、炙甘草、薄荷和生姜八味药组成, 具有疏肝解郁和养血健脾的功效。已有研究表明, 逍遥散在治疗抑郁症方面体现了中医药的整体观和系统观的特点, 具有独特的理论优势和丰富的科学内涵[1-3]。随着科学技术的发展, 逍遥散在临床和药理实验研究中的抗抑郁作用已被多次证实, 但是由于抑郁症是多病因、多机制的复杂疾病, 目前关于逍遥散治疗抑郁症的药理机制尚不完全清晰。
代谢组学作为系统生物学的重要组成部分, 是与表型更为接近的组学技术, 具有整体性、客观性、动态性和准确性的特点, 这一特点与中医药学的整体观和系统观不谋而合。近年来, 代谢组学在中医药研究领域得到快速应用, 而逍遥散调节抑郁症患者和动物模型中异常代谢物的研究也被广泛报道。
本课题组前期归纳总结了代谢组学在逍遥散治疗抑郁症药理研究中的一些应用[4]。Li等[5]基于慢性温和不可预知应激模型内源性代谢物变化探讨了抑郁症的病理机制。Chen等[6]归纳总结了逍遥散治疗抑郁症的代谢网络调控机制, 为逍遥散治疗抑郁症作用机制研究奠定了重要基础。此外, 课题组还从生物标志物角度出发, 聚焦了逍遥散治疗抑郁症临床疗效生物标志物富集的通路[7]。
随着代谢组学数据的积累与丰富, 功能模块划分方法为代谢网络的分析提供有力的技术支持。已有学者提出, 复杂疾病在治疗过程中, 可以借助生物网络分析方法解析疾病, 利用网络拓扑属性挖掘疾病的特点, 以期为阐明药物的治疗机制提供科学依据[8]。因此, 如何对疾病网络模型进行模块划分, 发现药物作用的功能模块, 有利于提高药物治疗疾病的精准性。代谢网络作为生物网络的重要组成部分, 其模块化策略为从代谢组学角度挖掘中药复方模块化作用机制提供新的研究思路。
因此, 本研究应用代谢网络的功能模块划分方法, 从功能模块角度探究逍遥散治疗抑郁症的生物学机制。通过数据库收集逍遥散调节差异代谢物、差异代谢物相关的酶以及与抑郁症相关的蛋白, 对逍遥散调节差异代谢物进行通路富集分析和交互分析, 利用STRING工具构建差异代谢物相关的酶与抑郁症的蛋白网络, 应用CNM分解算法提取网络蛋白功能模块并进行功能模块富集分析。本研究采用通路交互分析和代谢网络模块划分策略阐释逍遥散治疗抑郁症的生物学机制, 为从代谢调控角度深入研究中药复方药理作用机制提供思路参考和方法借鉴。
材料与方法逍遥散和抑郁症相关数据收集 通过抑郁症代谢物相关数据库MENDA (http://menda.cqmu.edu.cn:8080/index.php)[9]收集逍遥散调节的差异代谢物。MENDA数据库从5个电子文献数据库和5个代谢组学数据库中筛选出了10 000多条引文, 挑选了5 675个与抑郁症有关的差异代谢物条目。同时, 也通过公共数据库补充最新发表的文献, 将不同来源的数据合并成逍遥散调节抑郁症差异代谢物条目数据。通过OmicsNet数据库(https://www.omicsnet.ca/)获取代谢物和酶的关系[10]。最后在DisGeNET (http://www.disgenet.org/home/)[11]和OMIM (https://www.omim.org/)[12]疾病数据库中检索与抑郁症相关的蛋白。
通路富集分析与交互分析 利用KEGG数据库采用Fisher精确检验方法对逍遥散调节的代谢物进行通路富集分析, 选择Bonferroni校正后满足P < 0.05的通路。对显著富集的通路进行通路-通路交互分析, 构建交互网络。不同的通路之间包含相同的差异代谢物, 通路和通路之间用边的连接表示相互关系。本研究采用两个测量指标[13], 即杰卡德系数(JC)和重叠系数(OC)来描述不同通路之间的相互关系, 运算公式如下:
| $J C=\left|\frac{A \cap B}{A \cup B}\right|$ | (1) |
| $O C=\frac{|A \cap B|}{\min (|A|, |B|)}$ | (2) |
其中A和B是特定两条富集通路中包括逍遥散调节差异代谢物的列表。在任意两条显著富集通路中, 计算公式中的|A|和|B|分别表示两条通路上代谢物的数量。通过使用JC和OC两个系数的平均值来计算通路之间的关系大小。最后, 采用Cytoscape进行通路交互作用关系的可视化。
蛋白网络构建与功能模块识别 为了研究药物调节疾病网络重要模块, 本研究将逍遥散调节差异代谢物的酶与抑郁症疾病相关蛋白同时输入STRING(https://string-db.org/)[14]数据库进行蛋白-蛋白相互作用(protein-protein interaction, PPI)分析, 选取得分大于0.4的蛋白输入Cytoscape软件进行可视化分析。采用CNM算法(基于贪婪算法思想的社团结构检测算法)对蛋白网络进行模块划分, 挖掘网络中高度模块化的功能模块。CNM算法[15]首先初始化每个节点为一个模块, 采用堆数据结构计算和更新模块度Q, 在不断合并模块的过程中, 模块度Q有且仅有一个峰值, CNM算法将对应的模块划分作为最终的网络划分结果, 模块度运算公式如下:
| $Q=\sum\limits_{v=1}^{n_{c}}\left[\frac{l_{v}}{M}-\left(\frac{d_{v}}{2 M}\right)^{2}\right]$ | (3) |
其中nc是模块的个数, lv是模块v内部所包含的边数, dv是模块v中所有节点的度值之和, M表示网络的边数, CNM算法的时间复杂度为O(nlog2n)。
模块核心蛋白识别与网络拓扑属性分析 功能模块的拓扑属性包括节点数、边数、平均度、聚集系数、直径以及平均路径长度等, 通过对功能模块的拓扑属性进行分析可以发现网络中的重要节点。在生物过程中存在网络简约原则, 即潜在的关键分子在网络中以最短路径的方式存在。因此, 本研究采用经典的介数中心性(BC)度量每个模块中的中心节点[16]。节点i的介数中心性指网络中经过该节点的最短路径的数目占该网络中最短路径总数的比例, 其定义为:
| $B C_{i}=\frac{1}{N^{2}} \sum\limits_{s \neq i \neq t} \frac{n_{s t}^{i}}{g_{s t}}$ | (4) |
其中gst为从节点s到节点t的最短路径的数目, nsti为从节点s到节点t的gst条最短路径中经过节点i的最短路径数目。
功能模块的富集分析与相似性评价 本研究中对蛋白网络和功能模块的富集分析采用R语言“clusterProfiler”包, 功能模块的相似性评价采用杰卡德相似系数, 具体运算方法见公式(1)。
结果 1 逍遥散调节差异代谢物分析应用MENDA数据库并结合文献报道收集到的逍遥散治疗抑郁症调节的差异代谢物有97个, 其中, 频次在2以上的有34个差异代谢物, 其中排在前10位的由高到低分别是谷氨酸(7)、乳酸(7)、柠檬酸(6)、丙氨酸(6)、酪氨酸(6)、苯丙氨酸(5)、胆碱(5)、氧化三甲胺(5)、谷氨酰胺(5)和棕榈酸(5), 结果表明这些差异代谢物在逍遥散治疗抑郁症中发挥重要的作用。
2 通路富集分析对逍遥散调节的差异代谢物进行通路富集分析, 可以揭示逍遥散在代谢物层面治疗抑郁症的作用机制。图 1所示为通路富集分析的结果, 由图可知, 通路显著性依次为柠檬酸循环(TCA循环), 苯丙氨酸代谢, 缬氨酸、亮氨酸和异亮氨酸的生物合成, 谷胱甘肽代谢, 近端小管碳酸氢盐回收, 逆行内源性大麻素信号转导, 烟酸和烟酰胺代谢, 半胱氨酸与蛋氨酸代谢, 胆碱代谢和突触小泡周期等, 表明逍遥散可通过调节这些通路发挥抗抑郁作用。
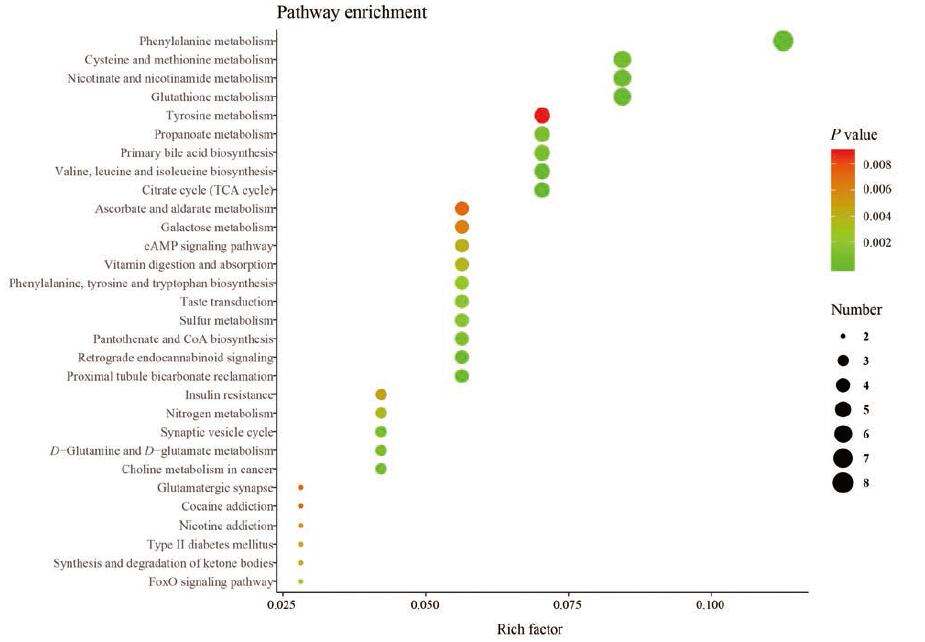
|
Figure 1 The top 30 KEGG pathways of enriched differential metabolites.The size of the bubble shows the enrichment score, while colors indicate enrichment significance |
为了进一步挖掘不同通路之间的相互关系, 本研究对48条显著富集的通路进行交互分析, 构建了一个由47个节点(通路)和269条边组成的交互网络, 并且进一步将交互网络划分为两个子网络, 结果如图 2所示。
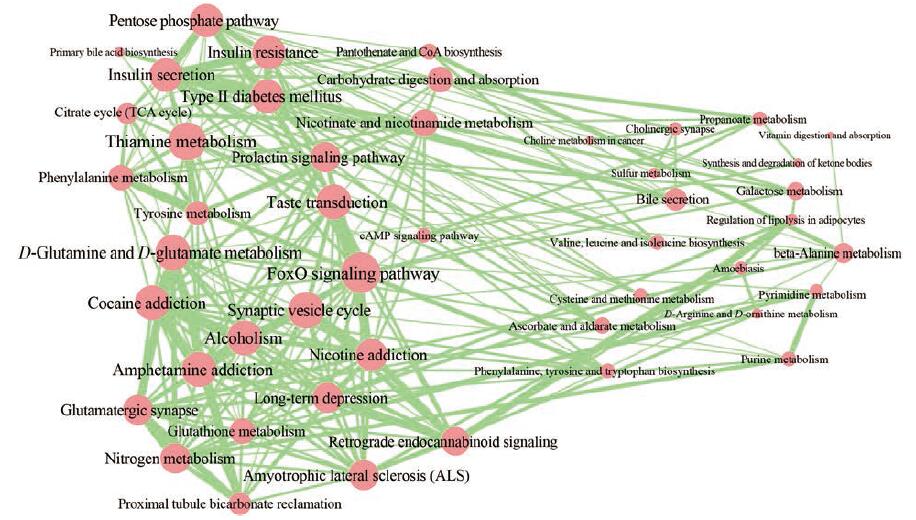
|
Figure 2 Pathway crosstalk among differential metabolites-enriched pathways.Nodes represent pathways, and edges represent crosstalk between pathways.Edge-width corresponds to the score of specific pathway pair.Larger edge-width indicates higher score |
第一个子网络中的通路主要包括神经系统(突触小泡循环、谷氨酰胺和谷氨酸代谢、谷氨酸能突触、长时程抑制)和细胞信号转导(FoxO信号通路、cAMP信号通路)等。在第二个子网络中, 许多通路与内分泌系统(调节脂肪细胞中的脂肪分解、胆汁分泌)和代谢途径(硫代谢、半乳糖代谢、丙氨酸代谢、缬氨酸、亮氨酸和异亮氨酸的生物合成, 苯丙氨酸、酪氨酸和色氨酸的生物合成, 半胱氨酸和蛋氨酸的代谢, 抗坏血酸盐和藻酸盐代谢, 嘌呤代谢, 精氨酸和鸟氨酸代谢, 嘧啶代谢)有关。采用通路交互分析的方法, 发现子网络内部的通路连接比不同子网络之间的通路连接更加紧密, 说明子网络内部的通路在功能上更为相似。此外, 两个子网络也不是彼此独立的, 而是通过多个通路相互连接。因此, 逍遥散通过调节两个子网络的多个通路发挥抗抑郁作用。
4 蛋白网络模块划分与核心蛋白的识别整合234个逍遥散调节差异代谢物的酶和258个抑郁症的蛋白, 构建包含476个节点和5 632条边的网络。利用CNM算法对蛋白网络进行模块划分, 最终得到9个功能模块, 如图 3所示。

|
Figure 3 Nine modules of protein network divided by CNM algorithm.The size of the node is related to the betweenness centrality |
表 1列出了各模块的基本特征和拓扑属性, 由表可知规模大的模块其包含的节点数相对较多, 平均每个节点连接的边的数目也多。不同网络节点数相差很大, 最大的模块1由168个节点及1 508条边组成, 平均每个节点含有8.97条边。
| 表 1 Basic characteristics and topological properties of the 9 modules |
本文也对每个模块的直径、聚集系数和平均路径长度进行了计算, 发现直径的变化范围在1~6, 且平均路径长度较小, 符合“六度分离理论”[17]。每个模块聚集系数较高, 符合复杂网络的“小世界特性”。这些结果表明, CNM算法划分蛋白网络模块具有合理性。
网络中节点因为拓扑属性不同, 重要程度也不同。本研究利用介数中心性排序, 设定大于平均介数的节点被保留, 共得到53个核心蛋白。通过查阅抑郁症疾病数据库, 发现其中有25个核心蛋白被报道与抑郁症相关, 文献报道蛋白数占模块核心蛋白数的47%。它们直接或间接参与了抑郁症的发生发展, 例如脑源性神经营养因子(BDNF)、五羟色胺转运体(SLC6A4)、白介素6 (IL6)、前列腺素内过氧化物合成酶2 (PTGS2)、cAMP效应元件结合蛋白1 (CREB1)、5-羟色胺受体1A (HTR1A)、多巴胺受体D3 (DRD3)、大麻素受体1(CNR1)、多巴胺D2受体(DRD2)和神经营养性酪氨酸激酶2型受体(NTRK2)等。
其中, 模块1、模块2、模块3和模块4分别含有的核心蛋白有11、16、11和11个, 模块2和模块3中含有已报道核心蛋白均为11个, 是核心蛋白数量最多的功能模块, 表明这些模块及其相应的核心蛋白与抑郁症发病机制有密切的关系, 逍遥散可以通过调节相应的功能模块及其核心蛋白发挥抗抑郁作用, 结果如表 2所示。
| 表 2 Hub proteins of 9 modules. *Indicates that the gene has been reported to be associated with depression in the literature, while - indicates that there is no core gene |
CNM算法的策略从网络中合理地划分了具体的模块。基于杰卡德相似系数算法的模块功能相似度分析, 可以评价各个模块与抑郁症功能的相关性。因此, 通过计算杰卡德相似系数从生物功能角度验证CNM算法划分蛋白网络模块的合理性。表 3结果显示9个模块所富集到的通路数量、模块与蛋白网络富集通路的交集和模块与蛋白网络富集通路的并集, 该结果为后续通路数占比的计算提供可靠的依据。
| 表 3 Comparison of pathway levels and gene levels between 9 modules and proteins network |
图 4列出9个模块中通路数与蛋白数在PPI网络中的比例关系。横坐标表示模块编号, 纵坐标代表模块中通路数与蛋白数所占的比例。从图 4结果可以看出, 模块1、模块3、模块6和模块8中均为通路数占比大于蛋白数占比, 其中模块1最为显著, 通路数占比达到0.39, 蛋白数占比达到0.35, 表明较少的蛋白可以富集到较多的通路, 证明模块分析在通路富集上具有明显优势。通过此方法, 还可判断通路富集能力较高的模块, 从而为评价主要模块和次要模块提供另一个重要的参考指标。
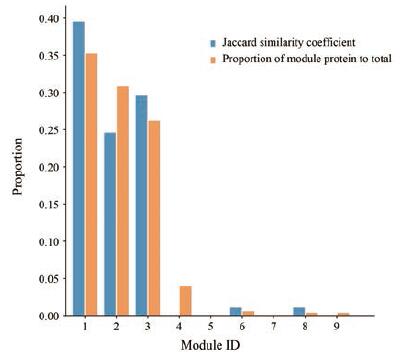
|
Figure 4 Comparison of the number and function of proteins between PPI and its modules.Blue bar chart represents Jaccard similarity coefficient, orange bar graph represents proportion of module protein to total |
生物网络具有显著的模块性, 探索模块结构是理解药物靶点网络的关键环节。如表 4所示, KEGG通路富集分析结果显示, 除了模块5和模块7外, 其余7个模块至少富集到一条生物学通路。模块1~3富集通路数较多, 定义为关键模块, 表 4列举了模块1~3对应的功能及通路。模块1富集在氨基酸代谢和碳水化合物代谢模块的通路有23条, 分别是半乳糖代谢, 丙氨酸、天门冬氨酸和谷氨酸代谢, 糖酵解/糖异生等; 模块2富集在免疫系统和信号转导模块的通路有25条, 分别是Ras信号通路、MAPK信号通路和PI3K-Akt信号通路等; 模块3富集在内分泌系统和神经系统功能的模块有23条, 分别是血清素能突触、多巴胺能突触和谷氨酸能突触等。以上结果提示, 不同功能模块富集不同的生物学功能, 模块划分对于解析逍遥散治疗抑郁的生物学机制具有重要意义。
| 表 4 The relationship between pathways and functions in different modules |
此外, 为了进一步研究各模块之间的关系, 本研究采用Cytoscape软件对模块和通路分类关系进行可视化分析, 结果如图 5所示。图中的功能包括6大类, 分别是内分泌系统: Gn RH信号通路、雌激素信号通路、甲状腺激素合成、催产素信号通路、调节脂肪细胞中的脂肪分解; 氨基酸代谢: 精氨酸和脯氨酸代谢、酪氨酸代谢、苯丙氨酸代谢、色氨酸代谢; 神经系统: 谷氨酸能突触、血清素能突触、长时程抑制; 信号转导: HIF-1信号通路、磷脂酶D信号通路、Apelin信号通路; 脂质代谢: 花生四烯酸代谢; 感官系统: TRP通道的炎性介质调节。模块1、模块2和模块3通路的连接体现了这些功能与抑郁症的发病机制有密切的联系。结果表明, PPI网络中各模块之间不是孤立的, 功能相近的模块之间相互连接更为紧密, 共同作为逍遥散治疗抑郁症的生物学机制。
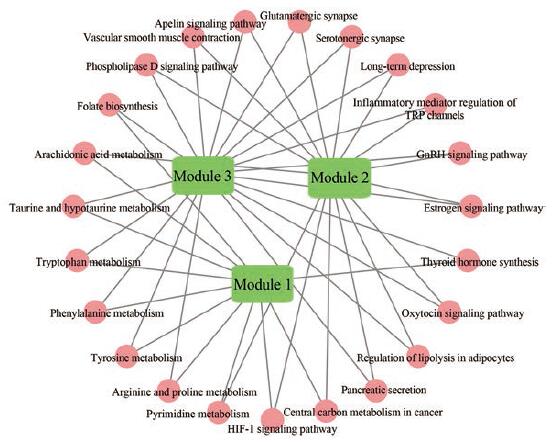
|
Figure 5 The functional relationships between the identified module 1, module 2, and module 3.Green nodes represent modules, pink nodes represent pathways.Each pathway is connected to two modules |
抑郁症的发生发展与遗传、生物化学、心理、社会和环境等多种因素有关, 其发病机制涉及神经、内分泌和免疫等多个方面。逍遥散作为经典的疏肝解郁名方, 实验和临床研究均证实其具有良好的抗抑郁作用。本研究整合逍遥散调节差异代谢物相关的234个酶和与抑郁症相关的258个蛋白, 构建蛋白相互作用网络, 网络中包含476个节点和5 632条边。应用CNM算法提取了网络中的9个功能模块, 并对这些模块进行拓扑属性分析, 挖掘出其中的核心蛋白53个。
逍遥散在抑郁症临床患者和抑郁样动物模型中表现出良好抗抑郁作用, 生物学机制与调节单胺类神经递质水平、影响神经营养因子及相关通路、调节下丘脑-垂体-肾上腺(HPA)轴功能、抑制炎症反应及抗氧化等有关[18, 19]。逍遥散可以通过调节这些生物学机制的关键靶点发挥抗抑郁作用。与此同时, 本研究结果也发现BDNF、SLC6A4、IL6、PTGS2、CREB1、HTR1A、DRD3、CNR1、DRD2和NTRK2等核心蛋白与抑郁症密切相关, 在这些核心蛋白中, 逍遥散可以逆转慢性束缚应激抑郁样模型引起BDNF的下降, 额叶皮层和海马CA1子区域中Trk B和神经营养因子-3 (NT-3)的增加[20]。逍遥散也可显著逆转应激大鼠杏仁核中焦虑样行为以及上调CRF1R和BDNF的表达水平[21]。逍遥散还可以显著上调慢性温和不可预知抑郁小鼠海马和皮质CREB和BDNF mRNA的表达水平, 提高海马磷酸化细胞外调节蛋白激酶(p ERK1/2)蛋白表达水平与血清BDNF表达水平[22]。此外, 也有研究表明逍遥散对降低模型大鼠血清炎性因子白细胞介素-1β(IL-1β)、IL6和肿瘤坏死因子-α(TNF-α)等水平方面均有一定作用。逍遥散可以有效地抑制肝郁脾虚抑郁症大鼠海马区IL6和TNF-α的分泌, 这可能是逍遥散治疗肝郁脾虚型抑郁症的作用机制之一[23, 24]。这些核心蛋白已经被文献证实, 因此逍遥散可能通过调节53个核心蛋白发挥抗抑郁作用。
本研究采用代谢通路的交互分析发现了逍遥散治疗抑郁症的重要生物学机制, 包括信号通路和代谢通路两个方面。在信号通路方面, 逍遥散可以通过FoxO和cAMP等信号通路发挥抗抑郁作用。慢性温和不可预知抑郁大鼠海马组织中的cAMP、PKA、p-CREB、BDNF的水平显著降低, 逍遥散干预后均有所提高, 提示逍遥散可能通过干预cAMP信号转导通路发挥抗抑郁作用[25]。在代谢通路方面, 逍遥散可以通过丙氨酸代谢, 缬氨酸、酪氨酸和色氨酸的生物合成, 精氨酸和鸟氨酸代谢等代谢通路发挥抗抑郁作用。慢性应激抑郁大鼠海马存在色氨酸代谢异常, 与抑郁症的发病机制密切相关。逍遥散可以通过调节TPH2和IDO1的表达水平来改善色氨酸的代谢, 从而发挥抗抑郁的作用[26]。
逍遥散治疗抑郁症代谢网络具有模块化的特征, 探索模块结构是理解药物靶点网络的关键环节。因此, 本研究运用模块划分方法, 从逍遥散治疗抑郁症代谢网络中一共识别出9个功能模块。
模块1是氨基酸代谢和碳水化合物代谢模块, 主要富集到氨基酸代谢和碳水化合物代谢相关的通路。GLUL是模块1的核心蛋白, 研究表明, GLUJTs是PI3K/Akt信号通路介导糖脂代谢的下游分子, 逍遥散组可以逆转模型组GLUT2蛋白含量降低, 逍遥散通过能量代谢发挥抗抑郁作用[27]。另外一项研究表明, 逍遥散中多个成分可通过钠钾ATP酶α1及ATP合酶α、β和γ亚基等靶点, 调节三羧酸循环、糖代谢、氨基酸代谢和氧化磷酸化等通路发挥抗抑郁作用[28]。这一结果与临床上抑郁症患者代表性症状“疲劳”和“食欲不振”高度吻合, 而逍遥散通过对能量代谢异常途径的纠偏作用达到治疗效果。因此, 从功能模块角度分析, 模块1是逍遥散治疗抑郁症网络中的重要模块, 推测模块1的氨基酸代谢和碳水化合物代谢可能是逍遥散治疗抑郁症的关键作用机制。
模块2富集到的通路数量最多, 有94条, 是免疫系统和信号转导功能模块, 主要富集到免疫系统和信号转导相关的通路。IL6和TNF是模块2的核心蛋白, 研究表明, 逍遥散给药3周能降低海马TNF-α和早期基因c-Fos的表达, 调节免疫系统功能和抑制海马神经元细胞凋亡[29]。另外一项研究表明, 逍遥散通过下调大鼠海马中的TNF-α/JAK2-STAT3通路来减轻压力引起的焦虑行为[30]。因此, 从含有报道核心蛋白角度分析, 模块2是逍遥散治疗抑郁症网络中的重要模块, 逍遥散可能通过干预免疫系统和信号转导功能模块通路发挥抗抑郁作用。
模块3是逍遥散治疗抑郁症靶点网络中的另一个关键模块, 其为内分泌系统和神经系统功能模块, 主要富集到内分泌系统和神经系统相关的通路。HTR1A、BDNF和CREB1是模块3的核心蛋白, 研究表明, 逍遥散给药4周能增加皮层5-HT和海马5-羟吲哚乙酸(5-HIAA)水平, 能升高血浆去甲肾上腺素含量, 表现出调节大鼠体内单胺类神经递质水平的作用[31]。逍遥散上调嗅球摘除抑郁样模型海马与皮质部位5-HT、多巴胺水平及5-HT1A mRNA与蛋白表达水平, 下调5-HT2A mRNA表达水平[32]。因此, 从含有报道核心蛋白角度分析, 模块3是逍遥散治疗抑郁症网络中的重要模块, 逍遥散可能通过干预内分泌系统和神经系统相关通路发挥抗抑郁作用。
不同模块富集不同的通路, 在这些模块中, 其中一部分已经被文献证明, 但另一部分模块的功能与逍遥散治疗抑郁症作用生物学机制的关系仍有待于进一步证实。
本研究采用通路交互分析结合功能模块研究方法, 发现了BDNF、SLC6A4和IL6等53个核心蛋白以及内分泌系统、氨基酸代谢、神经系统和信号转导等功能, 从代谢网络调控模块化的视角解析逍遥散治疗抑郁症的生物学机制。采用代谢网络模块分析策略的研究方法, 不仅为逍遥散治疗抑郁症作用的生物学机制研究提供了参考, 也可为深入代谢层次研究中药复方作用机制提供思路参考和方法借鉴。
作者贡献: 秦雪梅和田俊生负责研究思路的提出; 高耀、穆俊芳和令狐婷进行实验并处理数据; 田俊生、周玉枝和高晓霞提供撰写思路及修改论文; 高耀查阅部分文献, 处理数据, 撰写草稿。所有作者阅读并认可终稿。
利益冲突: 所有作者均声明无相关利益冲突。
| [1] |
Hao WZ, Li XJ, Zhang PW, et al. A review of antibiotics, depression, and the gut microbiome[J]. Psychiatry Res, 2020, 284: 112691. DOI:10.1016/j.psychres.2019.112691 |
| [2] |
Peng GJ, Tian JS, Gao XX, et al. Research on the pathological mechanism and drug treatment mechanism of depression[J]. Curr Neuropharmacol, 2015, 13: 514-523. DOI:10.2174/1570159X1304150831120428 |
| [3] |
Pan Q, Wu J, Liu Y, et al. Involvement of hepatic SHIP2 and PI3K/Akt signalling in the regulation of plasma insulin by Xiaoyaosan in chronic immobilization-stressed rats[J]. Molecules, 2019, 24: 1-17. |
| [4] |
Qin XM, Gao Y, Tian JS, et al. Ideas and strategies from quality evaluation of Radix Bupleurum for the development of new antidepressant drugs[J]. Acta Pharm Sin(药学学报), 2019, 54: 1402-1408. |
| [5] |
Li JB, Li YP, Tian JS, et al. Pathological study on depression mechanism based on endogenous metabolite changes of chronic unpredictable mild stress model[J]. Chin Tradit Herb(中草药), 2013, 44: 108-115. |
| [6] |
Chen JL, Tian JS, Zhou YZ, et al. Anti-depression mechanism of supercritical CO2 extract from Compound Chaigui Fang based on network pharmacology[J]. Acta Pharm Sin(药学学报), 2016, 51: 388-395. |
| [7] |
Gao Y, Zhao YX, Xu T, et al. Research progress on antidepressant therapeutic biomarkers of Xiaoyaosan[J]. J Tradit Chin Med, 2020, 6: 171-179. DOI:10.4103/wjtcm.wjtcm_16_20 |
| [8] |
Gu H, Chen YY, Wang PQ, et al. Comparison of different methods of module division by entropy and functional similarity of gene network and its modules for coronary heart disease[J]. Chin JPharmacol Toxic(中国药理学与毒理学杂志), 2018, 32: 377-384. |
| [9] |
Pu J, Yu Y, Liu Y, et al. MENDA: a comprehensive curated resource of metabolic characterization in depression[J]. Brief Bioinform, 2019, 21: 1455-1464. |
| [10] |
Zhou G, Xia J. Omics Net: a web-based tool for creation and visual analysis of biological networks in 3D space[J]. Nucleic Acids Res, 2018, 46: W514-W522. DOI:10.1093/nar/gky510 |
| [11] |
Piñero J, Bravo À, Queralt-Rosinach N, et al. DisGeNET: a comprehensive platform integrating information on human diseaseassociated genes and variants[J]. Nucleic Acids Res, 2017, 45: D833-D839. DOI:10.1093/nar/gkw943 |
| [12] |
Amberger JS, Bocchini CA, Schiettecatte F, et al. OMIM. org: Online Mendelian Inheritance in Man(OMIM®), an online catalog of human genes and genetic disorders[J]. Nucleic Acids Res, 2015, 43: D789-D798. DOI:10.1093/nar/gku1205 |
| [13] |
Liu M, Fan R, Liu X, et al. Pathways and networks-based analysis of candidate genes associated with nicotine addiction[J]. PLoS One, 2015, 10: e0127438. DOI:10.1371/journal.pone.0127438 |
| [14] |
Szklarczyk D, Gable AL, Lyon D, et al. STRING v11: proteinprotein association networks with increased coverage, supporting functional discovery in genome-wide experimental datasets[J]. Nucleic Acids Res, 2019, 47: D607-D613. DOI:10.1093/nar/gky1131 |
| [15] |
Clauset A, Newman ME, Moore C. Finding community structure in very large networks[J]. Phys Rev E Stat Nonlin Soft Matter Phys, 2004, 70: 066111. DOI:10.1103/PhysRevE.70.066111 |
| [16] |
Newman ME. Modularity and community structure in networks[J]. Proc Natl Acad Sci U S A, 2006, 103: 8577-8582. DOI:10.1073/pnas.0601602103 |
| [17] |
Travers J, Milgram S. An experimental study of the small world problem[J]. Sociometry, 1969, 32: 425-443. DOI:10.2307/2786545 |
| [18] |
Wang X, Ye XL, Liu XB, et al. Research status of antidepressant effect of Xiaoyaosan[J]. Chin J Exp Tradit Med Form(中国实验方剂学杂志), 2018, 24: 212-220. |
| [19] |
Jing LL, Zhu XX, Lv ZP, et al. Effect of Xiaoyaosan on major depressive disorder[J]. Chin Med, 2015, 10: 1-7. DOI:10.1186/s13020-015-0029-x |
| [20] |
Chen JX, Li W, Zhao X, et al. Effects of the Chinese traditional prescription Xiaoyaosan decoction on chronic immobilization stress-induced changes in behavior and brain BDNF, Trk B, and NT-3 in rats[J]. Cell Mol Neurobiol, 2008, 28: 745-755. DOI:10.1007/s10571-007-9169-6 |
| [21] |
Jiang YM, Li XJ, Meng ZZ, et al. Effects of Xiaoyaosan on stress-induced anxiety-like behavior in rats: involvement of CRF1 receptor[J]. Evid Based Complement Alternat Med, 2016, 2016: 1238426. |
| [22] |
Peng X, Zeng N, Gong XP, et al. Study on the BDNF/CREBsignal mechanism of antidepressant effect of Xiaoyao Powder[J]. Chin Med Pharmacol Clin(中药药理与临床), 2012, 28: 9-12. |
| [23] |
Yang J, Gong XP, Liu R, et al. Effect of the decoction of Xiaoyaosan and its efficacy drug-groups on the level of serum cytokines and corticosterone in CUMS model rats[J]. Chin Med Pharmacol Clin(中药药理与临床), 2013, 29: 4-6. |
| [24] |
Wan XM, Zhou R, Huang XT, et al. Effect of Xiaoyao powder on IL-6 and TNF-α in the hippocampus of depression rats with chronic unpredictable mild stress[J]. J Liaoning Univ Tradit Chin Med(辽宁中医药大学学报), 2020, 22: 47-51. |
| [25] |
Shi BY. Investigation on the Anti-depression Mechanism of Fufang Chaigui Fang Supercritical CO2 Extraction(复方柴归方超临界CO2萃取组分抗抑郁作用机制研究)[D]. Taiyuan: Shanxi University, 2014.
|
| [26] |
Jiao HY, Yan ZY, Ma QY, et al. Influence of Xiaoyaosan on depressive-like behaviors in chronic stress-depressed rats through regulating tryptophan metabolism in hippocampus[J]. Neuropsychiatr Dis Treat, 2018, 15: 21-31. |
| [27] |
Gao Y, Xu T, Wu D, et al. Energy metabolism mechanism of Xiaoyaosan in treatment of depression based on integrative pharmacology-based research platform of traditional Chinese medicine[J]. Chin J Pharmacol Toxic(中国药理学与毒理学杂志), 2019, 33: 481-491. |
| [28] |
Pan QX. The Mechanism of Liver Energy Metabolism Disorder in Rats with Liver Depression and Spleen Deficiency Syndrome and the Effect of Xiaoyaosan(肝郁脾虚证大鼠肝脏能量代谢紊乱的机制及逍遥散的调节作用)[D]. Bejing: Beijing University of Chinese Medicine, 2018.
|
| [29] |
Li YL. Effect of Xiaoyao San on the expression of TNF-α and c-fos in the hippocampus of depression model rats[J]. Heilongjiang Med Pharm(黑龙江医药科学), 2013, 36: 93-95. |
| [30] |
Li XJ, Ma QY, Jiang YM, et al. Xiaoyaosan exerts anxiolyticlike effects by down-regulating the TNF-α/JAK2-STAT3 pathway in the rat hippocampus[J]. Sci Rep, 2017, 7: 353. |
| [31] |
Jia GC, Zheng XY, Zhou YZ, et al. Effect of Xiaoyaosan on chronic unpredictable mild stress model in rats[J]. Chin JExp Tradit Med Form(中国实验方剂学杂志), 2011, 17: 136-140. |
| [32] |
He M, Liu JW, Gong XP, et al. Study on the mechanisms of the antidepressant effect of Xiaoyao Powder in olfactory bulbectomized depression rats[J]. Chin Med Pharmacol Clin(中药药理与临床), 2014, 30: 14-17. |
 2021, Vol. 56
2021, Vol. 56


