癌症时刻威胁着人类生命和公共健康, 如何攻克癌症仍然是医学上的一大难题。传统癌症疗法, 包括外科手术、化疗和放疗, 虽然取得了一定的成效, 但目前仍然存在疗效有限、毒副作用严重和根治困难等缺陷。加上肿瘤复杂的成分及结构特征等因素, 这些传统治疗策略的应用受到极大的限制。为解决这些问题, 肿瘤靶向治疗随着医学和生物学的发展应运而生。在治疗过程中, 根据识别方式不同, 靶向治疗主要可分为受体介导治疗与基于肿瘤微环境(tumor microenvironment, TME)特性的响应型或调节型治疗[1, 2]。
纳米材料包括一些高分子纳米材料、无机纳米材料和生物大分子等, 在生物检测、药物递送、医学成像、肿瘤治疗以及新兴的基因、免疫治疗等应用中显示出巨大的潜力[3-5]。基于本身存在的特殊的理化性质, 纳米材料能够用于荧光成像(fluorescence imaging, FLI)、光声成像(photoacoustic imaging, PAI)、超声成像(ultrasound imaging, USI)、光热疗法(photothermal therapy, PTT)、光动力疗法(photodynamic therapy, PDT)和化学动力疗法(chemodynamic therapy, CDT)等新型肿瘤诊断与治疗中。随着纳米技术和材料科学的发展, 越来越多的诊疗一体化智能纳米系统逐渐被开发出来, 相对于传统手段更为高效, 具有显著的优势。考虑到TME在实体瘤生长、恶化、抗性的产生、转移及复发等过程发挥着极其关键的作用, 并且与肿瘤相关的细胞、成分等相比, TME更加稳定、具体状况更易预测[2, 6, 7], 设计、制备出用于肿瘤诊疗的TME响应型纳米系统逐渐成为研究热点, 近年来越来越多的研究成果已被广泛报道。本文将简要介绍TME的典型特征, 总结TME响应的纳米系统用于肿瘤诊疗的相关研究进展。
1 TME的主要特征TME是一个低营养、低pH值、乏氧和缺血的局部环境, 由肿瘤周围血管、免疫细胞、肿瘤相关成纤维细胞(cancer-associated fibroblasts, CAFs)、细胞外基质(extracellular matrix, ECM)及多种细胞因子、酶和自由基等肿瘤相关的成分所构成[1, 8, 9]。
1.1 乏氧根据肿瘤类型的不同, 肿瘤内的氧分压(partial pressure of oxygen, PO2)从几乎不含氧到60 mm Hg不等, 并且随着肿瘤的恶化而逐渐降低[10]。因肿瘤微血管的结构与功能异常, O2在血管与肿瘤细胞之间的扩散距离增大, 因而无法被有效运输至特定部位。另外, 肿瘤本身或治疗性贫血导致的血液输氧能力减弱同样会造成局部PO2降低[11, 12]。乏氧不仅可以促进肿瘤生长、恶化和转移, 还会降低放疗和化疗的疗效[11, 13]。
1.2 低pH值基于Warburg效应[14], 肿瘤细胞主要依靠糖酵解获取能量, 代谢所产生的乳酸及H+分泌到胞外而形成pH 6.5~6.9的酸性微环境[15], 低于正常组织(pH 7.4)。低pH值环境会诱导肿瘤的恶性表型。同时, 这种酸性环境会促进血管内皮生长因子、碳酸酐酶和组织蛋白酶B (cathepsin B, CTSB)等相关成分的表达, 因而与肿瘤不可控生长及转移密切相关。此外, 低pH值还会使肿瘤产生多药耐药性(multidrug resistance, MDR), 影响化疗效果[15, 16]。
1.3 氧化应激增加活性氧(reactive oxygen species, ROS), 包括超氧阴离子(superoxide anion, ·O2-)、过氧化氢(hydrogen peroxide, H2O2)、羟基自由基(hydroxyl radical, ·OH)和单线态氧(singlet oxygen, 1O2)等, 对多种生理及病理作用具有重要影响。ROS通过多种机制在线粒体、过氧化物酶体、内质网及还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶复合物等部位中产生[17]。由于致癌刺激、线粒体功能障碍、细胞增殖失控及代谢活动增加等因素, 癌细胞表现出内在ROS氧化应激增加[17, 18], 其中, H2O2作为细胞氧化应激的重要标志[19], 在TME内浓度可达100μmol·L-1, 比正常组织高100倍[1]。氧化应激的增加促进了癌症恶性生长、遗传不稳定性及耐药性的发生。
1.4 高浓度谷胱甘肽谷胱甘肽(glutathione, GSH)能够维持生物系统内的氧化还原平衡, 是细胞中最丰富的内源性抗氧化剂。肿瘤组织内的GSH至少是正常细胞含量(0.5~10 mmol·L-1)的4倍[20]。过量的GSH可以清除具有细胞毒性的ROS, 因而显著增强了癌细胞对依赖ROS治疗的抵抗能力。
1.5 过表达酶酶在生物代谢过程中起着至关重要的作用。因代谢异常, 肿瘤内表现出部分酶过表达的现象。基质金属蛋白酶(matrix metalloproteinases, MMPs)是一种由癌细胞、肿瘤血管及CAFs分泌的钙、锌依赖性内肽酶, 在癌细胞重构ECM过程中起关键作用[8, 21, 22]。CTSB是另一种肿瘤中异常表达的酶, 可直接或间接降解部分ECM成分, 从而促进肿瘤细胞的转移[23]。TME中的过表达酶还包括透明质酸酶(hyaluronidase, HAase)和赖氨酰氧化酶等, 一些酶会在特定的肿瘤内过表达, 例如在前列腺癌中广泛存在的磷脂酶A2[1, 24, 25]。
2 TME响应型纳米诊疗剂TME的特性一方面促进了肿瘤的生长与转移; 另一方面却为新型癌症诊疗手段提供了一定的思路。基于TME特性的纳米诊疗剂主要可以分为: 乏氧响应型、pH响应型、氧化还原响应型、酶响应型, 以及双重和多重响应型。
2.1 乏氧响应型乏氧已被认为是实体瘤的关键特征[26]。目前, 针对缺氧环境所设计的响应型纳米探针的原理包括: ①磷光金属配合物与O2接触后, 一部分因与O2分子的碰撞相互作用而淬灭, 导致磷光的强度随着氧浓度的增加而降低; ②在缺氧区域内, 一些还原酶具有较高的浓度, 导致偶氮和醌基等官能团能被快速还原, 失去吸电子特性而反映缺氧状态; ③ 2-硝基咪唑类化合物等显像剂在缺氧的TME中发生生物化学反应而滞留在肿瘤细胞内[27], 可与正电子发射型断层显像(positron emission tomography, PET)结合而用于肿瘤诊断。
早期发展的一些氧淬灭型探针, 包括利用Ir、Ru和Pd等[28-30]磷光金属的配合物对乏氧部位进行无创分析, 例如Komatsu等[28]及Zhang等[30]分别制备出Ru配合物探针Ru-Py及Ir配合物探针BTP, 均能够在乏氧条件下显示明显磷光而具有应用于肿瘤诊断的潜力。随着光声技术(photoacoustic, PA)的发展, 一系列乏氧响应型PA探针逐渐被开发出来[26]。Knox等[31]合成了一种PA探针HyP-1, 该探针结构中含有一个氮氧化物触发器, 能够在体内乳腺癌与缺血模型中被血红素蛋白还原, 所产生的Red-HyP-1在波长760 nm处的信号明显增强。一些乏氧响应型放射性核素显像剂能够与纳米技术相结合而应用于PET中。如64Cu-ATSM可以选择性保留在缺氧细胞内, Shin等[32]在此基础上发展出负载该显像剂的全氟戊烷纳米滴, 实现了US-PET双模成像。
与此同时, 一些研究表明, 部分乏氧激活的前药分子单独使用时效果不佳, 但可以在TME中转化为毒性成分而杀死癌细胞[33]。替拉扎明(tirapazamine, TPZ)是此类前药的一个典型例子。在乏氧的肿瘤细胞内, TPZ经代谢后形成的超氧化物自由基可以破坏脱氧核糖核酸(deoxyribonucleic acid, DNA)结构, 表现出高度选择的毒性。基于此, Wang等[34]合成出负载TPZ的纳米粒, 并结合吲哚菁绿(indocyanine green, ICG)所介导的PDT可消耗更多O2而进一步提高了TPZ的疗效, 在4T1肿瘤模型中取得了显著的协同效果。另外, 乏氧响应型官能团, 包括硝基咪唑、偶氮和醌基等, 能够在TME内响应刺激而促使纳米系统释放化疗药物, 常被用于相关的结构设计中。Thambi等[35]将2-硝基咪唑衍生物偶联至羧甲基葡聚糖CM-De X主链上, 经自组装形成包裹多柔比星(doxorubicin, DOX)的纳米载体HR-NPs。经低氧刺激后, DOX在肿瘤处的释药率显著增加。Huang等[26]制备出含偶氮苯(azobenzene, azo)的可激活的生色团NR-azo及其脂质体系统Lipo-NR-azo, 两者均可以对肿瘤乏氧迅速产生反应, 释放出生色团NR-NH2和抗肿瘤药物氮芥。通过多光谱光声层析成像和FLI, NR-azo可以检测肿瘤处的低氧环境, 而LipoNR-azo能够对药物抑制肿瘤生长的过程进行跟踪, 为设计用于检测其他生物标志物和治疗的色团提供参考。Yang等[33]将光敏剂二氢卟吩e6 (chlorin e6, Ce6)、奥沙利铂(oxaliplatin, Oxa)前药分别与人血清白蛋白(human serum albumin, HSA)以酰胺键结合, 生成的HSA-Ce6 (HC)和HSA-Oxa (IV)(HO)通过偶氮苯相交联, 制备出乏氧反应型纳米系统HCHOA。在肿瘤缺氧部位, 该材料可由还原性酶迅速降解成10 nm以下超细HC、HO纳米粒。HC中的Ce6恢复光活性, 不仅能够用于生物成像, 还可以促进1O2的产生, 而HO则具有肿瘤治疗性。该方法实现了FLI、PDT与化疗的结合, 在体内显示出良好的抗肿瘤效果(图 1)。此外, 一些放疗增敏剂, 如沙纳唑(sanazole, SAN)[36], 可以靶向乏氧肿瘤细胞, 诱导细胞损伤与凋亡作用, 具有潜在的应用前景。
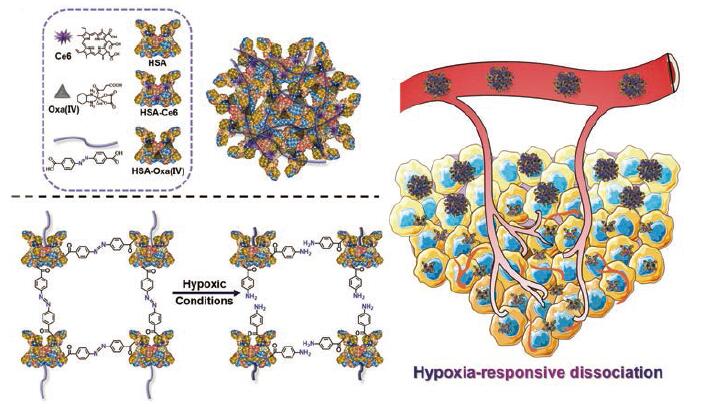
|
Figure 1 The structure and the improved tumor penetrating ability of hypoxia-responsive HCHOA.Ce6:Chlorin e6;Oxa: Oxaliplatin; HSA: Human serum albumin.(Adapted from Ref.33 with permission.Copyright © 2019 Wiley) |
实际上, 典型的乏氧环境一般仅存在于肿瘤深处, 因此限制了这类响应型纳米制剂的作用结果。另外, 一些材料与物质本身的缺陷, 如过渡金属氧淬灭型探针, 仍然可能存在空间分辨率、生物相容性和水溶性等问题, 一定程度上影响了该类制剂的应用。
2.2 pH响应型pH响应型的纳米诊疗剂主要作用原理有: ①利用部分结构的pKa值与TME中的pH值相近, 使其发生质子化而改变溶解性等相关性质; ②一些化学键或聚合物, 在低pH值的情况下断裂而释放显像剂或药物; ③对酸敏感的无机物能够在肿瘤微酸的环境中降解, 因此可用于制备载体部分。
Li等[6]以腙键作为pH响应部分, 合成出具有较高灵敏度的近红外(near infrared, NIR)荧光探针In NP1。然而, 由于仍然存在背景发光和淬灭效应等可能性, FLI不能量化体内准确的pH值[1]。考虑到PAI具有组织穿透力强和灵敏度高等特点, 可以将其应用于活体pH值检测中。Chen等[16]利用NIR染料IR825及pH敏感型染料BPOx与HSA制备出复合比率型探针HSA-BPOx-IR825 (C)。TME中低pH值可以使BPOx质子化, 使该探针在680和825 nm的PA信号比率随pH值降低而降低, 从而实现实时观察肿瘤生长过程中微环境的逐渐酸化及注射外部缓冲液后肿瘤处pH值的瞬间变化, 由此可指导肿瘤的治疗(图 2)。除FLI和PAI外, 核磁共振成像(magnetic resonance imaging, MRI)也被广泛应用于pH响应型的诊断工作中。
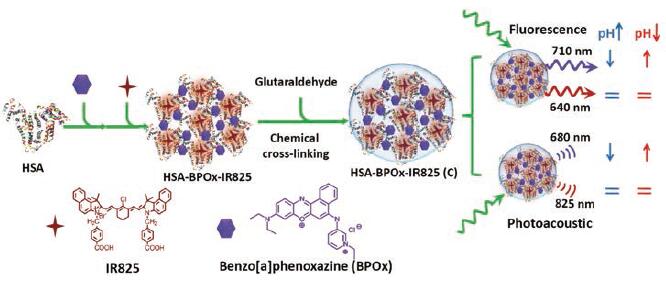
|
Figure 2 The formation of HSA-BPOx-IR825 (C) and its application in pH sensing under both ratio metric fluorescence and photoacoustic imaging.(Adapted from Ref.16 with permission.Copyright © 2015 Wiley) |
低pH值同样是药物选择性杀死癌细胞的理想触发点。近年来, 根据肿瘤内部酸性的微环境, 利用pH敏感的化学键、聚合物及无机物, 一系列的酸性pH响应型纳米药物递送和诊疗一体化系统被设计。这些纳米系统在正常情况下相对稳定, 但能够被酸性环境激活而在肿瘤部位释放化疗药物。Gurav等[37]采用巯基修饰的透明质酸(hyaluronic acid, HA)及普朗尼克F127制备出纳米凝胶Plu-HA-DOX, 酸性条件能使其中连接药物的腙键裂解。该凝胶表现出在pH 5.0的条件下缓慢持续地释放药物, 相对于游离的DOX, 该剂型所产生的细胞毒性显著提高。Liang等[38]通过希夫碱反应, 以氧化普鲁兰多糖和对酸敏感的壳聚糖接枝二氢咖啡酸CS-DA为原料制备出酸响应型水凝胶CS-DA/OP, 可用于负载DOX和阿莫西林(amoxicillin, AMX)。基于双模T1/T2 MRI造影剂能够提供比传统造影剂更准确、更详细的信息, Huang等[39]以T2造影剂Fe3O4为核心, 以聚丙氨酸包裹的介孔SiO2为pH响应的载体部分, 负载DOX与T1造影剂Mn-卟啉, 并在表面修饰靶向分子cRGD, 制备出T1/T2双模造影剂Mn-IOSP。在酸性环境下Mn-卟啉被释放而远离了Fe3O4核心, 由此避免了后者产生的强磁场干扰而导致的核磁共振(magnetic resonance, MR)信号的非预期淬灭。因此, Mn-IOSP能够作为较为理想的MRI造影剂应用于肿瘤诊断与精确指导的药物控释。一些对酸敏感的无机纳米材料如MnO2、CaCO3同样可以作为多功能纳米药物载体。Dong等[40]合成出pH响应型诊疗剂CaCO3@Ce6(Mn)-PEG(DOX), 在静脉注射后, 该纳米粒能够在肿瘤部位迅速降解, 有效地释放Ce6(Mn)和DOX并产生1O2, 实现MRI-FLI双模态成像与化疗-PDT联合治疗一体化。
虽然pH响应型的纳米诊疗手段已经取得了一定的进展, 但在设计与制备过程中仍然需要考虑一些问题。例如, 肿瘤的不同部位的pH值仍然存在差异, 某些位置pH值可能与周围正常组织相近, 这些因素都有可能影响纳米制剂作用的精确性。
2.3 氧化还原响应型 2.3.1 ROS响应型以ROS作为检测及治疗的开关, 主要有以下3种方式: ①与ROS直接发生反应, 改变作用分子的相关性质; ②生成O2改善缺氧状态, 提高放疗及化疗的治疗效果; ③利用芬顿反应原理产生过量的ROS, 破坏肿瘤细胞内蛋白质、脂质和DNA等生物大分子[17]。
在H2O2存在时, 辣根过氧化物酶(horseradish peroxidase, HRP)能够将无色的2, 2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸[2, 2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid), ABTS]催化成绿色、具有强NIR吸光度的氧化态, Chen等[41]设计出能够同时负载HRP及ABTS脂质体纳米载体Lipo@HRP & ABTS用于体内肿瘤及炎症处的PAI。该系统不仅可以通过H2O2的含量差异区分转移性淋巴结及非转移性淋巴结, 同时, 因H2O2响应型NIR吸收性质而能够有效地实现肿瘤处的光热消融, 具有很高的灵敏性及选择性。
Zhang等[42]将过氧化氢酶(catalase, CAT)封装在顺铂(cisplatin, DDP)前药与磷脂结合的脂质体中, 形成CAT@Pt(Ⅳ)-liposome。该制剂能够在肿瘤部位积聚并分解内源性H2O2, 显著改善缺氧状态而增强了DDP的化疗效果。同时, 在接受X射线辐射后, 与游离药物相比, 实验组的癌细胞DNA损伤水平达到最高, 证明该制剂是一种放疗与化疗相结合的纳米反应器(图 3)。
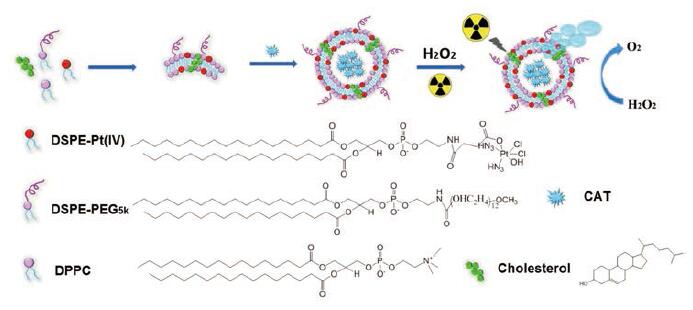
|
Figure 3 The preparation of CAT@Pt(IV)-liposome for tumor hypoxia relieved cancer chemo-radiotherapy.DSPE: 1, 2-Distearoyl-sn-glycero-3-phosphoethanolamine; PEG: Polyethylene glycol; CAT: Catalase; DPPC: 1, 2-Dipalmitoyl-snglycero-3-phosphocholine.(Adapted from Ref.42 with permission.Copyright © 2017 Elsevier) |
CDT常利用芬顿反应, 将内源性H2O2转化成有毒的·OH, 以此对细胞产生杀伤作用, 从而进行肿瘤治疗。Dong等[43]合成了一种多功能的纳米制剂BSO/GA-Fe(Ⅱ)@Liposome, 该材料能够富集在肿瘤处, 不仅可以促进H2O2氧化成·OH, 同时能够利用丁硫氨酸-亚砜亚胺(buthionine-sulfoximine, BSO)作为γ-谷氨酰半胱氨酸合成酶抑制剂减少GSH, 有效地降低GSH对ROS的清除, 从而放大细胞内的氧化应激, 导致癌细胞死亡。除了Fe2+以外, 其他一些过渡金属离子如Mn2+、Co2+、Cu+和Cu2+, 同样能够表现出强芬顿反应活性[44, 45]。
2.3.2 GSH响应型GSH可以断裂二硫键、二硒键和琥珀酰亚胺-硫醚键[46]等化学键, 这种肿瘤附近的还原性差异可以作为设计GSH响应型纳米诊疗剂的原理之一。肿瘤对生物素的消耗远远大于正常组织, 多种维生素转运体常在很多癌细胞中过表达, 基于此, Guo等[47]开发了一种含二硫键及生物素的NIR探针P6。P6可以被癌细胞膜上的生物素受体识别而运输至细胞中, 在被GSH激活后释放荧光团4而发挥FLI诊断功能; 此外, 该探针的近红外特性使其成为一种潜在的PA显像剂。近期, Wang等[48]将超顺磁性氧化铁(superparamagnetic iron oxide, SPIO)和脱镁叶绿酸-顺磁性锰两种纳米粒同时包裹于由二硫键交联的胶束中, 制备出MRI造影剂DCM@P-Mn-SPIO。该微粒可被TME中的GSH分解, 导致SPIO与P-Mn分离而出现双信号。在结合特别开发的“双对比增强减影成像”技术后, 肿瘤与正常组织信号比显著提高至11.6, 由此, 该微粒能够较为灵敏地筛查肿瘤部位、检测微小的肿瘤病灶。
高浓度的GSH同样可以作为触发纳米材料治疗癌症的开关。Zhai等[49]制备的GSH响应型富含二硒键的聚合物(CPT/DOX-CCM), 可以在肿瘤处还原性环境中加速喜树碱(camptothecin, CPT)的释放。设计GSH清除策略可以增强治疗效果, Wang等[50]利用芬顿反应原理, 合成了以精氨酸(arginine, Arg)为表面配体的硅酸锰纳米泡AMSNs并负载DOX。该材料能够靶向TME并显著提高GSH的消耗效率, 从而抑制了GSH依赖型过氧化物酶4 (glutathione-dependent peroxidases 4, GPX-4)的活性, 诱导癌细胞铁死亡。另外, AMSNs在降解时可释放Mn2+及DOX, 使诱导细胞死亡与MRI、化疗结合, 进一步提高了治疗效果(图 4)。
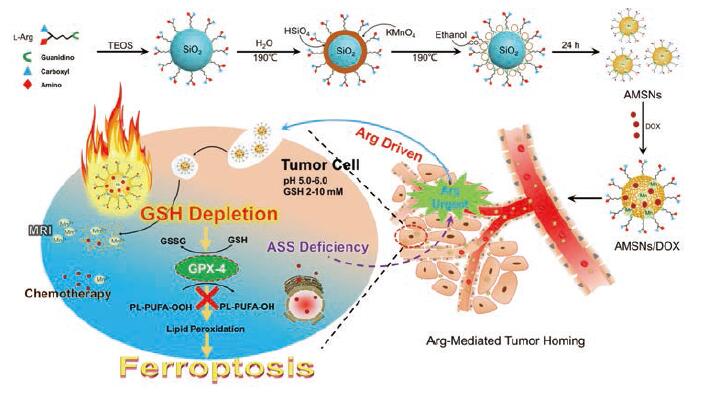
|
Figure 4 The GSH depletion and ferroptosis mechanism of AMSNs/DOX.TEOS: Tetraethyl orthosilicate; MRI: Magnetic resonance imaging; GSH: Glutathione; GSSG: Glutathione disulfide; ASS: Argininosuccinate synthetase; GPX-4:Glutathione-dependent peroxidases 4;Arg: Arginine; DOX: Doxorubicin.(Adapted from Ref.50 with permission.Copyright © 2018 American Chemical Society) |
与pH响应型纳米系统所存在的缺陷类似, 氧化还原响应型纳米制剂的灵敏性同样受不同部位的ROS或GSH浓度差异大小影响而受到一定的应用限制。
2.4 酶响应型由于酶本身的特性, 即能在温和的条件下催化反应, 且对底物能够表现出高选择性, 酶响应型的诊疗策略具有一定的优势[51]。在过去的几年里, 很多无机材料、凝胶和磷脂等常被用于此类纳米诊疗剂的制备中。
Cai等[52]根据MMPs能够降解凝胶的性质, 制备出能够通过荧光强度的变化而监测MMPs在癌细胞中活性的自荧光凝胶探针GelNPs。实际上, MMPs共有20多种膜型与溶解型的亚型, 其中MMP-2、MMP-7和MMP-9被认为与癌细胞的恶化和转移有关[51, 53, 54]。然而, MMPs家族的底物特异性相互重叠, 因此较难开发出针对特定亚型的探针。为解决此问题, Sun等[53]将荧光蛋白mCherry通过含有MMP-2酶解位点的肽段固定在NiFe2O4纳米粒上。根据空间位阻效应, 该探针特殊的结构使其荧光性质能够相对精准地被可溶型MMP-2激活, 而不易被锚定在肿瘤细胞膜上的MMP-14干扰, 因此具有较高的选择性。Wang等[22]合成了一种负载DOX及ICG的MMPs响应型水凝胶系统NDIMH, 实现实时监测、光疗和化疗的三位一体化。Ke等[55]将MMPs响应肽段引入嵌段共聚物制备出PEG-GPLGVRGDG-PDLLA (P1), 该系统进一步自组装成胶束纳米粒并负载紫杉醇(paclitaxel, PTX)。在肿瘤部位, 该共聚物中G与V之间的酰胺键能被MMP-2断裂, 形成PEG-GPLG和负载PTX的VRGDG-PDLLA, 后者中的肽段可加强细胞对药物的摄取, 由此提高化疗的疗效(图 5)。
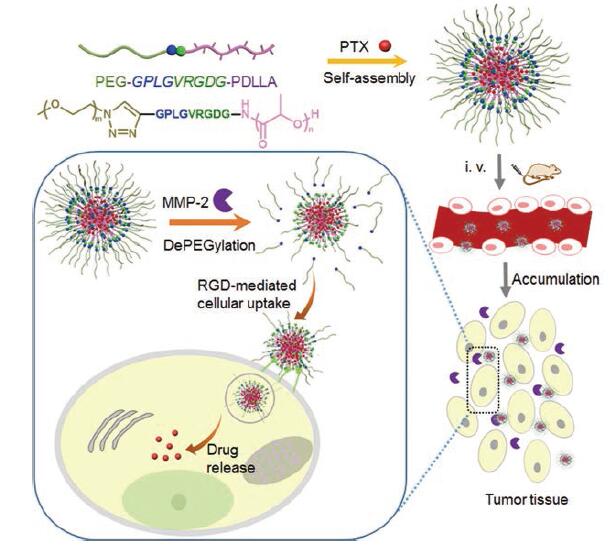
|
Figure 5 The preparation and working mechanism of PTX-loaded PEG-GPLGVRGDG-PDLLA.PTX: Paclitaxel; MMP-2:Matrix metalloproteinase-2.(Adapted from Ref.55 with permission.Copyright © 2017 American Chemical Society) |
除MMPs响应型外, 可以设计包含HA的纳米系统而实现由HAase激活的诊疗手段。Chen等[56]制备出包含HA及葡萄糖转运蛋白1 (glucose transporter 1, Glu1)抑制剂双氯芬酸(diclofenac, DC)的纳米金棒GNR/HA-DC。该材料通过靶向CD44高表达的肿瘤细胞而积聚在肿瘤处, 不仅利用纳米金优异的光热性能介导PTT, 并能够在HAase存在时释放出DC, 有效地诱导了肿瘤细胞细胞膜上Glu1的下调, 从而抑制了葡萄糖代谢和ATP依赖性热休克蛋白的合成, 使肿瘤对温度更加敏感, 以此提高了PTT的疗效。
然而, 酶响应型纳米诊疗剂易受环境(如温度、pH值)变化和TME内实际酶浓度等因素的影响。另外, 如果需要提高对不同亚型的选择性, 则应设计更加巧妙的响应方式。
2.5 双重及多重响应型除了对TME内单一的刺激响应以外, 为了提高疗效, GSH/酶型、GSH/pH型、GSH/H2O2型、pH/酶型和pH/H2O2型等多种双重响应型的纳米系统被大量开发。Guo等[25]合成了含CTSB酶解位点的甲基丙烯酰胺类共聚物, 并通过二硫键将小分子Gd螯合物(Gd-DOTA)连接到该共聚物上, 形成GSH/酶响应型探针pDHPMA-Cy5.5-SS-DOTA-Gd。相对于临床对比显像剂DTPA-Gd而言, 该探针MR信号更强, 对比更明显。并且, 由于在TME中能裂解成较小的分子, 该探针在一定的时间内维持稳定FL的同时, 又能有效地避免Gd在体内的大量残留, 以此提高了诊断的多功能性与安全性。Peng等[57]通过以共价连接SPIO纳米粒和含有二硫键的海藻酸衍生物, 制备出具有磁性和GSH/pH双重响应性的纳米凝胶SPIONAlgSS并同时封装DOX, 可实现同步MRI及有效化疗。
Lang等[58]合成了含MMP-9酶解位点的pH敏感型胶束pDM, 负载多西他赛(docetaxel, DTX)而形成pH/酶双敏感型给药系统。基于癌细胞过表达P-糖蛋白(P-glycoprotein, P-gp)是MDR的主要因素之一, Dong等[24]以HA和聚乙烯亚胺(polyethylenimine, PEI)为辅助材料合成出负载DOX的pH/酶响应型纳米薄片载体DOX@MoS2-PEI-HA。该薄片可以靶向CD44, 被TME中的HAase降解而加速DOX的释放, 并且, 肿瘤处微酸环境及NIR光照射能提高其释药量、介导PTT并抑制P-gp的表达, 从而逆转了耐药作用; 在标记64Cu后, MoS2能够被应用于PET中, 实现了诊疗一体化。Han等[59]设计出两步序贯给药策略治疗胰腺导管腺癌, 即首先通过二甲双胍(metformin, MET)激活腺苷单磷酸活化激酶通路, 产生破坏肿瘤基质的效果, 以此增强能够响应TME中低pH值及高表达的CTSB的纳米系统GEM-MNP-pHLIP的渗透, 释放吉西他滨(gemcitabine, GEM), 提高化疗疗效; 同时, 载体Fe3O4能够用于MRI而监测药物靶向行为, 实现监测与治疗一体化(图 6)。
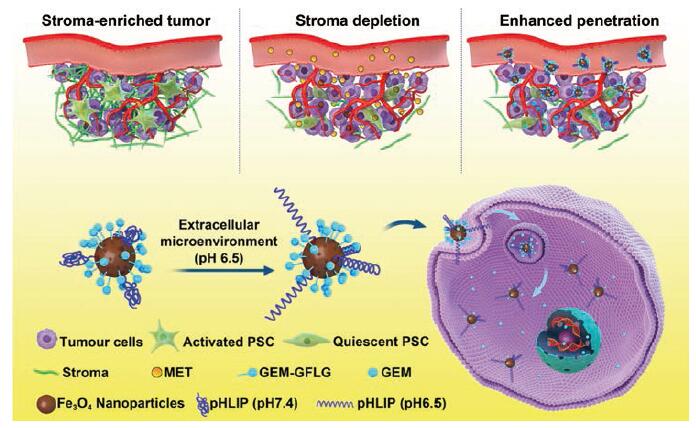
|
Figure 6 MET-introduced tumor stroma depletion and the working mechanism of pH/enzyme-responsive GEM-MNP-pHLIP.PSC: Pancreatic stellate cells; MET: Metformin; GEM: Gemcitabine.(Adapted from Ref.59 with permission.Copyright © 2020 American Chemical Society) |
根据芬顿反应原理, Lin等[60]研究出一种CDT纳米制剂MS@MnO2 NPs, 具有类似芬顿反应的特性, 当癌细胞摄取该纳米粒时, MnO2外壳与GSH发生氧化还原反应, 生成的Mn2+在HCO3-存在时可以与H2O2反应生成·OH而实现CDT。另外, MnO2的GSH激活性MRI对比效应使该系统实现监测与GSH发生氧化还原反应、药物释放及CDT的过程。最近, Sang等[45]制备出具有类超氧化物歧化酶活性的纳米酶PZIF67-AT。该酶一方面可将O2·-转化为H2O2; 另一方面可抑制CAT的活性, 实现H2O2在细胞内积累, 进而消耗微环境中大量的GSH, 以此抑制肿瘤生长, 为CDT提供了新的思路。Yao等[61]合成出pH/H2O2敏感型纳米系统CeUCNPs。该材料在低pH值刺激下释放DOX, 同时裂解H2O2, 形成O2以缓解乏氧环境, 还可以在NIR辐照下利用其包含的Yb3+和Tm3+将H2O和O2转化为·O2-及·OH, 以此结合化疗与PDT。
近年来, 多重响应型的纳米诊疗剂也被设计并用于TME的精准诊疗。Fu等[62]制备出GSH/pH/H2O2响应型多功能纳米系统HA-MnO2 NPs, 对MRI检测大鼠颅内胶质瘤具有高敏感性, 并能有效缓解瘤内缺氧。Liu等[63]将MnO2与牛血清白蛋白(bovine serum albumin, BSA)包裹于Hf与DDP前药组装成的纳米配位聚合物中, 制备出GSH/pH/H2O2多重响应的BM@NCP(DSP)-PEG。该系统能够在还原性环境中释放顺铂, 实现化疗; Hf可以增强放疗效果; MnO2能够与内源性H2O2反应, 生成O2, 改善肿瘤内的低氧环境, 防止肿瘤对化疗产生抗性。在酸性TME中, 裂解的Mn2+可以进一步增强体内MRI。该研究通过不同的TME响应机制加强了对癌症的疗效, 具有癌症协同治疗的应用前景(图 7)。Qi等[64]以半胱氨酸修饰的凝胶包裹DOX, 以Fe3O4为MR造影剂, 形成的纳米组装体在肿瘤酸性、高GSH和高MMPs的微环境中可长期释放DOX并同时实现MRI。
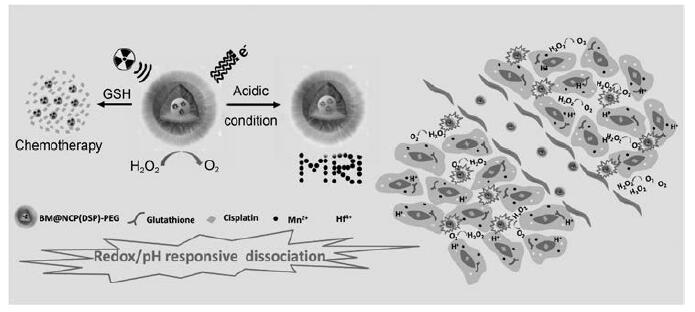
|
Figure 7 Synthesis and GSH/pH/H2O2-responsive behavior of BM@NCP(DSP)-PEG.(Adapted from Ref.63 with permission.Copyright © 2017 Wiley) |
目前, 已有越来越多的双重和多重响应型多功能智能纳米制剂被合成, 并逐渐成为TME响应型的纳米诊疗剂的研究及发展趋势。然而, 复杂的纳米系统所面临的问题不仅包括单一响应型存在的问题, 还需要考虑不同成分间可能存在的相互作用及整体的稳定性等因素。
3 总结与展望TME响应型纳米系统巧妙地利用肿瘤组织中的异常特征, 实现靶向运输、诊疗一体化、提高放疗化疗疗效和多重疗法结合等目标。本文总结了目前常见的乏氧、pH值、氧化还原和酶4种单一响应类型, 以及部分双重及多重类型的TME响应型纳米诊疗剂。这些纳米系统的制备已经成为癌症选择性治疗领域的热门方向之一。
然而, TME响应型的纳米制剂也存在一定的缺陷, 包括一些纳米材料固有的不足, 如生物降解和安全性问题, 与体内其他系统的作用机制不够清晰, 临床转化方面(生产、评估)存在限制等。另外, 在一些复杂的纳米系统, 不同成分之间的相互影响也将成为最重要的难题之一。因此, 设计制备过程简单、组分少、具有多重响应能力及多重诊疗功能, 且安全性较高的纳米粒是一个前景良好的领域。并且, 这些诊疗剂未来可能结合更多的受体、外部刺激如光、电、磁、声以及免疫、基因治疗等而发展更加精准、智能的诊断方法。最后, 需要制定可控、可放大的合成生产方案及系统的筛选和评估方案, 早日实现智能纳米诊疗剂的临床应用。
作者贡献: 杨雨琦和程亮完成本综述的提纲、撰写和修改; 巩飞和柏上对本综述提出修改建议。
利益冲突: 所有作者声明无利益冲突。
| [1] |
Gong F, Yang NL, Wang XW, et al. Tumor microenvironmentresponsive intelligent nanoplatforms for cancer theranostics[J]. Nano Today, 2020, 32: 100851. DOI:10.1016/j.nantod.2020.100851 |
| [2] |
Liu JJ, Chen Q, Feng LZ, et al. Nanomedicine for tumor microenvironment modulation and cancer treatment enhancement[J]. Nano Today, 2018, 21: 55-73. DOI:10.1016/j.nantod.2018.06.008 |
| [3] |
Shi JJ, Kantoff PW, Wooster R, et al. Cancer nanomedicine: progress, challenges and opportunities[J]. Nat Rev Cancer, 2017, 17: 20-37. DOI:10.1038/nrc.2016.108 |
| [4] |
Hou B, Wang DG, Gao J, et al. Advances of microenvironmentactivated nanosized drug delivery system for cancer immunotherapy[J]. Acta Pharm Sin(药学学报), 2019, 54: 1802-1809. |
| [5] |
Wang DD, Liu R, Wang Y, et al. In vitro targeting efficiency evaluation of reduction-responsive co-loaded doxorubicin/siRNA nanoparticles[J]. Acta Pharm Sin(药学学报), 2018, 53: 2104-2112. |
| [6] |
Li C, Xia JS, Wei XB, et al. pH-Activated near-infrared fluorescence nanoprobe imaging tumors by sensing the acidic microenvironment[J]. Adv Funct Mater, 2010, 20: 2222-2230. DOI:10.1002/adfm.201000038 |
| [7] |
Quail DF, Joyce JA. Microenvironmental regulation of tumor progression and metastasis[J]. Nat Med, 2013, 19: 1423-1437. DOI:10.1038/nm.3394 |
| [8] |
Najafi M, Goradel NH, Farhood B, et al. Tumor microenvironment: interactions and therapy[J]. J Cell Physiol, 2019, 234: 5700-5721. DOI:10.1002/jcp.27425 |
| [9] |
Xiang W, Shi RC, Kang X, et al. Monoacylglycerol lipase regulates cannabinoid receptor 2-dependent macrophage activation and cancer progression[J]. Nat Commun, 2018, 9: 2574. DOI:10.1038/s41467-018-04999-8 |
| [10] |
Casazza A, Di Conza G, Wenes M, et al. Tumor stroma: a complexity dictated by the hypoxic tumor microenvironment[J]. Oncogene, 2014, 33: 1743-1754. DOI:10.1038/onc.2013.121 |
| [11] |
Harris AL. Hypoxia—a key regulatory factor in tumour growth[J]. Nat Rev Cancer, 2002, 2: 38-47. DOI:10.1038/nrc704 |
| [12] |
Vaupel P, Harrison L. Tumor hypoxia: causative factors, compensatory mechanisms, and cellular response[J]. Oncologist, 2004, 9(suppl 5): 4-9. |
| [13] |
Brown JM, Wilson WR. Exploiting tumour hypoxia in cancer treatment[J]. Nat Rev Cancer, 2004, 4: 437-447. DOI:10.1038/nrc1367 |
| [14] |
Warburg O, Wind F, Negelein E. The metabolism of tumors in the body[J]. J Gen Physiol, 1927, 8: 519-530. DOI:10.1085/jgp.8.6.519 |
| [15] |
Wojtkowiak JW, Verduzco D, Schramm KJ, et al. Drug resistance and cellular adaptation to tumor acidic pH microenvironment[J]. Mol Pharm, 2011, 8: 2032-2038. DOI:10.1021/mp200292c |
| [16] |
Chen Q, Liu XD, Chen JW, et al. A self-assembled albuminbased nanoprobe for in vivo ratiometric photoacoustic pH imaging[J]. Adv Mater, 2015, 27: 6820-6827. DOI:10.1002/adma.201503194 |
| [17] |
Gupta SC, Hevia D, Patchva S, et al. Upsides and downsides of reactive oxygen species for cancer: the roles of reactive oxygen species in tumorigenesis, prevention, and therapy[J]. Antioxid Redox Signal, 2012, 16: 1295-1322. DOI:10.1089/ars.2011.4414 |
| [18] |
Pelicano H, Carney D, Huang P. ROS stress in cancer cells and therapeutic implications[J]. Drug Resist Updat, 2004, 7: 97-110. DOI:10.1016/j.drup.2004.01.004 |
| [19] |
Liu J, Liang JJ, Wu CL, et al. A doubly-quenched fluorescent probe for low-background detection of mitochondrial H2O2[J]. Anal Chem, 2019, 91: 6902-6909. |
| [20] |
Meng FH, Hennink WE, Zhong ZY. Reduction-sensitive polymers and bioconjugates for biomedical applications[J]. Biomaterials, 2009, 30: 2180-2198. DOI:10.1016/j.biomaterials.2009.01.026 |
| [21] |
Qiao YT, Wan JQ, Zhou LQ, et al. Stimuli-responsive nanotherapeutics for precision drug delivery and cancer therapy[J]. Wiley Interdiscip Rev Nanomed Nanobiotechnol, 2019, 11: e1527. DOI:10.1002/wnan.1527 |
| [22] |
Wang HH, Fu ZG, Li W, et al. The synthesis and application of nano doxorubicin-indocyanine green matrix metalloproteinaseresponsive hydrogel in chemophototherapy for head and neck squamous cell carcinoma[J]. Int J Nanomedicine, 2019, 14: 623-638. DOI:10.2147/IJN.S191069 |
| [23] |
Gondi CS, Rao JS. Cathepsin B as a cancer target[J]. Expert Opin Ther Targets, 2013, 17: 281-291. DOI:10.1517/14728222.2013.740461 |
| [24] |
Dong XH, Yin WY, Zhang X, et al. Intelligent MoS2 nanotheranostic for targeted and enzyme-/pH-/NIR-responsive drug delivery to overcome cancer chemotherapy resistance guided by PET imaging[J]. ACS Appl Mater Interfaces, 2018, 10: 4271-4284. DOI:10.1021/acsami.7b17506 |
| [25] |
Guo SW, Xiao XY, Wang XM, et al. Reductive microenvironment responsive gadolinium-based polymers as potential safe MRI contrast agents[J]. Biomater Sci, 2019, 7: 1919-1932. DOI:10.1039/C8BM01103F |
| [26] |
Huang J, Wu YL, Zeng F, et al. An activatable near-infrared chromophore for multispectral optoacoustic imaging of tumor hypoxia and for tumor inhibition[J]. Theranostics, 2019, 9: 7313-7324. DOI:10.7150/thno.36755 |
| [27] |
Liu JN, Bu WB, Shi JL. Chemical design and synthesis of functionalized probes for imaging and treating tumor hypoxia[J]. Chem Rev, 2017, 117: 6160-6224. DOI:10.1021/acs.chemrev.6b00525 |
| [28] |
Komatsu H, Yoshihara K, Yamada H, et al. Ruthenium complexes with hydrophobic ligands that are key factors for the optical imaging of physiological hypoxia[J]. Chemistry, 2013, 19: 1971-1977. DOI:10.1002/chem.201202809 |
| [29] |
Yu Q, Huang TC, Li YP, et al. Rational design of a luminescent nanoprobe for hypoxia imaging in vivo via ratiometric and photoluminescence lifetime imaging microscopy[J]. Chem Commun, 2017, 53: 4144-4147. DOI:10.1039/C7CC00668C |
| [30] |
Zhang SJ, Hosaka M, Yoshihara T, et al. Phosphorescent lightemitting iridium complexes serve as a hypoxia-sensing probe for tumor imaging in living animals[J]. Cancer Res, 2010, 70: 4490-4498. DOI:10.1158/0008-5472.CAN-09-3948 |
| [31] |
Knox HJ, Hedhli J, Kim TW, et al. A bioreducible N-oxide-based probe for photoacoustic imaging of hypoxia[J]. Nat Commun, 2017, 8: 1794. DOI:10.1038/s41467-017-01951-0 |
| [32] |
Shin U, Kim J, Lee J, et al. Development of 64Cu-loaded perfluoropentane nanodroplet: a potential tumor theragnostic nanocarrier and dual-modality PET-ultrasound imaging agents[J]. Ultrasound Med Biol, 2020, 46: 2775-2784. DOI:10.1016/j.ultrasmedbio.2020.05.019 |
| [33] |
Yang GB, Phua SZF, Lim WQ, et al. A hypoxia-responsive albumin-based nanosystem for deep tumor penetration and excellent therapeutic efficacy[J]. Adv Mater, 2019, 31: e1901513. DOI:10.1002/adma.201901513 |
| [34] |
Wang YZ, Xie Y, Li J, et al. Tumor-penetrating nanoparticles for enhanced anticancer activity of combined photodynamic and hypoxia-activated therapy[J]. ACS Nano, 2017, 11: 2227-2238. DOI:10.1021/acsnano.6b08731 |
| [35] |
Thambi T, Deepagan VG, Yoon HY, et al. Hypoxia-responsive polymeric nanoparticles for tumor-targeted drug delivery[J]. Biomaterials, 2014, 35: 1735-1743. DOI:10.1016/j.biomaterials.2013.11.022 |
| [36] |
Sreeja S, Krishnan Nair CK. Tumor control by hypoxia-specific chemotargeting of iron-oxide nanoparticle-Berberine complexes in a mouse model[J]. Life Sci, 2018, 195: 71-80. DOI:10.1016/j.lfs.2017.12.036 |
| [37] |
Gurav DD, Kulkarni AS, Khan A, et al. pH-Responsive targeted and controlled doxorubicin delivery using hyaluronic acid nanocarriers[J]. Colloids Surf B Biointerfaces, 2016, 143: 352-358. DOI:10.1016/j.colsurfb.2016.03.049 |
| [38] |
Liang YP, Zhao X, Ma PX, et al. pH-Responsive injectable hydrogels with mucosal adhesiveness based on chitosan-grafteddihydrocaffeic acid and oxidized pullulan for localized drug delivery[J]. J Colloid Interface Sci, 2019, 536: 224-234. DOI:10.1016/j.jcis.2018.10.056 |
| [39] |
Huang X, Yuan YP, Ruan WW, et al. pH-Responsive theranostic nanocomposites as synergistically enhancing positive and negative magnetic resonance imaging contrast agents[J]. J Nanobiotechnol, 2018, 16: 30. DOI:10.1186/s12951-018-0350-5 |
| [40] |
Dong ZL, Feng LZ, Zhu WW, et al. CaCO3 nanoparticles as an ultra-sensitive tumor-pH-responsive nanoplatform enabling realtime drug release monitoring and cancer combination therapy[J]. Biomaterials, 2016, 110: 60-70. DOI:10.1016/j.biomaterials.2016.09.025 |
| [41] |
Chen Q, Liang C, Sun XQ, et al. H2O2-responsive liposomal nanoprobe for photoacoustic inflammation imaging and tumor theranostics via in vivo chromogenic assay[J]. Proc Natl Acad Sci U S A, 2017, 114: 5343-5348. DOI:10.1073/pnas.1701976114 |
| [42] |
Zhang R, Song XJ, Liang C, et al. Catalase-loaded cisplatinprodrug-constructed liposomes to overcome tumor hypoxia for enhanced chemo-radiotherapy of cancer[J]. Biomaterials, 2017, 138: 13-21. DOI:10.1016/j.biomaterials.2017.05.025 |
| [43] |
Dong ZL, Feng LZ, Chao Y, et al. Amplification of tumor oxidative stresses with liposomal fenton catalyst and glutathione inhibitor for enhanced cancer chemotherapy and radiotherapy[J]. Nano Lett, 2019, 19: 805-815. DOI:10.1021/acs.nanolett.8b03905 |
| [44] |
Ranji-Burachaloo H, Gurr PA, Dunstan DE, et al. Cancer treatment through nanoparticle-facilitated fenton reaction[J]. ACS Nano, 2018, 12: 11819-11837. DOI:10.1021/acsnano.8b07635 |
| [45] |
Sang YJ, Cao FF, Li W, et al. Bioinspired construction of a nanozyme-based H2O2 homeostasis disruptor for intensive chemodynamic therapy[J]. J Am Chem Soc, 2020, 142: 5177-5183. DOI:10.1021/jacs.9b12873 |
| [46] |
Baldwin AD, Kiick KL. Reversible maleimide-thiol adducts yield glutathione-sensitive poly(ethylene glycol)-heparin hydrogels[J]. Polym Chem, 2013, 4: 133-143. DOI:10.1039/C2PY20576A |
| [47] |
Guo RY, Huang F, Zhang B, et al. GSH activated biotin-tagged near-infrared probe for efficient cancer imaging[J]. Theranostics, 2019, 9: 3515-3525. DOI:10.7150/thno.32742 |
| [48] |
Wang ZL, Xue XD, Lu HW, et al. Two-way magnetic resonance tuning and enhanced subtraction imaging for non-invasive and quantitative biological imaging[J]. Nat Nanotechnol, 2020, 15: 482-490. DOI:10.1038/s41565-020-0678-5 |
| [49] |
Zhai SD, Hu XL, Hu YJ, et al. Visible light-induced crosslinking and physiological stabilization of diselenide-rich nanoparticles for redox-responsive drug release and combination chemotherapy[J]. Biomaterials, 2017, 121: 41-54. DOI:10.1016/j.biomaterials.2017.01.002 |
| [50] |
Wang SF, Li FY, Qiao RR, et al. Arginine-rich manganese silicate nanobubbles as a ferroptosis-inducing agent for tumor-targeted theranostics[J]. ACS Nano, 2018, 12: 12380-12392. DOI:10.1021/acsnano.8b06399 |
| [51] |
Hu QY, Katti PS, Gu Z. Enzyme-responsive nanomaterials for controlled drug delivery[J]. Nanoscale, 2014, 6: 12273-12286. DOI:10.1039/C4NR04249B |
| [52] |
Cai B, Rao L, Ji XH, et al. Autofluorescent gelatin nanoparticles as imaging probes to monitor matrix metalloproteinase metabolism of cancer cells[J]. J Biomed Mater Res A, 2016, 104: 2854-2860. DOI:10.1002/jbm.a.35823 |
| [53] |
Sun L, Xie SP, Ji XR, et al. MMP-2-responsive fluorescent nanoprobes for enhanced selectivity of tumor cell uptake and imaging[J]. Biomater Sci, 2018, 6: 2619-2626. DOI:10.1039/C8BM00593A |
| [54] |
Yao Q, Kou LF, Tu Y, et al. MMP-responsive 'smart' drug delivery and tumor targeting[J]. Trends Pharmacol Sci, 2018, 39: 766-781. DOI:10.1016/j.tips.2018.06.003 |
| [55] |
Ke WD, Zha ZS, Mukerabigwi JF, et al. Matrix metalloproteinaseresponsive multifunctional peptide-linked amphiphilic block copolymers for intelligent systemic anticancer drug delivery[J]. Bioconjug Chem, 2017, 28: 2190-2198. DOI:10.1021/acs.bioconjchem.7b00330 |
| [56] |
Chen WH, Luo GF, Lei Q, et al. Overcoming the heat endurance of tumor cells by interfering with the anaerobic glycolysis metabolism for improved photothermal therapy[J]. ACS Nano, 2017, 11: 1419-1431. DOI:10.1021/acsnano.6b06658 |
| [57] |
Peng N, Ding X, Wang ZY, et al. Novel dual responsive alginatebased magnetic nanogels for onco-theranostics[J]. Carbohydr Polym, 2019, 204: 32-41. DOI:10.1016/j.carbpol.2018.09.084 |
| [58] |
Lang TQ, Dong XY, Zheng Z, et al. Tumor microenvironmentresponsive docetaxel-loaded micelle combats metastatic breast cancer[J]. Sci Bull, 2019, 64: 91-100. DOI:10.1016/j.scib.2018.12.025 |
| [59] |
Han HJ, Hou Y, Chen XH, et al. Metformin-induced stromal depletion to enhance the penetration of gemcitabine-loaded magnetic nanoparticles for pancreatic cancer targeted therapy[J]. J Am Chem Soc, 2020, 142: 4944-4954. DOI:10.1021/jacs.0c00650 |
| [60] |
Lin LS, Song JB, Song L, et al. Simultaneous fenton-like ion delivery and glutathione depletion by MnO2-based nanoagent to enhance chemodynamic therapy[J]. Angew Chem Int Ed Engl, 2018, 57: 4902-4906. DOI:10.1002/anie.201712027 |
| [61] |
Yao C, Wang WX, Wang PY, et al. Near-infrared upconversion mesoporous cerium oxide hollow biophotocatalyst for concurrent pH-/H2O2-responsive O2-evolving synergetic cancer therapy[J]. Adv Mater, 2018, 30: 1704833. DOI:10.1002/adma.201704833 |
| [62] |
Fu CP, Duan XH, Cao MH, et al. Targeted magnetic resonance imaging and modulation of hypoxia with multifunctional hyaluronic acid-MnO2 nanoparticles in glioma[J]. Adv Healthc Mater, 2019, 8: e1900047. DOI:10.1002/adhm.201900047 |
| [63] |
Liu JJ, Chen Q, Zhu WW, et al. Nanoscale-coordination-polymershelled manganese dioxide composite nanoparticles: a multistage redox/pH/H2O2-responsive cancer theranostic nanoplatform[J]. Adv Funct Mater, 2017, 27: 1605926. DOI:10.1002/adfm.201605926 |
| [64] |
Qi AH, Deng L, Liu X, et al. Gelatin-encapsulated magnetic nanoparticles for pH, redox, and enzyme multiple stimuli-responsive drug delivery and magnetic resonance imaging[J]. J Biomed Nanotechnol, 2017, 13: 1386-1397. DOI:10.1166/jbn.2017.2433 |
 2021, Vol. 56
2021, Vol. 56


