2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
天然产物是抗肿瘤药物的重要来源, 目前使用的抗肿瘤药物中约有50%直接或间接来源于天然产物, 包括生物碱、多糖、多酚、二萜和不饱和脂肪酸等多种化合物类型[1]。新结构天然产物的不断发现为新结构和新作用机制的抗肿瘤药物提供了物质基础。按照药物的作用靶点不同, 抗肿瘤天然产物可分为靶点特异性和多靶点药物。由于肿瘤的发生通常与多个信号通路异常有关, 因此多靶点抗肿瘤药物具有独特潜力。多靶点药物与单靶点药物相比, 可能具有更加广泛的抗肿瘤活性并可克服对单一靶点抑制导致的对药物的耐受。然而, 目前对多靶点天然产物的主要作用靶标和作用机制往往不够明确, 限制了基于靶标相互作用的结构优化和进一步研发。近年来, 基于多重组学的整合研究, 多靶点天然产物的靶点确证和修饰改造取得了长足的进展, 为该类药物的进一步研发提供了基础。本文总结了多个典型的多靶点抗肿瘤天然产物, 如丹参酮、姜黄素、白藜芦醇、青蒿素和三氧化二砷(arsenic trioxide, ATO) 等的研究进展, 包括抑制肿瘤细胞增殖、诱导自噬和凋亡、减轻肿瘤耐药、抑制肿瘤的迁移和侵袭、抑制肿瘤血管生成等方面的作用机制, 通过应用网络药理学、亲和色谱法、质谱法和小分子探针等新技术新方法确定作用靶标, 以及为克服这些天然产物的低生物利用度、水溶性差和结构不稳定等问题进行结构优化的探索, 以期为多靶点抗肿瘤天然产物的研究和开发提供线索。
1 丹参酮及其衍生物丹参(Salvia miltiorrhiza Bunge) 是唇形科植物丹参的干燥根和根茎, 在四川、山东和河南等地普遍栽植。丹参是我国常用的一种传统天然药物, 具有活血祛瘀的药效, 具有较为悠久的入药历史。
丹参的成分主要包括脂溶性成分和水溶性成分, 其中脂溶性成分主要为丹参酮型的二萜类化合物, 水溶性成分主要为聚酚酸类化合物[2]。从丹参中提取的丹参酮可分为丹参酮I、丹参酮ⅡA、丹参酮ⅡB、隐丹参酮和异隐丹参酮等10余个丹参酮单体, 其中活性较强、含量较高的是丹参酮IIA和隐丹参酮。总丹参酮具有抗菌、消炎和活血化淤等作用[2]。图 1为4种丹参酮的结构式, 它们的菲醌结构是丹参酮发挥细胞毒作用的基础, 菲醌结构与DNA分子相结合, 呋喃环和醌类结构可以产生自由基并引起DNA损伤, 抑制肿瘤细胞DNA合成。
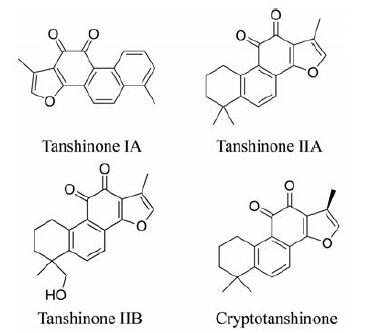
|
图 1 Structures of tanshinone derivatives |
丹参酮是一类多靶点抗肿瘤天然药物, 丹参酮对肿瘤细胞具有细胞毒作用, 能够诱导肿瘤细胞发生周期阻滞和凋亡, 并且抑制肿瘤细胞侵袭和转移, 其作用机制包括抑制癌细胞DNA合成, 影响与肿瘤细胞增殖、分化、凋亡和侵袭相关的众多基因表达, 也能改变肿瘤细胞表面抗原表达等。本文主要介绍丹参提取物中活性较强、含量较高的丹参酮IIA和隐丹参酮的抗肿瘤作用机制。
1.1.1 丹参酮诱导肿瘤细胞发生周期阻滞丹参酮类化合物通过改变肿瘤细胞的周期分布从而抑制肿瘤细胞增殖。丹参酮IIA能通过调控细胞周期相关蛋白表达, 使细胞发生G1期或S期阻滞, 从而抑制细胞增殖。例如丹参酮IIA能诱导肝癌细胞HepG2发生G1期阻滞, 主要是通过诱导TP53和p21基因的转录。TP53是人体重要的抑癌基因, 可以阻止肿瘤细胞增殖并诱导肿瘤细胞凋亡。蛋白p21充当G1和S期细胞周期进程的调节剂, p21的表达受p53控制, 并参与p53依赖的G1细胞周期阻滞[3]。另外还有重要的细胞增殖相关通路如磷脂酰肌醇激酶(phosphatidylinositol 3-kinase, PI3K) 和核因子-κB (nuclear factor κB, NF-κB) 通路也可以被丹参酮类化合物抑制, 不同结构的丹参酮类化合物能靶向多通路来抑制肿瘤细胞增殖。
1.1.2 丹参酮诱导肿瘤细胞发生凋亡研究发现丹参酮能够诱导肿瘤细胞发生凋亡[4]。隐丹参酮能快速抑制DU145前列腺癌细胞中的信号转导和转录激活因子3 (signal transducer and activator of transcription 3, STAT3) 的Tyr705磷酸化。STAT3在大多数人类实体瘤中均组成性激活, 并参与癌细胞的增殖和血管生成。抑制STAT3 Tyr705磷酸化能降低下游靶基因cyclin D1的表达并使细胞周期发生G1期阻滞, 同时抑制抗凋亡基因survivin和Bcl-xL的表达, 从而诱导细胞凋亡。隐丹参酮对STAT3的抑制不依赖于上游蛋白JAK2 (Janus-activated kinase 2), 能够直接与STAT3的SH2 (Src homology 2) 结构域结合, 从而抑制STAT3二聚体的生成[4]。此外, 丹参酮IIA促进凋亡相关蛋白caspase-3、caspase-8和caspase-9的表达, 下调蛋白激酶B (protein kinase B, AKT) 以及c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK) 的表达, 从而诱导卵巢癌细胞凋亡[5]。
1.1.3 丹参酮对肿瘤细胞迁移的影响丹参酮IIA作用于具有高转移能力的人肺巨细胞癌细胞PGCL3, 促进其CD9的表达上调, 从而抑制肿瘤细胞的运动和黏附过程。丹参酮IIA还能下调CD63和CD42a+的表达, 通过改变肿瘤细胞表面抗原的表达抑制肿瘤细胞的侵袭和迁移[6]。隐丹参酮还可通过下调巨噬细胞的浸润抑制肿瘤细胞的转移。隐丹参酮通过抑制PI3K的激活并下调其下游AKT和细胞外信号调节激酶1/2 (extracellular signal-regulated kinase 1/2, ERK1/2) 的磷酸化而限制巨噬细胞浸润[7]。隐丹参酮能显著抑制RAW264.7细胞向补体蛋白C5a的趋化迁移和巨噬细胞炎症蛋白1α (macrophage inflammatory protein 1α, MIP-1α) 诱导的迁移。
综上所述, 丹参酮类化合物主要作用于NF-κB、PI3K、caspase-3和JNK信号通路来发挥增殖抑制、诱导凋亡和抑制迁移等抗肿瘤作用。
1.2 丹参酮作用靶点的发现和确证网络药理学是结合了系统生物学和网络分析的综合学科, 为阐明药物-靶标的相互作用提供了强大工具。Cytoscape是一种开源软件, 可以与蛋白质-蛋白质、蛋白质-DNA、激酶-底物和遗传相互作用的大型数据库联用, 以及药物与靶分子之间的功能关系结合使用。通过Cytoscape使用安捷伦文献搜索(ALS) 和STITCH (化学物质相互作用的搜索工具) 方法构建了丹参酮IIA的两个药物靶标网络[8]。对ALS构建的网络的分析显示, 目标网络具有5个最高节点(蛋白质靶标), 分别对应于Fos、Jun、Src、PI3Kα和MAP2K1 (mitogen-activated protein kinase kinase 1)。STITCH构建的网络则显示了3个最高节点, 分别对应于细胞色素P450 3A4、细胞色素P450 A1和NF-κB[8]。尽管网络药理数据挖掘可能会导致假阳性靶点, 但这是一个简单迅速和可视的方式来寻找丹参酮IIA的分子机制和信号传导途径。另外, 通过逆向药效团的筛选平台PharmMapper以及PDTD、DrugBank和TTD药物靶标数据库, 研究人员评估预测了隐丹参酮的抗癌靶点。通过KEGG通路数据库进行了候选作用靶点的通路分析, 预测了潜在的药理活性和隐丹参酮作用的通路, 并在细胞水平验证了某些靶标。研究发现了8个具有抗癌潜力的靶标: MAP2K1、RARα (retinoic acid receptor α)、RXRα (retinoid X receptor α)、PDK1 (pyruvate dehydrogenase kinase, isozyme 1)、CHK1 (checkpoint kinase 1)、AR (androgen receptor)、Ang-1R (angiotensin Ⅱ type1 receptor) 和Kif11 (kinesin family member 11)。这些靶标主要与细胞周期、血管生成、细胞凋亡和雄激素受体有关[9]。
1.3 丹参酮IIA的结构优化由于丹参酮类药物具有水溶性差和生物利用度低等限制, 研究人员对其进行了结构优化以期改善相关药物性质。以丹参酮IIA为母体结构, 引入咪唑环, 得到一系列丹参酮IIA-咪唑衍生物。共轭芳香环数量的增加有效提高了丹参酮IIA分子的抗肿瘤活性, 其中末端苯环对位给电子取代基的化合物TA12显著抑制三阴性乳腺癌细胞的侵袭转移。此外, TA12能激活活性氧(reactive oxygen species, ROS) 的释放并调控PTEN (phosphatase and tensin homolog)/AKT信号通路, 从而抑制乳腺癌细胞的增殖与转移[10]。该研究表明基于丹参酮IIA的咪唑衍生物可作为抗肿瘤转移先导化合物, 为丹参酮IIA的结构修饰提供了新的思路。
丹参酮IIA磺酸钠(sodium tanshinone IIA sulfonate, STS, 图 2) 是丹参酮IIA的水溶性衍生物, 通过在丹参酮IIA的C-16位磺化而得到, 其水溶性大大高于丹参酮IIA, 它同样具有抗氧化、抗炎和保护心血管等药理活性。STS注射剂在国内已上市用于治疗冠心病、心绞痛和心肌梗塞, 但是STS的抗肿瘤活性不如丹参酮IIA和隐丹参酮显著[11]。
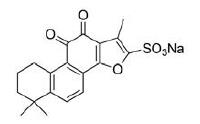
|
图 2 Structure of sodium tanshinone IIA sulfonate |
姜黄素(curcumin) 是从姜科植物根茎中提取出来的二酮化合物, 是一种广泛应用的食品添加剂。近年来有关姜黄素药理作用的研究取得了显著进展, 已发现其具有抗炎、抗氧化、抗病毒、抗感染、抗肿瘤、抗肝纤维化和抗动脉粥样硬化等广泛的药理活性。
姜黄素为橙黄色结晶粉末, 其结构式如图 3所示, 主链为不饱和脂族及芳香族基团, 含有酮键, 其抗肿瘤和抗血管生成能力一定程度上与其抗氧化活性相关。它被广泛用于治疗多种肿瘤, 包括肺癌、子宫颈癌、前列腺癌、乳腺癌、骨癌和肝癌。然而由于其水溶性差、生物利用度低以及半衰期短, 其有效性受到限制[12]。为了解决这些问题, 科研人员聚焦于姜黄素的新剂型的开发和结构修饰改造。
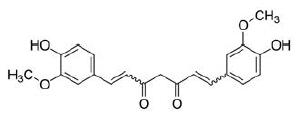
|
图 3 Structure of curcumin |
姜黄素具有抑制细胞增殖, 调控细胞自噬和促进细胞凋亡, 以及逆转肿瘤细胞多药耐药等抗肿瘤作用。
2.1.1 姜黄素抑制肿瘤细胞的增殖研究发现姜黄素可通过抑制细胞周期素依赖性激酶1 (cyclin-dependent kinase 1, CDK1) 的表达抑制AKT、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR) 和P70S6K1蛋白的激活。CDK1是丝氨酸/苏氨酸类蛋白激酶, 在G2/M期对细胞周期的进程起关键控制作用, 它是所有真核细胞细胞分裂的必要条件。姜黄素作用于人黑色素瘤A375和C8161细胞导致细胞阻滞于G2/M期, 抑制细胞增殖[13]。
2.1.2 姜黄素诱导肿瘤细胞自噬PI3K/AKT/mTOR是调控细胞自噬的主要信号通路。在哺乳动物细胞中, 哺乳动物雷帕霉素靶蛋白复合体1 (mTOR complex 1, mTORC1) 能抑制自噬的发生, 当ATP消耗过度以及环磷酸腺苷(cyclic adenosine monophosphate, cAMP) 积累时, 腺苷酸活化蛋白激酶(adenosine monophosphate activated protein kinase, AMPK) 磷酸化Raptor导致mTORC1失活, 从而解除mTOR对自噬的抑制作用[14]。姜黄素通过激活AMPK诱导人黑色素瘤A375和C8161细胞发生自噬[15]。mTORC1还通过磷酸化转录因子EB (transcription factor EB, TFEB), 使其定位于胞浆, 从而阻止自噬[16]。一种姜黄素衍生物被鉴定为TFEB的mTOR非依赖性激活剂, 该衍生物在N端特异结合TFEB, 促进TFEB的核易位使其激活, 从而诱导自噬发生和溶酶体生成。
2.1.3 姜黄素诱导肿瘤细胞发生凋亡姜黄素也能通过上调骨肉瘤MG63细胞中JNK的磷酸化和ATG5从而促进细胞凋亡[17]。Bcl-2蛋白是典型的抗凋亡蛋白, 通过结合beclin-1或Bcl-2相关X蛋白(Bcl-2-associated X protein, Bax), 抑制细胞自噬或凋亡。JNK1能够磷酸化Bcl-2, 使Bcl-2/beclin-1/Bax复合物解离, 诱导细胞发生凋亡。姜黄素还能通过上调胃癌细胞中p53和p21来激活p53信号通路, 抑制PI3K信号通路, 共同诱导肿瘤细胞凋亡和细胞周期阻滞[18]。
2.1.4 姜黄素逆转肿瘤细胞多药耐药姜黄素通过调控细胞膜转运蛋白和DNA修复机制来提高放疗和化疗的敏感性。以膜转运蛋白为例, 多药耐药蛋白ABCB1 (ATP-binding cassette subfamily B member 1) 能将细胞内的药物泵到细胞外, 导致细胞内有效药物浓度降低而产生多药耐药。姜黄素被证实能有效抑制ABCB1的表达, 并下调其他多药耐药相关蛋白, 从而增加伊立替康在小鼠结肠癌组织中的分布[19], 提高伊立替康的抗肿瘤疗效。
2.2 姜黄素作用靶点的确证传统的化学蛋白质组学利用亲和色谱法和质谱法来识别小分子与蛋白质的相互作用。尽管基于亲和力的化学蛋白质组学方法在细胞靶标的鉴定和阐明许多生物活性分子等方面取得了很大进展, 但非特异性结合可能会降低靶标鉴定的准确性。目前可点击的小分子探针已用于鉴定许多生物活性天然产物或药物的作用靶标[20]。研究人员通过合成能渗透细胞的、可点击的姜黄素探针(Cur-P) (图 4), 结合定量蛋白质组学方法, 确定了姜黄素在结肠癌HCT116细胞中可能的197个蛋白靶标。对初步鉴定得到的靶标进行GO (gene ontology) 分析发现, 候选靶标广泛分布于细胞核、线粒体和质膜等组分中。运用IPA (ingenuity pathway analysis) 通路分析显示, 姜黄素可能同时作用于多条信号通路(包括eIF2、eIF4/p70S6K、mTOR信号传导和线粒体功能障碍途径) 发挥抗癌作用。通过对确定的姜黄素关键靶标进行功能验证, 证实姜黄素可以下调细胞蛋白质合成, 诱导自噬, 诱导溶酶体激活和ROS产生, 从而导致肿瘤细胞死亡[21]。
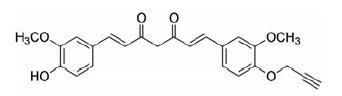
|
图 4 Structure of Cur-P |
由于姜黄素的结构不够稳定, 生物利用度低, 研究人员对其进行了大量的结构改造以期改善相关性质, 其官能团修饰包括去甲基化、氨基化、金属络合物和单羰基化等。单去甲氧基和双去甲氧基姜黄素能增强抗氧化能力以及对蛋白质或酶的抑制能力。去甲氧基姜黄素抑制ABCB1介导的ATP水解, 并有效抑制维拉帕米刺激的ATPase活性, 表明去甲氧基姜黄素对ABCB1具有更高亲和力[22]。氨基的引入可以增加姜黄素的水溶性和抗肿瘤活性。研究发现联氨基姜黄素与姜黄素相比, 能更有效地抑制人乳腺癌MDA-MB-231细胞STAT3磷酸化并下调一系列STAT3下游靶标, 从而抑制细胞增殖、细胞迁移和侵袭, 以及诱导细胞凋亡[23]。
3 白藜芦醇白藜芦醇(resveratrol) 于1940年被日本学者首次从毛叶藜芦的根中分离得到。浆果、虎杖和花生等植物中均含有较丰富的白藜芦醇。白藜芦醇的药理活性多样, 包括抗肿瘤、促进脂肪酸氧化、促进线粒体的呼吸作用和糖异生、触发活化的T细胞凋亡以及抑制促炎分子等, 因此对代谢与心血管疾病、癌症、中枢神经系统疾病和炎症等多种疾病具有潜在的治疗作用[24]。
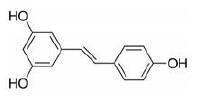
白藜芦醇是含有芪类结构的菲酮类多酚化合物(图 5), 具有顺式和反式两种类型结构, 反式异构体的生物活性强于顺式异构体。
|
图 5 Structure of trans-resveratrol |
白藜芦醇通过抑制肿瘤细胞生长、抑制肿瘤的迁移和侵袭、抑制肿瘤血管生成等发挥抗肿瘤活性, 其作用机制包括下调NF-κB, 以及调节STAT、MEK (mitogen-activated protein kinase kinase, MAPKK)/ERK和TGF-β1 (transforming growth factor-β1)/Smad (Sma-Mad) 信号通路、HIF-1α (hypoxia inducible factor-1α) 和VEGF (vascular endothelial growth factor), 减少药物外排转运蛋白, 协助细胞周期阻滞和凋亡, 以及调节肿瘤抑制性microRNA和上调p53表达。
3.1.1 白藜芦醇抑制肿瘤细胞增殖MEK/ERK信号通路是调控细胞增殖、分化、凋亡等生理或病理过程的主要途径之一。白藜芦醇能抑制黑色素瘤HT-144细胞MEK/ERK信号通路, 下调MEK1/2和ERK1/2磷酸化水平, 从而抑制细胞增殖[25]。白藜芦醇还能阻断肿瘤坏死因子β (tumor necrosis factor-β, TNF-β)/TNF-β受体诱导的NF-κB及其下游调控基因的激活, 从而抑制TNF-β诱导的CRC细胞增殖和侵袭[26]。
3.1.2 白藜芦醇抑制肿瘤细胞侵袭和迁移肿瘤细胞的侵袭和迁移与上皮细胞-间充质转化(epithelial-mesenchymal transition, EMT) 有关。EMT过程是指上皮细胞转化为间质表型, 其主要特征是细胞黏附分子E-cadherin表达下调等。EMT使上皮组织肿瘤细胞失去极性, 获得较高的迁移、侵袭和抗凋亡等能力, 形成具有间质表型的细胞[27]。EMT过程涉及多种信号转导通路。研究表明, 白藜芦醇能降低胃癌细胞中Hedgehog信号通路关键成分Gli-1的表达, 以及EMT关键成分Snail和N-cadherin的表达, 抑制胃癌的Hh信号传导途径和EMT, 上调E-cadherin的表达, 从而抑制胃癌细胞的侵袭和转移[28]。白藜芦醇还通过调控HER2 (human epidermal growth factor receptor 2)-ERK1/2信号通路抑制基质金属蛋白酶(matrix metalloproteinase, MMP) 9蛋白的表达, 发挥抗肿瘤细胞侵袭和迁移的活性[29]。
3.1.3 白藜芦醇抑制肿瘤血管生成由于肿瘤细胞增殖迅速, 增加了其代谢活性和耗氧量, 实体瘤会通过诱导缺氧反应性基因表达, 来迫使肿瘤细胞适应肿瘤内的缺氧环境。其中, 许多细胞应激因素例如缺氧、营养缺乏或ROS诱导剂, 是血管生成信号的重要刺激因素。HIF-1在血管生成中起重要作用, 可调节血管生成因子如VEGF、VEGFR (VEGF receptor)、碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)、IL-8和血管生成素[30]。白藜芦醇作用于人卵巢癌细胞A2780/CP70和OVCAR-3后, 通过多种机制显著抑制了细胞中HIF-1α蛋白的表达和VEGF的表达。白藜芦醇抑制AKT和丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK) 的活化, 通过抑制蛋白翻译调控因子, 包括核糖体蛋白S6激酶1、核糖体蛋白S6、真核起始因子4E结合蛋白1 (eukaryotic initiation factor 4E-binding protein 1, eIF4E-BP1) 和eIF4E, 共同抑制HIF-1α表达。白藜芦醇还通过蛋白酶体途径诱导HIF-1蛋白降解, 这些作用可能共同抑制卵巢癌组织中血管生成[31]。
3.2 白藜芦醇的靶点确证目前广泛的研究揭示了白藜芦醇可能作用于细胞内多个靶标, 调控细胞的生长、炎症和血管生成等。2003年研究人员通过高通量筛选发现白藜芦醇能活化SIRT1 (sirtuin-1), 这是一类依赖于NAD+的蛋白去乙酰化酶, 它与代谢、心血管疾病、炎症和衰老密切相关。白藜芦醇能显著降低SIRT1与乙酰化底物和NAD+作用的米氏常数[32]。然而在2012年的研究中报道, 白藜芦醇的直接作用靶点是磷酸二酯酶(phosphodiesterase, PDE), 通过抑制PDE活性, 从而激活cAMP和Epac1, 使Ca2+从内质网释放, 激活钙调蛋白依赖性蛋白激酶激酶β (calcium/calmodulin-dependent protein kinase kinase 2, CamKKβ)和AMPK, 最终间接激活SIRT1[33]。
2009年科研人员发明了一种药物亲和反应的靶点稳定性(drug affinity responsive target stability, DARTS) 技术来鉴定小分子药物的作用靶标, 该方法的原理是与药物结合后的靶标蛋白对蛋白酶敏感性降低, 再通过电泳和质谱技术来确定该药物结合的靶标蛋白。由于DARTS不需要对药物进行修饰, 并且与药物作用机制无关, 它得到了广泛的应用。Lomenick等[34]用DARTS鉴定了eIF4A为白藜芦醇的一个作用靶点。
目前在大量的肿瘤细胞系和动物模型中验证了白藜芦醇能直接或间接作用于肿瘤发生、发展和转移各个过程中多种途径的关键靶点, 包括: 肿瘤抑制因子p53和Rb; 细胞周期相关蛋白CDK、p21WAF1、p27KIP和INK以及检查点激酶ATM/ATR; 转录因子NF-κB、AP-1 (activator protein-1)、c-Jun和c-Fos; 血管生成和转移因子VEGF和MMP2/9; 以及凋亡和存活调节剂Bax/Bak、PUMA (p53 up-regulated modulator of apoptosis)、Noxa、TRAIL (TNF related apoptosis inducing ligand)、APAF (apoptotic protease-activating factor)、survivin、Bcl-2和Bcl-xL[35]。
3.3 白藜芦醇的结构优化白藜芦醇作为药物, 有着毒性较低的优势, 在人体中口服吸收率约为75%, 但肠道和肝脏的大量代谢导致口服生物利用度低于1%, 其在血液和组织中分布低, 半衰期短。因此白藜芦醇结构改造的衍生物主要解决生物利用度低这一问题, 常见的是白藜芦醇甲基化衍生物。例如, 天然存在的白藜芦醇活性类似物3, 5, 4'-三甲氧基-反式-二苯乙烯在大鼠中比白藜芦醇具有更高的血浆分布率、更长的半衰期和更低的清除率。白藜芦醇的二甲基衍生物紫檀芪在大鼠模型中显示出对治疗结肠癌有效, 并有更好的生物利用度[36]。
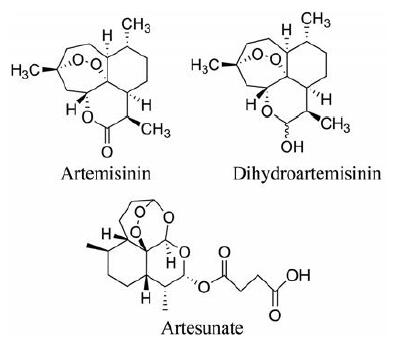
4 青蒿素青蒿素(artemisinin) 于1971年从传统药用植物青蒿中分离得到, 由于屠呦呦在发现青蒿素在疟疾治疗中的重要研究, 被授予2015年诺贝尔医学奖[37]。青蒿素的生物利用度较差, 其有效性有限。系列青蒿素衍生物(图 6) 包括青蒿琥酯(artesunate, ART)、青蒿醚、二氢青蒿素(dihydroartemisinin, DHA) 和青蒿酸等, 在抗疟、抗肿瘤以及治疗自身免疫性疾病方面得到广泛的研究。青蒿素及其衍生物是倍半萜烯内酯, 它独特的过氧化物内桥是主要发挥活性的关键结构。在存在游离亚铁离子的情况下, 青蒿素及其衍生物的内过氧化物桥断裂, 导致自由基生成, 最终导致疟原虫死亡[38]。青蒿素衍生物ART水溶性较好, 在生理条件下转化为具有生物活性的DHA, DHA也显示出比青蒿素更强的药理活性[39]。
|
图 6 Structures of artemisinin and its derivatives |
与其抗疟作用相似, 青蒿素及其衍生物主要通过诱导细胞产生自由基, 从而诱导细胞产生一系列应激应答, 包括抑制血管生成、与肿瘤相关的信号转导途径(Wnt/β-catenin途径和AMPK途径等) 和信号传感器[NF-κB、MYC/MAX (MYC associated factor X)、AP-1、CREBP (cAMP response element binding protein) 和mTOR等], 导致细胞凋亡、自噬、铁死亡和坏死等。
4.1.1 铁和血红素在青蒿素调控细胞毒性中的作用青蒿素的内过氧化物基团对其抗寄生虫和抗癌特性均至关重要, 游离铁和血红素介导了过氧化物内桥的断裂, 生成高反应性的以碳为中心的自由基, 参与蛋白质的烷基化反应并产生ROS[40]。游离亚铁离子(Fe2+) 被螯合后几乎完全阻碍青蒿素的抗肿瘤作用[41]。癌细胞对铁代谢有更高的需求, 比正常细胞有更高的铁含量, 因此青蒿素能够选择性靶向肿瘤细胞而对正常细胞作用较弱。另有研究认为[42], 血红素是青蒿素更强的活化剂, 血红素合成前体能够增强青蒿素的细胞毒性, 而血红素合成抑制剂琥珀酰丙酮能抑制青蒿素的活性。同样的, 血红素加氧酶(heme oxygenase, HMOX) 能抑制青蒿素二聚体的活性, 减少青蒿素诱导的ROS生成, 从而削弱青蒿素的细胞毒性[42]。
4.1.2 青蒿素诱导肿瘤细胞发生凋亡青蒿素诱导ROS产生并导致氧化应激、ER应激和DNA损伤等下游效应产生, 通常通过诱导caspase依赖的线粒体途径介导细胞凋亡而发挥其细胞毒性。例如DHA能铁依赖性地诱导人早幼粒细胞白血病HL-60细胞凋亡, 并伴随线粒体功能障碍和胱天蛋白酶激活, 并时间依赖性地激活p38-MAPK[43]。
DHA作用于Jurkat T淋巴瘤细胞会导致线粒体跨膜电位的破坏、细胞色素c的释放、胱天蛋白酶的活化以及指示凋亡诱导的DNA片段化。研究表明, 促凋亡的Bcl-2效应蛋白Bak和Bcl-2同源结构域蛋白Noxa是DHA诱导Jurkat细胞凋亡的重要介质, DHA触发Noxa的表达并激活Bak。DHA的促凋亡信号还涉及ROS的形成和膜氧化, 亲脂性自由基清除剂维生素E或亲水性自由基清除剂谷胱甘肽和N-乙酰基半胱氨酸预处理都会削弱DHA诱导的膜氧化和细胞凋亡[44]。
4.1.3 青蒿素诱导肿瘤细胞自噬研究表明[45], 溶酶体对于青蒿素诱导的ROS生成是必需的, 青蒿琥酯可在HeLa细胞溶酶体中蓄积并激活溶酶体功能。研究发现, 青蒿琥酯促进溶酶体V-ATPase的组装, 诱导细胞死亡[45]。Beclin1 (酵母自噬相关基因6的直系同源基因) 是自噬启动的关键调节基因。Beclin1募集胞浆蛋白以进行自噬降解, 并促进募集的膜复合物用于自噬体形成。Beclin1还作为募集PI3K III类(PI3KC3) 的支架, 这对于吞噬细胞形成至关重要。Bcl-2通过BH3结构域与beclin1相互作用, 阻止beclin1组装自噬前体结构, 抑制自噬。DHA能够激活人胰腺癌细胞中JNK通路, 导致Bcl-2的磷酸化并失活, 从而解除Bcl-2对beclin1的抑制, 使得beclin1的表达水平增加并诱导自噬[46]。
4.1.4 青蒿素抑制肿瘤生长和转移DHA能直接靶向血小板衍生的生长因子受体-α (platelet-derived growth factor receptor-α, PDGFR-α), 从而抑制卵巢癌细胞的生长和转移。DHA直接结合至PDGFR-α细胞膜内结构域, 通过加速泛素化降解而降低其稳定性, 并进一步抑制下游PI3K和MAPK信号转导, 抑制肿瘤细胞上皮-间质转化、生长和转移[47]。核基质蛋白Ciz1能与cyclin E、cyclin A和CDK2等调节细胞周期的蛋白质相互作用, 促进DNA复制和细胞增殖, DHA还能通过抑制TGF-β1/Smad信号传导和Ciz1来抑制乳腺癌细胞的增殖和转移[48]。
4.2 青蒿素的作用靶点确证青蒿素与癌症中广泛的细胞靶标和途径相关, 常见的报道包括p38-MAPK[43]、PI3K/AKT、Ras、NF-κB和Wnt/β-catenin[49]途径。然而由于细胞内定位、活化水平和细胞蛋白质组本身的组成等因素都可以导致差异结合, 因此在不同细胞类型和条件下, 青蒿素的作用也不同。研究人员应用LC-MS (liquid chromatography mass spectrometry)/MS结合iTRAQ (isobaric tags for relative and absolute quantitation) 定量分析DHA处理的PC3前列腺癌细胞的基因表达变化, 发现细胞蛋白质合成机制、氨基酸代谢以及伴侣蛋白热休克蛋白70 (heat shock protein 70, HSP70) 是DHA诱导PC3细胞毒性的潜在介质[50]。
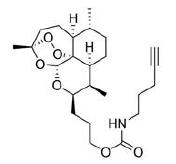
如文中所述, 青蒿素对癌细胞的抑制作用是铁依赖性的, 铁触发的青蒿素自由基更可能将细胞蛋白共价烷基化, 因此研究者利用被血红素激活的青蒿素化学探针ART-yne (图 7), 与HeLa细胞裂解液共孵育, 富集并鉴定了大约80种青蒿素烷基化的蛋白靶标[51]。这种化学蛋白质组学方法提供了一种可视化药物激活的直接方法, 因为青蒿素在表现出显著的烷基化特性之前需要先被激活, 另外, 相互作用蛋白的直接谱分析可以提供除基因表达之外的机制信息。该研究使用IPA和GO分析进一步阐明青蒿素靶蛋白的细胞分布和功能, 发现青蒿素潜在靶蛋白与分子运输、蛋白质运输、细胞死亡和存活以及核酸代谢等相关。研究者猜测血红素活化的青蒿素对蛋白质的烷基化作用选择性不高, 但铁活化的自由基机制和运铁蛋白受体1介导的铁耗竭途径可能对体内癌细胞或肿瘤组织更具特异性[51]。然而, 探针ART-yne的缺点是不能渗透细胞, 因此需要进一步设计具有细胞渗透活性的探针进行研究。
|
图 7 Structure of artesunate (ART)-yne |
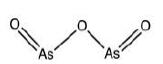
三氧化二砷(ATO), 俗称砒霜(图 8), 为白色无味粉末或结晶, 有非晶系、等轴晶系、单斜晶系的结晶或无色粉末三种状态。砷化物也是一种古老的药物。希波克拉底(公元前460~377) 曾用雌黄和雄黄作为防腐剂, 亚里士多德曾写过关于砷化物的用药性质, 伽林也曾将硫化砷作为敷剂来治疗溃疡[52]。哈尔滨医科大学的韩太云于1971年发现As2O3对急性早幼粒细胞白血病(acute promyelocytic leukemia, APL) 有特效, 张亭栋课题组于1974年制成亚砷酸注射液用以治疗APL。As2O3于1999年正式通过国家药品监督管理局的审批用于临床治疗APL, 并于2000年作为治疗复发性及耐药性APL的新药通过美国食品及药品管理局(Food and Drug Administration, FDA) 的审批[53]。
|
图 8 Structure of arsenic trioxide (ATO) |
ATO的抗肿瘤活性主要体现在对肿瘤细胞的增殖抑制、诱导凋亡、抑制肿瘤血管生成以及减少肿瘤耐药性等, 其作用靶点主要包括Pin1 (peptidylprolyl cis/trans isomerase NIMA-interacting 1)、Fas、NF-κB和Bcl-2等。
5.1.1 ATO抑制肿瘤细胞增殖Pin1酶是一种脯氨酰基顺反异构酶, 可改变磷酸化蛋白质的功能, 从而激活癌症驱动蛋白, 是癌症信号传导网络的主要调节因子, 同时还能使部分肿瘤抑制蛋白失活[54]。在大多数人类癌症中, Pin1过度活化, 并且与不良的临床反应相关, Pin1表达低的人群患各种癌症的风险较低[54]。ATO能抑制和降解Pin1, 并通过与Pin1活性位点的非共价结合抑制其致癌功能, 但同时会引起细胞表面通道蛋白降解, 引起ATO抗性。全反式维甲酸也可抑制和降解Pin1, 并能上调水通道蛋白9, 增加细胞对ATO的摄取, 解除了细胞对ATO的抗性, 二者的协同作用抑制了Pin1的功能和自我更新[55]。
一些药物治疗不能有效地清除肿瘤启动细胞/肿瘤干细胞(tumor initiative cells/cancer stem cells, TICs/CSCs), 这些细胞可能是肿瘤启动、生长、转移和耐药的原因。Pin1是TIC/CSC中一种关键的驱动因子, 例如Pin1在乳腺TICs/CSCs中高度富集, 可以促进它们的自我更新和肿瘤的启动[56]。因此ATO与ATRA联用靶向Pin1可以同时阻断多种癌症驱动途径并消除TICs/CSCs。
5.1.2 ATO诱导肿瘤细胞发生凋亡ATO诱导肿瘤细胞发生凋亡主要是通过Fas/FasL-caspase 3途径、NF-κB、TRAIL以及影响氧化还原稳态降低端粒酶活性等一系列方式。研究表明, ATO能导致SPCA1肺腺癌细胞凋亡, 其机制可能是ATO诱导Fas表达。Fas是一种跨膜受体, 与激动剂抗体或Fas配体(FasL) 结合可以通过激活caspase 8、caspase 3和线粒体途径来触发凋亡级联反应, 最终导致细胞死亡[57]。TRAIL通过与靶细胞表面死亡受体(death receptor, DR), 包括DR4和DR5结合, 可触发细胞凋亡。研究表明ATO可通过下调NF-κB的表达并增强TRAIL诱导人肺癌A549细胞凋亡[58]。
ATO还能通过影响氧化还原稳态诱导线粒体凋亡。氧化还原稳态是指抗氧化剂例如细胞内谷胱甘肽(glutathione, GSH)、超氧化物歧化酶(superoxide dismutase, SOD)、硫氧还蛋白(thioredoxin, Trx) 和ROS与氧化剂之间的平衡。GSH和SOD是调节氧化还原稳态平衡的关键因素, 作为自由基清除剂保护细胞免受氧化应激。ROS过度积累破坏细胞内氧化还原稳态, 导致细胞死亡。研究表明, ATO诱导GSH的消耗、Trx的下调和ROS的积累, 从而导致细胞氧化损伤并启动了线粒体凋亡[59]。
5.1.3 ATO抑制肿瘤血管生成肿瘤血管生成涉及的过程包括MMP诱导的细胞外基质降解, 血小板源性生长因子PDGF/PDGFR-β驱动的内皮细胞迁移, VEGF/VEGFR-2诱导的内皮细胞增殖, 以及成纤维细胞生长因子2 (fibroblast growth factor 2-basic, FGF-2)/FGFR-2和delta样Notch配体4 (delta-like ligand 4, Dll4)/Notch-1诱导的血管新生[60]。ATO通过显著抑制VEGF的上游调控因子HIF-1α以及VEGF-A的表达, 并抑制VEGFR-2、Dll4和Notch-1的表达, 发挥抗血管生成作用[61]。
5.2 ATO的靶点确证目前的很多研究中都是利用网络药理学方法对ATO的作用靶标进行预测。例如, DrugBank是一个注释丰富的生物信息学工具, 其中包含具有全面药物目标信息的多种药物数据, 提供了关于药物、药物靶标和药物作用的研究结果的详细信息。研究者使用DrugBank和STITCH识别ATO-靶标相互作用以获得ATO-靶标网络, 总共鉴定出ATO的19个候选靶基因。将有关靶基因的信息通过STRING进行进一步的KEGG通路和GO分析, 发现19个ATO候选靶基因富集于“染色质”、“染色体”和“核内腔”等基因集[62]。
6 天然产物靶点确证的方法目前用于天然药物靶点确证的常用方法主要包括基因组学、蛋白质组学和计算机辅助模拟等, 例如酵母双杂交法、亲和色谱和活性蛋白表达谱等方法[63], 还有文中列举的化合物探针这一类方法。此类方法大部分需要对化合物加以修饰或标记, 修饰后的化合物可能会改变某些化学活性, 以及可能存在无法渗透细胞的问题。近来科研人员也在尝试用一些非标记的方法, 例如白藜芦醇使用的药物亲和反应的靶点稳定性(DARTS) 方法, 药物与靶标结合后靶标蛋白对蛋白酶敏感性降低, 与对照组对比酶解反应后的差异, 找到可能的结合靶标并进行后续验证。还有氧化速率蛋白稳定性(stability of proteins from rates of oxidation, SPROX) 方法, 该方法利用过氧化氢氧化蛋氨酸侧链评估测量蛋白质-配体复合物的热力学性质, 天然产物与靶标蛋白结合后, 蛋氨酸侧链抗氧化能力增强, 再通过质谱技术检测蛋氨酸水平对靶标蛋白进行定量[63]。网络药理学也是近年来鉴定天然产物作用靶点的一项常用技术, 例如Connectivity Map数据库, 它有1 000多种小分子药物处理人类5种肿瘤细胞系前后的基因数据, 能帮助科研人员预测小分子化合物的作用模式。还有如PharmMapper、PDTD和DrugBank这样的数据库, 涵盖了药物的化学结构、药理作用、作用蛋白靶点和通路、药物间相互作用等信息, 都可以用来计算预测药物分子的作用靶点。鉴定天然产物作用靶点的方法很多, 不同的方法各有利弊, 需要选取多样、合适的方法来全面分析多靶点天然产物的作用靶标, 以最大程度增加准确性, 排除假阳性。
7 总结与展望文中列举的多靶点抗肿瘤天然产物的抗肿瘤活性有很多相似之处, 例如丹参酮、姜黄素、白藜芦醇和青蒿素都能作用于常见的细胞生长和凋亡相关通路和蛋白如PI3K/AKT、NF-κB、周期素依赖性激酶、caspase和Bcl-2等来抑制肿瘤细胞的增殖并诱导凋亡。它们也都能诱导活性氧的释放和积累, 造成细胞氧化应激, 诱导细胞凋亡。白藜芦醇和ATO也都会作用于HIF-1α和VEGF来抑制肿瘤血管新生。药物与靶点结合方式可以分为化学结合和物理结合两种方式, 它们大都与受体以化学结合方式结合, 包括共价键与非共价键结合, 如丹参酮的菲醌结构能与DNA分子相结合。
这些药物作用的不同之处也很明显, 如青蒿素及其衍生物主要通过诱导细胞产生自由基, 从而诱导细胞产生一系列应激应答发挥细胞毒作用, 铁和血红素对于激活青蒿素发挥活性至关重要。姜黄素除了有与其他药物相同的作用机制外, 它还能抑制ABCB1, 逆转肿瘤细胞多药耐药。ATO主要是增加细胞内ROS的浓度, 而发挥细胞毒性作用。
多靶点抗肿瘤天然药物的作用机制具有多靶点和多效应的特点, 能作用于肿瘤发生发展的多个阶段, 并且能够联合其他抗肿瘤药物以发挥更大的抗肿瘤效应。但这种多通路、多靶点的作用方式也可能带来不良反应, 例如ATO在临床应用上存在心脏毒性、肾毒性和肝毒性等问题。多靶点药物与靶向药物和细胞毒抗肿瘤药物相比较, 作用浓度高且活性较低。人们需要探寻多靶点抗肿瘤天然药物主要作用靶标, 并且进行进一步结构修饰和优化, 以提高药物对靶点的选择性, 提高疗效, 解决生物利用度低和不良反应较大等问题。多靶点抗肿瘤天然药物的主要作用靶标可以通过定量分析, 推测其主要作用靶点。另外, 得到完整的药物与靶点作用的结构后, 可根据化学结构推测其主要作用靶点。目前, 多靶点抗肿瘤天然药物的机制研究还不够深入, 研究人员需全面利用分子生物学技术, 从基因组和蛋白质组水平对抗肿瘤机制进行更深入更系统的研究, 推进其临床前和临床研究, 以确定这些药物的适应症, 实现药物的精准应用。
作者贡献: 段雨婷撰写, 蒙凌华指导修改。
利益冲突: 所有作者声明不存在利益冲突。
| [1] |
Newman DJ, Cragg GM. Natural products as sources of new drugs from 1981 to 2014[J]. J Nat Prod, 2016, 79: 629-661. DOI:10.1021/acs.jnatprod.5b01055 |
| [2] |
Tian XH, Wu JH. Tanshinone derivatives: a patent review (January 2006-September 2012)[J]. Expert Opin Ther Pat, 2013, 23: 19-29. DOI:10.1517/13543776.2013.736494 |
| [3] |
Ren X, Wang C, Xie B, et al. Tanshinone IIA induced cell death via miR30b-p53-PTPN11/SHP2 signaling pathway in human hepatocellular carcinoma cells[J]. Eur J Pharmacol, 2017, 796: 233-241. DOI:10.1016/j.ejphar.2016.11.046 |
| [4] |
Shin DS, Kim HN, Shin KD, et al. Cryptotanshinone inhibits constitutive signal transducer and activator of transcription 3 function through blocking the dimerization in DU145 prostate cancer cells[J]. Cancer Res, 2009, 69: 193-202. DOI:10.1158/0008-5472.CAN-08-2575 |
| [5] |
Zhang X, Zhou Y, Gu YE. Tanshinone IIA induces apoptosis of ovarian cancer cells in vitro and in vivo through attenuation of PI3K/AKT/JNK signaling pathways[J]. Oncol Lett, 2019, 17: 1896-1902. |
| [6] |
Zhang P, Pei Y, Qi Y. Influence of blood-activating drugs on adhesion and invasion of cells in lung cancer patients[J]. Chin J Integr Tradit West Med (中国中西医结合杂志), 1999, 19: 103-105. |
| [7] |
Don MJ, Liao JF, Lin LY, et al. Cryptotanshinone inhibits chemotactic migration in macrophages through negative regulation of the PI3K signaling pathway[J]. Br J Pharmacol, 2007, 151: 638-646. DOI:10.1038/sj.bjp.0707271 |
| [8] |
Chen SJ. Drug-target networks for tanshinone IIA identified by data mining[J]. Chin J Nat Med, 2015, 13: 751-759. |
| [9] |
Yuan DP, Long J, Lu Y, et al. The forecast of anticancer targets of cryptotanshinone based on reverse pharmacophore-based screening technology[J]. Chin J Nat Med (中国天然药物), 2014, 12: 443-448. |
| [10] |
Wu Q, Zheng K, Huang X, et al. Tanshinone-IIA-based analogues of imidazole alkaloid act as potent inhibitors to block breast cancer invasion and metastasis in vivo[J]. J Med Chem, 2018, 61: 10488-10501. DOI:10.1021/acs.jmedchem.8b01018 |
| [11] |
Zhou ZY, Zhao WR, Zhang J, et al. Sodium tanshinone IIA sulfonate: a review of pharmacological activity and pharmacokinetics[J]. Biomed Pharmacother, 2019, 118: 109362. DOI:10.1016/j.biopha.2019.109362 |
| [12] |
Feng T, Wei Y, Lee RJ, et al. Liposomal curcumin and its application in cancer[J]. Int J Nanomedicine, 2017, 12: 6027-6044. DOI:10.2147/IJN.S132434 |
| [13] |
Zhao G, Han X, Zheng S, et al. Curcumin induces autophagy, inhibits proliferation and invasion by downregulating AKT/mTOR signaling pathway in human melanoma cells[J]. Oncol Rep, 2016, 35: 1065-1074. DOI:10.3892/or.2015.4413 |
| [14] |
Galluzzi L, Bravo-San Pedro JM, Levine B, et al. Pharmacological modulation of autophagy: therapeutic potential and persisting obstacles[J]. Nat Rev Drug Discov, 2017, 16: 487-511. DOI:10.1038/nrd.2017.22 |
| [15] |
Ornelas IM, Silva TM, Fragel-Madeira L, et al. Inhibition of PI3K/Akt pathway impairs G2/M transition of cell cycle in late developing progenitors of the avian embryo retina[J]. PLoS One, 2013, 8: e53517. DOI:10.1371/journal.pone.0053517 |
| [16] |
Sardiello M. Transcription factor EB: from master coordinator of lysosomal pathways to candidate therapeutic target in degenerative storage diseases[J]. Ann N Y Acad Sci, 2016, 1371: 3-14. DOI:10.1111/nyas.13131 |
| [17] |
Zhang Y, Chen P, Hong H, et al. JNK pathway mediates curcumin-induced apoptosis and autophagy in osteosarcoma MG63 cells[J]. Exp Ther Med, 2017, 14: 593-599. DOI:10.3892/etm.2017.4529 |
| [18] |
Fu H, Wang C, Yang D, et al. Curcumin regulates proliferation, autophagy, and apoptosis in gastric cancer cells by affecting PI3K and P53 signaling[J]. J Cell Physiol, 2018, 233: 4634-4642. DOI:10.1002/jcp.26190 |
| [19] |
Neerati P, Sudhakar YA, Kanwar JR. Curcumin regulates colon cancer by inhibiting P-glycoprotein in in-situ cancerous colon perfusion rat model[J]. J Cancer Sci Ther, 2013, 5: 313-319. |
| [20] |
Wang J, Gao L, Lee YM, et al. Target identification of natural and traditional medicines with quantitative chemical proteomics approaches[J]. Pharmacol Therapeut, 2016, 162: 10-22. DOI:10.1016/j.pharmthera.2016.01.010 |
| [21] |
Wang J, Zhang J, Zhang CJ, et al. In situ proteomic profiling of curcumin targets in hct116 colon cancer cell line[J]. Sci Rep, 2016, 6: 22146. DOI:10.1038/srep22146 |
| [22] |
Teng YN, Hsieh YW, Hung CC, et al. Demethoxycurcumin modulates human P-glycoprotein function via uncompetitive inhibition of ATPase hydrolysis activity[J]. J Agric Food Chem, 2015, 63: 847-855. DOI:10.1021/jf5042307 |
| [23] |
Wang X, Zhang Y, Zhang X, et al. The curcumin analogue hydrazinocurcumin exhibits potent suppressive activity on carcinogenicity of breast cancer cells via STAT3 inhibition[J]. Int J Oncol, 2012, 40: 1189-1195. DOI:10.3892/ijo.2011.1298 |
| [24] |
Diaz-Gerevini GT, Repossi G, Dain A, et al. Beneficial action of resveratrol: how and why?[J]. Nutrition, 2016, 32: 174-178. DOI:10.1016/j.nut.2015.08.017 |
| [25] |
Lei MJ, Dong Y, Sun CX, et al. Resveratrol inhibits proliferation, promotes differentiation and melanogenesis in HT-144 melanoma cells through inhibition of MEK/ERK kinase pathway[J]. Microb Pathog, 2017, 111: 410-413. DOI:10.1016/j.micpath.2017.09.029 |
| [26] |
Buhrmann C, Yazdi M, Popper B, et al. Evidence that TNF-β induces proliferation in colorectal cancer cells and resveratrol can down-modulate it[J]. Exp Biol Med, 2019, 244: 1-12. DOI:10.1177/1535370218824538 |
| [27] |
Kim CW, Hwang KA, Choi KC. Anti-metastatic potential of resveratrol and its metabolites by the inhibition of epithelial-mesenchymal transition, migration, and invasion of malignant cancer cells[J]. Phytomedicine, 2016, 23: 1787-1796. DOI:10.1016/j.phymed.2016.10.016 |
| [28] |
Gao Q, Yuan Y, Gan HZ, et al. Resveratrol inhibits the hedgehog signaling pathway and epithelial-mesenchymal transition and suppresses gastric cancer invasion and metastasis[J]. Oncol Lett, 2015, 9: 2381-2387. DOI:10.3892/ol.2015.2988 |
| [29] |
Tang FY, Chiang EP, Sun YC. Resveratrol inhibits heregulin-β1-mediated matrix metalloproteinase-9 expression and cell invasion in human breast cancer cells[J]. J Nutr Biochem, 2008, 19: 287-294. DOI:10.1016/j.jnutbio.2007.03.003 |
| [30] |
Pollard JW. Tumour-educated macrophages promote tumour progression and metastasis[J]. Nat Rev Cancer, 2004, 4: 71-78. DOI:10.1038/nrc1256 |
| [31] |
Cao Z, Fang J, Xia C, et al. trans-3, 4, 5'-Trihydroxystibene inhibits hypoxia-inducible factor 1alpha and vascular endothelial growth factor expression in human ovarian cancer cells[J]. Clin Cancer Res, 2004, 10: 5253-5263. DOI:10.1158/1078-0432.CCR-03-0588 |
| [32] |
Howitz KT, Bitterman KJ, Cohen HY, et al. Small molecule activators of sirtuins extend Saccharomyces cerevisiae lifespan[J]. Nature, 2003, 425: 191-196. DOI:10.1038/nature01960 |
| [33] |
Park SJ, Ahmad F, Philp A, et al. Resveratrol ameliorates aging-related metabolic phenotypes by inhibiting cAMP phosphodiesterases[J]. Cell, 2012, 148: 421-433. DOI:10.1016/j.cell.2012.01.017 |
| [34] |
Lomenick B, Hao R, Jonai N, et al. Target identification using drug affinity responsive target stability (DARTS)[J]. Proc Natl Acad Sci U S A, 2009, 106: 21984-21989. DOI:10.1073/pnas.0910040106 |
| [35] |
Ko JH, Sethi G, Um JY, et al. The role of resveratrol in cancer therapy[J]. Int J Mol Sci, 2017, 18: 2589. DOI:10.3390/ijms18122589 |
| [36] |
Walle T. Bioavailability of resveratrol[J]. Ann N Y Acad Sci, 2011, 1215: 9-15. DOI:10.1111/j.1749-6632.2010.05842.x |
| [37] |
Zhang JF. A Detailed Chronological Record of Project 523 and the Discovery and Development of Qinghaosu (Artemisinin) (迟到的报告-五二三项目与青蒿素研发纪实)[M]. Guangzhou: Yangcheng Evening News Publishing Company, 2006: 17.
|
| [38] |
Winzeler EA, Manary MJ. Drug resistance genomics of the antimalarial drug artemisinin[J]. Genome Biol, 2014, 15: 544. DOI:10.1186/s13059-014-0544-6 |
| [39] |
Cui L, Su XZ. Discovery, mechanisms of action and combination therapy of artemisinin[J]. Expert Rev Anti Infect Ther, 2009, 7: 999-1013. DOI:10.1586/eri.09.68 |
| [40] |
Mercer AE, Maggs JL, Sun XM, et al. Evidence for the involvement of carbon-centered radicals in the induction of apoptotic cell death by artemisinin compounds[J]. J Biol Chem, 2007, 282: 9372-9382. DOI:10.1074/jbc.M610375200 |
| [41] |
Efferth T, Benakis A, Romero MR, et al. Enhancement of cytotoxicity of artemisinins toward cancer cells by ferrous iron[J]. Free Radic Biol Med, 2004, 37: 998-1009. DOI:10.1016/j.freeradbiomed.2004.06.023 |
| [42] |
Stockwin LH, Han B, Yu SX, et al. Artemisinin dimer anticancer activity correlates with heme-catalyzed reactive oxygen species generation and endoplasmic reticulum stress induction[J]. Int J Cancer, 2009, 125: 1266-1275. DOI:10.1002/ijc.24496 |
| [43] |
Lu JJ, Meng LH, Cai YJ, et al. Dihydroartemisinin induces apoptosis in HL-60 leukemia cells dependent of iron and p38 mitogen-activated protein kinase activation but independent of reactive oxygen species[J]. Cancer Biol Ther, 2008, 7: 1017-1023. DOI:10.4161/cbt.7.7.6035 |
| [44] |
Handrick R, Ontikatze T, Bauer KD, et al. Dihydroartemisinin induces apoptosis by a Bak-dependent intrinsic pathway[J]. Mol Cancer Ther, 2010, 9: 2497-2510. DOI:10.1158/1535-7163.MCT-10-0051 |
| [45] |
Hamacher-Brady A, Stein HA, Turschner S, et al. Artesunate activates mitochondrial apoptosis in breast cancer cells via iron-catalyzed lysosomal reactive oxygen species production[J]. J Biol Chem, 2011, 286: 6587-6601. DOI:10.1074/jbc.M110.210047 |
| [46] |
Wei Y, Sinha S, Levine B. Dual role of JNK1-mediated phosphorylation of Bcl-2 in autophagy and apoptosis regulation[J]. Autophagy, 2008, 4: 949-951. DOI:10.4161/auto.6788 |
| [47] |
Li X, Ba Q, Liu Y, et al. Dihydroartemisinin selectively inhibits PDGFRα-positive ovarian cancer growth and metastasis through inducing degradation of PDGFRα protein[J]. Cell Discov, 2017, 3: 17042. |
| [48] |
Li Y, Zhou X, Liu J, et al. Dihydroartemisinin inhibits the tumorigenesis and metastasis of breast cancer via downregulating CIZ1 expression associated with TGF-β1 signaling[J]. Life Sci, 2020, 248: 117454. DOI:10.1016/j.lfs.2020.117454 |
| [49] |
Zhong G, Liang R, Yao J, et al. Artemisinin ameliorates osteoarthritis by inhibiting the Wnt/β-catenin signaling pathway[J]. Cell Physiol Biochem, 2018, 51: 2575-2590. DOI:10.1159/000495926 |
| [50] |
Wong YK, Xu C, Kalesh KA, et al. Artemisinin as an anticancer drug: recent advances in target profiling and mechanisms of action[J]. Med Res Rev, 2017, 37: 1492-1517. DOI:10.1002/med.21446 |
| [51] |
Zhou Y, Li W, Xiao Y. Profiling of multiple targets of artemisinin activated by hemin in cancer cell proteome[J]. ACS Chem Biol, 2016, 11: 882-888. DOI:10.1021/acschembio.5b01043 |
| [52] |
Jolliffe DM. A history of the use of arsenicals in man[J]. J R Soc Med, 1993, 86: 287-289. |
| [53] |
Ma J. The application of arsenic trioxide in the treatment of leukemia[J]. China Prescr Drug (中国处方药), 2004, 10: 17-20. |
| [54] |
Lu KP. Prolyl isomerase Pin1 as a molecular target for cancer diagnostics and therapeutics[J]. Cancer Cell, 2003, 4: 175-180. DOI:10.1016/S1535-6108(03)00218-6 |
| [55] |
Kozono S, Lin YM, Seo HS, et al. Arsenic targets Pin1 and cooperates with retinoic acid to inhibit cancer-driving pathways and tumor-initiating cells[J]. Nat Commun, 2018, 9: 3069. DOI:10.1038/s41467-018-05402-2 |
| [56] |
Rustighi A, Zannini A, Tiberi L, et al. Prolyl-isomerase Pin1 controls normal and cancer stem cells of the breast[J]. EMBO Mol Med, 2014, 6: 99-119. DOI:10.1002/emmm.201302909 |
| [57] |
O'Brien DI, Nally K, Kelly RG, et al. Targeting the Fas/Fas ligand pathway in cancer[J]. Expert Opin Ther Targets, 2005, 9: 1031-1044. DOI:10.1517/14728222.9.5.1031 |
| [58] |
Wang JY, Zhao XQ, Wang CM, et al. Arsenic trioxide enhances TRAIL inducing human lung cancer cell line A549 cells apoptosis by down-regulate the expression of NF-kappaB[J]. J Sichuan Univ (Med Sci Edi) (四川大学学报(医学版)), 2012, 43: 834-838. |
| [59] |
Zhou L, Jiang L, Xu M, et al. Miltirone exhibits antileukemic activity by ROS-mediated endoplasmic reticulum stress and mitochondrial dysfunction pathways[J]. Sci Rep, 2016, 6: 20585. DOI:10.1038/srep20585 |
| [60] |
Carmeliet P, Jain RK. Molecular mechanisms and clinical applications of angiogenesis[J]. Nature, 2011, 473: 298-307. DOI:10.1038/nature10144 |
| [61] |
Yang MH, Zang YS, Huang H, et al. Arsenic trioxide exerts anti-lung cancer activity by inhibiting angiogenesis[J]. Curr Cancer Drug Targets, 2014, 14: 557-566. DOI:10.2174/1568009614666140725090000 |
| [62] |
Zhou CY, Gong LY, Liao R, et al. Evaluation of the target genes of arsenic trioxide in pancreatic cancer by bioinformatics analysis[J]. Oncol Lett, 2019, 18: 5163-5172. |
| [63] |
Li YB, Lv C, Zhang WD. Application of methods on target identification and validation of label-free natural products[J]. Acta Pharm Sin (药学学报), 2019, 54: 98-104. |
 2021, Vol. 56
2021, Vol. 56


