2. 南华大学附属第二医院, 湖南 衡阳 421001;
3. 大理大学公共卫生学院, 云南 大理 671000;
4. 湘潭医卫职业技术学院, 湖南 湘潭 411104;
5. 大理大学农学与生物科学学院, 云南 大理 671000;
6. 云南省昆虫生物医药研发重点实验室, 云南 大理 671000
2. The Second Hospital of Nanhua University, Hengyang 421001, China;
3. College of Public Health, Dali University, Dali 671000, China;
4. Xiangtan Medicine and Health Vocational College, Xiangtan 411104, China;
5. College of Agriculture and Biological Science, Dali University, Dali 671000, China;
6. Yunnan Provincial Key Laboratory of Entomological Biopharmaceutical R & D, Dali 671000, China
溃疡性结肠炎(ulcerative colitis, UC)是一种炎症性肠病, 一般以肠道慢性、持续性、复发和非特异性溃疡为特征, 主要的临床表现为腹痛、腹泻和便血等, 病情迁延难愈, 甚至有癌变风险, 已被世界卫生组织列为现代难治性疾病[1-3]。目前UC的病因尚未完全明确, 研究表明, 肠道菌群失调在UC的发病机制中起着重要的作用[4-7]。
肠道菌群是寄居于宿主肠道内并与宿主共生的多种微生物群落的总称, 包括细菌群、古生菌群和真菌群等, 厚壁菌门(Firmicutes)及拟杆菌门(Bacteroidetes)是人类肠道内的主要细菌, 其相对丰度占比为66%~98%;定植于人体肠道内的菌群数量约是人体细胞数量的10倍, 种类多达1 000多种, 被认为是人体器官或人类的第二基因组, 在宿主的代谢和免疫中起着决定性作用[8]。正常情况下, 肠道菌群在机体内保持动态平衡; 一旦平衡被破坏, 便形成肠道菌群失调, 表现为肠道菌群多样性、结构和细菌丰度的变化, 尤其是益生菌的减少和病原菌的增加, 是UC的潜在发病机制[1]。
目前临床上常采用5-氨基水杨酸类和糖皮质激素、免疫抑制剂等治疗UC, 但存在治愈率低、易复发等不足, 且长期使用会产生一些不良反应, 如不耐受或过敏反应等[9, 10]。我国拥有丰富的动植物中草药资源, 由于其“多成分、多靶点、多途径、整体调节”等特点, 成为近年来抗UC药物的研究热点之一。研究显示, 中草药(活性成分、单味中草药及其提取物、中药复方)可以有效改善UC的症状; 而调节肠道菌群失调是中草药治疗UC的重要潜在靶点; 如小檗碱可以增加产乳酸菌和碳水化合物水解菌, 减少条件致病菌[11]; 黄柏酮可调节肠道菌群组成[12]; 美洲大蠊醇提物和黄连解毒汤可增加乳酸杆菌属Lactobacillus等有益菌, 减轻结肠炎症[13, 14]。本文对基于肠道菌群调控的抗UC中草药进行初步总结, 以期为相关研究提供参考。
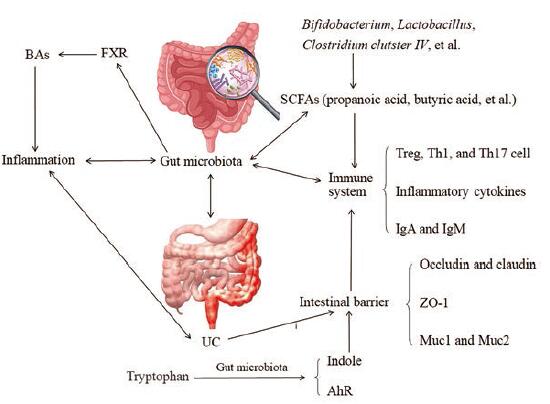
1 肠道菌群影响UC的作用机制肠道菌群与胆汁酸(bile acids, BAs)、短链脂肪酸(short-chain fatty acids, SCFAs)和色氨酸等代谢, 免疫系统以及肠黏膜屏障等相互作用(图 1), 并可通过以上机制加剧或缓解UC。
|
Figure 1 Association of gut microbiota with bile acids (BAs), tryptophan, short-chain fatty acids (SCFAs), immune system, and ulcerative colitis (UC).FXR: Farnesoid X receptor; Treg: Regulatory T cells; Th: T-helper cell; Muc: Mucin; ZO-1:Zona occluden; Ah R: Aryl hydrocarbon receptor |
BAs由胆固醇合成, 分为初级BAs和次级BAs。在肝脏中, 初级BAs结合牛磺酸(小鼠)或甘氨酸(人), 释放到肠道; 肠道菌群可通过胆盐水解酶将共轭的初级BAs转化为游离BAs, 游离BAs通过脱羟基进一步转化为次级BAs; 次级BAs的增加, 可能对结肠上皮结构和功能产生有害影响, 如诱导DNA氧化损伤、诱发炎症等[15, 16]。
BAs与肠道菌群可相互作用, BAs可直接影响肠道细菌的整体代谢, 还可通过改变菌群组成、结构等重塑肠道菌群, 如促进胆汁酸代谢细菌的生长, 抑制乳酸杆菌属等细菌的生长[17]。研究显示, 乳酸杆菌属可恢复肠道免疫系统平衡, 诱导调节性T细胞(regulatory T cells, Treg)分化, 提高肠黏膜屏障的完整性, 还可减少促炎细胞因子; UC动物模型中, 乳酸杆菌属丰度降低, 摄入Lactobacillus plantarum L15可减轻结肠炎, 改善葡聚糖硫酸钠(dextran sulfate sodium, DSS)诱导的肠道菌群失调[5, 18, 19]。
此外, BAs是法尼酯衍生物X受体(farnesoid X receptor, FXR)的内源性激动剂, 通过与FXR结合, 诱导产生抗菌肽, 调控炎症反应、肠屏障功能以及肠道菌群等[15, 16]。
有研究发现, UC动物模型中, 牛磺鹅去氧胆酸水平、血清总BAs含量显著增加, 乳酸杆菌属丰度降低, 提示UC动物机体内胆汁酸代谢发生紊乱、肠道菌群失调[15, 20]。
1.1.2 短链脂肪酸代谢SCFAs, 如丁酸、丙酸和乙酸等, 是肠道菌群转化膳食成分产生的代谢物, 也是维持肠内稳态的重要物质, 可降低肠道的p H值, 减少结肠氧化应激, 抑制病原菌的生长, 调节炎症相关信号通路和辅助性T细胞17 (T-helper cell 17, Th17)/Treg细胞平衡, 维持肠黏膜屏障, 为肠细胞提供能量, 发挥抗炎作用[1, 2, 21-24]。有研究报道UC患者SCFAs代谢产物减少, 可能导致机体肠道、免疫功能等障碍[25, 26]; 另有研究显示, 在UC患者或动物模型中, 特异性产SCFAs菌, 如Clostridium clutster IV、Clostridium subcluster XIVa、Butyricimonas spp.、罗氏菌属Roseburia等丰度降低, 通过调节上述产SCFAs菌丰度及SCFAs水平, 可能是改善UC症状的作用机制之一[14, 27-29]。
1.1.3 色氨酸代谢色氨酸是一种必需的芳香族氨基酸, 是大量微生物和宿主代谢物的生物合成前体。色氨酸在胃肠道的代谢主要包括: 通过吲哚胺2, 3-双加氧酶(indoleamine 2, 3-dioxygenase, IDO) 1作用使色氨酸沿犬尿酸途径分解代谢; 由肠菌将色氨酸直接转化为吲哚及吲哚衍生物[芳基烃受体(aryl hydrocarbon receptor, Ah R)配体]等。肠道菌群可调节色氨酸代谢, 通过调节肠道菌群及色氨酸、吲哚乙酸的稳态, 可激活结肠组织Treg细胞中的Ah R信号, 增加抗炎细胞因子, 如白细胞介素-10 (interleukin-10, IL-10)和转化生长因子-β(transforming growth factor-β, TGF-β)的分泌, 减轻DSS诱导的小鼠结肠炎的严重程度[30-32]。有研究报道UC患者的IDO1活性较高, 血清色氨酸、吲哚丙酸等吲哚衍生物水平较低, 且血清色氨酸与炎症标志物水平呈负相关[33, 34]; 吲哚-3-甲醇可通过增加IL-22的水平, 促进丁酸的产生, 增加肠道中产生丁酸的革兰阳性菌丰度, 调节菌群失调, 抑制小鼠结肠炎[35]; 另有研究显示, UC动物模型中, 色氨酸水平与乳酸杆菌属丰度呈正相关[11]; 通过摄入色氨酸可改善DSS诱导的小鼠结肠炎症状[36]。
此外, 丝氨酸和苏氨酸等氨基酸的代谢也与UC的发生和发展密切相关, 补充丝氨酸可改变结肠微生物群的组成, 恢复丝氨酸和苏氨酸等代谢, 有助于DSS诱导UC动物模型结肠组织的修复[11, 37]。
1.2 调节免疫系统 1.2.1 免疫细胞溃疡性结肠炎是一种自身免疫性疾病, 肠道菌群失调是UC影响宿主肠黏膜免疫的重要病理因素[38]。研究显示, UC大鼠的肠上皮细胞损伤以及肠道紧密连接屏障功能丧失, 肠道通透性增加[39]; 肠道紧密连接的损伤和黏蛋白的耗尽使细菌和一些抗原侵入结肠固有层, 导致宿主天然免疫系统的激活, 诱导T细胞激活[5]; T细胞的过度激活和Treg细胞的缺乏导致持续性免疫紊乱和肠道炎症[2]。研究发现, 在UC患者和小鼠粪便中, 阿克曼菌属的强效的抗炎肠道细菌艾克曼菌(Akkermansia muciniphila, 俗称“Akk菌”)丰度显著降低, 而口服灭活的Akk菌或其外膜蛋白Amuc_1100, 可减少巨噬细胞和细胞毒性T淋巴细胞的结肠浸润, 改善UC症状[40]。
在UC动物模型中, 促炎细胞因子水平显著升高, 可导致UC的免疫细胞(Th1/Th2和Th17/Treg)失衡; 而通过调节特异性肠道菌群(乳酸杆菌属、产丁酸菌等)及其代谢物, 可恢复Th1/Th2和Th17/Treg稳态, 缓解UC症状; 研究提示, 与肠道免疫系统平衡相关的乳酸杆菌属可诱导Treg细胞分化; 脆弱拟杆菌Bacteroides fragilis能特异性诱导全身Th1和Treg细胞反应, 保护小鼠免受病原体诱导的结肠炎的影响[2, 5, 13]。
1.2.2 免疫活性物质免疫活性物质包括细胞因子(白细胞介素、肿瘤坏死因子等)和免疫球蛋白等。研究显示, 白细胞介素(IL-6、IL-1β、IL-10和IL-17等)、肿瘤坏死因子α(tumor necrosis factor alpha, TNF-α)等细胞因子及免疫球蛋白(IgA和IgM等)水平的变化与UC的发生和发展关系密切[18]。
炎性细胞因子是在刺激反应中产生的小蛋白, 主要由外周的免疫细胞合成, 包括促炎细胞因子(IL-6、IL-17、IL-1β和TNF-α等)和抗炎细胞因子(IL-4和IL-10等), 肠道菌群可能通过调控炎性细胞因子的表达调节肠黏膜屏障的完整性, 影响黏膜免疫功能, 引起免疫性炎症, 如乳酸杆菌属可通过刺激免疫细胞, 抑制促炎细胞因子释放, 诱导抗炎细胞因子分泌[13]; 正常情况下, 抗炎细胞因子维持肠道通透性, 而当抗炎细胞因子IL-10的功能被抑制时, 促炎细胞因子TNF-α、IL-1β和IL-6等大量产生, 诱发炎症反应, 可能导致肠黏膜功能障碍[41]。研究报道, 在UC动物模型中, TNF-α、IL-6和IL-1β水平显著升高, IL-10水平明显降低, 肠道某些特异性菌群的变化与这些炎性细胞因子的表达密切相关[18], 如瘤胃菌科(Ruminococcaceae)、阿克曼菌属Akkermansia、双歧杆菌属Bifidobacterium等菌群变化与肠细胞损伤和结肠中促炎性细胞因子水平呈负相关; 而双歧杆菌属对DSS诱导的结肠炎具有保护作用, 如减少促炎细胞因子的表达和氧化损伤[18, 42]。
免疫球蛋白是具有抗体活性的一类蛋白质, 可保护机体不受微生物和“外来物”的危害; IgA和IgM等免疫球蛋白能与肠道微生物群相互作用, 维持肠道菌群多样性[43]。IgA是研究的最为广泛且与肠道菌群调节相关的免疫因子之一, 可阻止有害的细菌侵入机体[43]。研究报道, 在UC患者和动物模型中, 肠道菌群失调程度与免疫球蛋白指标水平明显相关, 随肠道菌群失调加重, 血清IgM和IgA水平下降[44]。
1.2.3 其他Toll样受体4 (Toll-like receptors 4, TLR4)是Toll样受体蛋白家族的成员, TLR4的轻微激活是维持免疫稳态的必要条件, 但过度激活又可诱导宿主产生一系列促炎免疫反应[12]。研究显示, 在UC患者和动物模型中, TLR4的过度激活启动了TLR信号转导中的关键接头分子髓样分化因子88 (myeloid differentiation factor 88, MyD88)的活化, 触发核因子κB (nuclear factor kappa-B, NF-κB)信号通路的激活和炎症介质的产生, 诱导TLR4-MyD88-NF-κB信号通路紊乱[45]。
NOD样受体(NOD-like receptors, NLR)的家族成员NLRP12 (NOD-like receptors family 12)是TLR信号通路的负向调节因子, 可维持结肠微生物多样性, 促进共生菌生长, 减轻结肠炎症; 肠道菌群失调可能刺激TLR4过度表达, 抑制NLRP12的表达, 在UC的发生和发展中发挥重要作用[9]。有研究显示, UC患者NLRP12的水平明显下调[9, 46]。
1.3 影响肠黏膜屏障肠黏膜屏障是指将肠腔内细菌和抗原等物质与机体内环境隔离, 防止致病性抗原侵入黏膜下层组织的肠黏膜结构; 肠道菌群在肠道黏膜上皮细胞中定植, 附着在肠黏膜表面, 形成抵御外界刺激的化学屏障[47]。肠道菌群紊乱可影响肠黏膜紧密连接蛋白的表达及分布, 抑制黏蛋白的生成, 破坏肠道黏液层, 损害肠黏膜屏障的完整性和功能[12]。在UC患者或动物模型中, 紧密连接跨膜蛋白occludin、claudin和带状闭合蛋白-1(zona occluden 1, ZO-1)等紧密连接蛋白或黏蛋白Muc1、Muc2表达下降, 肠黏膜屏障受到破坏, 而调节某些特异性菌群可改变上述紧密连接蛋白和黏蛋白的表达, 修复受损的肠黏膜屏障, 缓解UC症状; 乳酸杆菌属可通过防止细胞因子诱导的肠上皮细胞凋亡和提高肠上皮细胞Muc2 mRNA水平, 保护结肠屏障功能, 减轻肠道炎症[5, 41, 48-50]。
2 中草药治疗溃疡性结肠炎的肠道菌群调节据报道, 基于肠道菌群调节发挥抗UC作用的中草药包括: 中草药活性成分(黄酮类、生物碱类、多酚类和萜类等)、单味中草药及其提取物和中药复方等, 其可通过影响肠道菌群的多样性、结构、组成以及代谢产物等, 调节肠道菌群失调并有效改善UC症状[51-71]。
2.1 活性成分 2.1.1 黄酮类黄酮类化合物是两个具有酚羟基的苯环通过中间三碳链相互连接而成的一类化合物。研究显示, 黄芩苷(baicalin)、高良姜素(galangin)、匹诺塞林(pinocembrin)、芹菜素(apigenin)、根皮素(phloretin)等多种黄酮类化合物可改善UC的肠道菌群失调, 减轻其炎症反应(表 1[5, 41, 48, 51, 52])。
| 表 1 Flavanoids on anti-UC |
黄芩苷是从中药黄芩中提取的一种黄酮类化合物。研究发现, 黄芩苷可以升高粪便丁酸水平及产丁酸菌Butyricimonas spp.、Roseburia spp.和Subdoligranulum spp.等丰度, 增加ZO-1、occludin和Muc2的表达, 调节Th17/Treg平衡, 减轻UC大鼠的肠黏膜损伤, 提示黄芩苷可用于治疗UC[48, 53]。
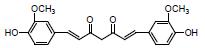
高良姜素是中药高良姜主要的活性物质。研究显示, 高良姜素可调节DSS诱导UC小鼠的肠道菌群多样性, 上调厚壁菌门/拟杆菌门(F/B)比例, 增加益生菌Lactobacillus spp.、产丁酸菌Butyricimonas spp.及SCFAs(乙酸、丙酸和丁酸)水平, 抑制IL-6、IL-1β和TNF-α等促炎症因子, 揭示高良姜素的抗UC作用机制可能与调节肠道菌群失调及抗炎等有关[51, 54]。
匹诺塞林存在于中药蜂胶中。研究提示, 匹诺塞林给药后, DSS诱导UC大鼠的盲肠Lactobacillus spp.增多, SCFAs (乙酸和丁酸)水平升高, 结肠组织中炎症相关因子IL-6、IL-1β和TNF-α水平下降, 肠黏膜紧密连接蛋白occludin和ZO-1表达增加, UC症状得到缓解, 表明匹诺塞林可能通过调节肠道菌群失衡、抗炎、恢复肠黏膜屏障功能等发挥抗UC作用[41]。
芹菜素存在于车前子、藿香等中药中, 可以通过激活NLRP6调节肠道菌群的组成, 减轻小鼠急性结肠炎的症状[52]。
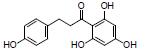
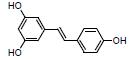
根皮素存在于苹果和梨等植物中。研究报道, 根皮素可以升高DSS诱导UC小鼠粪便中乳酸杆菌属和另枝菌属Alistipes丰度, 降低颤杆菌属Oscillibacter和Ruminiclostridium_6丰度, 保护肠黏膜屏障完整性, 恢复脾脏的Th17/Treg平衡, 抑制NF-κB和NLRP3炎症体激活; 对UC有较好的疗效, 其作用机制可能与调控免疫炎症反应、修复肠黏膜屏障及调节肠道菌群失衡有关[5]。
2.1.2 生物碱生物碱是存在于生物有机体中含负氧化态氮原子的环状化合物。研究发现, 小檗碱(berberine)、氧化小檗碱(oxyberberine)、吴茱萸碱(evodiamine)、巴马汀(palmatine)等多种生物碱类化合物具有抗UC活性(表 2[11, 45, 55, 56])。
| 表 2 Alkaloids on anti-UC |
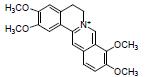
小檗碱又称黄连素, 是从中药黄连(Coptis chinensis Franch.)中分离得到的一种异喹啉类生物碱。Liao等[11]研究显示, 小檗碱可以增加产乳酸菌和碳水化合物水解菌(乳酸杆菌属和阿克曼菌属等), 减少条件致病菌(颤螺菌属Oscillospira和Mucispirillum菌属等), 调节氨基酸代谢, 改善DSS诱导UC大鼠的结肠损伤, 表明小檗碱可能通过调节肠道菌群失调和氨基酸代谢减轻UC炎症。另有研究显示, 小檗碱抗UC的作用可能还与恢复肠道菌群、脂质代谢, 调节Treg/Th17平衡等有关[57, 58]。
Li等[45]研究提示, 氧化小檗碱的抗UC疗效优于小檗碱, 肠道菌群可以将体内小檗碱转化为氧化小檗碱, 提高其生物活性; 其作用机制可能与改善肠道菌群紊乱, 调控免疫炎症反应, 抑制TLR4-MyD88-NF-κB信号通路, 修复肠黏膜屏障有关。
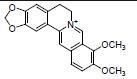
吴茱萸碱是从中药吴茱萸中分离出的喹诺酮类生物碱。研究发现, 吴茱萸碱可增加Lactobacillus acidophilus丰度, 调节厚壁菌门与拟杆菌门比例, 提高乙酸水平, 抑制促炎细胞因子的释放, 降低DSS引起的UC大鼠肠上皮损伤, 提示吴茱萸碱可能通过调节肠道菌群和其代谢物以及抗炎等减轻UC炎症[55]。
巴马汀是中药黄腾的生物活性成分, 属于异喹啉生物碱。研究显示, 巴马汀可抑制血浆中色氨酸分解代谢, 降低结肠组织中IDO1 (色氨酸分解代谢的限速酶)的蛋白表达, 恢复DSS诱导UC小鼠的肠屏障完整性, 提示巴马汀可能通过调节肠道菌群失调和恢复肠黏膜屏障, 缓解UC症状[56]。
苦豆子是豆科槐属多年生草本植物, 其主要化学成分是生物碱。研究显示, 苦豆子的总生物碱提取物可增加厚壁菌门相对丰度, 降低拟杆菌门、拟杆菌属Bacteroides丰度, 改善DSS诱导的小鼠结肠炎; 提示苦豆子可能通过调节肠道菌群失衡, 发挥抗UC作用[15]。
2.1.3 多酚多酚是指具有多个酚基的化合物, 通过调节肠道菌群失调发挥抗UC作用的代表性多酚有白藜芦醇(resveratrol)、姜黄素(curcumin)、绿原酸(chlorogenic acid)和没食子酸(gallic acid)等(表 3[18, 20, 58, 59])。
| 表 3 Polyphenols on anti-UC |
白藜芦醇主要来源于中药虎杖。研究报道, 白藜芦醇可降低阿克曼菌属丰度, 增加双歧杆菌属比例, 抑制IL-6、IL-1β和TNF-α等促炎细胞因子的表达, 减轻结肠组织损伤, 提示白藜芦醇可能通过调节肠道菌群组成及炎性细胞因子治疗UC[18]。另有研究显示, 白藜芦醇可逆转肠道菌群失调(增加Akk菌和Ruminococcus gnavus, 降低Bacteroides acidifaciens, 上调乙酸和正丁酸水平), 诱导Tregs抑制Th1/Th17细胞, 对UC小鼠有保护作用[60]。
姜黄素是从中药姜黄中提取的天然黄色多酚。研究显示, 姜黄素可增加Clostridium cluster IV、Clostridium subcluster XIVa和粪便SCFAs水平, 抑制NF-κB的激活, 改善黏膜通透性, 逆转DSS诱导UC小鼠的结肠炎症, 表明姜黄素的抗UC作用机制可能与调节肠道菌群紊乱和抑制NF-κB的表达相关[28]。
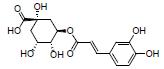
绿原酸主要来源于忍冬科植物忍冬的花蕾(中药金银花)。研究提示, 绿原酸可增加阿克曼菌属的相对比例, 抑制γ-干扰素(interferon-γ, IFN-γ)、TNF-α和IL-6等炎性细胞因子分泌和NF-κB信号通路, 改善DSS诱导的急性结肠炎, 揭示绿原酸对UC的保护作用可能与调节肠道菌群失调及抗炎等有关[59]。
没食子酸存在于五倍子等多种药用植物中。研究报道, 没食子酸可通过调节胆汁酸代谢(减少脱氧胆酸和牛磺鹅去氧胆酸等)和氨基酸代谢, 逆转肠道菌群失调, 发挥抗UC作用[20]。
2.1.4 萜类萜类化合物是分子式以异戊二烯为整数倍的烃类及其含氧衍生物。据报道, 萜类化合物柴胡皂甙D (saikosaponin D)和雷公藤甲素(triptolide)可通过调节肠道菌群失调, 改善UC的病理变化(表 4[61, 62])。
| 表 4 Terpenoids on anti-UC |
柴胡皂甙D是从中药柴胡中分离得到的三萜类化合物。有研究表明, 柴胡皂甙D可增加粪便肠道菌群多样性, 降低Ruminiclostridium-6丰度, 增加罗氏菌属(产丁酸菌)丰度, 下调结肠组织TNF-α、IL-6和IL-1β的表达, 上调结肠组织IL-10、Muc1、Muc2的mRNA表达及ZO-1和claudin-1蛋白水平, 减轻DSS诱导的肠道炎症, 其作用机制可能与调节肠道菌群紊乱、调控炎症反应、恢复肠屏障的完整性等有关[61]。
雷公藤甲素是从中药雷公藤中分离出的环氧化二萜内酯化合物。研究显示, 雷公藤甲素可显著改善肠道菌群α和β多样性。在门水平上, 厚壁菌门数量增加, 拟杆菌门数量降低; 在属水平上, 减少拟杆菌属和毛螺菌属Lachnospiraceae等的数量, 改善DSS诱导UC小鼠的症状。提示, 雷公藤甲素可能通过调节肠道菌群的组成和加速菌群的恢复, 发挥治疗UC的作用[62]。
2.1.5 其他黄柏酮(obacunone)、丹酚酸A (salvianolic acid A)、瑞香素(daphnetin)等化合物可通过调节肠道菌群失调治疗UC (表 5[12, 39, 63])。
| 表 5 Chemical compounds on anti-UC |
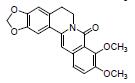
黄柏酮是中药黄柏的有效成分, 属于柠檬苦素类化合物。研究发现, 黄柏酮可降低变形菌门(Proteobacteria)、志贺氏菌属Escherichia-Shigella丰度、促进紧密连接蛋白的表达, 抑制TLR4/NF-κB信号的过度激活, 减轻DSS诱导UC小鼠的症状, 作用机制可能与调节肠道菌群组成和TLR4/NF-κB信号通路等有关[12]。
另有研究报道, 中药丹参提取物中的水溶性酚酸类化合物丹酚酸A、瑞香的主要活性成分香豆素衍生物瑞香素、灵芝提取物中的灵芝多糖及人体血液循环中最为丰富的甾体物质去氢表雄酮, 可调节肠道菌群失调(增加有益菌及SCFAs-产生菌, 减少致病菌), 抑制促炎细胞因子的分泌或改善肠黏膜完整性, 缓解UC症状[39, 63-65]。
2.2 单味中草药及其提取物木榄[Bruguiera gymnorhiza (L.) Lam.]、嘉宝果(Myrciaria cauliflora Berg)、美洲大蠊(Periplaneta americana)、华蟾素(cinobufacini)等单味中草药及其提取物的抗UC作用与调节肠道菌群紊乱有关(表 6[13, 66-68])。
| 表 6 Single traditional Chinese medicine (TCM) and its extracts on anti-UC |
木榄为我国传统药用植物, 其水提物对DSS诱导的UC小鼠有保护作用, 潜在机制可能包括维持宿主的肠道菌群平衡, 如促进肠道益生菌(双歧杆菌属和乳酸杆菌属)的生长, 抑制病原菌(拟杆菌属)等的定植[66]。
嘉宝果的果皮富含酚类化合物, 其水提物可以减轻UC大鼠的结肠炎严重程度, 其作用机制可能与逆转菌群失调(增加乳酸杆菌属和双歧杆菌属)、抗炎和抗氧化有关; 该研究结果还显示, 嘉宝果提取物对UC大鼠肠道菌群的调节作用强于美沙拉嗪[67]。
美洲大蠊是蜚蠊科昆虫, 有胃肠道保护等多种生物活性。研究发现, 在DSS诱导的UC大鼠中表现出肠道菌群失调的症状, 即F/B比例下调, 益生菌乳酸杆菌属、罗氏菌属和果胶杆菌属Pectobacterium降低, 这些益生菌与检测到的促炎细胞因子(IFN-γ、TNF-α、IL-6和IL-1β等)呈负相关, 而美洲大蠊醇提物可通过恢复肠道菌群失衡, 改善肠黏膜屏障功能, 激活KELCH样ECH关联蛋白1/核因子-E2相关因子, 减轻结肠炎症[13]。
华蟾素是中华大蟾蜍全皮的水提物。研究报道, DSS诱导UC小鼠中的致病菌克雷伯菌属Klebsiella、变形杆菌属Proteus、肠杆菌属Entrobacter的相对丰度显著升高, 而华蟾素可降低以上致病菌的相对丰度, 增强肠黏膜屏障完整性, 改善UC症状, 作用机制可能与调节肠道菌群组成有关[68]。
2.3 中药复方黄连解毒汤(Huang-lian-Jie-du decoction)、黄芩汤(Huangqin decoction)、理中汤(Lizhong decoction)、大黄牡丹汤(Rhubarb Peony decoction)、三黄熟艾汤(Sanhuangshu'ai decoction)等中药复方可通过调控肠道菌群改善UC的肠道炎症及相关症状(表 7[1-3, 9, 14, 69-71])。
| 表 7 Formulae of TCM on anti-UC |
黄连解毒汤由中药黄连(Coptidis Rhizoma)、黄芩(Scutellariae Radix)、黄柏(Phellodendri Chinensis Cortex) 和栀子(Gardeniae Fructus) 组成, 具有多种药理活性。黄连解毒汤的正丁醇组分可以抑制肠道病原体的生长, 增加有益菌乳酸杆菌属及Clostridium IV、Clostridium XIVa、另枝菌属等产SCFAs细菌的相对丰度, 恢复DSS诱导UC小鼠的肠道菌群稳态, 减轻UC病理损伤, 提示黄连解毒汤可能通过调节UC小鼠肠道菌群的结构和功能障碍, 减轻UC症状[14]。
黄芩汤由黄芩(Scutellariae Radix)、白芍(Paeoniae Radix Alba)、大枣(Jujubae Fructus) 和炙甘草(Glycyrrhizae Radix Et Rhizoma) 4味中药组成, 是临床常用于治疗UC的中药复方[72]。研究显示, 黄芩汤可恢复肠道菌群多样性, 增加乳酸杆菌属丰度, 减少变形菌门、Ruminococcaceae_UCG-014等丰度, 降低炎症介质的表达, 改善DSS诱导UC小鼠的肠道炎症, 作用机制可能与调节肠道菌群紊乱, 调控炎症反应有关[69]。
理中汤由人参(Ginseng Radix Et Rhizoma)、白术(Atractylodes Macrocephala)、炙甘草(Glycyrrhizae Radix Et Rhizoma) 和干姜(Zingiberis Rhizoma) 4种中药组成。研究表明, 理中汤可能通过改善肠道菌群紊乱, 如降低与肠道炎症有关的志贺氏菌属和Enterobacter等丰度, 升高布劳特氏菌属Blautia、Prevotellaceae UCG-001和Ruminiclostridium 9等丰度; 缓解UC小鼠的病理症状; 同时, 反映微生物活性的粪便代谢物谱显示, 理中汤给药后, L-色氨酸和胆酸水平明显增加, 而脱氧胆酸和腺苷水平显著降低[3]。
大黄牡丹汤由大黄(Rhei Radix Et Rhizoma)、牡丹皮(Moutan cortex)、桃仁(Persicae semen)、冬瓜仁(Benincasae semen) 和芒硝(Natrii Sulfas) 5味中药组成, 可增加放线菌门(Actinobacteria) 和Butyricicoccus pullicaecorum丰度, 减少变形菌门和拟杆菌门丰度, 恢复肠道Th17/Treg稳态和SCFAs的含量, 下调IL-6、TNF-α、IFN-γ和IL-10等, 上调TGF-β, 减轻DSS诱导UC小鼠的病理变化, 提示大黄牡丹汤可能通过调节肠道菌群紊乱, 减轻炎性反应等, 发挥抗UC作用[2]。
三黄熟艾汤由黄芩(Scutellariae Radix)、黄连(Coptidis Rhizoma)、黄柏(Phellodendri Chinensis Cortex) 和熟艾(Artemisiae Argyi Folium) 4味中药组成。研究显示, 三黄熟艾汤可通过促进Lactobacillus spp.相对丰度的恢复, 重建肠道菌群平衡, 抑制NF-κB信号和氧化应激, 改善UC症状[70]。
清肠温中方由中药黄连(Coptidis Rhizoma)、炮姜(Zingiberis Rhizoma Praeparata)、苦参(Sophora flavescens Ait)、青黛(Indigo Naturalis)、地榆炭(Sanguisorbae Radix)、木香(Aucklandiae Radix)、三七(Notoginseng Radix Et Rhizoma) 和炙甘草(Glycyrrhizae Radix Et Rhizoma) 组成。研究报道, 清肠温中方可以调节肠道菌群组成, 选择性地增加保护菌, 减少病原菌, 抑制TLR4/Blimp-1轴的活性, 促进肠道微生物介导NLRP12表达, 以改善肠黏膜屏障, 抑制肠道炎症, 有效缓解DSS诱导的结肠炎症状[9]。
溃结灵汤由救必应(Ilicis Rotundae Cortex)、白术(Atractylodes Macrocephala)、白芍(Paeoniae Radix Alba)、水蛭(Hirudo) 和炙甘草(Glycyrrhizae Radix Et Rhizoma) 5味中药组成。研究发现, 溃结灵汤可提高肠道中革兰阳性菌的相对丰度, 降低潜在致病菌的相对丰度, 调节丁酸代谢, 改善UC症状, 提示溃结灵汤的抗UC作用可能与重塑肠道菌群组成和功能有关[71]。
嘎日迪散是一种常用的治疗UC的蒙药方剂, 由野罂粟(Papaver nudicaule L.) 和阿给(Artemisia frigida Willd) 组成, 可以缓解DSS诱导UC小鼠的肠道组织损伤, 其作用机制可能与调节肠道菌群失衡有关, 且毛螺菌属可能是其治疗UC的重要靶点[1]。
3 总结与展望肠道菌群失调与UC的发生发展密切相关。中草药活性成分(黄酮类、生物碱类、多酚类和萜类等)、单味中草药及其提取物、中药复方等可通过调节肠道菌群多样性及组成、结构等有效改善UC症状。
中草药是传统中医药的核心部分, 据报道, 其他中医疗法, 如电针和艾灸等, 也可通过调节肠道菌群多样性和组成等, 显著减轻UC的临床症状和病理损伤[73-75]; 另有研究显示, 通过肠道菌群有助于鉴别UC的大肠湿热、脾虚失运两种中医证候[76], 提示肠道菌群在以中草药为中心的中医药抗UC研究前景可观。
目前该研究领域仍存在一些不足: 现阶段研究常采用16S r RNA或16S rDNA检测肠道菌群变化, 然而, 16S r RNA或16S rDNA测序主要包括细菌和古菌基因组, 忽略了非细菌生物, 如病毒、真菌和噬菌体; 多项研究只讨论了抗UC中草药对肠道菌群结构和组成的调控, 而对肠道菌群功能和代谢的调控机制的研究有待深入; 中药复方成分复杂, 其具体抗UC作用机制有待深入研究, 且研究多局限于动物实验, 临床试验研究相对较少; 药物可影响菌群的生长和组成, 也可被菌群代谢失活或转化, 直接或间接地影响免疫调节药物的活性及药物的治疗效果[77], 肠道菌群对具体抗UC药物的影响尚有待深入探索。
随着宏基因组学、宏转录组学、新一代测序技术(高通量或大规模并行测序)等的开发, 克服了传统方法的局限性, 对肠道菌群的研究更为深入, 可更全面地分析肠道菌群的结构组成、多样性等。新一代测序可描述样本中存在的所有DNA或RNA信息, 分析整个微生物组以及患者样本中的人类宿主基因组或转录组; 还可与靶向方法相结合, 如使用16S rRNA和内部转录间隔序列的保守区引物分别进行细菌和真菌的检测, 对这些微生物进行物种水平的鉴别。目前该技术已应用于中枢神经系统感染、呼吸道感染、腹泻等疾病[78]。
肠道菌群可产生各种生物活性代谢产物, 这些代谢产物可以通过吸收进入肠肝循环而进入宿主血液循环系统。与疾病表型相关的特定代谢物可以通过基于粪便、血浆、尿液和组织的代谢组学技术进行鉴定, 从而对微生物组、代谢组和宿主表型进行联合分析, 以发现潜在的联系机制。今后的研究, 可考虑将新一代测序技术与代谢组学技术等联用, 进一步探索肠道菌群中非细菌生物及代谢产物的变化, 并将中草药的治疗作用与肠道菌群的多样性、结构、组成变化及代谢产物的差异相联系, 更准确地阐述中草药通过调节肠道菌群抗UC的机制。未来对肠道菌群的解释和信息挖掘, 应结合临床经验及相关文献建立完整的知识体系, 并在此基础上构建对应数据库, 如肠道菌群代谢物库等。其次, 应加强对抗UC中草药活性成分的研究(应用筛选等技术得到活性先导化合物, 探索其合成方法, 评价高效低毒成分的活性), 并可考虑将已取得的研究结果尽快进行临床验证, 如将已经在动物实验中明确的抗UC中草药调节的特定菌群, 通过粪菌移植或对特定菌群进行培养、鉴定后用于UC的临床实验; 还可通过抑制微生物酶、消减特定菌株和引进新菌株及菌群的遗传修饰等, 对相关菌群进行靶向干预, 有助于提高UC治疗效果并实现精准医疗[77]。
作者贡献: 高鹏飞、陶柱萍、龙宇、尹爱武负责组织文章的框架, 文章的撰写及修改; 李灿委、范孟然、刘卫红负责收集整理文献资料; 厉颖为文章提供了重要的指导和意见。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Pei LY, Ke YS, Zhao HH, et al. Regulatory effect of Garidisan on dysbiosis of the gut microbiota in the mouse model of ulcerative colitis induced by dextran sulfate sodium[J]. BMC Complement Altern Med, 2019, 19: 329. DOI:10.1186/s12906-019-2750-y |
| [2] |
Luo S, Wen R, Wang Q, et al. Rhubarb Peony Decoction ameliorates ulcerative colitis in mice by regulating gut microbiota to restoring Th17/Treg balance[J]. J Ethnopharmacol, 2019, 231: 39-49. DOI:10.1016/j.jep.2018.08.033 |
| [3] |
Zou J, Shen Y, Chen M, et al. Lizhong decoction ameliorates ulcerative colitis in mice via modulating gut microbiota and its metabolites[J]. Appl Microbiol Biotechnol, 2020, 104: 5999-6012. DOI:10.1007/s00253-020-10665-1 |
| [4] |
Etienne-Mesmin L, Chassaing B, Gewirtz AT. Tryptophan: a gut microbiota-derived metabolites regulating inflammation[J]. World J Gastrointest Pharmacol Ther, 2017, 8: 7-9. DOI:10.4292/wjgpt.v8.i1.7 |
| [5] |
Wu M, Li P, An Y, et al. Phloretin ameliorates dextran sulfate sodium-induced ulcerative colitis in mice by regulating the gut microbiota[J]. Pharmacol Res, 2019, 150: 104489. DOI:10.1016/j.phrs.2019.104489 |
| [6] |
Ma XR, Wang YL, Zou DX, et al. Comparison of intestinal bacteria and inflammatory cytokine expression in rats with ulcerative colitis after treatment of three regiments[J]. Acta Pharm Sin(药学学报), 2019, 54: 1241-1250. |
| [7] |
Chen Y, Zhang L, Hong G, et al. Probiotic mixtures with aerobic constituent promoted the recovery of multi-barriers in DSS-induced chronic colitis[J]. Life Sci, 2020, 240: 117089. DOI:10.1016/j.lfs.2019.117089 |
| [8] |
Chen D, Wu J, Jin D, et al. Fecal microbiota transplantation in cancer management: current status and perspectives[J]. Int J Cancer, 2019, 145: 2021-2031. DOI:10.1002/ijc.32003 |
| [9] |
Sun Z, Pei W, Guo Y, et al. Gut Microbiota-mediated NLRP12 expression drives the attenuation of dextran sulphate sodiuminduced ulcerative colitis by Qingchang Wenzhong Decoction[J]. Evid Based Complement Alternat Med, 2019, 2019: 9839474. |
| [10] |
Sood A, Mahajan R, Singh A, et al. Role of faecal microbiota transplantation for maintenance of remission in patients with ulcerative colitis: a pilot study[J]. J Crohns Colitis, 2019, 13: 1311-1317. DOI:10.1093/ecco-jcc/jjz060 |
| [11] |
Liao Z, Xie Y, Zhou B, et al. Berberine ameliorates colonic damage accompanied with the modulation of dysfunctional bacteria and functions in ulcerative colitis rats[J]. Appl Microbiol Biotechnol, 2020, 104: 1737-1749. DOI:10.1007/s00253-019-10307-1 |
| [12] |
Luo XP, Yue B, Yu ZL, et al. Obacunone protects against ulcerative colitis in mice by modulating gut microbiota, attenuating TLR4/NF-κB signaling cascades, and improving disrupted epithelial barriers[J]. Front Microbiol, 2020, 11: 497. DOI:10.3389/fmicb.2020.00497 |
| [13] |
Ma XW, Hu YC, Li X, et al. Periplaneta americana ameliorates dextran sulfate sodium-induced ulcerative colitis in rats by Keap1/Nrf-2 activation, intestinal barrier function, and gut microbiota regulation[J]. Front Pharmacol, 2018, 9: 944. DOI:10.3389/fphar.2018.00944 |
| [14] |
Yuan ZW, Yang LH, Zhang XS, et al. Therapeutic effect of n-butanol fraction of Huang-lian-Jie-du Decoction on ulcerative colitis and its regulation on intestinal flora in colitis mice[J]. Biomed Pharmacother, 2020, 121: 109638. DOI:10.1016/j.biopha.2019.109638 |
| [15] |
Jia Y, Yuan Z, Zhang X, et al. Total alkaloids of Sophora alopecuroides L. ameliorated murine colitis by regulating bile acid metabolism and gut microbiota[J]. J Ethnopharmacol, 2020, 255: 112775. DOI:10.1016/j.jep.2020.112775 |
| [16] |
Guo J, Han X, Tan H, et al. Blueberry extract improves obesity through regulation of the gut microbiota and bile acids via pathways involving FXR and TGR5[J]. iScience, 2019, 19: 676-690. DOI:10.1016/j.isci.2019.08.020 |
| [17] |
Tian Y, Gui W, Koo I, et al. The microbiome modulating activity of bile acids[J]. Gut microbes, 2020, 11: 979-996. DOI:10.1080/19490976.2020.1732268 |
| [18] |
Li F, Han Y, Cai X, et al. Dietary resveratrol attenuated colitis and modulated gut microbiota in dextran sulfate sodium-treated mice[J]. Food Funct, 2020, 11: 1063-1073. DOI:10.1039/C9FO01519A |
| [19] |
Yu P, Ke CX, Guo JX, et al. Lactobacillus plantarum L15 alleviates colitis by inhibiting LPS-mediated NF-κB activation and ameliorates DSS-induced gut microbiota dysbiosis[J]. Front Immunol, 2020, 11: 575173. DOI:10.3389/fimmu.2020.575173 |
| [20] |
Li Y, Xie Z, Gao T, et al. A holistic view of gallic acid-induced attenuation in colitis based on microbiome-metabolomics analysis[J]. Food Funct, 2019, 10: 4046-4061. DOI:10.1039/C9FO00213H |
| [21] |
Hu Q, Yuan B, Wu X, et al. dietary intake of pleurotus eryngii ameliorated dextran-sodium-sulfate-induced colitis in mice[J]. Mol Nutr Food Res, 2019, 63: e1801265. DOI:10.1002/mnfr.201801265 |
| [22] |
Parada Venegas D, De la Fuente M K, Landskron G, et al. Short chain fatty acids(SCFAs)-mediated gut epithelial and immune regulation and its relevance for inflammatory bowel diseases[J]. Front Immunol, 2019, 10: 277. DOI:10.3389/fimmu.2019.00277 |
| [23] |
Russo E, Giudici F, Fiorindi C, et al. Immunomodulating activity and therapeutic effects of short chain fatty acids and tryptophan post-biotics in inflammatory bowel disease[J]. Front Immunol, 2019, 10: 2754. DOI:10.3389/fimmu.2019.02754 |
| [24] |
Silva JPB, Navegantes-Lima KC, Oliveira ALB, et al. Protective mechanisms of butyrate on inflammatory bowel disease[J]. Curr Pharm Des, 2018, 24: 4154. |
| [25] |
Gonçalves P, Araújo JR, Di Santo JP. A cross-talk between microbiota-derived short-chain fatty acids and the host mucosal immune system regulates intestinal homeostasis and inflammatory bowel disease[J]. Inflamm Bowel Dis, 2018, 24: 558-572. DOI:10.1093/ibd/izx029 |
| [26] |
Lloyd-Price J, Arze C, Ananthakrishnan AN, et al. Multi-omics of the gut microbial ecosystem in inflammatory bowel diseases[J]. Nature, 2019, 569: 655-662. DOI:10.1038/s41586-019-1237-9 |
| [27] |
Fuentes S, Rossen NG, van der Spek MJ, et al. Microbial shifts and signatures of long-term remission in ulcerative colitis after faecal microbiota transplantation[J]. ISME J, 2017, 11: 1877-1889. DOI:10.1038/ismej.2017.44 |
| [28] |
Ohno M, Nishida A, Sugitani Y, et al. Nanoparticle curcumin ameliorates experimental colitis via modulation of gut microbiota and induction of regulatory T cells[J]. PLoS One, 2017, 12: e185999. |
| [29] |
Chen W, Fan H, Liang R, et al. Taraxacum officinale extract ameliorates dextran sodium sulphate-induced colitis by regulating fatty acid degradation and microbial dysbiosis[J]. J Cell Mol Med, 2019, 23: 8161-8172. DOI:10.1111/jcmm.14686 |
| [30] |
Agus A, Planchais J, Sokol H. Gut Microbiota regulation of tryptophan metabolism in health and disease[J]. Cell Host Microbe, 2018, 23: 716-724. DOI:10.1016/j.chom.2018.05.003 |
| [31] |
Roager HM, Licht TR. Microbial tryptophan catabolites in health and disease[J]. Nat Commun, 2018, 9: 3210-3294. DOI:10.1038/s41467-018-05689-1 |
| [32] |
Wei YL, Chen YQ, Gong H, et al. Fecal microbiota transplantation ameliorates experimentally induced colitis in mice by upregulating AhR[J]. Front Microbiol, 2018, 9: 1921. DOI:10.3389/fmicb.2018.01921 |
| [33] |
Nikolaus S, Schulte B, Al-Massad N, et al. Increased tryptophan metabolism is associated with activity of inflammatory bowel diseases[J]. Gastroenterology, 2017, 153: 1504-1516. DOI:10.1053/j.gastro.2017.08.028 |
| [34] |
Alexeev EE, Lanis JM, Kao DJ, et al. Microbiota-derived indole metabolites promote human and murine intestinal homeostasis through regulation of interleukin-10 receptor[J]. Am J Pathol, 2018, 188: 1183-1194. DOI:10.1016/j.ajpath.2018.01.011 |
| [35] |
Busbee PB, Menzel L, Alrafas HR, et al. Indole-3-carbinol prevents colitis and associated microbial dysbiosis in an IL-22-dependent manner[J]. JCI Insight, 2020, 5: e127551. DOI:10.1172/jci.insight.127551 |
| [36] |
Scott SA, Fu JJ, Chang PV. Microbial tryptophan metabolites regulate gut barrier function via the aryl hydrocarbon receptor[J]. Proc Natl Acad Sci U S A, 2020, 117: 19376-19387. DOI:10.1073/pnas.2000047117 |
| [37] |
Zhang H, Hua R, Zhang B, et al. Serine alleviates dextran sulfate sodium-induced colitis and regulates the gut microbiota in mice[J]. Front Microbiol, 2018, 9: 3062. DOI:10.3389/fmicb.2018.03062 |
| [38] |
Harris PA, Berger SB, Jeong JU, et al. Discovery of a first-inclass receptor interacting protein 1(RIP1)kinase specific clinical candidate(GSK2982772)for the treatment of inflammatory diseases[J]. J Med Chem, 2017, 60: 1247-1261. DOI:10.1021/acs.jmedchem.6b01751 |
| [39] |
Wang K, Yang Q, Ma Q, et al. Protective effects of salvianolic acid A against dextran sodium sulfate-induced acute colitis in rats[J]. Nutrients, 2018, 10: 791. DOI:10.3390/nu10060791 |
| [40] |
Wang L, Tang L, Feng Y, et al. A purified membrane protein from Akkermansia muciniphila or the pasteurised bacterium blunts colitis associated tumourigenesis by modulation of CD8+T cells in mice[J]. Gut, 2020, 69: 1988-1997. DOI:10.1136/gutjnl-2019-320105 |
| [41] |
Hu L, Wu C, Zhang Z, et al. Pinocembrin protects against dextran sulfate sodium-induced rats colitis by ameliorating inflammation, improving barrier function and modulating gut microbiota[J]. Front Physiol, 2019, 10: 908. DOI:10.3389/fphys.2019.00908 |
| [42] |
Bian X, Wu W, Yang L, et al. Administration of Akkermansia muciniphila ameliorates dextran sulfate sodium-induced ulcerative colitis in mice[J]. Front Microbiol, 2019, 10: 2259. DOI:10.3389/fmicb.2019.02259 |
| [43] |
Magri G, Comerma L, Pybus M, et al. Human secretory IgM emerges from plasma cells clonally related to gut memory B cells and targets highly diverse commensals[J]. Immunity, 2017, 47: 118-134. DOI:10.1016/j.immuni.2017.06.013 |
| [44] |
Wang Y, Li JX, Wang HH, et al. Relationship of intestinal flora imbalance and immunoglobulin in patients with ulcerative colitis[J]. J Pract Med(实用医学杂志), 2016, 32: 1631-1634. |
| [45] |
Li C, Ai G, Wang Y, et al. Oxyberberine, a novel gut microbiotamediated metabolite of berberine, possesses superior anti-colitis effect: impact on intestinal epithelial barrier, gut microbiota profile and TLR4-MyD88-NF-κB pathway[J]. Pharmacol Res, 2020, 152: 104603. DOI:10.1016/j.phrs.2019.104603 |
| [46] |
Chen L, Wilson JE, Koenigsknecht MJ, et al. NLRP12 attenuates colon inflammation by maintaining colonic microbial diversity and promoting protective commensal bacterial growth[J]. Nat Immunol, 2017, 18: 541-551. DOI:10.1038/ni.3690 |
| [47] |
Tian Y, Zhou Y, Huang S, et al. Fecal microbiota transplantation for ulcerative colitis: a prospective clinical study[J]. BMC Gastroenterol, 2019, 19: 116. DOI:10.1186/s12876-019-1010-4 |
| [48] |
Zhu L, Xu LZ, Zhao S, et al. Protective effect of baicalin on the regulation of Treg/Th17 balance, gut microbiota and short-chain fatty acids in rats with ulcerative colitis[J]. Appl Microbiol Biotechnol, 2020, 104: 5449-5460. DOI:10.1007/s00253-020-10527-w |
| [49] |
Sun J, Chen H, Kan J, et al. Anti-inflammatory properties and gut microbiota modulation of an alkali-soluble polysaccharide from purple sweet potato in DSS-induced colitis mice[J]. Int J Biol Macromol, 2020, 153: 708-722. DOI:10.1016/j.ijbiomac.2020.03.053 |
| [50] |
Van der Post S, Jabbar KS, Birchenough G, et al. Structural weakening of the colonic mucus barrier is an early event in ulcerative colitis pathogenesis[J]. Gut, 2019, 68: 2142-2151. DOI:10.1136/gutjnl-2018-317571 |
| [51] |
Xuan H, Ou A, Hao S, et al. Galangin protects against symptoms of dextran sodium sulfate-induced acute colitis by activating autophagy and modulating the gut microbiota[J]. Nutrients, 2020, 12: 347. DOI:10.3390/nu12020347 |
| [52] |
Radulovic K, Normand S, Rehman A, et al. A dietary flavone confers communicable protection against colitis through NLRP6 signaling independently of inflammasome activation[J]. Mucosal Immunol, 2018, 11: 811-819. DOI:10.1038/mi.2017.87 |
| [53] |
Shen J, Cheng J, Zhu S, et al. Regulating effect of baicalin on IKK/IKB/NF-κB signaling pathway and apoptosis-related proteins in rats with ulcerative colitis[J]. Int Immunopharmacol, 2019, 73: 193-200. DOI:10.1016/j.intimp.2019.04.052 |
| [54] |
Sangaraju R, Nalban N, Alavala S, et al. Protective effect of galangin against dextran sulfate sodium(DSS)-induced ulcerative colitis in Balb/c mice[J]. Inflamm Res, 2019, 68: 691-704. DOI:10.1007/s00011-019-01252-w |
| [55] |
Wang M, Lin L, Chen Y, et al. Evodiamine has therapeutic efficacy in ulcerative colitis by increasing Lactobacillus acidophilus levels and acetate production[J]. Pharmacol Res, 2020, 159: 104978. DOI:10.1016/j.phrs.2020.104978 |
| [56] |
Zhang X, Yuan Z, Qu C, et al. Palmatine ameliorated murine colitis by suppressing tryptophan metabolism and regulating gut microbiota[J]. Pharmacol Res, 2018, 137: 34-46. DOI:10.1016/j.phrs.2018.09.010 |
| [57] |
Liao Z, Zhang S, Liu W, et al. LC-MS-based metabolomics analysis of berberine treatment in ulcerative colitis rats[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2019, 1133: 121848. DOI:10.1016/j.jchromb.2019.121848 |
| [58] |
Cui H, Cai Y, Wang L, et al. Berberine regulates Treg/Th17 balance to treat ulcerative colitis through modulating the gut microbiota in the colon[J]. Front Pharmacol, 2018, 9: 571. DOI:10.3389/fphar.2018.00571 |
| [59] |
Zhang Z, Wu X, Cao S, et al. Chlorogenic acid ameliorates experimental colitis by promoting growth of Akkermansia in mice[J]. Nutrients, 2017, 9: 677. DOI:10.3390/nu9070677 |
| [60] |
Alrafas HR, Busbee PB, Nagarkatti M, et al. Resveratrol modulates the gut microbiota to prevent murine colitis development through induction of Tregs and suppression of Th17 cells[J]. J Leukoc Biol, 2019, 106: 467-480. DOI:10.1002/JLB.3A1218-476RR |
| [61] |
Li P, Wu M, Xiong W, et al. Saikosaponin-d ameliorates dextran sulfate sodium-induced colitis by suppressing NF-κB activation and modulating the gut microbiota in mice[J]. Int Immunopharmacol, 2020, 81: 106288. DOI:10.1016/j.intimp.2020.106288 |
| [62] |
Wu H, Rao Q, Ma GC, et al. Effect of Triptolide on dextran sodium sulfate-induced ulcerative colitis and gut microbiota in mice[J]. Front Pharmacol, 2019, 10: 1652. |
| [63] |
Ji J, Ge X, Chen Y, et al. Daphnetin ameliorates experimental colitis by modulating microbiota composition and Treg/Th17 balance[J]. FASEB J, 2019, 33: 9308-9322. DOI:10.1096/fj.201802659RR |
| [64] |
Cao J, Zhang H, Yang Z, et al. Effect of dehydroepiandrosterone on the immune response and gut microbiota in dextran sulfate sodium-induced colitis mice[J]. Mol Immunol, 2020, 118: 60-72. DOI:10.1016/j.molimm.2019.12.008 |
| [65] |
Xie J, Liu Y, Chen B, et al. Ganoderma lucidum polysaccharide improves rat DSS-induced colitis by altering cecal microbiota and gene expression of colonic epithelial cells[J]. Food Nutr Res, 2019, 63: 1559. |
| [66] |
Lin Y, Zheng X, Chen J, et al. Protective effect of Bruguiera gymnorrhiza(L.)Lam. fruit on dextran sulfate sodium-induced ulcerative colitis in mice: role of Keap1/Nrf2 pathway and gut microbiota[J]. Front Pharmacol, 2019, 10: 1602. |
| [67] |
Da SJ, Batista AG, Cazarin C, et al. Aqueous extract of Brazilian berry(Myrciaria jaboticaba)peel improves inflammatory parameters and modulates lactobacillus and bifidobacterium in rats with induced-colitis[J]. Nutrients, 2019, 11: 2776. DOI:10.3390/nu11112776 |
| [68] |
Bai Y, Wang S, Xu W, et al. Cinobufacini ameliorates experimental colitis via modulating the composition of gut microbiota[J]. PLoS One, 2019, 14: e223231. |
| [69] |
Li MY, Luo HJ, Wu X, et al. Anti-Inflammatory effects of Huangqin Decoction on dextran sulfate sodium-induced ulcerative colitis in mice through regulation of the gut microbiota and suppression of the Ras-PI3K-Akt-HIF-1α and NFκB pathways[J]. Front Pharmacol, 2019, 10: 1552. |
| [70] |
Wu ZC, Zhao ZL, Deng JP, et al. Sanhuang Shu'ai decoction alleviates DSS-induced ulcerative colitis via regulation of gut microbiota, inflammatory mediators and cytokines[J]. Biomed Pharmacother, 2020, 125: 109934. DOI:10.1016/j.biopha.2020.109934 |
| [71] |
Pan G, Liu B, Li S, et al. Kuijieling, a Chinese medicine alleviates DSS-induced colitis in C57BL/6J mouse by improving the diversity and function of gut microbiota[J]. FEMS Microbiol Lett, 2020, 367: fnaa082. DOI:10.1093/femsle/fnaa082 |
| [72] |
Song HX, Ma XR, Wang DF, et al. Potential mechanism of Huangqin decoction for the treatment of ulcerative colitis based on network pharmacology[J]. Acta Pharm Sin(药学学报), 2020, 55: 247-255. |
| [73] |
Wei D, Xie L, Zhuang Z, et al. Gut microbiota: a new strategy to study the mechanism of electroacupuncture and moxibustion in treating ulcerative colitis[J]. Evid Based Complement Alternat Med, 2019, 2019: 9730176. |
| [74] |
Liu GH, Liu HM, Chen YS, et al. Effect of electroacupuncture in mice with dextran sulfate sodium-induced colitis and the influence of gut microbiota[J]. Evid Based Complement Alternat Med, 2020, 2020: 2087903. |
| [75] |
Qi Q, Liu Y, Jin X, et al. Moxibustion treatment modulates the gut microbiota and immune function in a dextran sulphate sodiuminduced colitis rat model[J]. World J Gastroenterol, 2018, 24: 3130-3144. DOI:10.3748/wjg.v24.i28.3130 |
| [76] |
Zhang Y, Cai L, Qi J, et al. Gut microbiota contributes to the distinction between two traditional Chinese medicine syndromes of ulcerative colitis[J]. World J Gastroenterol, 2019, 25: 3242-3255. DOI:10.3748/wjg.v25.i25.3242 |
| [77] |
Lam KN, Alexander M, Turnbaugh PJ. Precision medicine goes microscopic: engineering the microbiome to improve drug outcomes[J]. Cell Host Microbe, 2019, 26: 22-34. DOI:10.1016/j.chom.2019.06.011 |
| [78] |
Gu W, Miller S, Chiu CY. Clinical metagenomic next-generation sequencing for pathogen detection[J]. Annu Rev Pathol, 2019, 14: 319-338. DOI:10.1146/annurev-pathmechdis-012418-012751 |
 2021, Vol. 56
2021, Vol. 56