慢性阻塞性肺病(COPD)和哮喘是呼吸道常见的以气道阻塞为主要表现的复杂炎症性疾病。2015年全球估计有317万人死于慢性阻塞性肺病, 占同年全世界所有死亡人数的5%;2016年, 全球共有2.51亿例慢性阻塞性肺病病例; 到2030年, COPD将会成为世界第三大死亡原因[1]。而2015年有38.3万人死于哮喘, 截止到目前大约已经有2.35亿人罹患哮喘。二者均为呼吸系统慢性炎症性疾病, 很难进行明确区分。由于均存在不同程度的气流受限、支气管缩窄、呼吸困难、气道分泌物增多等临床表现, 且均有不同程度的气道重塑, 故在治疗方面也趋同, 常常需要多种药物联合治疗[2, 3]。
COPD和哮喘等慢性呼吸系统疾病最为明显的一个特征就是慢性炎症反应, 通常涉及复杂的炎症过程, 包括各种炎症细胞如上皮细胞、巨噬细胞以及中性粒细胞, 以及炎症细胞释放的各种炎症介质和趋化因子。炎症变化和蛋白酶水平失衡可导致肺功能迅速下降, 肺内炎症反应增强以及炎症介质和酶水平进一步升高, 导致气道阻塞, 疾病加重[4]。这些炎症细胞还释放蛋白酶, 例如中性粒细胞弹性蛋白酶(NE)、组织蛋白酶和基质金属蛋白酶(MMP)等, 它们可能直接导致肺损伤, 如肺气肿和黏液分泌过多等。因此, 对COPD和哮喘的最为关键的抗炎治疗已经成为研发的重点。基于非选择性磷酸二酯酶(PDEs)抑制剂黄嘌呤类化合物的临床疗效, 各种PDEs已被开发用于呼吸系统疾病的炎症治疗。目前PDE抑制剂中仅有罗氟司特被批准上市用于COPD的临床治疗, 然而由于剂量依赖的不良反应, 限制了该药物在临床上的广泛使用。尽管也有许多PDE抑制剂已被开发用于哮喘的治疗, 并且它们潜在的抗炎治疗作用已在各种动物的哮喘模型中得到证实, 其中比较有潜力的PDE4抑制剂CHF6001已进入Ⅱ期临床研究, 但迄今为止除茶碱类外还没有一个PDE抑制剂被批准用于哮喘的治疗。鉴于该类药物抗炎治疗的巨大优势和潜力, 此类药物现已成为研究的热点[5]。
20世纪30年代以来, 黄嘌呤类化合物(如茶碱)被用于治疗呼吸系统疾病如COPD和哮喘, 大量研究结果说明茶碱可能同时具有支气管扩张和抗炎作用, 显示出较好的临床疗效[6, 7]。黄嘌呤的作用机制可解释为PDE非选择性抑制剂, 这促进了人们对各种PDEs在调节COPD和哮喘等疾病相关细胞中环腺苷单磷酸(cAMP)和环鸟苷单磷酸(cGMP)水平作用的兴趣[8, 9]。环腺苷酸和环鸟苷酸是细胞内的第二信使, 它们在视觉、嗅觉、代谢、肌肉收缩、记忆、免疫反应、神经传递、胞吐作用、细胞生长和分化等生理过程中起重要作用, 可调节多种细胞过程, cAMP和cGMP的合成和降解受到严格调控, PDEs催化cAMP和cGMP水解开环分别生成AMP和GMP, 这是细胞内降解cAMP和cGMP的唯一途径[10]。目前已知的PDE家族有11个, 其特征是在结构、底物特异性、抑制剂选择性、组织和细胞分布、激酶调控、蛋白质相互作用和亚细胞分布方面存在差异[11], 鉴于其生理作用和体内分布广泛的性质, PDEs已被作为药物研究的靶点, 靶向各种疾病的治疗, 例如充血性心力衰竭、勃起功能障碍、炎症性肠病和类风湿关节炎、COPD和哮喘等[12], 但目前PDEs家族中仅有靶向PDE1、PDE3、PDE4、PDE5的药物成功进入市场。
1 选择性PDE3、4及双重抑制剂的治疗作用简述PDE3是一种既可水解cAMP的酶, 也可水解cGMP的酶。然而, 它水解cAMP的速率是水解cGMP的10倍。PDE3有两种亚型: PDE3A (主要存在于平滑肌中)和PDE3B (主要存在于脂肪组织中)。PDE3的活性在呼吸系统中主要集中在肺泡巨噬细胞、内皮细胞、血小板中; 它也参与调节心脏收缩力和血管平滑肌。选择性PDE3抑制剂包括氨力农、米力农、西洛酰胺和西洛他唑[13]。迄今为止, 还没有可以明确区分PDE3A和PDE3B的亚型选择性抑制剂。大量研究发现PDE3同工酶被认为在气道平滑肌的功能中占主导地位, PDE3抑制剂则可使气道平滑肌松弛, 现已被开发作为支气管扩张剂[14]。PDE3抑制剂如siguazodan、SK & F94120和ORG-9935可以松弛气道平滑肌, 但有研究发现PDE3抑制剂可能与心血管死亡率增加有关[15, 16]。
PDE4是一种特异性水解cAMP的酶, 其家族由PDE4A、PDE4B、PDE4C和PDE4D四种亚型构成, 每一种亚型都有对应的基因编码并分别具有不同的细胞分布及作用。PDE4主要分布于气道平滑肌细胞以及淋巴细胞、肥大细胞、巨噬细胞、中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞、单核细胞、上皮细胞等炎症细胞和免疫细胞中, 调节这些细胞内cAMP的水平。抑制PDE4可引起炎性细胞和免疫调节细胞内cAMP水平升高, 从而抑制炎性细胞功能, 松弛气道平滑肌。PDE4也在成纤维细胞中表达, 选择性PDE4抑制剂能有效抑制基质金属蛋白酶的产生, 显示了抑制组织重塑在相关肺部疾病中的治疗价值[17]。目前认为PDE4B主要分布于免疫和炎症细胞中, 在4种亚型中具有最强的致炎作用, 也是PDE4抑制剂发挥抗炎作用的主要靶点。PDE4D则多位于中枢神经细胞中, 与PDE4抑制剂的不良反应有关[18-21], 口服选择性PDE4抑制剂受到恶心、呕吐、腹泻、腹痛和消化不良等胃肠道不良反应、头痛和体重减轻的限制。这些令人不耐受的剂量依赖的相关不良反应是新药开发的主要瓶颈。一系列PDE4抑制剂如罗氟司特和GSK256066已开发用于COPD和哮喘等呼吸系统疾病的抗炎治疗。罗氟司特可以改善COPD和哮喘患者的肺功能, 治疗效果显著, 但有恶心、呕吐等胃肠道不良反应, 其严重程度足以降低依从性。因此, 在开发更多创新药物的漫长而崎岖的道路上, 需要在提高疗效的同时尽可能地减轻不良反应[22, 23]。
鉴于单独应用PDE3或者PDE4抑制剂的局限性, PDE3/4的双重抑制似乎是一种更有吸引力的方式来靶向治疗COPD和哮喘的关键病理特征。目前已有证据显示双靶点PDE3/4抑制剂具有协同抑制效应, 包括协同抗炎和支气管扩张作用。在人肺泡巨噬细胞的研究中, Milara等[24]发现单独应用PDE3或PDE4抑制剂仅能抑制约20%的脂多糖(LPS)诱导的细胞因子释放, 而联合抑制PDE3/4能有效抑制约90%的LPS诱导的细胞因子释放。在上皮细胞方面, Wright等[25]研究发现rolipam仅部分抑制IL-1β诱发的人气道上皮细胞和A549细胞释放粒细胞巨噬细胞集落刺激因子(GM-CSF), 而双靶点PDE3/4抑制剂ORG-9935能完全抑制这一作用。另有研究发现, 单独使用PDE3或PDE4抑制剂对松弛支气管肌固有张力是无效的, 但联合使用可以有效地放松支气管肌固有张力[26]。此外, 单独抑制PDE3或PDE4对致敏原或LTC4诱导的人气道平滑肌收缩无抑制作用, 但二者联合作用时具有协同抑制收缩的作用[27]。另外, PDE3和PDE4抑制剂都被证明能激活囊性纤维化跨膜传导调节(CFTR)介导的氯离子分泌, 从而增强了黏液纤毛清除, 显示出了额外的益处[28-30]。因此开发对PDE3和PDE4具有双重抑制活性的药物, 以便在同一分子中获得抗炎和支气管扩张活性, 对于COPD和哮喘等呼吸系统疾病的未来治疗具有重要意义。
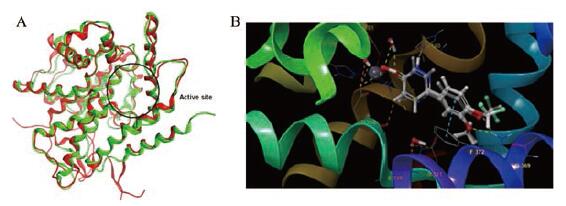
所有PDEs结构由3个区域组成: 氮端调节域、催化域和碳端区域, 其中催化区域位于碳端(约270个氨基酸)在所有的PDEs中高度保守, 氨基末端的调节域是高度可变的, 可能与酶的调控有关[31]。PDEs催化结构是α-螺旋结构, 由3个更小的子结构域组成, 这3个子域共同构成了1个深口袋。在所有PDEs家族中, 这个口袋包含17个绝对保守的残基中的12个。它是酶上唯一具有足够体积容纳cAMP大小分子的口袋。口袋里有1个锌结合位点, 锌离子附近还有第二个金属离子位点, 通常由环核苷酸水解所需的镁离子占据。所述双金属结合位点(M口袋)位于结合袋的一端。结合袋的另一端具有高度保守的疏水钳, 以及1个完全保守的谷氨酰胺残基(Q口袋)位于这个疏水通道的一端。研究认为, 保守的催化区域包含对于水解环核苷酸磷酸二酯键很重要的共同常见结构元素, 以及负责不同基因家族之间底物亲和力和抑制剂敏感性差异的家族特异性决定簇。PDEs的催化区域是其抑制剂与其结合发挥作用的主要部位, 虽然这一区域整体来看是高度保守的, 但每个PDEs底物结合位点都有独特的特征, 可以利用这些特征赋予PDEs选择性。PDE3同工酶就比较特殊, 是一个由44个氨基酸插入在第五和第六个α螺旋之间, 位于蛋白质的表面, 而催化位点位于3个子域交界处的1个深口袋, 氨基酸的插入可能会影响抑制剂的选择性, 但是基于高度保守的催化区域为双靶点PDE3/4抑制剂的发现提供了共同的结构基础[32-36]。其中PDE3A和PDE3B的催化区域高度保守, PDE4B和PDE4D的催化区域也是高度保守的[33], PDE3B (PDB: 1SO2)与PDE4B (PDB: 5OHJ)蛋白叠合(图 1A)充分显示了这一特点, 鉴于PDE3B和PDE4D催化区域的序列高度保守, 且蛋白叠合的空间活性结合位点也有较好的重合性, 故此处仅选取化合物zardaverine与PDE4D (PDB: 1XOR)的结合作用模式进行展示(图 1B)。结合模式显示: 哒嗪酮环上氧原子通过锌离子和活性位点的配位水与H164、D200、D201、D318配位, 哒嗪酮上的氮原子与H160配位, 分子剩余部分具有与罗氟司特邻苯二酚醚结合模式相似的作用, 通过π-π积作用与F372作用, 邻苯二酚醚上的两个氧原子与Q369形成氢键配位[37]。
|
Figure 1 A: The overlap of PDE3B (from PDB: 1SO2 as red cartoon) and PDE4B (from PDB: 5OHJ as green cartoon); B: Interaction model for zardaverine with PDE4D |
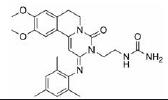
到目前为止, 至少已有4个药物处于临床研究阶段(zardaverine、benzafentrine、pumafentrine和ensifen‐trine), 其中ensifentrine显示了较好的治疗效果和研究前景(表 1)。
| 表 1 Dual PDE3/4 inhibitors that reached clinical trials |
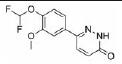
Zardaverine是一种吡啶酮类衍生物, 开发用于哮喘的治疗。其作用机制是抑制PDEs的活性, 并表现出对PDE3和PDE4同工酶的选择性。目前由Takeda公司作为双靶点的PDE3/4抑制剂开发, 已进入Ⅱ期临床研究阶段。Pitts等[38, 39]报告了该化合物在酶学水平对人PDE3和PDE4的IC50分别为110、210 nmol·L-1, 且动物实验已证实zardaverine具有抗炎和支气管扩张的双重作用。Kips等[40]评估了zardaverine在有气道炎症和高反应性的动物体内模型中的作用, 与安慰剂预处理相比, zardaverine在30μmol·kg-1剂量时可显著地抑制LPS诱导中性粒细胞增加、肺泡灌洗液中弹性酶活性和TNF-α释放增加(P < 0.01)。在临床试验中, Brunnee等[41]研究了其对12例可逆支气管阻塞患者的支气管扩张作用。以沙丁胺醇作为阳性对照药, 安慰剂为空白对照药, 通过检测肺功能特定电导率(sGaw)和一秒钟内用力呼气量(FEV1)来反映患者服用zardaverine后支气管扩张作用的有效性。患者在服用200 mg沙丁胺醇后, FEV1至少增加15%;患者以每隔15 min分4次吸入总剂量为6 mg的zardaverine, 重复给药后, 与安慰剂相比, 给予zardaverine治疗的患者sGaw和FEV1在重复吸入的最初1 h内显著增加, 但在近5 h内并没有增加, 且zardaverine和安慰剂之间的FEV1最大平均差发生在吸入后1 h, 为12%, 服用zardaverine的患者中有7位患者FEV1 > 15%, 然而, 有3名患者出现了不良反应(头痛、嗜睡、眩晕、恶心), 还有1名患者因呕吐退出了研究。这一项Ⅱ期临床试验证实了zardaverine有适度的、短时间的支气管扩张作用, 但是安全性和耐受性较差。Ukena等[42]在10例慢性气道阻塞的患者身上进行了一项Ⅱ期临床试验以研究zardaverine的支气管扩张作用的有效性, 分别给予患者zardaverine (1.5、3.0和6.0 mg 3种剂量)、沙丁胺醇(0.3 mg一种剂量)或安慰剂中的1个, 研究证实与阳性药沙丁胺醇相比, zardaverine具有微弱的支气管扩张作用, 同时zardaverine的FEV1%增加的持续时间一般少于1 h, 而沙丁胺醇超过3 h, 造成zardaverine作用时间短暂最有可能的原因是吸入的zardaverine容易被人体清除, 从而仅有短暂的支气管扩张作用。考虑到其有胃肠道不良反应和较短的作用时间[43], 限制了其临床的开发, 目前未有进一步试验进展的相关数据报道。
2.1.2 BenzafentrineBenzafentrine (AH 21-132)是一种苯并萘啶类衍生物, 由Novartis公司开发用于哮喘的治疗。该化合物抑制豚鼠血小板中的PDE3的IC50为1.74μmol·L-1, 抑制豚鼠中性粒细胞中的PDE4的IC50为1.76μmol·L-1[44]。一项体外研究发现, benzafentrine使豚鼠离体气管肌松弛, 正是通过抑制PDEs实现的[45]。Kings等[46]发现在豚鼠动物模型中benzafentrine对人重组淋巴细胞因子和细胞因子诱导豚鼠肺嗜酸性粒细胞增多的抑制作用, 分析得出benzafentrine发挥这种作用正是作为PDE3/4抑制作用实现的。鉴于benzafentrine在体内外表现出的支气管扩张和抗炎活性, Foster等[47]开展了Ⅰ期临床试验, 以12名健康志愿者为研究对象, 研究了benzafentrine在口服、静脉和吸入这3种途径下对患者支气管扩张作用的有效性。通过乙酰甲胆碱个体化负荷+维持剂量方案, 使人体支气管收缩, 并且使人体特定气道电导率近似稳态下降, 在这种条件下进行试验, 通过测定特定气道电导率变化来反映化合物对气道扩张的作用。研究已显示其以吸入方式给药后对支气管扩张的有效性, 并且效用呈明显的时间依赖和剂量依赖性, 尤其当benzafentrine的剂量达到24 mg时, 能缓解80%的气道收缩效应, 且对血压和心率都无影响, 该化合物的半衰期为25 min, 作用时间比较短暂。尽管有较好的临床数据, 但是临床资料却显示该药的Ⅰ期临床研发已经停止了, 相关的药代数据并未公布, 可能是药物进入体内后的再分布作用, 使该药物在作用部位作用时间短暂, 限制了药物的作用。
2.1.3 PumafentrinePumafentrine也是一种苯并萘啶类衍生物, 其抑制PDE3和PDE4的IC50值分别为28和7 nmol·L-1。它是由Altana公司(现为Takada)开发用于治疗COPD和哮喘患者。在2002年后期, 该公司的Ⅱ期临床试验没有达到预期的作用时间, 该项研究便停止了, 具体的临床数据没有公布。但Altana公司在2003年年度报告上提出了可能将转而研究该药的活性代谢产物, 以期改善原有的代谢引起的作用短暂问题, 目前仍处于临床前研究, 相关的进展未见报道[48, 49]。
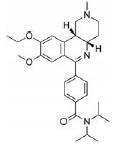
2.1.4 EnsifentrineEnsifentrine (RPL554)是一种奎宁类似物, 其抑制人PDE3和PDE4的IC50值分别为40 pmol·L-1和1.5μmol·L-1[50]。它由Vernalis公司开发作为一种新型吸入的PDE3/4抑制剂用于治疗COPD和哮喘, 目前已处于Ⅱ期临床研究阶段。Boswell-Smith等[51]通过一系列体内外药理学研究证实ensifentrine与气道疾病的相关性, 具有双重的支气管扩张和抗炎活性, ensifentrine可以显著抑制LPS刺激的人类单核细胞释放TNF-α, 计算得其IC50为0.52μmol·L-1, 通过研究吸入ensifentrine在组胺诱导的支气管收缩的麻醉豚鼠动物模型中对豚鼠支气管的扩张作用, 结果显示组胺诱导的支气管收缩效果在动物吸入ensifentrine后显著降低。Franciosi等[52]进行了4项临床研究以考察ensifentrine对健康志愿者、COPD患者和哮喘患者支气管扩张作用的安全性和有效性, 通过测定人体FEV1的变化来衡量化合物支气管扩张作用的有效性。研究结果显示ensifentrine对哮喘患者可产生快速的支气管扩张作用, 患者在1 h内FEV1增加520 mL, 较安慰剂增加14%;通过研究化合物对LPS诱导的炎症细胞浸润的影响, 观察LPS诱导后6 h患者痰中中性粒细胞计数的百分比变化, 研究发现ensifentrine并未显著降低痰液中中性粒细胞的百分比(ensifentrine组为80.3%, 而安慰剂组为84.2%), 这是因为ensifentrine显著减少了中性粒细胞和总细胞的程度。这些临床结果均显示ensifentrine与安慰剂相比, 有较强的支气管扩张作用和显著降低中性粒细胞水平, 且耐受性良好, 不良事件一般较轻, 安慰剂组和积极治疗组发生不良事件的频率相同, 所有的不良事件都是单次发生, 没有复发。治疗组间不良事件的强度一般较轻, 频率相同, 且血压心率都没有统计学差异。Bjermer等[53]为了研究ensifentrine与沙丁胺醇、安慰剂的剂量范围效应和安全性, 以29例轻、中度哮喘患者为研究对象, 研究结果显示ensifentrine可引起剂量依赖性支气管扩张, 其扩张幅度与最大剂量的沙丁胺醇相当, 且全身不良反应较小。Maurer等[54]也进行了一项Ⅱa期临床试验以研究ensifentrine的支气管扩张和抗炎活性的有效性和安全性, 共有403名COPD患者(平均年龄63.2岁)入组, 患者随机接受每日两次4种剂量(0.75、1.5、3、6 mg)之一雾化的ensifentrine或安慰剂。所有剂量的ensifentrine均可产生显著的支气管扩张作用, 第4周的FEV1峰值比基线增加至少200 mL, 所有剂量的ensifentrine也导致FEV1从基线显著增加至65~119 mL, ensifentrine能发挥持续4周的支气管扩张作用。在4周期间, COPD症状有明显的临床和统计上的改善, 所有剂量水平的安全性与安慰剂相似, 上述多项临床结果显示, 其进入全身血液系统能被快速清除, 同时吸入给药也使得进入全身剂量大大减少, 这些使得全身不良反应最小化。Ensifentrine是一种耐受性良好的化合物, 治疗窗广和较好的安全性具有抗炎和支气管扩张的双重作用, 使其成为呼吸系统疾病的非常有前景的新型治疗方法, 进一步的研究正在进行中。
2.2 处于临床前研究阶段的PDE3/4抑制剂目前有关新型双靶点的PDE3/4抑制剂的大多数数据来自临床前研究, 有很多研究者报告了具有双靶点活性的化合物的临床前研究结果, 包括合成与构效关系等数据, 现总结如下。
2.2.1 咪唑并[1,2-a]吡嗪/喹喔啉类衍生物咪唑并[1,2-a]吡嗪/喹喔啉衍生物(图 2), 具有支气管扩张和PDEs抑制活性, 并表现出对PDE3和PDE4的选择性, 因此在哮喘的治疗中具有潜在的应用价值[55]。作为一种支气管扩张剂, SCA40已被开发用于哮喘患者的治疗, 目前已处于临床前研究阶段。Bonnet等[56]首次报道了SCA40具有抑制PDEs的作用。Pocock等[57]研究了SCA40对牛气管肌肉的松弛效果与PDE的关系, 使用豚鼠心室和牛气管中分离到PDE1、PDE3和PDE4同工酶, 测得SCA40对PDE1、PDE3和PDE4的pIC50值为 < 4、7.16、5.39;通过对组胺预处理收缩的牛气管环的松弛效果测定, 与其他阳性松弛剂相比, SCA40的pD2值为6.58。以上结果证实SCA40发挥气管松弛作用是通过抑制PDEs实现的, 主要是选择性抑制PDE3和PDE4。鉴于之前对SCA40的研究显示了较好的药理活性, Vitse等[58]设计了一系列咪唑并[1,2-a]吡嗪类衍生物, 以咪唑[1,2-a]吡嗪为母核, 6位为溴取代, 8位为氨基或烷基氨基取代, 考察2、3和8位取代基的不同对PDE3和PDE4抑制活性的影响。构效关系研究表明, 2、3和8位的取代都会影响PDE3和PDE4抑制活性, 进而对平滑肌松弛作用有影响, 尤其是2位为氰基取代时对PDE3有更好的抑制效果, 其中就有先前提到的活性较好的SCA40, 这些为该类化合物的后续结构改造提供了设计思路。PAB-110是曼彻斯特大学开发的作为支气管扩张剂用于哮喘患者的治疗。Parra等[59]将SCA40化合物的6, 7位与苯环稠合构成咪唑并[1,2-a]喹喔啉类化合物, 研究此类化合物在1,2, 4位有不同取代基对活性的影响。构效关系研究结果显示, 苯环的存在使得大多数咪唑并[1,2-a]喹喔啉类化合物对PDE3的抑制活性急剧下降, 对PDE4的抑制作用也有一定下降, 只有2, 4位分别有氰基和氨甲基取代的PAB110对PDE3具有较好的抑制作用, 且对PDE3和PDE4没有选择性。生物活性评价其作为豚鼠离体气管的松弛剂的活性值pD2为6.02±0.10, 与在相同条件下对SCA40的测量值相近。PAB-110是最有潜力的化合物, 其通过抑制PDE3和PDE4发挥气道松弛作用机制与SCA40相似。
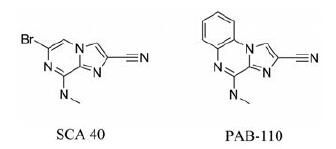
|
Figure 2 Imidazo[1,2-a]pyrazine/quinoxalines derivatives |
顺式四氢邻苯二嗪酮/哒嗪类化合物是由Van der Mey等[60]将具有哒嗪酮结构的选择性PDE3抑制剂(如LY264233、LY197055和tetrahydrobenzimidazole II)与PDE4抑制剂(如tetrahydrophthalazinone I)的结构片段用连接基加以连接, 构成目标化合物顺式四氢邻苯二嗪酮/哒嗪类化合物(图 3), 通过衍生化得到一系列有PDE3和PDE4抑制活性的四氢邻苯二嗪酮/哒嗪类杂化物, 并进行体内外药理活性研究。大多数化合物表现出中等到高水平的人PDE3抑制活性(pIC50值在5.4~7.5之间), 同时也是PDE4的有效抑制剂(pIC50值在7.0~8.7之间)。构效关系的研究揭示, 连接基的种类和哒嗪酮上所连苯基取代基对PDE3与PDE4的抑制作用影响不大, 哒嗪酮的5位有甲基取代时活性较好, 且哒嗪酮苯基部分与连接基以对位取代比间位取代活性提升10倍, 显示较好的PDE3和PDE4的抑制作用。体内抗炎活性采用花生四烯酸诱导的小鼠耳水肿模型, 测定化合物对小鼠耳水肿的抑制效果, 化合物2、4、5在30 mol·kg-1 po浓度下, 对小鼠耳水肿形成的抑制作用为42%~47%, 在体内表现出最有效的抑制活性。目前化合物1~5都由Takada公司开发作为PDE3/4抑制剂用于哮喘的治疗, 目前正处于临床前研究阶段。
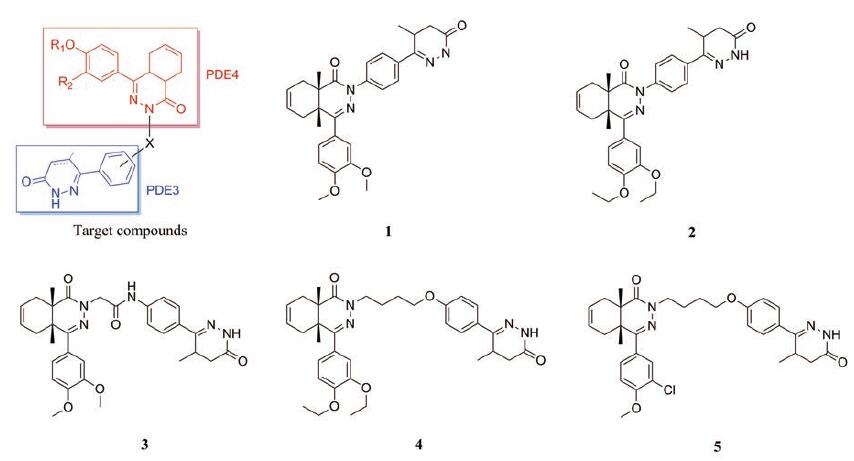
|
Figure 3 cis-Tetrahydrophthalazinone/pyridazinone hybrids |
稠合双环杂芳族二氢吡啶酮类衍生物(图 4)是化合物KCA-1490的类似物, KCA-1490作为一种双PDE3/4抑制剂, 具有非常强的支气管扩张和抗炎活性, 在进行体内外药理学研究时发现, 其治疗效果优于罗氟司特[61, 62], 而KCA-1490的发现来源于ibudilast。Ibudilast是一种非选择性PDE抑制剂, 在日本用于治疗过敏和哮喘。该化合物抑制PDE3、PDE4和PDE5同工型的Ki值在3.3至78μmol·L-1之间, 同时它在微摩尔范围内也抑制大多数PDE其他家族。为了提高PDE3和PDE4的抑制活性, 后期进行了一系列结构设计改造, 包括采用哒嗪酮基取代异丙基酮基, 并将哒嗪酮基团由吡唑并吡啶的C-3向C-4位的迁移等改造, 构效关系研究结果发现KCA-1490是一个非常有潜力的双靶点PDE3/4抑制剂, 其对人PDE3、PDE4的IC50分别为2.38、0.07μmol·L-1, 且对组胺和乙酰胆碱诱导的豚鼠支气管收缩的抑制作用优于罗氟司特。故Ochiai等[63]对KCA-1490进行了一系列结构改造, 用稠合5-6/6-6双环杂芳族化合物代替吡唑并[1,5-a]吡啶而得到系列化合物, 在取代基不变的条件下, 考察环的大小、环中杂原子数目和种类以及杂原子的位置对组胺诱导的豚鼠支气管收缩的抑制活性的影响。构效关系结果显示, 与对照组相比, 含有咪唑并吡啶的化合物6和喹啉类化合物7对支气管收缩的抑制率为97%~99%, 两者均具有较好的支气管扩张作用。在进一步的活性评价中, 两个化合物在大鼠LPS模型的抗炎活性显著。这两个化合物现由Kyorin公司开发用于COPD和哮喘的治疗, 与KCA-1490目前都处于临床前研究阶段。
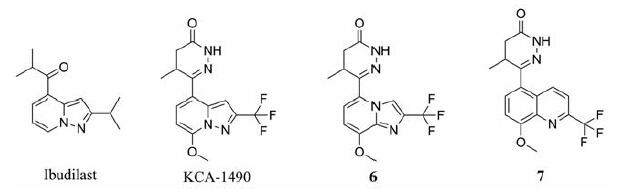
|
Figure 4 Fused bicyclic heteroaromatic dihydropyridone derivatives |
鉴于单独使用选择性PDE3或PDE4抑制剂不良反应明显, 在临床上的疗效有限, 因此联合抑制PDE3和PDE4似乎是治疗COPD和哮喘等炎症性气道疾病的一种有吸引力的策略。越来越多的实验已经证实双靶点PDE3/4抑制剂具有广泛的抗炎和支气管扩张、抗气道重塑以及刺激黏膜纤毛清除的潜力, 同时抑制PDE3和PDE4能最佳地抑制参与COPD和哮喘发病机制和吸入途径的某些关键炎症细胞类型的活性。在后续研究中的策略包括: ①改善口服给药的剂量限制的不良反应, 提高吸入给药的活性水平; ②平衡两个作用靶点的活性水平, 尽量避免当其中一个靶点活性水平还未或已经达到预期药效时, 另一个靶点活性就已经达到产生毒性反应的水平; ③有意识提高各个亚型选择性, 降低亚型选择性不足所带来的不良反应风险。
因此, 尽管已有有效的疗法可用于COPD和哮喘等呼吸系统疾病的治疗, 但许多患者的疾病症状仍未得到充分控制, 开发可满足这些未满足需求的药物仍有大量的需求。设计可以从全身循环中迅速清除的亚型选择性的吸入性双PDE3/4抑制剂成为目前PDEs抑制剂研究的主流方向, 但目前尚无此类药物投入市场, 且只有很少一部分双靶点PDE3/4抑制剂进入临床试验。Ensifentrine是唯一一个已经成功通过Ⅱ期临床试验的双靶点PDE3/4抑制剂, Ⅲ期临床试验也在进行中, 该药在前期临床试验显示出的较好的有效性和安全性的潜力为此类药物的后续研发带来了新的希望。然而, 目前仍然存在一个关键的问题, 从疗效的角度来开发具有协同作用的PDE3/4抑制剂, 是否可以不需要观察协同作用在潜在不良反应方面的影响?
总之, 越来越多的证据已经表明, 双靶点PDE3/4抑制剂对参与炎症和支气管扩张的细胞具有附加或协同作用, 而对每一单独使用PDE选择性抑制剂可达到的效果有所不同。此外, ensifentrine与毒蕈碱受体拮抗剂在气道舒张方面显示出协同作用, 这表明PDE3/4抑制剂与现有的其他药物联合使用可能比单独使用这些药物更有临床疗效, 这些积极的研究结果为双靶点PDE3/4抑制剂的进一步开发和应用提供了更多的可能, 受到了研究者的广泛关注, 这类药物未来有望成为治疗呼吸系统疾病的一类新型药物。
作者贡献:董敏完成文献调研、初稿撰写及文件编辑, 张翔完成文章修改、审核。
利益冲突:作者声明本文不存在任何利益冲突。
| [1] |
Hatzelmann A, Morcillo EJ, Lungarella G, et al. The preclinical pharmacology of roflumilast-a selective, oral phosphodiesterase4 inhibitor in development for chronic obstructive pulmonary disease[J]. Pulm Pharmacol Ther, 2010, 23: 235-256. DOI:10.1016/j.pupt.2010.03.011 |
| [2] |
Boulet LP, FitzGerald JM, Levy ML, et al. A guide to the translation of the Global Initiative for Asthma(GINA)strategy into improved care[J]. Eur Respir J, 2012, 39: 1220-1229. DOI:10.1183/09031936.00184511 |
| [3] |
Jeffery PK. Differences and similarities between chronic obstructive pulmonary disease and asthma[J]. Clin Exp Allergy, 1999, 29: 14-26. DOI:10.1046/j.1365-2222.1999.00004.x-i2 |
| [4] |
Contreras S, Milara J, Morcillo E, et al. Selective inhibition of phosphodiesterases 4A, B, C and D isoforms in chronic respiratory diseases: current and future evidences[J]. Curr Pharm Design, 2017, 23: 2073-2083. |
| [5] |
Gross NJ, Barnes PJ. New therapies for asthma and chronic obstructive pulmonary disease[J]. Am J Respir Crit Care Med, 2017, 195: 59-166. |
| [6] |
Boswell-Smith V, Cazzola M, Page CP. Are phosphodiesterase 4 inhibitors just more theophylline?[J]. J Allergy Clin Immunol, 2006, 117: 1237-1243. DOI:10.1016/j.jaci.2006.02.045 |
| [7] |
Baba K, Sakakibara A, Yagi T, et al. Effects of the ophylline withdrawal in well-controlled asthmatics treated with inhaled corticosteroid[J]. J Asthma, 2001, 38: 615-624. DOI:10.1081/JAS-100107539 |
| [8] |
Howell RE. Multiple mechanisms of xanthine actions on airway reactivity[J]. J Pharmacol Exp Ther, 1990, 255: 1008-1014. |
| [9] |
Howell LL, Coffin VL, Spealman RD. Behavioral and physiological effects of xanthines in nonhuman primates[J]. Psychopharmacology, 1997, 129: 1-14. DOI:10.1007/s002130050155 |
| [10] |
Yan J, Zhu HB. Cyclic nucleotide phosphodiesteraseⅣexpression, activity and targeting in cells of cardiovascular system[J]. Acta Pharm Sin(药学学报), 2007, 42: 571-575. |
| [11] |
Omori K, Kotera J. Overview of PDEs and their regulation[J]. Circ Res, 2007, 100: 309-327. DOI:10.1161/01.RES.0000256354.95791.f1 |
| [12] |
Page C, Cazzola M. Bifunctional drugs for the treatment of asthma and chronic obstructive pulmonary disease[J]. Eur Respir J, 2014, 44: 475-482. DOI:10.1183/09031936.00003814 |
| [13] |
Zuo H, Cattani-Cavalieri I, Musheshe N, et al. Phosphodiesterases as therapeutic targets for respiratory diseases[J]. Pharmacol Ther, 2019, 197: 225-242. DOI:10.1016/j.pharmthera.2019.02.002 |
| [14] |
Matera MG, Page C, Cazzola M. PDE inhibitors currently in early clinical trials for the treatment of asthma[J]. Expert Opin Investig Drugs, 2014, 23: 1267-1275. DOI:10.1517/13543784.2014.921157 |
| [15] |
Beute J, Lukkes M, Koekoek EP, et al. A pathophysiological role of PDE3 in allergic airway inflammation[J]. JCI Insight, 2018. DOI:10.1172/jci.insight.94888 |
| [16] |
Ding B, Abe J, Wei H, et al. Functional role of phosphodiesterase 3 in cardiomyocyte apoptosis: implication in heart failure[J]. Circulation, 2005, 111: 2469-2476. DOI:10.1161/01.CIR.0000165128.39715.87 |
| [17] |
Martin-Chouly CAE, Astier A, Jacob C, et al. Modulation of matrix metalloproteinase production from human lung fibroblasts by type 4 phosphodiesterase inhibitors[J]. Life Sci, 2004, 75: 823-840. DOI:10.1016/j.lfs.2004.01.021 |
| [18] |
Skoumbourdis AP, LeClair CA, Stefan E, et al. Exploration and optimization of substituted triazolothiadiazines and triazolopyridazines as PDE4 inhibitors[J]. Bioorg Med Chem Lett, 2009, 19: 3686-3692. DOI:10.1016/j.bmcl.2009.01.057 |
| [19] |
Yu S, Pearson AD, Lim RKV, et al. Targeted delivery of an antiinflammatory PDE4 inhibitor to immune cells via an antibodydrug conjugate[J]. Mol Ther, 2016, 24: 2078-2089. DOI:10.1038/mt.2016.175 |
| [20] |
Li H, Zuo J, Tang W. Phosphodiesterase-4 inhibitors for the treatment of inflammatory diseases[J]. Front Pharmacol, 2018, 9: 1048. DOI:10.3389/fphar.2018.01048 |
| [21] |
Sun CY, Zhang L, Cheng KD, et al. Progress in the study of phosphodiesterases 4[J]. Chin Pharmacol Bull(中国药理学通报), 2006, 22: 1161-1167. |
| [22] |
Rabe KF. Update on roflumilast, a phosphodiesterase 4 inhibitor for the treatment of chronic obstructive pulmonary disease[J]. Br J Pharmacol, 2011, 163: 53-67. DOI:10.1111/j.1476-5381.2011.01218.x |
| [23] |
Ting PC, Lee JF, Kuang R, et al. Discovery of oral and inhaled PDE4 inhibitors[J]. Bioorg Med Chem Lett, 2013, 23: 5528-5532. DOI:10.1016/j.bmcl.2013.08.056 |
| [24] |
Milara J, Navarro A, Almudever P, et al. Oxidative stress-induced glucocorticoid resistance is prevented by dual PDE3/PDE4 inhibition in human alveolar macrophages[J]. Clin Exp Allergy, 2011, 41: 535-546. DOI:10.1111/j.1365-2222.2011.03715.x |
| [25] |
Wright LC, Seybold J, Robichaud A, et al. Phosphodiesterase expression in human epithelial cells[J]. Am J Physiol, 1998, 275: L694-L700. |
| [26] |
Rabe KF, Tenor H, Dent G, et al. Phosphodiesterase isozymes modulating inherent tone in human airways: identification and characterization[J]. Am J Physiol, 1993, 264: L458-L464. |
| [27] |
Schmidt DT, Watson N, Dent G, et al. The effect of selective and non-selective phosphodiesterase inhibitors on allergen-and leukotriene C4-induced contractions in passively sensitized human airways[J]. Br J Pharmacol, 2000, 131: 1607-1618. DOI:10.1038/sj.bjp.0703725 |
| [28] |
Liu S, Veilleux A, Zhang L, et al. Dynamic activation of cystic fibrosis transmembrane conductance regulator by type 3 and type 4D phosphodiesterase inhibitors[J]. J Pharmacol Exp Ther, 2005, 314: 846-854. DOI:10.1124/jpet.105.083519 |
| [29] |
Tyrrell J, Qian X, Freire J, et al. Roflumilast combined with adenosine increases mucosal hydration in human airway epithelial cultures after cigarette smoke exposure[J]. Am J Physiol Lung Cell Mol Physiol, 2015, 308: L1068-L1077. DOI:10.1152/ajplung.00395.2014 |
| [30] |
Penmatsa H, Zhang W, Yarlagadda S, et al. Compartmentalized cyclic adenosine 3',5'-monophosphate at the plasma membrane clusters PDE3A and cystic fibrosis transmembrane conductance regulator into microdomains[J]. Mol Biol Cell, 2010, 21: 1097-1110. DOI:10.1091/mbc.e09-08-0655 |
| [31] |
Xu RX, Rocque WJ, Lambert MH, et al. Crystal structures of the catalytic domain of phosphodiesterase 4B complexed with AMP, 8-Br-AMP, and rolipram[J]. J Mol Biol, 2004, 337: 355-365. DOI:10.1016/j.jmb.2004.01.040 |
| [32] |
Fossa P, Giordanetto F, Menozzi G, et al. Structural basis for selective PDE 3 inhibition: a docking study[J]. Quant Struct-Act Relat, 2002, 21: 267-275. DOI:10.1002/1521-3838(200208)21:3<267::AID-QSAR267>3.0.CO;2-S |
| [33] |
Zhang W, Ke H, Tretiakova AP, et al. Identification of overlapping but distinct cAMP and cGMP interaction sites with cyclic nucleotide phosphodiesterase 3A by site-directed mutagenesis and molecular modeling based on crystalline PDE4B[J]. Protein Sci, 2001, 10: 1481-1489. DOI:10.1110/ps.6601 |
| [34] |
Manganiello VC, Taira M, Degerman E, et al. Type Ⅲ cGMPinhibited cyclic nucleotide phosphodiesterases (PDE3 gene family)[J]. Cell Signalling, 1995, 7: 445-455. DOI:10.1016/0898-6568(95)00017-J |
| [35] |
Degerman E, Belfrage P, Manganiello VC. Structure, localization, and regulation of cGMP-inhibited phosphodiesterase(PDE3)[J]. J Biol Chem, 1997, 272: 6823-6826. DOI:10.1074/jbc.272.11.6823 |
| [36] |
Ochiai K, Takita S, Kojima A, et al. Phosphodiesterase inhibitors. Part 4: design, synthesis and structure-activity relationships of dual PDE3/4-inhibitory fused bicyclic heteroaromatic-4,4-dimethylpyrazolones[J]. Bioorg Med Chem Lett, 2012, 22: 5833-5838. DOI:10.1016/j.bmcl.2012.07.088 |
| [37] |
Lee ME, Markowitz J, Lee JO, et al. Crystal structure of phosphodiesterase 4D and inhibitor complex[J]. FEBS Lett, 2002, 530: 53-58. DOI:10.1016/S0014-5793(02)03396-3 |
| [38] |
Asif M. Bronchodilator and positive inotropic activity of pyridazine compound zardaverine as a phosphodiesterase isozymes inhibitor[J]. J Mod Med Chem, 2015, 3: 31-34. |
| [39] |
Pitts WJ, Vaccaro W, Huynh T, et al. Identification of purine inhibitors of phosphodiesterase 7(PDE7)[J]. Bioorg Med Chem Lett, 2004, 14: 2955-2958. DOI:10.1016/j.bmcl.2004.03.021 |
| [40] |
Kips JC, Joos GF, Peleman RA, et al. The effect of zardaverine, an inhibitor of phosphodiesterase isoenzymes III and IV, on endotoxin-induced airway changes in rats[J]. Clin Exp Allergy, 1993, 23: 518-523. DOI:10.1111/j.1365-2222.1993.tb03240.x |
| [41] |
Brunnee T, Engelstatter R, Steinijans VW, et al. Bronchodilatory effect of inhaled zardaverine, a phosphodiesterase Ⅲ and Ⅳ inhibitor, in patients with asthma[J]. Eur Respir J, 1992, 5: 982-985. |
| [42] |
Ukena D, Rentz K, Reiber C, et al. Effects of the mixed phosphodiesterase Ⅲ/Ⅳ inhibitor, zardaverine, on airway function in patients with chronic airflow obstruction[J]. Respir Med, 1995, 89: 441-444. DOI:10.1016/0954-6111(95)90214-7 |
| [43] |
Schudt C, Hatzelmann A, Beume R, et al. Phosphodiesterase inhibitors: history of pharmacology[M]//Phosphodiesterases as Drug Targets. Berlin Heidelberg: Springer, 2011: 1-46.
|
| [44] |
Hatzelmann A, Engelstätter R, Morley J, et al. Enzymatic and functional aspects of dual-selective PDE 3/4 inhibitors[M]//Phosphodiesterase Inhibitors. Berlin Heidelberg: Springer, 1996: 147.
|
| [45] |
Small RC, Boyle JP, Duty S, et al. Analysis of the relaxant effects of AH 21-132 in guinea-pig isolated trachealis[J]. Br J Pharmacol, 1989, 97: 1165-1173. DOI:10.1111/j.1476-5381.1989.tb12575.x |
| [46] |
Kings MA, Chapman I, Kristersson A, et al. Human recombinant lymphokines and cytokines induce pulmonary eosinophilia in the guinea pig which is inhibited by ketotifen and AH 21-132[J]. Int Arch Allergy Immunol, 1990, 91: 354-361. DOI:10.1159/000235141 |
| [47] |
Foster RW, Rakshi K, Carpenter JR, et al. Trials of the bronchodilator activity of the isoenzyme-selective phosphodiesterase inhibitor AH 21-132 in healthy volunteers during a methacholine challenge test[J]. Br J Clin Pharmacol, 1992, 34: 527-534. DOI:10.1111/j.1365-2125.1992.tb05658.x |
| [48] |
Giembycz MA. Life after PDE4: overcoming adverse events with dual-specificity phosphodiesterase inhibitors[J]. Curr Opin Pharmacol, 2005, 5: 238-244. DOI:10.1016/j.coph.2005.04.001 |
| [49] |
Giembycz MA. Phosphodiesterase-4: selective and dual-specificity inhibitors for the therapy of chronic obstructive pulmonary disease[J]. Proc Am Thor Soc, 2005, 2: 326-333. DOI:10.1513/pats.200504-041SR |
| [50] |
Liu S, Veilleux A, Zhang L, et al. Dynamic activation of cystic fibrosis transmembrane conductance regulator by type 3 and type 4D phosphodiesterase inhibitors[J]. J Pharmacol Exp Ther, 2005, 314: 846-854. DOI:10.1124/jpet.105.083519 |
| [51] |
Boswell-Smith V, Spina D, Oxford AW, et al. The pharmacology of two novel long-acting phosphodiesterase 3/4 inhibitors, RPL554 [9,10-dimethoxy-2(2,4,6-trimethylphenylimino)-3-(Ncarbamoyl-2-aminoethyl)-3,4,6,7-tetrahydro-2H-pyrimido[6,1-a] isoquinolin-4-one] and RPL565 [6,7-dihydro-2-(2,6-diisopropylphenoxy)-9,10-dimethoxy-4H-pyrimido [6,1-a] isoquinolin-4-one][J]. J Pharmacol Exp Ther, 2006, 318: 840-848. DOI:10.1124/jpet.105.099192 |
| [52] |
Franciosi LG, Diamant Z, Banner KH, et al. Efficacy and safety of RPL554, a dual PDE3 and PDE4 inhibitor, in healthy volunteers and in patients with asthma or chronic obstructive pulmonary disease: findings from four clinical trials[J]. Lancet Respir Med, 2013, 1: 714-727. DOI:10.1016/S2213-2600(13)70187-5 |
| [53] |
Bjermer L, Stewart J, Abbott-Banner K, et al. RPL554, an inhaled PDE3/4 inhibitor, causes comparable bronchodilation to high dose nebulised salbutamol in asthmatics with fewer systemic effects[J]. Eur Respir J, 2016, 48: PA4905. |
| [54] |
Maurer B, Singh D, Martinez F, et al. Late breaking abstractRPL554, a first-in-class dual PDE3/4 inhibitor, causes significant bronchodilation and symptom relief; a phase 2b COPD study[J]. Eur Respir J, 2018, 52: OA1940. |
| [55] |
Laurent F, Portet K, Benezech V, et al. Relaxant and phosphodiesterase inhibition activities of imidazo[1,2-a]pyrazine derivatives[J]. Fund Clin Pharmacol, 1996, 1: 65. |
| [56] |
Bonnet PA, Michel A, Laurent F, et al. Synthesis and antibronchospastic activity of 8-alkoxy-and 8-(alkylamino) imidazo [1,2-a] pyrazines[J]. J Med Chem, 1992, 35: 3353-3358. DOI:10.1021/jm00096a008 |
| [57] |
Pocock TM, Laurent F, Isaac LM, et al. Effects of SCA40 on bovine trachealis muscle and on cyclic nucleotide phosphodiesterases[J]. Eur J Pharmacol, 1997, 334: 75-85. DOI:10.1016/S0014-2999(97)01147-3 |
| [58] |
Vitse O, Laurent F, Pocock TM, et al. New imidazo [1,2-a] pyrazine derivatives with bronchodilatory and cyclic nucleotide phosphodiesterase inhibitory activities[J]. Bioorg Med Chem, 1999, 7: 1059-1065. DOI:10.1016/S0968-0896(99)00019-X |
| [59] |
Parra S, Laurent F, Subra G, et al. Imidazo[1,2-a]quinoxalines: synthesis and cyclic nucleotide phosphodiesterase inhibitory activity[J]. Eur J Med Chem, 2001, 36: 255-264. DOI:10.1016/S0223-5234(01)01213-2 |
| [60] |
Van der Mey M, BommeléKM, Boss H, et al. Synthesis and structure-activity relationships of cis-tetrahydrophthalazinone/pyridazinone hybrids: a novel series of potent dual PDE3/PDE4 inhibitory agents[J]. J Med Chem, 2003, 46: 2008-2016. DOI:10.1021/jm030776l |
| [61] |
Ochiai K, Ando N, Iwase K, et al. Phosphodiesterase inhibitors. Part 2: design, synthesis, and structure-activity relationships of dual PDE3/4-inhibitory pyrazolo [1,5-a] pyridines with anti-inflammatory and bronchodilatory activity[J]. Bioorg Med Chem Lett, 2011, 21: 5451-5456. DOI:10.1016/j.bmcl.2011.06.118 |
| [62] |
Allcock RW, Blakli H, Jiang Z, et al. Phosphodiesterase inhibitors. Part 1: synthesis and structure-activity relationships of pyrazolopyridine-pyridazinone PDE inhibitors developed from ibudilast[J]. Bioorg Med Chem Lett, 2011, 21: 3307-3312. DOI:10.1016/j.bmcl.2011.04.021 |
| [63] |
Ochiai K, Takita S, Kojima A, et al. Phosphodiesterase inhibitors. Part 5: hybrid PDE3/4 inhibitors as dual bronchorelaxant/antiinflammatory agents for inhaled administration[J]. Bioorg Med Chem Lett, 2013, 23: 375-381. DOI:10.1016/j.bmcl.2012.08.121 |
 2021, Vol. 56
2021, Vol. 56