2. 河南农业大学信息与管理科学学院, 河南 郑州 450002
2. College of Information and Management Science, Henan Agricultural University, Zhengzhou 450002, China
红花(Carthamus tinctorius L.), 别名红蓝花、刺红花、草红花, 是菊科红花属一年生双子叶草本植物, 红花作为红花属中唯一的栽培种, 是集油用、药用和工业用于一体的特种经济作物[1, 2]。据《本草纲目》记载, 红花具有“活血、润燥、止痛、散肿通经”的作用。据统计, 《中国药典》2015年版收载含红花的中成药近百种, 中国药典2015版规定, 作为中药材使用的红花干燥花丝中HSYA含量应不低于1.0%[3], 因此, 其HSYA含量高低直接决定了红花花丝中药材的等级。药理学研究结果表明HSYA是红花中最主要的活性成分, 它在治疗心脑血管疾病、糖尿病、抗血栓、抗肿瘤、抗炎、护肝等方面都有很好的作用[4, 5]。
HSYA和其他类黄酮化合物一样也是通过苯丙氨酸代谢途径合成, 苯丙氨酸在苯丙氨酸解氨酶(phenylalanine ammonialyase, PAL)、肉桂酸-4-羟化酶(cinnamate 4-hydroxylase, C4H)、4-香豆酰辅酶A连接酶(4-coumaryol CoA ligase, 4CL)催化下生成香豆酰辅酶A, 再与3分子的丙二酸单酰辅酶A在查尔酮合酶(chalcone synthase, CHS)的作用下生成查尔酮, 一部分查尔酮在细胞色素P450氧化酶(cytochrome P450, CYP450)和C-糖基转移酶(C-glycosyltransferases, CGTs)的催化下生成HSYA和其他类醌式查尔酮类化合物, 一部分查尔酮在查尔酮异构酶(chalcone isomerase, CHI)的作用下生成柚皮素, 然后在一系列酶的催化下生成黄酮、黄酮醇、花青素等其他黄酮类化合物[6-8] (图 1)。CHS被认为是合成红花黄酮类化合物和HSYA的关键酶, 也是其限速酶, 但也有研究表明PAL、C4H、4CL的表达量高低也与类黄酮的积累有很大的相关性[9, 10], 但到目前为止, 对红花中黄酮类化合物的生物合成及调控的研究仍不够深入。

|
Figure 1 Schematic for the putative biosynthesis pathways of hydroxysafflor yellow A (HSYA) and flavonoids in safflower. PAL: Phenylalanine ammonia lyase; C4H: Innamate 4-hydroxylase; 4CL: 4-Coumaroyl CoA-ligase; CHS: Chalcone synthase; CGT: C-Glucosyltransferase; P450: Cytochrome P450; CHI: Chalcone isomerase; FNSⅠ: Flavone synthase Ⅰ; F3H: Flavanone 3-hydroxylase; DFR: Dihydroflavonol 4-reductase; ANS: Anthocyanidin synthase; UGT: UDP-glycosyltransferases |
茉莉酸甲酯(methyl jasmonate, MeJA)作为一种植物内源激素和信号分子, 在植物的生长、发育、免疫调控、次生代谢、生物胁迫和非生物胁迫等方面都发挥着重要作用[11-14]。大量研究发现, MeJA通过激活或抑制相应转录因子的活性, 调控植物类黄酮[15]、二萜[16]、三萜[17]等多种植物次生代谢的关键酶的基因表达, 从而参与植物次生代谢的生物合成过程调控。有研究表明, MeJA能够诱导HSYA积累[18], 另外, 有研究发现不同花色红花花丝中HSYA含量不同[19], 推测MeJA对HSYA的诱导积累和不同花色红花中HSYA含量差异与HSYA生物合成相关基因的表达差异有关, 但具体是哪些(个)基因的相关研究还不够深入。本研究用豫红花1号作为MeJA处理材料, 对处理后的HSYA含量、相关合成基因进行定量分析, 同时对不同花色红花中的HSYA生物合成关键基因的表达量进行定量分析, 以期为MeJA调控HSYA生物合成及不同花色红花中HSYA含量差异的分子机制提供理论参考。
材料和方法材料 研究材料“豫红花1号”及管状花色颜色为白色(W)、黄色(Y)、橙黄色(OY)、红色(R)红花品系种植于河南农业科学院现代农业研究开发基地。茉莉酸甲酯(MeJA)购自上海生工有限公司, HSYA标准品购自中国食品药品检定研究院, 引物为河南尚亚生物技术有限公司合成。
样本处理 以“豫红花1号”作为MeJA处理材料, 为了减小实验误差, 选取在大田中开花第一天的顶果球红花花冠连同茎杆一起剪下, 放入1/2浓度的Hoagland标准营养液中, 移至光照培养箱中培养, 生长条件为(26 ± 1) ℃、16 h/8 h (光照/黑暗), 24 h后进行MeJA处理, 分别用0、50、100、200 μmol·L-1 MeJA喷施红花花序, 对照组用MeJA溶剂喷施, 每个处理设置3个生物学重复, 在处理后的0、3、6、12、24 h取样, 液氮速冻保存, 用于RNA提取和HSYA含量测定。
不同花色红花品系的取样 取不同花色红花品系开花第三天的花冠用于RNA提取和HSYA含量测定, 为了减小实验误差, 每个花色品系选取5~10株上的花序均匀混合, 取3个生物学重复。
HSYA标准曲线制定 称HSYA标准品10.0 mg, 加25%甲醇溶解并于10 mL容量瓶中定容, 经0.45 μm微孔滤膜过滤, 取滤液供HPLC测定使用。分别吸取HSYA对照品溶液0.25、0.50、0.75、1.0、2.0、4.0 mL置于10 mL容量瓶中, 加25%甲醇定容至刻度, 混匀, 取9 μL进样。色谱条件参考杨玉霞等[13]方法, 并稍作修改:色谱柱: Agilent C18柱(4.6 mm×250 mm, 5 μm); 检测波长: 403 nm; 流动相:甲醇-乙腈-0.7%的磷酸水溶液(26:2:72);流速: 1.0 mL·min-1; 柱温: 30 ℃; 进样量: 10 μL。
样本中HSYA含量测定 精密称取红花样品粉末100 mg, 精密量取25%甲醇10 mL, 称量, 25 ℃超声(300 W, 50 kHz)处理40 min, 取出后称重并补足失重。用0.45 μm滤膜过滤得供试品溶液。Agilent Zorbax Eclipse XDB-C18色谱柱(4.6 mm ×250 mm, 5 μm); 以甲醇-乙腈-0.7%磷酸溶液(26:2:72)为流动相等度洗脱; 检测波长403 nm; 流速1.0 mL·min-1; 柱温30 ℃; 进样量10 μL。
样品总RNA提取及逆转录反应 按照华越洋生物公司的Quick RNA Isolation Kit试剂盒说明书提取样品的总RNA; 按照天根生物科技有限公司的Fast Quant RT Super Mix说明书进行逆转录反应。
Real-time PCR分析 采用Eppendorf Mastercycler ep Realplex 2.2 Detection System进行实时荧光定量PCR, 根据红花转录组数据[20]和参考文献[21]设计PAL1、PAL2、PAL3、PAL4、PAL5、C4H1、4CL1、4CL2、4CL3、4CL4、4CL5、CHS1、CHS2、CHS3、CHS4、CHS5、CHI1、CHI2基因的特异引物, 以Ct60s作为内参基因, 引物序列如表 1所示。用天根生物科技公司的Super Real Pre Mix (SYBR Green)试剂盒进行荧光定量PCR反应, 扩增体系20 μL: 2×SuperReal Pre Mix 10 μL、上游引物(10 μmol·L-1) 0.5 μL、下游引物(10 μmol·L-1) 0.5 μL、cDNA模板5 μL、ddH2O 3 μL。荧光定量PCR条件设置反应程序: 95 ℃变性20 s、55 ℃退火20 s、72 ℃延伸20 s扩增45个循环。
| Table 1 The primers sequences used for real-time PCR |
数据分析 用2-ΔΔCT相对定量方法计算出各基因的相对表达量, 用标准曲线法对样品的HSYA含量进行定量分析。用单因素方差对样品的基因表达和HSYA含量进行统计分析, 结果以平均值±标准差的形式表示, P < 0.05表示差异具有显著水平。
结果与分析 1 适度的MeJA处理能够促进红花管状花中HSYA的积累为了确定MeJA对HSYA的积累是否有影响及最适处理浓度, 采用不同浓度(0、50、100、200 μmol·L-1)对红花进行喷施处理, 为了减少在自然环境中外界因素如光照、温度、风力等变化对激素处理的影响, 选取开花一致的红花花序, 连同茎秆一同剪下后置于营养液中稳定培养24 h后进行MeJA喷施处理, 在处理3 h后, 通过液相色谱对红花管状花中的HSYA含量进行定量分析, 结果显示MeJA处理能够显著增加HSYA的积累, 其中100 μmol·L-1的MeJA处理对HSYA促进效果最为明显(图 2A), 所以, 在后续的实验中选取该浓度MeJA对红花进行处理。
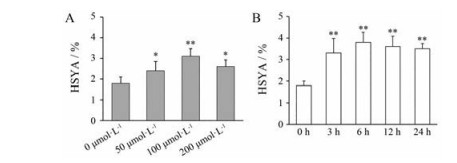
|
Figure 2 Effect of different concentration of MeJA (A) and different treatment time (B) on HSYA content. A: *P < 0.05, **P < 0.01 vs 0 μmol·L-1; B: **P < 0.01 vs 0 h. MeJA: Methyl jasmonate |
为了进一步验证适度的MeJA处理能够提高红花HSYA的含量, 用100 μmol·L-1的MeJA对红花进行了不同时间处理, 结果表明, 随着不同时长处理, 红花HSYA的积累呈现升高的趋势, 其中处理6 h后, HSYA的含量达到高峰(图 2B), 这一结果进一步证明了适度的MeJA处理能够促进红花中HSYA的积累。
2 MeJA处理对HSYA合成相关基因的影响通过HSYA的结构推测其合成的最初底物是查尔酮, 为了进一步研究MeJA处理对红花HSYA积累的分子机制, 通过红花转录组数据及文献检索的方式, 找到了可能参与红花HSYA合成的相关基因, 以MeJA处理6 h的红花管状花为材料提取RNA, 并以喷施MeJA溶剂的红花为对照材料, 通过荧光定量PCR对参与查尔酮合成前后的18个基因进行定量分析。定量分析结果(图 3)表明, 与对照组(mock)相比, MeJA处理组中大部分基因的表达量都有所升高, 其中PAL2、PAL4、4CL2、4CL4、4CL5、CHS3、CHS4和CHI2的表达量显著升高。其中CHS是参与植物查尔酮合成的最为关键酶, 被认为是植物类黄酮合成途径的第一个酶, 而HSYA的合成是以查尔酮为底物, 因此, 推测MeJA主要通过提高PAL2、PAL4、4CL2、4CL4、4CL5、CHS3、CHS4、CHI2的转录水平参与调控HSYA的生物合成过程, 其中CHS3、CHS4的表达量升高可能是MeJA诱导HSYA积累的主要因素。

|
Figure 3 Effect of MeJA treatment on expression of related genes involved in HSYA biosynthesis. *P < 0.05, **P < 0.05 vs Mock |
研究室前期在红花种质资源收集与评价的研究过程中, 发现大量管状花花色变异的种质资源, 根据红花管状花颜色可以将红花种质资源大体分为4类, 分别为白色(W)、黄色(Y)、橙黄色(OY)和红色(R) (图 4), 对不同花色红花品系的HSYA含量进行测定, 结果表明, 白色红花中未检测到HSYA, 黄色(Y)、橙黄色(OY)和红色(R)中HSYA含量较高, 并呈现R > OY > Y > W的趋势, 但OY、Y和W中HSYA的含量差异并不明显(图 5)。

|
Figure 4 The phenotype of safflower with different colors (white, yellow, orange-yellow, red) |
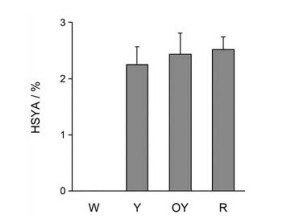
|
Figure 5 The content of HSYA in safflower with different colors. W: White; Y: Yellow; OY: Orange-yellow; R: Red |
为了研究在不同红花品系中HSYA积累差异的分子机制, 对不同花色红花中HSYA合成的关键基因进行了定量分析, 荧光定量PCR分析结果显示, PAL3、PAL4、CL5、CHS1、CHS3和CHI2在红色、橙黄色和黄色红花品系中明显高于白色红花品系, 其中CHS1和CHI2的表达量达到显著水平(图 6), 但PAL3、PAL4、CL5、CHS1、CHS3和CHI2的基因表达量在红色、橙黄色和黄色红花品系中表达差异不明显。
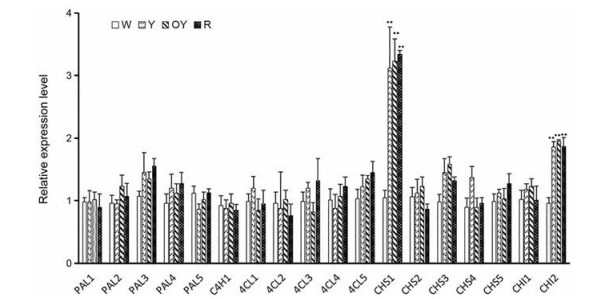
|
Figure 6 Quantitative analysis of the expression of related genes involved in HSYA biosynthesis in safflower with different colors. **P < 0.05 vs white safflower |
红花(Carthamus tinctorius L)是一种重要的药用植物, 其花丝和种子是传统中药材, 广泛应用于预防和治疗心脑血管疾病、骨质疏松症及妇科等疾病, 目前, 从红花中分离的化学成分超过100种, 主要包括类黄酮、生物碱、有机酸等[22], 其中醌式查尔酮糖苷类化合物是红花中特有的化学成分, 也构成红花红色素和黄色素的主要成分, 这些化合物具有很强的药理学活性, 其中HSYA是药理学活性最强的成分, 临床上广泛应用于治疗心、脑血管疾病的红花黄色素注射液的主要成分之一就是HSYA[23]。因此HSYA含量的高低直接决定了中药材红花花丝的等级标准, 如何提高红花HSYA含量也是红花遗传育种改良的主要目标之一, 但目前关于红花HSYA生物及合成调控的研究相对较少。
MeJA作为一种植物内源性激素, 在植物的次生代谢调控中起重要作用, MeJA广泛应用于悬浮培养细胞中诱导产生目标次生代谢产物, 如雷公藤素[24]、丹参酚酸类化合物[14]等。在本研究中, 适度外施MeJA处理红花花冠, 可以提高红花HSYA含量, 另有研究表明, MeJA处理红花可促使红花中芦丁、山柰酚-3-O-β-芸香糖苷、红花红色素等类黄酮化合物的积累[18], 这说明MeJA作为外源诱导子有利于红花类黄酮的积累。本研究为了更加深入地了解MeJA对HSYA的调控, 综合分析了18个与HSYA合成相关的基因, 结果显示, MeJA处理使PAL2、PAL4、4CL2、4CL4、4CL5、CHS3、CHS4和CHI2的转录水平明显调高, 植物中CHS家族一般包含多个基因, 这些基因通过不同的调控方式参与植物抗逆、生长发育等生理过程, Guo等[21]通过花粉管导入法在红花中过表达CHS1基因可以显著增加红花醌式查尔酮类化合物的含量, 本研究中发现MeJA处理后CHS3和CHS4的转录水平和HSYA含量都明显升高, MeJA对CHS1基因表达只有微弱的诱导作用, 这说明CHS3和CHS4也参与HSYA生物合成, 提示MeJA对HSYA的诱导作用主要通过CHS3和CHS4基因实现。
另外, 在红花种质资源的收集鉴定过程中, 发现大量花色变异的红花种质资源, 定量分析发现不同花色红花品系的HSYA含量有一定差异性, 红色、橙黄色和黄色红花品系中HSYA含量明显高于白色红花, 本研究通过对HSYA合成的关键基因的表达进行定量分析, 初步找到了影响HSYA在不同花色红花中含量差异的潜在候选基因, 与MeJA诱导PAL2、PAL4、4CL2、4CL4、4CL5、CHS3、CHS4和CHI2等基因的转录水平提高从而使HSYA含量升高的机制不同, CHS1和CHI2的转录水平在不同花色红花中存在明显差异, 红色、橙黄色和黄色红花品系中CHS1和CHI2基因的表达水平明显高于白色, 因为CHS催化产物是HSYA合成的直接底物, 所以推断CHS1在不同花色红花中的表达差异是不同花色红花HSYA含量差异的因素之一。但qRT-PCR结果显示CHS2、CHS3、CHS4和CHS5在白色红花品系中也有一定的表达量, 但白色红花中检测不到HSYA, 说明其他参与HSYA生物合成的下游基因如CGT、P450在白色红花中存在功能或表达缺失。
综上所述, 外源MeJA刺激可提高HSYA含量及该合成途径中关键基因的表达, 为今后进一步研究外源诱导子影响HSYA次生代谢途径机制提供了依据, 不同花色红花HSYA含量差异的机制探讨, 为红花品种的遗传改良提供了一定参考。
作者贡献: 谭政委和梁慧珍设计了本实验, 李磊和杨红旗完成实验材料种植、采样和处理, 余永亮、许兰杰、董薇、夏伟完成了样品HSYA定量测定、基因的定量分析, 谭政委和李磊完成了数据分析、论文初稿的写作, 梁慧珍和马新明指导论文写作与修改。
利益冲突: 本文的研究内容无任何利益冲突。
| [1] |
Pearl SA, Bowers JE, Reyes-Chin-Wo S, et al. Genetic analysis of safflower domestication[J]. BMC Plant Biol, 2014, 14: 43. DOI:10.1186/1471-2229-14-43 |
| [2] |
Pearl SA, Burke JM. Genetic diversity in Carthamus Tinctorius (Asteraceae; safflower), an underutilized oilseed crop[J]. Am J Bot, 2014, 101: 1640-1650. DOI:10.3732/ajb.1400079 |
| [3] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. Vol 1. Beijing: China Medical Science Press, 2015.
|
| [4] |
Li CY, Yin JG, Zhang J, et al. Pharmacokinetic profiles of hydroxysafflor yellow A following intravenous administration of its pure preparations in healthy Chinese volunteers[J]. J Ethnopharmacol, 2015, 162: 225-230. DOI:10.1016/j.jep.2014.12.068 |
| [5] |
Chen Z, Liu L, Liu Y, et al. Hydroxysafflor yellow A induces autophagy in human liver cancer cells by regulating Beclin 1 and ERK expression[J]. Exp Ther Med, 2020, 19: 2989-2996. |
| [6] |
Kazuma K, Takahashi T, Sato K, et al. Quinochalcones and flavonoids from fresh florets in different cultivars of Carthamus tinctorius L[J]. Biosci Biotechnol Biochem, 2000, 64: 1588-1599. DOI:10.1271/bbb.64.1588 |
| [7] |
Li H, Dong Y, Yang J, et al. De novo transcriptome of safflower and the identification of putative genes for oleosin and the biosynthesis of flavonoids[J]. PLoS One, 2012, 7: e30987. DOI:10.1371/journal.pone.0030987 |
| [8] |
Winkel-Shirley B. Flavonoid biosynthesis. A colorful model for genetics, biochemistry, cell biology, and biotechnology[J]. Plant Physiol, 2001, 126: 485-493. DOI:10.1104/pp.126.2.485 |
| [9] |
Chen GJ, Liu HP, Wei Q, et al. The acyl-activating enzyme PhAAE13 is an alternative enzymatic source of precursors for anthocyanin biosynthesis in petunia flowers[J]. J Exp Bot, 2017, 68: 457-467. |
| [10] |
Dehghan S, Sadeghi M, Poppel A, et al. Differential inductions of phenylalanine ammonialyase and chalcone synthase during wounding, salicylic acid treatment, and salinity stress in safflower, Carthamus tinctorius[J]. Biosci Rep, 2014, 34: e00114. DOI:10.1042/BSR20140026 |
| [11] |
Howe G, Jander G. Plant immunity to insect herbivores[J]. Annu Rev Plant Biol, 2008, 59: 41-66. DOI:10.1146/annurev.arplant.59.032607.092825 |
| [12] |
Glazebrook J. Contrasting mechanisms of defense against biotrophic and necrotrophic pathogens[J]. Annu Rev Phytopathol, 2005, 43: 205-227. DOI:10.1146/annurev.phyto.43.040204.135923 |
| [13] |
Browse J, Howe GA. New weapons and a rapid response against insect attack[J]. Plant Physiol, 2008, 146: 832-838. DOI:10.1104/pp.107.115683 |
| [14] |
Browse J. Jasmonate: an oxylipin signal with many roles in plants[J]. Vitam Horm, 2005, 72: 431-456. DOI:10.1016/S0083-6729(05)72012-4 |
| [15] |
Luo XP, Zhu DY, Huang YJ, et al. Effects of methyl jasmonate accumulation of flavonoids and related gene expression of Buckwheat Sprouts[J]. Gen Appl Biol (基因组学与应用生物学), 2015, 34: 1040. |
| [16] |
Wang XY, Cui GH, Huang LQ, et al. Effects of methyl jasmonat on accumulation and release of tanshiones in suspension cultures on Salvia miltiorrhiza hairy root[J]. China J Chin Mater Med (中国中药杂志), 2007, 32: 300-302. |
| [17] |
Peng L, Yan YG, Chen Y, et al. Transcriptome analysis of Polygala tenuifolia seedlings induced by methyl jasmonate and mining of key genes for triterpenoid biosynthetic pathway[J]. Chin Tradit Herb Drugs (中草药), 2020, 51: 2517-2529. |
| [18] |
Xu LJ, Liang HZ, Yu YL, et al. Carthamus tinctorius L.: evaluation on correlations of hydroxysafflor with flower color and the difference among cultivars[J]. Chin Agric Sci Bull (中国农学通报), 2018, 34: 41-45. |
| [19] |
He BX, Xue YR, Tu YH, et al. CtCHS4 induces the accumulation of safflower quinone chalcones in response to methyl jasmonate induction[J]. Acta Pharm Sin (药学学报), 2018, 53: 636-645. |
| [20] |
Chen J, Tang XH, Ren CX, et al. Full-length transcriptome sequences and the identification of putative genes for flavonoid biosynthesis in safflower[J]. BMC Genomics, 2018, 19: 548. DOI:10.1186/s12864-018-4946-9 |
| [21] |
Guo DD, Xue YR, Li DQ, et al. Overexpression of CtCHS1 increases accumulation of quinochalcone in safflower[J]. Front Plant Sci, 2017, 8: 1409. DOI:10.3389/fpls.2017.01409 |
| [22] |
Zhang LL, Tian K, Tang ZH, et al. Phytochemistry and pharmacology of Carthamus tinctorius L[J]. Am J Chin Med, 2016, 44: 197-226. DOI:10.1142/S0192415X16500130 |
| [23] |
Li CY, Yin JG, Zhang J. Pharmacokinetic profiles of hydroxysafflor yellow A following intravenous administration of its pure preparations in healthy Chinese volunteers[J]. J Ethnopharmacol, 2015, 162: 225-230. DOI:10.1016/j.jep.2014.12.068 |
| [24] |
Su P, Guan HY, Zhao YJ, et al. Identification and functional characterization of diterpene synthases for triptolide biosynthesis from Tripterygium wilfordii[J]. Plant J, 2018, 93: 50-65. DOI:10.1111/tpj.13756 |
 2020, Vol. 55
2020, Vol. 55


