2. 上海中医药大学中药现代制剂技术教育部工程研究中心, 上海 201203
2. Engineering Research Center of Modern Preparation Technology of TCM of Ministry of Education, Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China
片剂具有生产成本低、运输储存能耗小、给药剂量准确和患者服用方便等优点, 是中药新药研发常选用的剂型之一[1, 2]。但中药片剂生产过程还是存在诸多困难和缺陷, 如裂片、松片、硬度较差、崩解/溶出迟缓等[3, 4]。直接压片过程简单、载药量高, 特别适合于对湿热敏感的药物[5], 但直压受物料本身的性质如流动性和可压性等影响, 对药物本身性质要求高[6]。解决药物不能直压的常用办法是将药物与直压性能好的辅料混合, 以改善压片过程和片剂性质。而中药复杂的成分导致不同种类的中药性质不一, 且中药日服剂量一般较大, 所以辅料的可选范围及其改善空间有限。
共处理技术是一种将药物或辅料与其他一种或以上的辅料通过一定处理方式, 得到性能改善的共处理产品的技术[7, 8]。共处理手段通常只涉及到物理层面的修饰和加工, 因此不会改变药物或辅料自身的化学结构和稳定性[7]。共处理的常用技术包括喷雾干燥、热熔挤出、流化床包裹、共研磨和共沉淀等[9]。其中, 流化床包裹技术具有诸多优点, 如集物料制备与干燥于一体、干燥温度低和能够实现不同物料的分层分布等, 因此适合中药这类成分复杂的物质。
本课题组前期对27种中药粉体的流动性和可压性进行了研究。结果发现, 它们均不能满足粉末直接压片的要求, 且81.5%中药粉体同时存在可压性差和流动性差的问题[10]。随后, 本课题组以穿心莲提取物为研究对象, 选用流化包裹工艺, 以6%~12%羟丙基甲基纤维素(HPMC) E3为改性剂制备了基于该中药提取物的改性粒子, 并成功通过连续直压工艺制备了载药量为76.4%的片剂, 但HPMC包裹对片剂崩解产生了一定的不利影响[11]。据文献[12, 13]报道, 加入致孔剂进行共处理既能改善药物的压缩成型性, 同时由于其致孔作用产生的孔隙又能改善药物的崩解/溶出问题。碳酸氢铵在60 ℃发生受热完全分解[14], 因此在物料流化制备过程中即可除去, 从而在粒子内部或表面留下孔洞, 制得多孔粒子。基于上述发现, 本研究旨在通过流化床底喷技术将HPMC表面包裹与碳酸氢铵致孔相结合, 研究它们协同用于改善中药粉体压片关键性能的前景。
材料与方法药品与试剂 干姜醇提物(批号170510, 汉中天然谷生物科技股份有限公司); 栀子水提物(批号20170501, 陕西斯诺特生物技术有限公司); 灵芝水提物(批号20161101, 宁波立华植物提取技术有限公司); 葛根醇提物(批号: 170906, 汉中天然谷生物科技股份有限公司); HPMC E3 (批号3E150124L1, Dow Chemicals公司); 碳酸氢铵(批号20190911)、硬脂酸镁(批号20170808) (国药集团化学试剂有限公司)。中药提取物原粉系由中药醇提或水提后, 经喷雾干燥制备而得。
仪器 FLZB 1.5实验型多功能流化床(创志机电科技发展有限公司); Longer BT100-2J蠕动泵(兰格恒流泵有限公司); Korsch XP1感应压片机(德国Korsch公司); YD-20KZ智能片剂硬度仪(天津市天大天发科技有限公司); LB-2D型崩解时限测定仪(上海黄浦药检仪器有限公司); DHG-9203A电热恒温鼓风干燥箱(上海精宏实验设备有限公司); Leica EM ACE600溅射仪(奥地利莱卡显微系统公司); QUANTA FEG 259环境扫描电子显微镜(荷兰飞利浦公司); BT-1000型粉体综合特性测试仪(丹东市百特仪器有限公司); Marlven-2000粒径测定仪(英国马尔文公司); HE53红外快速水分测试仪(梅特勒-托利多仪器有限公司)。
流化改性复合粒子的制备 采用流化床底喷法对初始物料(干姜、葛根、栀子和灵芝提取物)进行包裹改性, 根据本课题组前期研究, 确定底料与辅料的投料用量为:初始物料投料量为400 g, HPMC用量为初始底料用量的7%, 碳酸氢铵为初始底料用量的15%。流化床工艺参数如下:进风温度60 ℃, 雾化压力1.20 bar, 进风量50~100 m3·h-1, 包衣液加入速率为8 r·min-1。进液完成后于鼓风烘箱内干燥2 h, 按照公式(1)计算其收率(PY)。各产品缩写见表 1。
| Table 1 Abbreviation of parent powders and modified products using fluid bed. PLR: Puerariae Lobatae Radix; GF: Gardeniae Fructus; Gan: Ganoderma; ZR: Zingiberis Rhizoma; HPMC: Hydroxypropyl methyl cellulose |
| $ {\rm{PY}}\left( {\rm{\% }} \right) = \frac{{{m_0}}}{{{m_1}}} \times 100 $ | (1) |
其中, m0为流化后的实际产品重量, m1为流化后理论产品的总重量。
含水量 样品的含水量(moisture content, MC)通过红外快速水分测定仪进行测定。取2 g左右的样品均匀撒在称量盘上, 设定温度为105 ℃, 当水分含量在30 s内不发生变化时, 则为样品的含水量。每个样品测定3次。
粒径与粒径分布 采用马尔文激光粒径仪的干法模块进行测量。将一定量的样品加入到进样器的金属槽中, 按照预设好的标准操作程序进行测定, 记录样品的中位粒径(D0.5)值和粒径分布(span)值。每个样品重复3次。
堆密度、振实密度、卡尔指数和豪斯纳比值 采用粉体综合测定仪进行测定。预先称量体积为100 cm3的金属桶的质量, 记为m1; 将待测样品自由填充入金属桶内, 待填充满后用刮板刮去多余样品, 此时重量记为m2。堆密度(bulk density, ρb)由公式(2)进行计算:
| $ {\rho _{\rm{b}}} = \frac{{{m_2} - {m_1}}}{{100}} $ | (2) |
将延伸桶与金属桶连接好, 继续向内填充样品, 保证样品量在振实后不低于金属桶顶部。振动6 min, 结束后去除延伸桶, 并用刮板刮去多余样品, 此时重量记为m3。振实密度(tap density, ρt)由公式(3)进行计算:
| $ {\rho _{\rm{t}}} = \frac{{{m_3} - {m_1}}}{{100}} $ | (3) |
卡尔指数(Carr's index, CI)和豪斯纳比值(hausner ratio, HR)通过公式(4)和公式(5)计算得到:
| $ {\rm{CI}} = \frac{{{\rho _{\rm{t}}} - {\rho _{\rm{b}}}}}{{{\rho _{\rm{t}}}}} \times 100 $ | (4) |
| $ {\rm{HR}} = \frac{{{\rho _{\rm{t}}}}}{{{\rho _{\rm{b}}}}} $ | (5) |
休止角 休止角(angle of repose, AR)通过固定漏斗法测定。将样品自由通过固定漏斗, 在平台上形成堆积的圆锥体, 测量圆锥体的高度(h), 结合已知的平台半径(r), 根据公式(6)计算休止角θ:
| $ {\rm{tan}}\theta = \frac{h}{r} $ | (6) |
粉体表面形态 样品的表面形态由扫描电镜在加速电压10 kV下测定。样品通过喷铂金进行处理, 在不同放大倍数下观察。
压缩成型性 各改性粒子通过感应式压片机单冲模式压制。冲头直径8.5 mm, 压速每分钟10片, 片重220 mg, 压制样品前先压1片空白硬脂酸镁润滑冲头, 在6、9和12 kN压力下各压制3片。
用硬度测定仪测定每个片剂的直径(D, mm)、厚度(T, mm)和硬度(F, N), 其抗张强度(tensile strength, TS, MPa)通过公式(7)计算:
| $ {\rm{TS}} = \frac{{2F}}{{\pi DT}} $ | (7) |
快速弹性复原和压缩比 快速弹性复原(fast elastic stretch, FES)和压缩比(compression ratio, CR)由压片机自动记录获得。
功和能 有效功(effective work, E2)和解压缩过程中由于弹性复原损耗的能量(elastic work, E3)均由压片机数据系统自动记录获得。塑性常数(plasticity, PL)和单位有效功(net energy per unit of quality, Esp)由公式(8)和公式(9)计算得到:
| $ {\rm{PL}} = \frac{{{E_2}}}{{{E_2} + {E_3}}} \times 100 $ | (8) |
| $ {E_{{\rm{sp}}}} = \frac{{{E_{2{\rm{}}}}}}{M} $ | (9) |
其中, M为片剂的质量。
崩解时间 按照2020版《中国药典》第四部对中药片剂的崩解时限要求, 选择水为崩解介质, 温度为37 ± 1 ℃, 每个样品压制6片, 硬度为60 N, 测定其崩解时间。
片剂表面形态 样品的表面形态由扫描电镜在加速电压10 kV下测定。
结果与讨论 1 粉体学性质表 2总结了各种粒子的粉体学性质。复合粒子的收率主要与物料的性质有关, 而与所加入的辅料基本无关。因此, 致孔组与未致孔组的收率基本一致。物料的水分含量对粉体学性质和压片及片剂性质有一定的影响。因此, 本研究将各物料的含水量控制在较低且相似的范围内。
| Table 2 Micromeritic properties of parent powders and modified products using fluid bed (n = 3, x±s). AR: Angle of repose; ρb: Bulk density; ρt: Tapped density; CI: Carr index; HR: Hausner ratio; D0.5: The median particle size; MC: Moisture content; PY: Product yield |
图 1为代表性粒子(葛根)的扫描电镜图, 其他中药提取物粒子的扫描电镜图结果与其类似。综合4种提取物扫描电镜图可以发现, 原粉的粒子大多呈不规则状或类球状, 经过流化包裹HPMC于原粉外层后, 粒子形态发生了明显变化, 呈表面较为光滑且凹凸起伏的多粒子聚集体样, 偶见小孔。加入碳酸氢铵共处理后的复合粒子虽然形态与HPMC组相似, 但表面出现了许多孔洞, 说明包衣液中的NH4HCO3分布在中药粒子的表面, 受热后分解成气体从而产生孔隙。
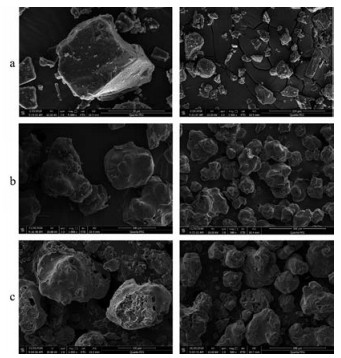
|
Figure 1 Representative scanning electron photomicrographs of particles (with Pueraria extract as an example). a: Parent particles. Magnification: 5 000×(left), 1 500×(right); b: Composite particles prepared by fluidized bed coating with HPMC; c: Composite particles prepared by fluidized bed coating with HPMC and NH4HCO3. Magnification: 1 000×(left), 500×(right) |
粒径和粒径分布主要影响物料的流动性。同时, 粒径过细容易发生静电作用, 导致粉体吸附在仪器表面, 从而造成物料的损失。图 2为4种中药提取物各种粒子的粒径分布图, 结合表 2可以发现, 原粉的中位粒径较小(24~50 μm), 经过流化床共处理后, 物料粒径显著增大(110~280 μm), 并且其粒径分布变窄。主要原因是物料在流化过程中, HPMC溶液的黏合作用使得粉末逐渐团聚, 并且HPMC包裹在粒子表面增厚粒子的直径, 从而增大粒子的粒径, 减小粒径分布。而碳酸氢铵的加入对复合粒子的粒径和粒径分布有一定影响, 推测可能因为碳酸氢铵在流化制备过程中由于不断挥发使得粒子的体积增大, 同时其产气作用可能导致粒子的破碎, 从而影响致孔复合粒子的粒径和粒径分布。
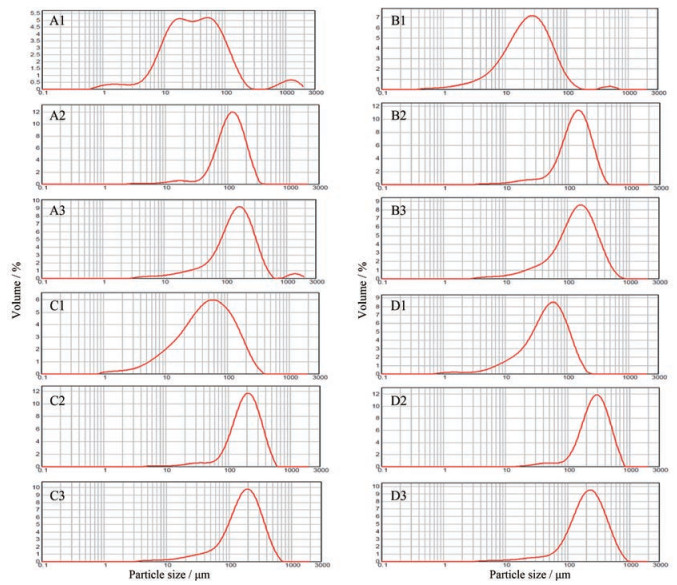
|
Figure 2 Particle size distribution profiles of various materials |
表征粉体流动性的方式有很多, 目前尚未有一个统一的标准, 休止角法、卡尔指数和豪斯纳比值是表征粉体流动性常用的方法[15]。从表 2中可以看出, 原粉的休止角、卡尔指数和豪斯纳比值均大于加入HPMC进行共处理的物料, 而加入碳酸氢铵后流动性进一步得到改善。以休止角为例, 除灵芝水提物外, 其他原粉的休止角均大于50°, 未致孔组的休止角为40°~44°, 致孔组的休止角为37°~42°, 基本能够达到片剂生产要求[16]。这主要得益于粒子的形态从片状不规则状转变为球形或近球形, 以及粒径的显著增大和粒径分布更为均一, 同时HPMC包覆在粒子表面能够增加原粒子间的距离, 降低粒子间的范德华力和静电作用。
2 压片过程及片剂相关性质 2.1 片剂的表面形态图 3为代表性中药提取物(葛根)的片剂表面扫描电镜图, 灵芝、栀子与干姜提取物压制的片剂均呈现相似的特征。从60 N的片剂横截面扫描电镜图可以观察到, 致孔粒子制备的片剂表面有较多细小的孔隙, 而未致孔组的片剂表面相对致密。这是因为致孔粒子的可压性更好, 在较小的压力下即能够达到60 N的硬度; 而未致孔粒子则需要在较大的压力下才能够达到60 N的硬度, 因此形成的片剂表面更加紧实。在9 kN压力下压制的片剂正好相反, 致孔粒子形成的片剂表面比未致孔组的更为紧实致密。这主要是由于致孔粒子的蜂窝状结构能够增大压片时的接触面积, 从而增加粒子间的结合力, 而未致孔组的片剂表面有较多的缝隙和孔洞, 说明粒子间的结合力较小。因此, 扫描电镜图的结果能够佐证致孔组片剂抗张强度的提高。
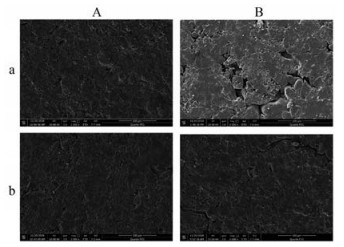
|
Figure 3 Representative scanning electron photomicrographs of tablets prepared by composite particles (with Pueraria extract as an example). A: Tablets with hardness of 60 N; B: Tablets prepared under the pressure of 9 kN; a: Composite particles prepared by fluidized bed coating with HPMC; b: Composite particles prepared by fluidized bed coating with HPMC and NH4HCO3. Magnification: 1 000× |
样品的上冲压力与抗张强度曲线图见图 4。片剂的抗张强度主要用来表征片剂的机械强度, 抗张强度值越大, 表明物料的压缩成型性越好[17], 其对压力作图得出的压缩曲线不受片剂的形状、尺寸和厚度影响, 能够有效地反映出粉体本身的特性。葛根和干姜醇提物的原粉压缩性极差, 在6~12 kN内其片剂抗张强度不超过0.5 MPa, 但加入HPMC进行共处理得到的复合粒子组抗张强度显著增加, 而加入碳酸氢铵得到的致孔粒子组的抗张强度进一步增加(对葛根醇提物原粉而言, 抗张强度分别提高了3.8~8.1倍和5.7~10.9倍; 对于干姜醇提物而言, 则分别提高了4.3~5.4倍和11.0~14.8倍)。栀子和灵芝水提物原粉的压缩成型性也较差, 相较于栀子水提物的原粉, 未致孔组和致孔组的抗张强度分别提高了0.5~0.9倍和0.9~1.7倍; 而相较于灵芝水提物原粉, 未致孔组和致孔组的抗张强度分别提高了0.2~0.7倍和0.5~1.1倍。总体而言, 改性复合粒子能够显著改善中药提取物的压缩成型性, 并且对压缩性极差的物料有更加明显的改善作用。这是因为在流化过程中, HPMC不断包裹在粒子表面, 使得物料表面性质逐渐趋于HPMC, 而HPMC的塑性变形力强, 具有极佳的压缩成型性。此外, 加入碳酸氢铵的致孔组改善效果优于未致孔组, 这主要归因于碳酸氢铵随着物料制备过程不断挥发, 从而形成表面和内部具有孔隙的物料, 高的孔隙率有利于在压片过程中增大粒子间和粒子内的接触面积从而增大片剂的结合力。
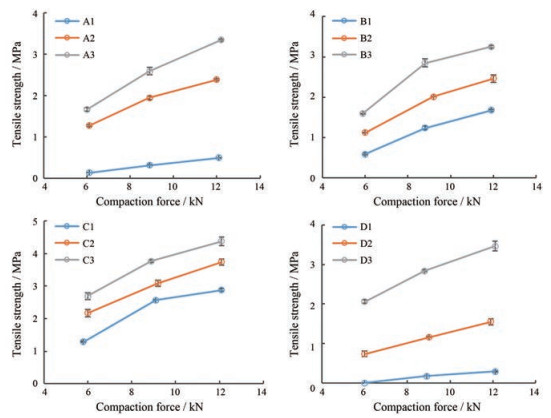
|
Figure 4 Tensile strength profiles for tablets prepared by various materials (n = 3, x±s) |
FES主要用来表征物料在解压缩过程中的轴向弹性复原能力。当FES的值越大, 弹性复原能力越大, 说明发生裂片的趋势越大。因此, 在实际生产中, 保持片剂足够的硬度情况下应使其FES尽可能小。FES及其他压片参数见表 3。经过流化包裹改性的复合粒子的片剂FES与原粉基本无差别。通常片剂的硬度增大, FES会随之增大, 但流化床制备的复合粒子既能够改善物料的压缩成型性, 并且对FES基本无影响。
| Table 3 Relative tablet properties of parent and fluid-bed coating particles (n = 3, x±s). CR: Compression ratio; FES: Fast elastic stretch; E2: Effective work; E3: Elastic work; PL: Plasticity. The relative tablets properties were determined under the compaction force of 9 kN |
CR表征的是在一定压力下物料的体积减小能力, 即CR值越小, 物料的压缩性越好[18]。4种中药提取物改性前后的CR值基本不变, 或改性后略有减小。推测可能是因为加入的改性剂碳酸氢铵和HPMC, 前者因为挥发后基本无残留, 而后者的加入量较少(7%), 因此对初始物料的压缩能力影响不大, 说明改性作用可能主要改善的是物料压缩时的结合能力。
2.5 功和能PL是塑性常数, 描述的是物料塑性变形的能力, 当PL值越接近100%, 说明在压片过程中物料的塑性变形能力越好[19]。从表 3数据中可以看出, 4种中药提取物原粉的PL值均大于85%, 加入HPMC和碳酸氢铵改性后PL值有所增加, 但增加程度有限。这主要是由于原粉自身发生的即是塑性形变且形变能力较好, 并且加入的改性剂用量较低, 因此对物料自身的塑性变形能力改善有限。Esp表征的是在压缩形变过程中作用于物料不可逆形变的单位有效功和能量。4种物料的Esp曲线与抗张强度曲线有相似趋势(图 5)。Esp随着上冲压力的增大而增大, 说明随着压力的增大, 有更多的功和能量用于物料的不可逆形变, 从而增加片剂的抗张强度。此外, 在同一压片力下, HPMC改性的复合粒子组的Esp大于原粉组, 而致孔复合粒子组的Esp进一步增大, 说明有更多的能量作用于复合粒子的压缩过程, 从而增加其片剂的抗张强度。但栀子水提物没有呈现这一规律, 这可能是由于压片过程复杂, 涉及粒子的重排、破碎和结合[20], 片剂的抗张强度改善是多方面因素的共同作用, 并且中药提取物的化学成分复杂, 因此可能功和能方面的变化不是改善栀子水提物片剂抗张强度的主要因素, 但Esp仍具有一定的指导意义。
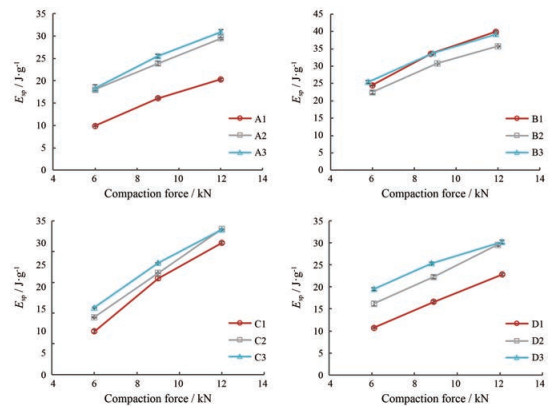
|
Figure 5 Net energy per unit of quality (Esp) profiles for tablets prepared by various materials (n = 3, x±s) |
图 6为4种中药提取物及其复合粒子所压制片剂的崩解时间图。干姜和葛根醇提物原粉的压缩性能极差, 因此难以压制60 N的片剂。栀子和灵芝水提物原粉崩解时间短(~10 min)。与原粉组相比, 未致孔组的崩解时间有所延长, 增加了1.3~1.6倍, 这主要是因为HPMC本身较强的黏性所致。而致孔组的崩解时间相对于未致孔组减小了20.2%~27.0%, 对于崩解时间长于60 min的葛根-HPMC复合粒子而言, 其加入碳酸氢铵后崩解时间改善了52.1%。这得益于碳酸氢铵在挥发后形成的孔隙有助于崩解介质快速进入片子内部, 加快崩解介质对物料的润湿, 从而加快片剂的崩解速率。因此, 流化共处理时加入碳酸氢铵能在一定程度上改善HPMC所导致的片剂崩解时间延长问题。
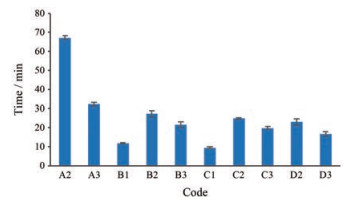
|
Figure 6 Disintegration time of tablets prepared by various materials (n = 3, x±s) |
将两种中药水提物(栀子和灵芝)和两种中药醇提物(干姜和葛根)分别通过流化包裹制备成未致孔(仅加入7% HPMC)和致孔(加入7% HPMC和15%碳酸氢铵)复合粒子, 并将这两组复合粒子与原粉进行了粉体学性质(表面形态、粒径、流动性)和压片及片剂性质(压缩成型性、压缩功和能、崩解时限)的比较。结果表明, 未致孔的复合粒子在流动性与压缩成型性方面均显著优于原粉, 一方面是因为流化包裹作用能够增大粒子的粒径、改变粒子的形态和减小粒子间的作用力, 从而改善流动性; 另一方面是因为HPMC本身的塑性变形能力强, 可增加用于片剂形成的有效功, 从而增大片剂的抗张强度。致孔复合粒子能够获得进一步改善的粉体学和片剂性质, 这主要是因为碳酸氢铵的挥发致孔作用能够增大粒子的比表面积, 从而增大压片时粒子内和粒子间结合力。此外, 包衣液中加入碳酸氢铵还能有效改善由于HPMC本身黏性所导致的片剂崩解速率变慢的问题。这主要是归功于碳酸氢铵挥发作用产生的孔隙能够在崩解过程中使崩解介质通过孔隙快速进入片剂内部, 从而加快片剂的崩解。总体而言, 将压缩成型性较差的中药提取物与HPMC和碳酸氢铵一起进行流化共处理有望显著改善中药原粉的粉体学性质和压片及片剂性质, 这为改善一些中药提取物片剂制备性质提供了一个可行的策略。
作者贡献:罗毓负责实验的实施和论文的撰写; 吴飞负责实验数据的整理和分析; 沈岚负责论文的审阅和修改; 林晓负责实验的构思与设计; 冯怡负责实验平台的提供。
利益冲突:本文无利益冲突。
| [1] |
Adeoye O, Alebiowu G. Flow packing and compaction properties of novel coprocessed multifunctional directly compressible excipients prepared from tapioca starch and mannitol[J]. Pharm Devel Technol, 2014, 19: 901-910. |
| [2] |
Mangal S, Meiser F, Morton D, et al. Particle engineering of excipients for direct compression:understanding the role of material properties[J]. Curr Pharm Des, 2015, 21: 5877-5889. |
| [3] |
Li YN, Wu ZF, Wan N, et al. Current situations and problem analysis of influencing factors of traditional Chinese medicine tablets on forming quality[J]. Chin J Chin Mater Med (中国中药杂志), 2018, 43: 1547-1553. |
| [4] |
Liu HN, Yang SL, Yang M, et al. Modernization of traditional Chinese medicine manufacturing:research and application of key technologies in industrialization of solid preparations[J]. Mod Chin Med (中国现代中药), 2020, 22: 155-161. |
| [5] |
Garg N, Pandey P, Kaushik D, et al. Development of novel multifunction directly compressible co-processed excipient by melt granulation technique[J]. Int J Pharm Invest, 2015, 5: 266-274. |
| [6] |
Vanhoorne V, Peeters E, Van Snick B, et al. Crystal coating via spray drying to improve powder tabletability[J]. Eur J Pharm Biopharm, 2014, 88: 939-944. |
| [7] |
Chow K, Tong HH, Lum S, et al. Engineering of pharmaceutical materials:an industrial perspective[J]. J Pharm Sci, 2008, 97: 2855-2877. |
| [8] |
Rojas J, BuckNer I, Kumar V. Co-proccessed excipients with enhanced direct compression functionality for improved tableting performance[J]. Drug Dev Ind Pharm, 2012, 38: 1159-1170. |
| [9] |
Echeverry E, Rojas J. Functionality enhancement of sorbitol and anhydrous calcium diphosphate composites for direct compression applications[J]. Int J Res Pharm Sci, 2014, 5: 299-303. |
| [10] |
Li Z, Wu F, Zhao LJ, et al. Evaluation of fundamental and functional properties of natural plant product powders for direct compaction based on multivariate statistical analysis[J]. Adv Powder Technol, 2018, 29: 2881-2894. |
| [11] |
Li Z, Xian JC, Wu F, et al. Development of TCM-based composite particles for direct compaction by particle design[J]. Powder Technol, 2018, 338: 481-492. |
| [12] |
Zhou M, Shen L, Lin X, et al. Design and pharmaceutical applications of porousparticles[J]. RSC Adv, 2017, 7: 39490-39501. |
| [13] |
Tanimura S, Tahara K, Takeuchi H. Spray-dried composite particles of erythritol and porous silica for orally disintegrating tablets prepared by direct tableting[J]. Powder Technol, 2015, 286: 444-450. |
| [14] |
Gervelas C, Serandour AL, Geiger S, et al. Direct lung delivery of a dry powder formulation of DTPA with improved aerosolization properties:effect on lung and systemic decorporation of plutonium[J]. J Control Release, 2007, 118: 78-86. |
| [15] |
Reynolds GK, Campbell JI, Roberts RJ. A compressibility based model for predicting the tensile strength of directly compressed pharmaceutical powder mixtures[J]. Int J Pharm, 2017, 531: 215-224. |
| [16] |
Yu LF, Hu RF, Su D, et al. Characterizing flowability of microcrystalline cellulose and its visualizing the correlation of the performance parameters[J]. Acta Pharm Sin (药学学报), 2018, 53: 806-811. |
| [17] |
Osamura T, Takeuchi Y, Onodera R, et al. Characterization of tableting properties measured with a multi-functional compaction instrument for several pharmaceutical excipients and actual tablet formulations[J]. Int J Pharm, 2016, 510: 195-202. |
| [18] |
Li JZ, Wu F, Lin X, et al. Novel application of hydroxypropyl methylcellulose to improving direct compaction properties of tablet fillers by co-spray drying[J]. Rsc Adv, 2015, 5: 69289-69298. |
| [19] |
Szepes A, Piroska SR, János B, et al. Characterization and utilization of starches extracted from Florencia and Waxy Maize Hybrids for tablet formulation:compaction behaviour and tablet properties[J]. Am J Plant Sci, 2014, 5: 787-798. |
| [20] |
Paul S, Taylor LJ, Murphy B, et al. Powder properties and compaction parameters that influence punch sticking propensity of pharmaceuticals[J]. Int J Pharm, 2017, 521: 374-383. |
 2020, Vol. 55
2020, Vol. 55


