尿激酶原(pro-urokinase, pro-UK)可用于血栓的治疗[1, 2], 于1973年首次发现于组织培养液中。pro-UK在血浆中只有微弱的活性, 但当其到达血栓表面时, 可被该处的纤溶酶激活, 并进一步将血栓处的纤溶酶原变为纤溶酶, 达到溶解血栓的目的。pro-UK具有纤维蛋白选择性, 出血风险小, 溶栓作用强, 再通率高的优点, 属于第二代溶栓药物[3]。由于pro-UK在组织中含量很低, 提取纯化成本高, 商业化应用一般采用重组技术生产。上世纪90年代, 德国Grünenthal公司用大肠杆菌表达的非糖基化pro-UK (Saruplase)开展了治疗心肌梗死的临床试验[4, 5], 但是由于不良反应问题, 未能得到欧盟的批准[6]。同一时期美国Abbott公司研制的pro-UK (Prolyse)也由于种种问题被FDA拒之门外[7, 8]。2011年, 我国批准首款pro-UK产品上市, 该产品通过基因工程构建的中国仓鼠卵巢细胞(CHO细胞)表达获得。
CHO细胞表达的蛋白具有特定的翻译后修饰, 如糖基化修饰, 在结构上与天然蛋白的结构更加一致[9, 10]。糖基化可以影响蛋白的体内半衰期、蛋白质间的亲和力以及免疫原性, 属于重组蛋白药物的关键质量属性[11]。糖基化在维持蛋白功能的同时也增加了产品的不均一性或异质性, 对产品的质量控制提出了挑战。随着分析技术的不断进步, 人们越来越关注蛋白的糖基修饰情况[12]。
本文针对重组人pro-UK糖基修饰情况展开研究。pro-UK的结构比较复杂, 含411个氨基酸残基, 有12条分子内二硫键, 分子内含有4个结构域:表皮生长因子结构域(第5~49位氨基酸残基)、Kringle结构域(第50~136位氨基酸残基)、连接区(第136~143位氨基酸残基)、丝氨酸蛋白酶结构域(第144~411位氨基酸残基), 完整蛋白相对分子质量(Mr)约50 000, 存在N-糖基化及O-糖基化修饰。本文采用液质联用技术对该蛋白的糖基化位点、类型及相对比例进行了分析, 以期更加深入地了解其结构异质性, 促进产品质量标准的提高。
材料与方法试剂与仪器 超纯水(Milli-Q超纯水机制备, 购自美国Millipore公司); 乙腈(色谱纯, AH015, 霍尼韦尔贸易上海有限公司); 甲酸(F112034, 上海阿拉丁生化科技股份有限公司); 碘化钠(10017160)、碳酸氢铵(20002760), 国药集团化学试剂有限公司; 二硫苏糖醇(DTT, V3151, 美国Promega公司); 碘乙酰胺(IAM, 161625, 北京拜尔迪生物技术有限公司); 甲酸铵(70221, 美国Sigma-Aldrich公司); pro-UK分析样品为检定后留样; 变性剂RapiGest SF (186001860, 美国Waters公司); 糖苷酶(PNGaseF, P0705, 美国NewEngland公司); Trypsin试剂盒(T7575, 美国Sigma-Aldrich公司); GlycoWorks RapiFluor-MS N-糖分析试剂盒(176003606, 美国Waters公司); 完整蛋白Mr及液质肽图测定流动相A (含0.1%甲酸的水溶液), 流动相B (含0.1%甲酸的乙腈溶液); 寡糖图谱分析流动相A (100 mmol·L-1的甲酸铵, 用甲酸调节pH至4.4), 流动相B (乙腈)。
超滤管 (截留相对分子质量10 000, 密理博中国有限公司); 完整蛋白Mr测定用色谱柱(BEH300 C4, 3.5 μm, 2.1 mm×50 mm, 货号186004495);肽图测定用色谱柱(BEH300 C18, 1.7 μm, 2.1 mm×100 mm, 货号186003686);寡糖图谱分析色谱柱(BEH Glycan, 1.7 μm, 2.1 mm×150 mm, 货号186004742);超高效液相色谱-质谱联用系统(ACQUITY H-Class-Xevo G2 QTof), 以上色谱柱及液质联用仪均购自美国Waters公司。
完整蛋白Mr测定
未处理样品 取1支样品(冻干粉, 每支2 mg), 用超纯水2 mL溶解, 离心后取上清上样。
切除N-糖基样品 取溶解后的样品0.5 mL, 用超滤管浓缩至100 μL, 加入变性溶液(0.1% Rapigest SF) 400 μL混匀, 取100 μL加入糖苷酶PNGase F 5 μL, 37 ℃孵育3 h, 离心后取上清上样。
还原后切除N-糖基样品 取溶解后的样品0.5 mL, 用超滤管浓缩至100 μL, 加入变性溶液400 μL混匀, 取200 μL, 加入1 mol·L-1 DTT溶液2 μL, 45 ℃孵育30 min。完毕后加入变性溶液300 μL, 混匀后用超滤管浓缩至100 μL, 重复加液及离心步骤2次, 最后浓缩至150 μL, 取100 μL加入糖苷酶PNGase F 5 μL, 37 ℃孵育3 h, 离心后取上清上样。
检测条件 柱温35 ℃; 样品池温度10 ℃; 上样量10 μL; 流速0.2 mL·min-1; 洗脱梯度: 7 min内流动相B由10%至85%;质谱采集模式: MS/灵敏度; 毛细管电压: 3 000 V; Cone电压: 40 V; 去溶剂气体温度: 450 ℃; 源温: 120 ℃; 去溶剂气体流速: 600 L·h-1, 扫描范围(m/z): 500~3 000。用20 μg·mL-1碘化钠溶液对质谱仪进行校正后连接UPLC与质谱进行检测。用Unify软件对采集的数据进行处理并计算Mr。
液质肽图测定 取1支供试品, 用超纯水2 mL溶解, 取500 μL加入超滤管中, 12 000 r·min-1离心5 min; 加入超纯水0.35 mL, 12 000 r·min-1离心5 min, 重复该步骤4次; 最后用超纯水调节体积至0.2 mL, 从中取50 μL, 加入0.2%的RapiGest SF 50 μL并混匀, 加入1 mol·L-1 DTT溶液2 μL于37 ℃反应1 h, 再加入1 mol·L-1 IAM溶液4 μL室温暗处反应1 h, 加入胰蛋白酶5 μg, 37 ℃孵育15 h; 加入糖苷酶PNGaseF 3 μL, 37 ℃孵育2 h。
柱温40 ℃; 样品池温度10 ℃; 上样10 μL; 流速0.2 mL·min-1; 洗脱梯度: 60 min内流动相B由1%至60%;质谱采集模式: MSe/灵敏度; 毛细管电压: 3 000 V; Cone电压: 40 V; 去溶剂气体温度: 350 ℃; 源温: 120 ℃; 去溶剂气体流速: 800 L·h-1; 扫描范围(m/z): 50~2 000;二级质谱碰撞能量: 20.00~45.00 eV。结合一级及二级质谱数据对样品的氨基酸序列及翻译后修饰进行鉴定。
寡糖图谱测定 用N-糖分析试剂盒标记N-糖基:取1支样品用超纯水1 mL溶解, 取7.5 μL置于EP管中, 加入5% RapiGest SF溶液6 μL并混匀, 90 ℃加热3 min, 取出冷却3 min, 加入Rapid PNGase F酶1.2 μL及水15.3 μL, 50 ℃温育5 min, 取出冷却3 min。加入RapiFluor-MS试剂溶液12 μL并混匀, 室温反应5 min, 然后加入乙腈358 μL稀释。按说明书步骤纯化标记后的糖基。
液相参数:激发波长330 nm, 发射波长420 nm; 柱温60 ℃; 进样10 μL; 洗脱梯度: 60 min内流动相B由75%至50%。质谱仪采集模式: MS/灵敏度; 毛细管电压3 000 V; Cone电压40 V; 去溶剂气体温度350 ℃; 源温120 ℃; 去溶剂气体流速800 L·h-1, 扫描范围(m/z): 1 000~3 000。结合质谱及荧光检测结果, 对各N-糖进行定性定量。
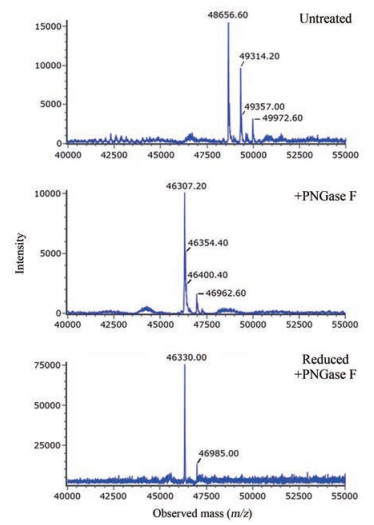
结果 1 完整蛋白水平分析异质性采用液质联用技术分别测定未处理样品、切除N-糖基样品及还原后切除N-糖基样品的完整蛋白Mr (图 1)。结果显示, 未处理样品的Mr呈现明显的异质性, 切除N-糖基后异质性减弱, 但仍存在两种主要的Mr形式。
|
Figure 1 Comparison of deconvoluted intact mass spectra of pro-UK with different treatments |
根据GenBank数据库中的人源pro-UK (编号AAA61253)的氨基酸序列, 计算得出其理论Mr为46 344.73, 还原后为46 368.97, 与实测结果46 307.20和46 330.00分别存在37.53和38.97的差异。经后续的液质肽图分析证实, 重组人pro-UK的氨基酸序列与数据库中的序列相比在C-末端缺少Ala-Leu两个氨基酸(Mr减少184.24), 且存在岩藻糖化(+Fuc)修饰(Mr增加146.14), 理论Mr应为46 307.23, 还原后为46 331.47, 实测结果与之基本一致。按同样方法还对其他影响Mr的修饰进行了鉴定, 并将各实测Mr与理论值进行了匹配(表 1)。结果显示, 这些Mr异质性均是由于糖基修饰所致。
| Table 1 Observed Mr of pro-UK with different modifications. A2F refers to disialo, galactosylated, fucosylated, biantennary N-glycan. A3F refers to trisialylated, galactosylated, fucosylated, triantennary N-glycan. A4F refers to tetrasialylated, galactosylated, fucosylated, tetraantennary N-glycan. O-glycan 1 refers to Hex-HexNAc-Neu5Ac. O-glycan 2 refers to Hex-HexNAc-Neu5Ac2 |
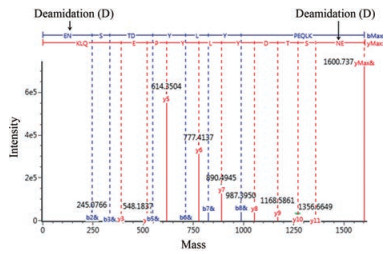
通过对该蛋白的序列分析, 该蛋白仅存在1个N-糖基修饰序列子(N302ST), 即仅可能在302位天冬酰胺残基(N)发生N-糖基修饰, 如果发生修饰, 经PNGase F切除糖基后, 天冬酰胺残基会脱氨基(deamidation)变为天冬氨酸(D), 形成0.98的质量标记。通过对液质肽图进行分析, 未发现含N302的肽段, 只有含D302的肽段T33 (串联质谱结果见图 2, Mr结果见表 2), 结合完整蛋白Mr测定结果中, 未处理样品中不存在不含N-糖基修饰的蛋白信号(图 1), 可以判断该蛋白的N302均发生了N糖基修饰, N-糖基的异质性见第3部分。
|
Figure 2 MS/MS spectrum for peptide T33 with an N-glycosylation site |
| Table 2 Observed Mr and ratio of peptides with N/O-glycosylation site |
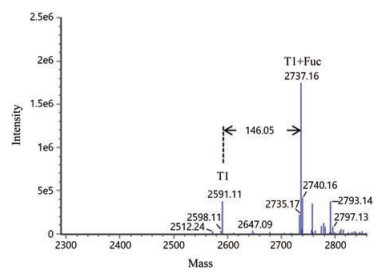
O-糖基可修饰于丝氨酸(S)或苏氨酸(T)残基, 通过对液质肽图中O-糖基化肽段的分析, 发现肽段T1 (S1NELHQVPS9NCDCLNGGT18CVS21NK)均存在岩藻糖化(Fuc)修饰(Mr结果见表 2), 并通过串联质谱结果进行了验证(图 3)。在糖基化位点鉴定方面, 根据串联质谱结果, 发现岩藻糖化的肽段片段T18CVS21NK, 所以糖基化位点只能为T18或S21; 结合文献资料报道, 以及岩藻糖化修饰位点的N端通常有两个连续的甘氨酸残基(G)[13, 14], 据此判断修饰位点为T18。
|
Figure 3 MS/MS spectrum for peptide T1 with an O-linked fucose |
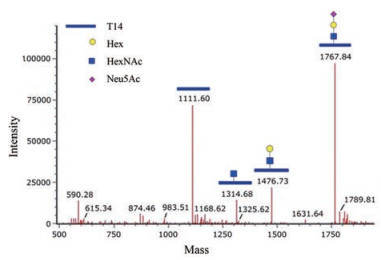
肽段T14 (KPS138S139PPEELK)也存在O-糖基修饰, 通过查阅文献, 没有发现之前有关此处糖基修饰的报道。该处的糖基类型有2种, 主要为Hex-HexNAc-Neu5Ac (O-glycan 1, 串联质谱结果见图 4), 还有少量为Hex-HexNAc-Neu5Ac2 (O-glycan 2, 见表 2)。由于T14含有两个连续的S, 未能获得理想的串联质谱片段以确定何处为糖基化位点。此外, 该处为不完全修饰, 即只有部分蛋白发生O-糖基修饰。通过提取离子流方式计算无糖基修饰及2种不同糖型修饰肽段的比例, 结果见表 2。值得注意的是, 串联质谱图是经软件处理所得, 图中标示Mr为肽段碎片加合质子后的最大丰度同位素峰的Mr, 而表 2中的Mr均为单同位素Mr, 二者之间存在1~2的差异。
|
Figure 4 MS/MS spectrum for peptide T14 with an O-glycan 1 |
将蛋白的N-糖基切下并进行荧光标记, 通过液相色谱分离, 得到10余个由寡糖形成的色谱峰(图 5)。用质谱测定各色谱峰中寡糖的Mr, 并与CHO细胞表达的蛋白中常见糖型的Mr进行匹配, 结果对其中的12种寡糖(包括同分异构体)进行了鉴定, 实测Mr与理论Mr的误差均小于0.03。这12种寡糖中含量较多的糖型为A2F和A3F, 二者在所有糖型中的比例将近80%。
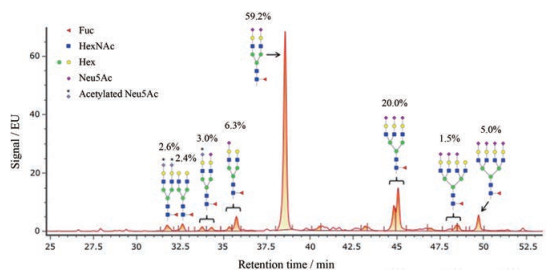
|
Figure 5 Annotated fluorescence (FLR) chromatograms from the HILIC-UPLC/FLR/MS analysis of pro-UK |
糖基化是重组蛋白药物的一类非常重要的翻译后修饰, 也是导致产品异质性的重要原因[15]。糖基化修饰与表达体系密切相关[16], 还受生产工艺参数的影响, 因此, 糖基的类型及相对比例可在一定程度上反映生产工艺的稳定性[17]。此外, 糖基化还会对产品的安全有效产生影响, 比如促红素的糖基对其活性及半衰期影响明显[18, 19], 单克隆抗体的糖基类型可影响其与Fc受体的亲和力[20]。有研究表明, pro-UK的糖基化会影响其稳定性及酶活性[21-23]。当糖基修饰对重组蛋白药物的安全有效产生显著影响时, 应作为关键质量参数进行控制。
本文结果显示, 虽然T18全部发生岩藻糖化, 不对蛋白的异质性产生影响, 但另一个位点S138/139发生部分修饰, 未修饰及2种糖型修饰的比例分别为93.6%、6.0%、0.4%, 增加了蛋白的异质性。N302虽然全部发生N-糖基化, 但糖型有10余种, 使蛋白的异质性大大增加。在位点鉴定方面, S138/139处的O-糖基修饰未见相关报道, 该位点介于pro-UK的Kringle结构域与丝氨酸蛋白酶结构域之间, 且其附近(135与136位氨基酸之间)还存在一个纤溶酶酶切位点, 所以该处糖基化修饰是否影响蛋白活性是值得研究的问题。鉴于糖基修饰的重要性, 为保证产品的质量一致性和工艺稳定性, 应研究建立相对定量的评价方法, 监测产品的批间一致性, 并通过数据的不断积累及对产品认知的不断提高, 确定不同糖型与产品安全性、有效性的关联, 为提升产品质量奠定基础。
综上所述, 本文采用液质联用技术对pro-UK的糖基修饰情况进行了分析鉴定, 明确了糖基修饰对结构异质性的影响, 为该品种质量标准的提高提供了数据支持。
作者贡献:陶磊负责实验设计、实验操作、数据整理及文章撰写; 于雷负责实验操作、数据整理及文章修改; 丁有学负责文章修改; 毕华负责实验设计、数据整理及文章修改; 饶春明负责实验设计、数据整理及文章修改。
利益冲突:本文研究内容无任何利益冲突。
| [1] |
Yao Z, Li W, Cheng L, et al. Comparison of the effect of recombinant human pro-urokinase and tirofiban on myocardial blood flow perfusion in ST elevation myocardial infarction patients receiving primary percutaneous coronary intervention:a one-center retrospective observational study[J]. Medicine (Baltimore), 2019, 98: e16143. |
| [2] |
Fu Y, Gu XS, Hao GZ, et al. Comparison of myocardial microcirculatory perfusion after catheter-administered intracoronary thrombolysis with anisodamine versus standard thrombus aspiration in patients with ST-elevation myocardial infarction[J]. Catheter Cardiovasc Interv, 2019, 93: 839-845. DOI:10.1002/ccd.28112 |
| [3] |
Kadir RRA, Bayraktutan U, et al. Urokinase plasminogen activator:a potential thrombolytic agent for ischaemic stroke[J]. Cell Mol Neurobiol, 2020, 40: 347-355. |
| [4] |
Meyer J. Clinical profile of saruplase:angiographic findings[J]. Int J Clin Pract Suppl, 1998, 99: 9-15. |
| [5] |
Spiecker M, Windeler J, Vermeer F, et al. Thrombolysis with saruplase versus streptokinase in acute myocardial infarction:five-year results of the PRIMI trial[J]. Am Heart J, 1999, 138: 518-524. DOI:10.1016/S0002-8703(99)70155-9 |
| [6] |
Moser M, Bode C. Pharmacology and clinical trial results of saruplase (scuPA) in acute myocardial infarction[J]. Expert Opin Investig Drugs, 1999, 8: 329-335. |
| [7] |
Furlan A, Higashida R, Wechsler L, et al. Intra-arterial prourokinase for acute ischemic stroke. The PROACT Ⅱ study:a randomized controlled trial. Prolyse in acute cerebral thromboembolism[J]. JAMA, 1999, 282: 2003-2011. |
| [8] |
del Zoppo GJ, Higashida RT, Furlan AJ, et al. PROACT:a phase Ⅱ randomized trial of recombinant pro-urokinase by direct arterial delivery in acute middle cerebral artery stroke[J]. Stroke, 1998, 29: 4-11. |
| [9] |
Tejwani V, Andersen MR, Nam JH, et al. Glycoengineering in CHO cells:advances in systems biology[J]. Biotechnol J, 2018, 13: e1700234. |
| [10] |
Betts Z, Dickson AJ. Improved CHO cell line stability and recombinant protein expression during long-term culture[J]. Methods Mol Biol, 2017, 1603: 119-141. |
| [11] |
Yang X, Bartlett MG. Glycan analysis for protein therapeutics[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2019, 1120: 29-40. DOI:10.1016/j.jchromb.2019.04.031 |
| [12] |
Carillo S, Mittermayr S, Farrell A, et al. Glycosylation analysis of therapeutic glycoproteins produced in CHO cells[J]. Methods Mol Biol, 2017, 1603: 227-241. |
| [13] |
Moloney DJ, Lin AI, Haltiwanger RS. The O-linked fucose glycosylation pathway. Evidence for protein-specific elongation of O-linked fucose in Chinese hamster ovary cells[J]. J Biol Chem, 1997, 272: 19046-19050. |
| [14] |
Gohlke M, Baude G, Nuck R, et al. O-Linked L-fucose is present in Desmodus rotundus salivary plasminogen activator[J]. J Biol Chem, 1996, 271: 7381-7386. DOI:10.1074/jbc.271.13.7381 |
| [15] |
Xu GL, Wei W, Luo JH, et al. Impact of glycosylation on monoclonal antibody structure, function and related CMC regulatory considerations[J]. Acta Pharm Sin (药学学报), 2020, 55: 1345-1350. |
| [16] |
Qi LQ, Zhao J, Wei W, et al. Assessment of monoclonality of cell bank for recombinant biologics production[J]. Acta Pharm Sin (药学学报), 2019, 54: 1325-1329. |
| [17] |
Li MY, Ebel B, Paris C, et al. Real-time monitoring of antibody glycosylation site occupancy by in situ Raman spectroscopy during bioreactor CHO cell cultures[J]. Biotechnol Prog, 2018, 34: 486-493. |
| [18] |
Murakami M, Kiuchi T, Nishihara M, et al. Chemical synthesis of erythropoietin glycoforms for insights into the relationship between glycosylation pattern and bioactivity[J]. Sci Adv, 2016, 2: e1500678. |
| [19] |
Kianmehr A, Mohammadi HS, Shokrgozar MA, et al. In silico design and analysis of a new hyperglycosylated analog of erythropoietin to improve drug efficacy[J]. Adv Biomed Res, 2015, 4: 142. DOI:10.4103/2277-9175.161548 |
| [20] |
Cambay F, Henry O, Durocher Y, et al. Impact of N-glycosylation on Fcγ receptor/IgG interactions:unravelling differences with an enhanced surface plasmon resonance biosensor assay based on coiled-coil interactions[J]. MAbs, 2019, 11: 435-452. |
| [21] |
Wang P, Zhang J, Sun Z, et al. Glycosylation of prourokinase produced by Pichia pastoris impairs enzymatic activity but not secretion[J]. Protein Expr Purif, 2000, 20: 179-185. DOI:10.1006/prep.2000.1310 |
| [22] |
Lenich C, Pannell R, Henkin J, et al. The influence of glycosylation on the catalytic and fibrinolytic properties of pro-urokinase[J]. Thromb Haemost, 1992, 68: 539-544. DOI:10.1055/s-0038-1646314 |
| [23] |
Yang B, Li TD. Effect of glycosylation at Asn302 of pro-urokinase on its stability in culture supernatant[J]. Chin Med Sci J, 2006, 21: 128-130. |
 2020, Vol. 55
2020, Vol. 55


