2. 浙江省震元制药研究院, 浙江 绍兴 312071
2. Zhejiang Zhenyuan Pharmaceutical Research Institute, Shaoxing 312071, China
地塞米松(dexamethasone, Dex)等糖皮质激素具有抗炎、抗过敏、抗休克及非特异性免疫抑制等多种作用, 临床上主要用于治疗过敏性及自身免疫性疾病。当长期或大剂量使用时, 往往会引起肌肉萎缩[1]、高血糖、高血脂[2, 3]和向心性肥胖[4, 5]等不良反应, 对患者的身体产生不良影响, 目前尚无有效的治疗方法, 因此, 研究开发可缓解激素引起的代谢紊乱等不良反应的药物具有重要的意义。小檗碱(berberine, BBR)是黄柏、黄连、刺檗和印度小檗等植物中的主要成分, 属于原小檗碱类的苄基异喹啉季铵生物碱[6], 具有广泛的药理活性, 如降糖、降脂[7]、抗微生物[8]和抗肿瘤等。本实验采用动物及细胞实验, 探讨BBR对地塞米松引起的代谢紊乱及内脏脂肪堆积的治疗作用及相关机制。
材料与方法主要试剂 BBR (南京泽朗生物科技有限公司); 生理盐水(四川科伦药业股份有限公司); 地塞米松磷酸钠(MedChemExpress公司); 胰岛素(Tocris); 3-异丁基-1-甲基黄嘌呤(3-isobutyl-1-methylxanthine, IBMX)、油红染料(Sigma公司); 动物用抗生素头孢呋辛钠(国药集团致君制药有限公司); RNA提取试剂盒(Invitrogen公司); qRT-PCR试剂盒(Applied Biosystems公司); 小鼠来源的GAPDH抗体和AMPKα抗体、辣根过氧化物酶(HRP)标记的驴抗兔二抗、HRP标记的山羊抗小鼠二抗(Proteintech公司); 兔源p-AMPKα抗体(Immunoway公司); 兔源PPARγ抗体(Cell Signaling Technology公司)。
实验用仪器 低温冷冻台式离心机(ST16R)、微量分光光度计(Nanodrop2000c) (美国Thermo公司); 生物安全柜(NV-437-400S, 美国NUAIRE公司); 低温冰箱(MDF-U53V, 日本松下公司); 实时定量PCR仪(ABI 7500FAST, 美国Applied Biosystems公司); 凝胶成像系统(美国Bio-rad公司); MRI测试设备(美国AGILENT公司); 组织破碎仪(武汉谷歌生物有限公司); 7100全自动生化分析仪(日本日立公司)。
实验动物 C57 BL/6N雄性小鼠18只, 6周龄, 初始体质量20~22 g, 北京维通利华实验动物技术有限公司购入[SCXK (京) 2016-0006]。动物实验方案由中国医学科学院药物研究所伦理委员会审核并批准(审批编号00005965)。
实验用细胞 小鼠前脂肪细胞3T3-L1购自中国医学科学院基础医学研究所基础医学细胞中心。
小鼠前脂肪细胞3T3-L1分化诱导 小鼠前脂肪细胞3T3-L1用含有10%胎牛血清(fetal bovine serum, FBS)的DMEM高糖培养基培养于37 ℃、5% CO2饱和湿度恒温培养箱内, 当细胞融合度达到70%~80%时, 采用含有0.02% EDTA的胰酶消化传代。以细胞数为每毫升4×104个的细胞悬液置于6孔板中培养, 设空白对照组(DMEM)、溶剂对照组(Con)、模型组(Dex)和给药组(2.5、5和10 μmol·L-1 BBR)。待细胞长满并接触抑制2天, 分化孔由分化诱导液[90% DMEM、10% FBS、1.0 μmol·L-1 Dex、0.5 mmol·L-1 IBMX (溶剂为DMSO)、1.0 μg·mL-1胰岛素(溶剂为pH = 3的盐酸水溶液)]培养2天后, 用分化维持液[90% DMEM、10% FBS、1.0 μg·mL-1胰岛素(溶剂为pH = 3的盐酸水溶液)]维持培养7~15天, 分化孔每次换液时, 空白对照孔换新鲜培养基, 溶剂对照组换含有与分化孔所用溶液等量溶剂的培养基。在细胞分化末期使用含有2.5、5和10 μmol·L-1 BBR的完全培养基培养24 h。
油红染色及定量 使用双蒸水配置60%油红染料, 过滤得到澄清的油红染液。加药处理后的6孔板弃培养基, PBS清洗2次, 使用4%多聚甲醛固定15 min, 固定结束后PBS清洗1遍, 每孔加入油红染液1.2 mL, 避光染色15 min, PBS清洗数次, 显微镜观察并拍照。
分别向油红染色后的各培养孔内加入异丙醇500 μL, 摇匀使染料重新溶解在异丙醇内, 收集异丙醇溶液于1.5 mL离心管内, 800 r·min-1离心5 min, 吸取上清液100 μL加入96孔板, 置于酶标仪中, 在490 nm波长下测定各孔OD值, 每组设置3个平行孔, 以异丙醇孔调零, 对油红染色结果进行定量分析。
动物实验分组及模型的建立 C57BL/6N小鼠随机分为对照组(Con)、模型组(Dex)及BBR组, 每组6只, 给予正常维持饲料。小鼠适应性饲养1周后皮下植入渗透泵(2004型号, 0.25 μL·h-1, 可维持4周, 购自美国Alzet公司), 对照组渗透泵内容物为生理盐水, 模型组及小檗碱组渗透泵内容物为Dex磷酸二钠溶液(1.4 μg·day-1), 手术后连续3天注射头孢呋辛钠抗生素, BBR组小鼠以100 mg·kg-1·day-1灌胃, 连续灌胃4周。每周测量小鼠体重及摄食量。
小动物核磁成像 给药结束后取出渗透泵, 隔日待小鼠状态恢复后通过小动物核磁成像进行体脂检测。具体步骤如下: ①异氟烷麻醉, 固定于线圈上, 头先进, 定位于腹部中心; ②自旋回波序列(SE)行T1加权像, TR = 500 ms, TE = 6.1 ms, 层厚1 mm, 矩阵256×256, FOV 50 mm×100 mm, 平均值= 8。使用Siemens Inveon Workplace软件进行图像处理。
血生化指标检测 采用日立7100全自动生化分析仪, 测定小鼠血清样本中总胆固醇(cholestrol, CHO)、甘油三酯(triglyceride, TG)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol, LDL-c)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol, HDL-c)和葡萄糖(glucose, Glu)水平。具体过程如下:按说明书向生化非定值质控品冻干粉中加入相应体积的纯水, 平衡40 min; 仪器自检后测定各项生化非定值质控品, 测定结果均在测定范围内后检测小鼠血浆样品。
AMPKα及PPARγ的mRNA表达检测 取药物处理后的脂肪细胞6孔板, 弃培养基, PBS洗去残留液体, 每孔加入Trizol 1 mL, 按Invitrogen试剂盒说明书提取总RNA, 使用Nanodrop2000C测定RNA的浓度, 均一上样量。PCR扩增: PCR总反应体系20 μL, 含RNA模板5 μL、Master Mix 10 μL、RT Enzyme Mix 0.16 μL、DEPC H2O 4.34 μL、引物0.5 μL。PCR反应条件: 48 ℃ 30 min; 95 ℃ 10 min; 95 ℃ 15 s、60 ℃ 1 min, 40个循环。每个qPCR重复2次, 以GAPDH作为内参基因, 目的基因的相对表达量通过公式2-ΔΔCt计算。AMPKα mRNA引物:正向5'-GTTCAGGCACCCTCA CATCA-3', 反向5'-CAAGCAGGACGTTCTCAGGT-3'; PPARγ mRNA引物:正向5'-CCAGCTCTACAACAGG CCTC-3', 反向5'-GTGAGACATCCCCACAGCAA-3'; GAPDH mRNA引物:正向5'-CTCCCACTCTTCCAC CTTCG-3', 反向5'-TAGGGCCTCTCTTGCTCAGT-3'。
称取小鼠附睾脂肪约100 mg, 加入500 μL Trizol及组织破碎珠, 使用组织破碎仪70 Hz条件破碎5 min, 4 ℃下12 000 r·min-1离心15 min, 取上清, 其后RNA提取及Real-time PCR实验步骤与细胞中AMPKα及PPARγ的mRNA表达的测定相同。
AMPKα、p-AMPKα及PPARγ的蛋白表达 取分别由2.5、5和10 μmol·L-1浓度BBR处理后的脂肪细胞, 弃去培养基, PBS清洗2次, 加入细胞裂解液提取细胞总蛋白, 并用BCA法测定蛋白浓度, 制备相同上样量的蛋白样品, 利用SDS-PAGE胶点样后电泳。100 V下将电泳条带转至PVDF膜, 5%脱脂奶粉室温下封闭3 h, 加入p-AMPKα、AMPKα及PPARγ一抗4 ℃孵育过夜, 洗膜后加HRP标记的二抗室温孵育2 h, 洗膜后曝光, 使用Image Lab软件对结果进行分析处理。
称取小鼠附睾脂肪约200 mg, 加入200 μL组织蛋白裂解液及组织破碎珠, 使用组织破碎仪70 Hz条件破碎5 min, 4 ℃下12 000 r·min-1离心30 min, 取上清, BCA法测定蛋白浓度, 其余步骤与细胞中p-AMPKα、AMPKα及PPARγ蛋白表达检测相同。
统计学分析 数据采用GraphPad Prism6统计软件进行统计分析及作图, 显著性差异比较采用t检验法进行, 以P < 0.05为差异具有统计学意义。
结果 1 BBR对小鼠前脂肪细胞分化的影响油红染色结果(图 1)显示, 处于分化末期的前脂肪细胞胞内脂滴生成增多, 随着加入BBR浓度的增加, 油红上色区域减少, 且量化值不断降低。结果表明, BBR可剂量依赖性地抑制小鼠前脂肪细胞向成熟的脂肪细胞分化, 减少脂肪组织的产生。
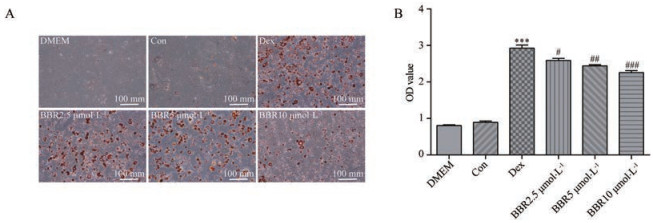
|
Figure 1 Representative image (A) and quantitative analysis (B) of oil red staining. 3T3-L1 cells are treated with 2.5, 5, 10 μmol·L-1 berberine (BBR), respectively for 24 h following differentiated with dexamethasone (Dex). Cells untreated (DMEM), treated with solvent (Con) and differentiated with dexamethasone (Dex) are used as control. n = 3, mean ± SEM. ***P < 0.001 vs Con; #P < 0.05, ##P < 0.01, ###P < 0.001 vs Dex |
由图 2可知, 给予Dex的模型组小鼠体重显著低于对照组小鼠(P < 0.05); BBR组小鼠体重与模型组无显著差异。各组小鼠饲料消耗量无明显差异。

|
Figure 2 Body weight (A) and food uptake analysis (B). C57BL/6N mice are implanted with Dex osmotic pump and treated with BBR by gavage (100 mg·kg-1·day-1) for four weeks. Dex-treated mice are used as model control (Dex), while mice implanted with saline contained osmotic pump are used as negative control (Con). n = 3, mean ± SEM. *P < 0.05 vs Con |
为了确定模型建立是否成功, 本研究以比目鱼肌重与胫骨长度之比作为肌肉萎缩的指标, 结果可见, 模型组比值较对照组显著降低(图 3A、B), 即C57BL/6N小鼠在长期接受Dex作用后, 出现了肌肉萎缩, 符合糖皮质激素长期刺激时产生的生理变化, 而BBR则可缓解糖皮质激素类对肌肉分解的不良反应。
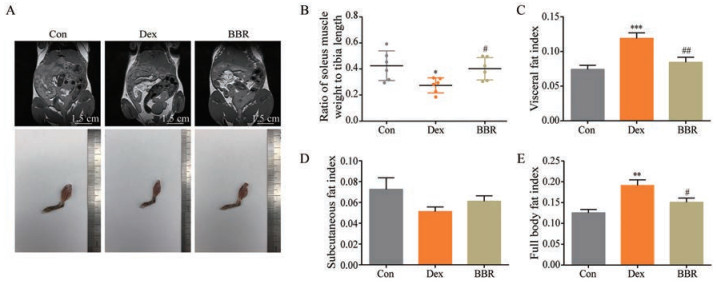
|
Figure 3 BBR modulated fat accumulation and muscle properties in Dex treated C57BL/6N mice. A, up: Representative MRI images tested using Pharma Scan 70/16 US small animal MRI (Bruker, Germany); A, down: Representative images of muscle atrophy; B: Ratio of soleus muscle weight to tibia length; C: Visceral fat index; D: Subcutaneous fat index; E: Full body fat index. n = 6, mean ± SEM. *P < 0.05, **P < 0.01, ***P < 0.001 vs Con; #P < 0.05, ##P < 0.01 vs Dex |
通过小动物核磁技术对小鼠体内脂肪进行成像。模型组在激素连续作用4周后, 成像显示该组小鼠内脏脂肪堆积与对照组相比明显增多, 皮下脂肪无显著性变化, BBR灌胃后内脏脂肪含量降低约33.3%, 体脂率下降(图 3A、C~E)。
4 小檗碱改善小鼠糖脂代谢水平由图 4可知, 模型组小鼠血液中TG、CHO、LDL-c含量及血糖水平显著高于对照组小鼠, 而HDL-c含量与对照组小鼠相比显著降低, BBR灌胃治疗后可改善上述指标, 显著降低高脂血症, 增加HDL-c水平。
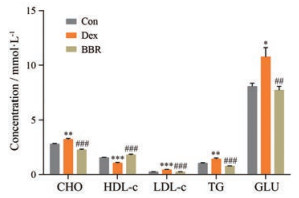
|
Figure 4 BBR modulated plasma lipid and glucose levels disturbed by Dex. Plasma cholesterol (CHO), high-density lipoprotein cholesterol (HDL-c), low-density lipoprotein cholesterol (LDL-c), triglyceride (TG), and glucose (GLU) levels are measured with enzymatic methods using an automatic biochemical analyzer. n = 6, mean ± SEM. *P < 0.05, **P < 0.01, ***P < 0.001 vs Con by unpaired t test; ##P < 0.01, ###P < 0.001 vs Dex |
Real-time PCR结果(图 5)显示, 与对照组相比, 模型组3T3-L1细胞中PPARγ表达量显著升高而AMPKα表达量显著降低, BBR可剂量依赖性增加3T3-L1细胞AMPKα表达并降低PPARγ表达。体内实验结果显示, Dex可增加小鼠脂肪组织PPARγ表达并降低AMPKα表达, 与模型组相比, BBR可显著增加小鼠脂肪组织AMPKα表达, 降低PPARγ表达水平。

|
Figure 5 Effect of BBR on mRNA expression of AMPKα and PPARγ in 3T3-L1 cells (A) and mouse adipose tissue (B).Total RNA was extracted from cells or epididymal fat, and analyzed by quantitative real-time PCR for AMPKα and PPARγ, the results were normalized to GAPDH. A: n = 3, B: n = 6, mean ± SEM. *P < 0.05, **P < 0.01, ***P < 0.001 vs Con; #P < 0.05, ###P < 0.001 vs Dex |
Western blot实验结果显示, Dex对小鼠前脂肪细胞及小鼠附睾脂肪组织中AMPKα活化具有一定的抑制作用, 同时使PPARγ表达升高。BBR可促进模型组3T3-L1细胞及模型组小鼠附睾脂肪组织中AMPKα的活化, 抑制PPARγ蛋白的表达(图 6)。
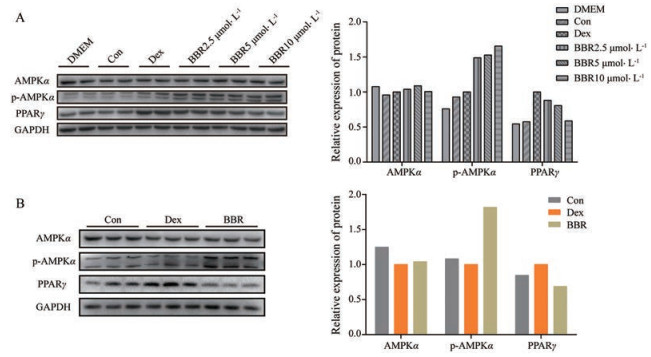
|
Figure 6 Effects of BBR on the protein expression of AMPKα and PPARγ in 3T3-L1 cells (A) and mouse adipose tissue (B). The protein expression of p-AMPKα, AMPKα, and PPARγ was evaluated by Western blot, GAPDH was used as control |
研究表明, BBR具有降脂、降血糖和调节代谢性疾病的作用[9-11], 但能否对长期使用激素引起的代谢紊乱具有改善作用, 鲜有报道。通过建立糖皮质激素诱导C57小鼠模型, 本研究观察到长期注射糖皮质激素药物会引起小鼠体内脂代谢紊乱, CHO和TG等血浆脂质含量明显升高, 同时会引起小鼠向心性肥胖, 主要表现为腹膜内而非皮下脂肪堆积。口服BBR后可改善小鼠血糖和血脂水平, 明显抑制内脏脂肪堆积, 降低体脂含量。PCR及Western blot实验结果表明, BBR可显著降低小鼠脂肪组织PPARγ表达, 促进AMPKα的磷酸化。细胞实验证明, 前脂肪细胞经激素诱导分化, PPARγ表达水平上升, 由于PPARγ是脂肪分化早期重要的转录因子, 过度表达会刺激前脂肪细胞向成熟脂肪细胞的转变。给予BBR后, 可显著降低3T3-L1细胞PPARγ表达, 减少细胞分化。同时本研究发现, BBR也促进3T3-L1细胞中AMPK磷酸化。AMPK是能量代谢调节过程中的关键分子, 与代谢性疾病密切相关, 参与脂肪酸氧化及胰岛素抵抗等多种生物学过程, 其表达主要受到体内AMP/ATP比例变化的影响, 当AMP水平升高或ATP含量降低时, 则会刺激AMPK的表达, 从而增加ATP的合成, 促进分解代谢[12]。AMPK活化可减少脂肪酸、胆固醇的产生并促进脂肪酸氧化, 同时对脂代谢下游通路起到调节作用, 是代谢性疾病的研究热点。PPARγ是过氧化物酶体增殖剂激活受体(PPARs)的亚型之一, 属于核激素受体家族中的配体激活受体, 主要存在于脂肪组织中, 可以调节脂肪细胞分化、脂肪生成和葡萄糖代谢的基因表达, 与2型糖尿病、肌萎缩症、动脉粥样硬化、肥胖和其他代谢疾病有密切的关系[13-15]。BBR作为一种多靶点药物, 可减少动物脂肪组织及3T3-L1细胞中PPARγ表达, 同时升高p-AMPKα蛋白及mRNA水平, BBR可能通过影响p-AMPKα及PPARγ的表达来发挥抑制脂肪组织中前脂肪细胞分化, 减少脂肪组织堆积, 调节血糖和血脂作用。
本研究结果提示, BBR具有改善由激素引起的内脏脂肪堆积及糖脂代谢紊乱的作用。AMPK及PPARγ途径可能起到重要的作用, 为进一步探讨BBR治疗激素引起的代谢紊乱等不良反应提供研究基础。
作者贡献: 马晓蕾负责动物和细胞实验的操作及论文的撰写; 蒋卫、樊伟明及傅小峰参与了数据分析及文献检索; 王璐璐及蒋建东负责实验设计及论文审阅。
利益冲突: 所有作者均不存在利益冲突。
| [1] |
Shimizu N, Yoshikawa N, Ito N, et al. Crosstalk between glucocorticoid receptor and nutritional sensor mTOR in skeletal muscle[J]. Cell Metab, 2011, 13: 170-182. DOI:10.1016/j.cmet.2011.01.001 |
| [2] |
Raalte DHV, Ouwens DM, Diamant M. Novel insights into glucocorticoid-mediated diabetogenic effects:towards expansion of therapeutic options[J]. Eur J Clin Invest, 2009, 39: 81-93. DOI:10.1111/j.1365-2362.2008.02067.x |
| [3] |
Androulakis II, Kaltsas GA, Kollias GE. Patients with apparently nonfunctioning adrenal incidentalomas may be at increased cardiovascular risk due to excessive cortisol secretion[J]. J Clin Endocrinol Metab, 2014, 99: 2754-2762. DOI:10.1210/jc.2013-4064 |
| [4] |
Ferrau F, Korbonits M. Metabolic comorbidities in Cushing's syndrome[J]. Eur J Endocrinol, 2015, 173: M133-M157. DOI:10.1530/EJE-15-0354 |
| [5] |
Arnaldi G, Scandali VM, Trementino L, et al. Pathophysiology of dyslipidemia in Cushing's syndrome[J]. Neuroendocrinology, 2010, 92(Suppl 1): 86-90. |
| [6] |
Komal S, Ranjan B, Neelam C, et al. Berberis aristata:a review[J]. Int J Res Ayurveda Pharm, 2011, 2: 383-388. |
| [7] |
Jiang T, Jia YH, Li YS. Research progress of berberine lipid-lowering mechanism[J]. Drugs Clin (现代药物与临床), 2016, 31: 727-730. |
| [8] |
Liu Y, Zhao Y, Guo DL, et al. Synergistic antimicrobial activity of berberine hydrochloride, baicalein and borneol against candida albicans[J]. Chin Herb Med, 2017, 9: 353-357. DOI:10.1016/S1674-6384(17)60115-1 |
| [9] |
Chang W, Chen L, Hatch GM. Berberine as a therapy for type 2 diabetes and its complications:from mechanism of action to clinical studies[J]. Biochem Cell Biol, 2015, 93: 479-486. DOI:10.1139/bcb-2014-0107 |
| [10] |
Zhao L, Cang Z, Sun H, et al. Berberine improves glucogenesis and lipid metabolism in nonalcoholic fatty liver disease[J]. BMC Endocr Disord, 2017, 17: 13. DOI:10.1186/s12902-017-0165-7 |
| [11] |
Shen N, Li CN, Huan Y, et al. Research progress of berberine in regulating blood glucose and lipid metabolism disorders[J]. Acta Pharm Sin (药学学报), 2010, 45: 699-704. |
| [12] |
Ke R, Xu Q, Li C, et al. Mechanisms of AMPK in the maintenance of ATP balance during energy metabolism[J]. Cell Biol Int, 2018, 42: 384-392. DOI:10.1002/cbin.10915 |
| [13] |
Berger JP, Akiyama TE, Meinke PT. PPARs:therapeutic targets for metabolic disease[J]. Trends Pharmacol Sci, 2005, 26: 244-251. DOI:10.1016/j.tips.2005.03.003 |
| [14] |
Staels B, Fruchart JC. Therapeutic roles of peroxisome proliferator-activated receptor agonists[J]. Diabetes, 2005, 54: 2460-2470. DOI:10.2337/diabetes.54.8.2460 |
| [15] |
Grimaldi PA. The roles of PPARs in adipocyte differentiation[J]. Prog Lipid Res, 2001, 40: 269-281. DOI:10.1016/S0163-7827(01)00005-4 |
 2020, Vol. 55
2020, Vol. 55


