2. 国家药品监督管理局药用辅料质量研究与评价重点实验室, 中国食品药品检定研究院, 北京 100050
2. NMPA Key Laboratory for Quality Research and Evaluation of Pharmaceutical Excipients, National Institutes for Food and Drug Control, Beijing 100050, China
聚维酮(povidone)具有优良的生理惰性和生物相容性, 应用广泛, 和纤维素类衍生物、丙烯酸类化合物并称为三大主要合成药用辅料[1]。聚维酮由单体N-乙烯基-2-吡咯烷酮(N-vinyl-2-pyrrolidinone, NVP)加引发剂聚合而成, 常见的引发剂有过氧化物[2]和偶氮类化合物[3]等, 聚合方式一般采用水溶液聚合, 其反应机制如图 1所示。
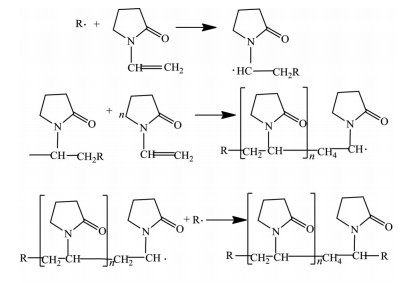
|
Figure 1 Synthetic mechanism of povidone |
由于聚维酮的聚合度不同, 分子量范围在几千到上百万。分子量不同, 用途大有不同, 例如分子量较低的聚维酮可用作助溶剂; 分子量稍高一些的聚维酮常用作粘合剂; 高分子量的聚维酮可用作制备亲水凝胶型缓释片。然而, 各国药典均未引入分子量检查项, 仅采用K值对聚维酮进行分类。K值是与规定浓度的聚维酮水溶液相对于水的黏度有关的特征值, 范围在10~120之间, 常见聚维酮品种有K12、K15、K17、K25、K30、K60和K90。K值是基于黏度计算出的理化指标, 而黏度又是与高聚物分子量有关的物理量, 因此聚维酮K值的大小能反映其分子量大小, 测定K值具有一定意义。不同型号聚维酮的K值、近似分子量和具体应用详见表 1[4-6]。
| Table 1 K-values and applications of different types of povidone |
聚维酮K值采用Fikentscher's方程[5]计算, 见式(1)、(2), 其中式(1)经变换可得式(3)。
| $ {\rm{lg}}z = c\left( {\frac{{0.000{\rm{}}075\;K_{{\rm{}}}^2}}{{1 + 0.001{\rm{}}5\;K \times c}}} \right) + 0.001\;K $ | (1) |
| $ K = \frac{{\sqrt {300c{\rm{lg}}z + {{\left( {c + 1.5c{\rm{lg}}z} \right)}^2}} + 1.5c{\rm{lg}}z - c}}{{0.15c + 0.003{c^2}}} $ | (2) |
| $ \frac{{{\rm{lg}}z}}{c}\frac{{0.000{\rm{}}075\;K_{{\rm{}}}^2}}{{1 + 0.001{\rm{}}5\;K \times c}} + 0.001\frac{K}{C} $ | (3) |
式(1)~(3)中, z为样品水溶液相对水的黏度; c为浓度(×10-2 g·mL-1); K为聚维酮K值。当样品水溶液浓度极小, 式(3)结合Mark-Houwink公式(4)和特性黏数计算公式(5), 可得式(6)。由式(6)可知聚维酮K值与分子量存在一定关系, 证明K值能反映聚维酮的分子量。
| $ \left[ \eta \right] = k{M^a} $ | (4) |
| $ \left[ \eta \right] = \mathop {{\rm{lim}}}\limits_{c \to 0} \frac{{{\rm{ln}}z}}{c} $ | (5) |
| $ k{M^a} = 2.303\left( {0.000{\rm{}}075\;{K^2} + 0.001\frac{K}{c}} \right) $ | (6) |
式(4)中[η]为高聚物的稀溶液特性黏数; α和k是与高聚物溶剂体系性质、温度等有关的常数; M为高聚物分子量。
目前, 各国药典[4, 7-9]对聚维酮K值测定都基于乌式毛细管黏度计, 该法是一种相对测量法, 在重力作用下, 测量一定体积的样品溶液和纯溶剂分别流经毛细管所需时间之比, 仅适用于测量不受剪切速率影响的流体, 即牛顿流体。乌氏毛细管黏度计法所需实验器材普及率高、价格低廉, 但样品用量大、耗时、人为误差大、重现性差[10]。有研究[10]采用锥板式旋转流变仪测定聚维酮K值。该法解决了乌式毛细管黏度计法耗时长、重现性差的问题, 其缺点是:锥板式旋转流变仪是开放系统, 样品用量较小, 若样品易挥发或易与空气产生作用, 导致样品损失, 可能造成黏度测量的偏差; 当样品放置在锥形板流变仪中时, 由表面活性物质形成的薄膜会引起界面效应, 可能掩盖流体的真实剪切流变学[11], 聚维酮具有两亲性, 有一定表面活性, 因此采用锥板式旋转流变仪测定聚维酮溶液黏度存在一定偏差; 锥板式旋转流变仪是基于层与层间平流的假设, 当剪切速率过高, 即转速太快, 容易形成湍流[12], 导致测量黏度有偏差。以上几种因素会对聚维酮溶液黏度的测定带来负面影响, 增大K值测定的误差。
美国药典USP42-NF37在〈914〉中提到压力驱动法测定黏度, 微流体流变仪正是基于压力驱动的原理[13], 因其能控制温度和剪切速率, 所以适用于牛顿流体和非牛顿流体黏度的测量。微流体流变仪可用于亚微升样品的表征[14], 极大地减少了样品用量, 测定时间仅需几十秒, 能完全自动化、高通量采集样品, 避免人为误差, 对于大批量的检验工作提供了便捷的手段, 实验过程中全封闭, 避免了上述两种方法溶剂挥发的风险。基于以上特点, 本文建立了一种新方法—微流体流变仪法测定不同型号聚维酮的K值。
由于乌氏黏度计测分子量的误差较大[15]以及没有已知分子量的聚维酮标准品, 本研究采用高效凝胶色谱法和多角度激光散射仪联用技术(gel permeation chromatography-multi angle laser light scattering, GPC-MALLS)测其重均分子量(Mw), 初步探讨聚维酮K值与Mw的关系, 建立两者的数学模型。
材料与方法材料与仪器 聚维酮K12来源:国外A厂家, 批号79163256B0、62898586B0、25666447B0 (编号K12-A-1、K12-A-2、K12-A-3); 1厂家, 批号GBK20180309、GBK20180516、GBK20180907 (编号K12-1-1、K12-1-2、K12-1-3);聚维酮K15来源: 1厂家, 批号GBK20180802、GBK20180817、GBK20180916 (编号K15-1-1、K15-1-2、K15-1-3); 2厂家, 批号18090101 (编号K15-2-1);聚维酮K17来源:国外A厂家, 批号40854075L0、52266447G0、39933609T0 (编号K17-A-1、K17-A-2、K17-A-3); 1厂家, 批号GBK20180622、GBK20180626、GBK20180801 (编号K17-1-1、K17-1-2、K17-1-3); 2厂家, 批号18090601、18102601 (编号K17-2-1、K17-2-2); 3厂家, 批号20172208、20172211、20172212 (编号K17-3-1、K17-3-2、K17-3-3);聚维酮K25来源:国外A厂家, 批号14187575L0、23306675L0、63537624U0 (编号K25-A-1、K25-A-2、K25-A-3); 1厂家, 批号GBK20180321、GBK20180421、GBK 20180517 (编号K25-1-1、K25-1-2、K25-1-3); 3厂家, 批号20171908、20171909、20171910 (编号K25-3-1、K25-3-2、K25-3-3); 4厂家, 批号130318006、130318007、130318003 (编号K25-4-1、K25-4-2、K25-4-3);聚维酮K30来源:国外B厂家, 批号0002243710 (编号K30-B-1); 4厂家, 批号010518008、010518009、010518014 (编号K30-4-1、K30-4-2、K30-4-3); 5厂家, 批号170501、170702、F204C180501 (编号K30-5-1、K30-5-2、K30-5-3); 6厂家, 批号180901、180903、180905 (编号K30-6-1、K30-6-2、K30-6-3);聚维酮K60来源: 1厂家, 批号GBK20180511、GBK20180415、GBK20180226 (编号K60-1-1、K60-1-2、K60-1-3);聚维酮K90来源:国外A厂家, 批号75892368E0、12147924U0、20506497V0、67621424U0 (编号K90-A-1、K90-A-2、K90-A-3、K90-A-4); 1厂家, 批号GBK20180720、GBK20180827、GBK20180914 (编号K90-1-1、K90-1-2、K90-1-3); 3厂家, 批号20172107、20172108、20172109 (编号K90-3-1、K90-3-2、K90-3-3);硝酸钠(国药集团化学试剂有限公司, 批号20190816); ProClinTM 300液体防腐剂(美国SIGMA-ALORICH公司, 批号MKCH7182)。
XS205DU十万分子之一电子天平(瑞士METTLER公司); 乌氏毛细管黏度计(毛细管黏度常数0.009 862 mm2·s-2, 德国SI Analytics公司); m-VROC微流体流变仪(美国RheoSense公司); Agilent 1260凝胶色谱仪(美国Agilent公司); DAWN HELLOS-Ⅱ多角度激光散射检测器(美国Wyatt公司); Optilab T-rEX示差折光检测器(美国Wyatt公司); Shodex Ohpak SB-806M HQ色谱柱(日本Shodex公司); 恒温水浴锅(德国Julabo公司); 屈臣氏水。
乌氏毛细管黏度计法测定各型号聚维酮K值 取本品适量, 精密称定, 置100 mL量瓶中, 加水适量使溶解, 在(25 ± 0.05) ℃恒温水浴中放置1 h后, 加水稀释至刻度, 分别制得浓度为0.05 g·mL-1的聚维酮K12溶液、聚维酮K15溶液和聚维酮K17溶液, 以及浓度为0.01 g·mL-1的聚维酮K25溶液、聚维酮K30溶液、聚维酮K60溶液和聚维酮K90溶液, 将样品溶液注入乌式毛细管黏度计中, 放置15 min后, 测得样品溶液的流出时间t, 同法测得水的流出时间t0, 按式(2)计算K值(以Ku表示), z按t/t0计算。
微流体流变仪法测定条件考察
测定浓度考察 各型号聚维酮样品随机选择一批次, 配制与乌氏毛细管黏度计法浓度一致的各型号聚维酮溶液, 用微流体流变仪分别测得水和样品溶液在剪切速率2 000 s-1、温度25 ℃下的表观黏度η0和η, 按式(2)计算K值, z按η/η0计算。
剪切应力考察 各型号聚维酮样品随机选择一批次, 以最终确定的浓度为标准, 配制各型号聚维酮样品溶液。将微流体流变仪实验温度设为25 ℃, 分别测定各溶液在剪切速率为1 000、2 000、3 000、4 000和5 000 s-1时的黏度。
测定温度考察 将微流体流变仪实验剪切速率设为2 000 s-1, 分别测定各型号聚维酮样品溶液在20、22、24、25、26、28和30 ℃时的黏度。
微流体流变仪法测定各型号聚维酮K值 以最终确定的浓度为标准, 配制各型号聚维酮样品溶液, 采用微流体流变仪, 于最终确定的剪切应力和温度条件下, 测定分别测得水和聚维酮样品溶液的表观黏度η0和η, 按式(2)计算K值(以Km表示)。
微流体流变仪法和乌氏毛细管黏度计法的比较 运用SPSS软件, 对乌氏毛细管黏度计法和微流体流变仪法测得的K值进行配对样本T检验, P > 0.05, 认为结果无显著性差异。
聚维酮分子量的测定 随机选择各型号聚维酮一批次, 以0.1 mol·L-1硝酸钠为溶剂, 配制系列浓度样品溶液, 经示差折光检测器梯度浓度分析后, 得到不同型号聚维酮样品在0.1 mol·L-1硝酸钠中的比折光指数增量(dn/dc值)。采用GPC-MALLS法测定各型号聚维酮分子量, 色谱条件: Shodex Ohpak SB-806M HQ色谱柱(300 mm×8 mm), 0.1 mol·L-1硝酸钠为流动相, 流速0.5 mL·min-1, 进样量100 μL, 柱温35 ℃, Optilab T-rEX示差折光检测器和DAWN HELLOS-Ⅱ多角度激光散射检测器串联。
结果 1 乌氏毛细管黏度计法测定各型号聚维酮K值共测定7种不同型号56批次聚维酮样品的K值(Ku), 结果见图 2。
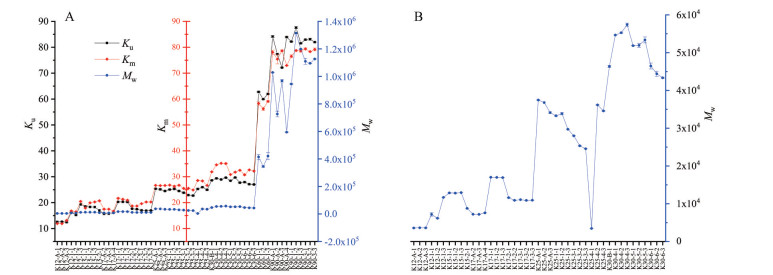
|
Figure 2 A: The results of Ku, Km and Mw of different types of povidone; B: Partial enlarged figure of A about the Mw. Ku: K-values measured by Ubbelohde capillary viscometer. n = 2, x ± U; Km: K-values measured by microfluidic rheometer. n = 4, x ± s; Mw: weight-average molecular weights measured by gel permeation chromatography-multi angle laser light scattering (GPC-MALLS). n = 2, x ± U |
结果发现, 聚维酮K25、K30和K90测得结果与乌式黏度计测得结果相差较大, 可能由于0.01 g·mL-1聚维酮K25和K30溶液黏度较小, 与水十分接近, 导致结果偏差大, 所以增大浓度至0.05 g·mL-1继续考察; 而浓度为0.01 g·mL-1的聚维酮K90溶液黏度较大, 剪切速率对其黏度影响较大, 导致结果偏差大, 因此减小浓度至0.005 g·mL-1继续考察。浓度改变前后, 各型号K值结果见表 2。最终确定聚维酮K12、K15、K17、K25和K30的测试浓度为0.05 g·mL-1, 聚维酮K60的测试浓度为0.01 g·mL-1, 聚维酮K90的测试浓度为0.005 g·mL-1。
| Table 2 Comparison of K-values of povidone of different types measured by microfluidic rheometer. n = 4, x ± s. c1 (10-2 g·mL-1): the concentration of each type of povidone was consistent with that of Ubbelohde capillary viscometer method; Km1: K-values were measured at c1 concentration by microfluidic rheometer; c2 (10-2 g·mL-1): changed concentration of povidone K25, povidone K30, povidone K90; Km2: K-values were measured at c2 concentration by microfluidic rheometer. "-" means that the test concentration of the first experiment was qualified, so the second experiment was not carried out |
以剪切速率为横坐标、黏度为纵坐标绘制系列曲线(图 3)。结果表明, 在上述剪切速率范围内, 各型号聚维酮样品溶液黏度基本无变化。最终确定剪切速率为2 000 s-1。
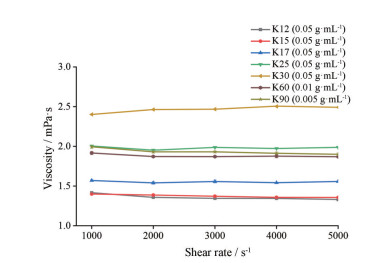
|
Figure 3 Curve of viscosity of different types of povidone sample solution with shear rate. n = 4, x ± s |
以温度为横坐标、黏度为纵坐标绘制系列曲线(图 4)。在上述温度范围内, 由于浓度较低, 各型号聚维酮样品溶液黏度变化较小。综合各国药典聚维酮K值测定条件, 最终确定温度为25 ℃。
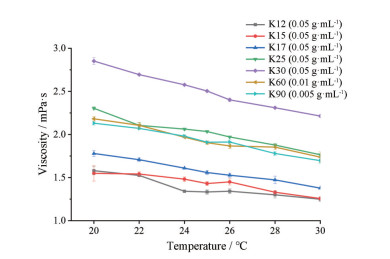
|
Figure 4 The viscosity of povidone samples varied with temperature. n = 4, x ± s |
按微流体流变仪法, 于25 ℃、剪切速率为2 000 s-1条件下, 共测定7种不同型号56批次聚维酮样品的K值(Km), 结果见图 2。
3 微流体流变仪法和乌氏毛细管黏度计法的比较配对样本T检验结果显示, 微流体流变仪法和乌氏毛细管黏度计法测定的结果无显著性差异(P = 0.053), 即两种方法的结果一致。以Ku为横坐标、Km为纵坐标(图 5), 得到方程, Km = 0.893 9 Ku + 4.617 6, R2 = 0.986 2, 拟合程度良好。
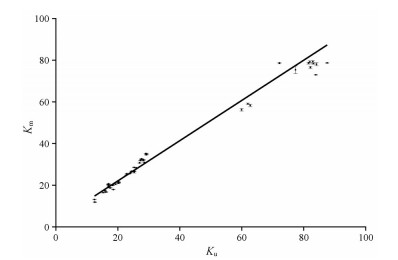
|
Figure 5 The relationship between Ku and Km, Km = 0.893 9 Ku + 4.617 6, R2 = 0.986 2. n = 4, x ± s |
聚维酮K值是根据黏度计算得到的数据, 而黏度是与高聚物分子量有关的物理参数, 本节将初步探讨聚维酮分子量与K值关系。利用GPC分离功能, 将待测样品分离为分子量不同的片段, 而每片段的浓度(ci)和分子量(Mi)分别由示差折光检测器和多角度激光散射检测器测得, 由此可计算出重均分子量(Mw), 见式(7)。
| $ {M_{\rm{w}}} = \frac{{\mathop \sum \nolimits {c_i}{M_i}}}{{\mathop \sum \nolimits {c_i}}} $ | (7) |
图 6为某厂家聚维酮K30某一次进样的色谱图, 其中蓝色线表示样品经过示差折光检测器形成的图谱, 红色线表示样品经过多角度激光散射检测器形成的图谱。由图 6多角度激光散射检测器形成的图谱可知, 该样品分子量近似正态分布, 峰型较窄, 结合待测样品的浓度以及对应型号的dn/dc值, 得到多分散系数为2.054, Mw为4.618×104, 其余样品分子量结果见图 2。分析Mw和Km的关系, 将Mw取以10为底的对数对Km进行拟合, 得到关系式: lgMw = -0.000 4 Km2 + 0.072 7 Km + 2.791, 拟合效果最佳, R2 = 0.990 1, 故可利用Km估算其Mw。
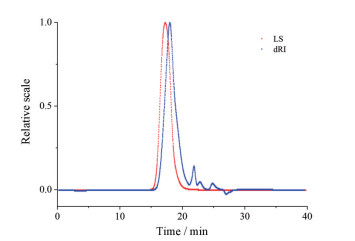
|
Figure 6 The typical chromatogram of povidone K30 by GPC-MALLS. LS: Chromatogram by MALLS; dRI: Chromatogram by refractive index detector |
本研究采用乌氏毛细管黏度计法和微流体流变仪法两种方法测定聚维酮7种型号共56批次样品的K值, 通过SPSS软件分析两种方法测得的K值, 结果无显著性差异(P > 0.05)。在今后的研究检验中可以考虑使用微流体流变仪法代替乌氏毛细管黏度计法, 能够显著节省时间和用样量, 实验过程全封闭、自动化程度高, 可减少人为误差, 提高实验结果的准确性和重现性。本研究还初步探究了Mw和Km的关系, 得到方程, lgMw = -0.000 4 Km2 + 0.072 7 Km + 2.791, 相关系数达0.990 1, 拟合程度良好, 可将微流体流变仪法测得的Km带入上述方程估算其Mw。
除此之外, 微流体流变仪的设计原理使得其可以在更广泛的领域得到应用。如微流体流变仪通过压力驱动来测定黏度, 能够很好的模拟注射剂推注过程, 通过调节温度和剪切速率测定注射剂黏度, 可以为后续注射剂一致性评价提供一种新的评价方法。有资料显示, 眨眼时剪切速率能高达4 000~100 000 s-1[16], 传统流变仪已不适用, 而微流体流变仪可用于测定与眨眼同等剪切速率下眼用制剂的黏度, 为眼用制剂处方筛选和临床运用提供了新的技术手段。
作者贡献: 孙会敏、涂家生、王珏、胡丽构思和设计实验; 胡丽进行实验并收集数据; 王珏、胡丽完成初稿; 孙会敏、涂家生、王珏修改文章; 所有作者都对文章内容负有主要责任。
利益冲突: 无任何利益冲突。
| [1] |
Higuchi A, Shirano K, Harashima M, et al. Chemically modified polysulfone hollow fibers with vinylpyrrolidone having improved blood compatibility[J]. Biomaterials, 2002, 23: 2659-2666. DOI:10.1016/S0142-9612(01)00406-9 |
| [2] |
Song ZP. Popcorn Polymerization of N-Vinylpyrrolidone (N-乙烯基吡咯烷酮的爆米花聚合)[D]. Hangzhou: Zhejiang University, 2004. http://cdmd.cnki.com.cn/Article/CDMD-10335-2004042931.htm
|
| [3] |
Zeng Y, Wang Y, Xie JJ, et al. Study on the synthesis of medium-high molecular weight of PVP K60 with low residual monomer[J]. Fine Spec Chem (精细与专用化学品), 2012, 20: 48-52. |
| [4] |
The United States Pharmacopeial Convention. US Pharmacopoeia/National Formulary[S]. 42nd Ed. US: The United States Pharmacopeial Convention, 2019: 3604-3607.
|
| [5] |
Kibbe AH. Povidone[M]//Rowe RC. Handbook of Pharmaceutical Excipients (6th Ed). London: RPS Publishing, 2009: 581-585.
|
| [6] |
U. S. Food and drug administration. Inactive Ingredient Database[DB/OL]. US: FDA, 2020[2020-02-18]. https://www.accessdata.fda.gov/scripts/cder/iig/index.cfm.
|
| [7] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of People's Republic of China (中华人民共和国药典)[S]. Part 4. Beijing: China Medical Science Press, 2015: 1240-1241.
|
| [8] |
Editorial Committee of The Japanese Pharmacopoeia. The Japanese Pharmacopoeia[S]. 17nd Ed. Japan: Ministry of Health and Welfare, 2016: 1439-1441.
|
| [9] |
European Pharmacopoeia Commission.European Pharmacopoeia[S]. 9.0nd Ed. France: European Directorate for Quality Medicines, 2017: 3391-3394.
|
| [10] |
Chen YP, Zhang XY, Shi XY, et al. K-value determination of povidone K30[J]. Chin J Pharm (中国医药工业杂志), 2017, 48: 900-903. |
| [11] |
Sharma V, Jaishankar A, Wang YC, et al. Rheology of globular proteins:apparent yield stress, high shear rate viscosity and interfacial viscoelasticity of bovine serum albumin solutions[J]. Soft Matter, 2011, 7: 5150-5160. DOI:10.1039/c0sm01312a |
| [12] |
Larson RG. Instabilities in viscoelastic flows[J]. Rheol Acta, 1992, 31: 213-263. DOI:10.1007/BF00366504 |
| [13] |
Pharmacopeial Convention U. S. US Pharmacopoeia/National Formulary[S]. 42nd Ed. US: U. S. Pharmacopeial Convention, 2019: 7091-7092.
|
| [14] |
Yoon EK, Yang JH, Lee WS. Auxin and abscisic acid responses of auxin response factor 3 in arabidopsis lateral root development[J]. J Plant Biol, 2010, 53: 150-154. DOI:10.1007/s12374-010-9100-4 |
| [15] |
Wang GJ, Cao H. Research progress of lentinan[J]. Pharm J Chin PLA (解放军药学学报), 2011, 27: 81-85. |
| [16] |
Elliott S. More than meets the eye-Estimating blinking shear rates[EB/OL]. US: RheoSense Inc, 2020[2020-02-18]. https://www.rheosense.com/thank-you-for-downloading-the-application-note-viscosity-of-ophthalmic-solutions?submissionGuid=44cacb92-413d-4b33-b9dc-34ddfaeec44b.
|
 2020, Vol. 55
2020, Vol. 55


